Full English text available from: www.revespcardiol.org/en
La tomografía de coherencia óptica (OCT) es una nueva técnica de imagen intracoronaria basada en la luz, con una resolución espacial sin precedentes1,2. Actualmente su resolución axial es de tan solo 15 μm, es decir, 10 veces superior a la proporcionada por técnicas más clásicas como la ecografía intravascular (IVUS) basada en ultrasonidos (150 μm). La OCT permite, por lo tanto, obtener imágenes tomográficas de muy alta calidad de la pared coronaria y, especialmente, las estructuras más cercanas a la luz vascular1,2. Además, numerosos estudios con validación histológica han confirmado su valor para diferenciar adecuadamente los diferentes tipos de placa de ateroma, como las placas fibrosas (señal con brillo homogéneo), las lipídicas (atenuación progresiva de la señal) y las calcificadas (áreas con atenuación pero de bordes muy bien definidos). La OCT permite, por primera vez, la medición exacta del grosor de la cápsula fibrosa que cubre los cores lipídicos, y es capaz de diagnosticar in vivo fibroateromas de cápsula fina. De forma similar, esta técnica permite identificar las señales características que producen los cúmulos de macrófagos y cristales de colesterol en la pared vascular y también pequeñas roturas de la íntima o trombos intracoronarios que hasta ahora no se podía visualizar con IVUS1,2. Todo ello explica su enorme atractivo para la caracterización de las placas vulnerables y el estudio de la micromorfología de las placas que ya han presentado una complicación. Sin embargo, su penetración en la pared vascular es limitada, por lo que la visualización de estructuras alejadas de la luz (cercanas a la adventicia) está comprometida cuando hay una cantidad importante de placa de ateroma. Tampoco logra penetrar a través de trombos rojos (ricos en fibrina), que dejan una marcada sombra posterior1,2. Por lo tanto, no es una técnica adecuada para medir el volumen total de placa de ateroma; en este sentido, la IVUS sigue siendo la técnica de elección cuando se quiere estudiar la progresión o la regresión de la aterosclerosis coronaria.
Desde un punto de vista práctico, con la tecnología inicial (dominio de tiempo) la adquisición de imágenes era relativamente lenta y, al ser necesario eliminar completamente la sangre del interior de la coronaria, la extensión del segmento finalmente visualizado era pequeña. Con la tecnología actual (dominio de frecuencia), una retirada automática muy rápida de la óptica permite, durante una simple inyección de contraste radiológico, visualizar perfectamente segmentos coronarios de hasta 70 mm de longitud1,2.
La OCT también brinda nuevas posibilidades para valorar los resultados del intervencionismo coronario y, muy especialmente, del implante de stents1–3. Así, gracias a su resolución, puede analizar y medir, con una precisión inigualable, la luz residual, el grado de expansión del stent respecto a los segmentos de referencia, la correcta aposición de sus elementos estructurales contra la pared vascular, la existencia de prolapso de placa o material trombótico dentro del stent y la aparición de disecciones (dentro del stent o en sus bordes), incluso si son muy pequeñas1–3. La sensibilidad de la OCT para la detección de todos estos fenómenos es muy superior a la proporcionada por IVUS. Sin embargo, probablemente todavía sea de mayor interés la capacidad de la OCT para evaluar la respuesta reparadora que se produce en la pared vascular a largo plazo. De hecho, la OCT permite, por primera vez, visualizar la presencia de recubrimiento (o su ausencia) en los elementos metálicos del stent y medir con precisión el grado de proliferación neointimal4. De nuevo, la capacidad de la OCT para analizar todos estos fenómenos de reparación vascular es muy superior a la obtenida con IVUS, que no puede visualizar bien el recubrimiento del stent y tiene importantes limitaciones para analizar los grados leves de hiperplasia neointimal que habitualmente se producen tras el implante de stents liberadores de fármacos (SLF) (figura). No es de extrañar, por lo tanto, que en múltiples estudios se haya elegido la OCT como técnica de elección para comparar la respuesta vascular tras implante de diferentes tipos de SLF. En muchos de estos estudios algunos de los mencionados parámetros morfológicos se han elegido como objetivos primarios de valoración. Estas variables morfológicas tienen gran trascendencia desde un punto de vista tanto fisopatológico como mecanicista, y están ampliamente aceptadas como objetivos surrogados válidos de eficacia y seguridad1–4. Por otro lado, el tamaño muestral requerido para la comparación de estos parámetros morfológicos tardíos de reparación vascular es mucho menor que el necesario cuando se utilizan los objetivos clásicos de la valoración angiográfica, que a su vez ya es menor que el requerido en los estudios con objetivos de valoración clínicos, tanto de seguridad (trombosis del stent, infarto de miocardio) como de eficacia (necesidad de nueva revascularización de la lesión diana).
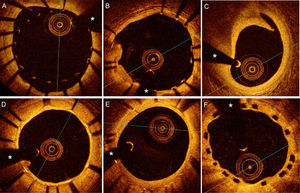
A-C: imágenes de coherencia óptica obtenidas inmediatamente tras implante de stents. A: muy mala aposión de la porción proximal de un stent que mostraba un excelente resultado angiográfico inicial. B: aposición incompleta de grado menor de algunos elementos metálicos del stent (de las 3:00 a las 5:00 del cuadrante) en un paciente con síndrome coronario agudo; en el lado opuesto (de las 7:00 a las 9:00 del cuadrante), se aprecia prolapso de placa. C: disección angiográficamente silente del borde distal de un stent. D-E: imágenes obtenidas en el seguimiento. D: excelente recubrimiento tardío de un stent liberador de fármaco. E: mínima proliferación neointimal visualizada durante el seguimiento de un stent liberador de fármaco. F: adecuado recubrimiento tardío de un dispositivo vascular bioabsorbible. Los elementos de los stents metálicos se presentan como estructuras brillantes con sombra posterior, mientras que los elementos plásticos de los dispositivos bioabsorbibles se presentan como cuadros negros que no dejan sombra. *Sombra generada por la guía de angioplastia.
Con los SLF de nueva generación, las tasas de reestenosis y de trombosis muy tardía se han reducido de manera significativa5,6. Sin embargo, todavía no se ha logrado eliminar por completo la aparición de «fracasos» del stent. En principio, la aparición de reestenosis en el stent no supone un problema clínico grave, ya que su presentación clínica es habitualmente benigna, pero sigue representando un reto terapéutico no bien resuelto. Por el contrario, aun siendo excepcional, la trombosis del stent puede tener unas consecuencias clínicas devastadoras7. Una reparación vascular incompleta o muy retrasada puede ser una consecuencia indeseable de implantar SLF8,9. Así, estudios anatomopatológicos han demostrado ocasionalmente fenómenos inflamatorios locales (especialmente con los SLF de primera generación), mala aposición del stent adquirida y, más frecuentemente, falta de endotelización del stent8,9. Estos fenómenos pueden explicar la presencia de un «stent vulnerable» a presentar esta temible complicación7. Por todos estos motivos, actualmente los esfuerzos terapéuticos se centran fundamentalmente en garantizar una perfecta reparación vascular tras implantar estos nuevos dispositivos. Es aquí donde la valoración con OCT tiene un papel enormemente atractivo1–4.
IMPLANTE DE STENTS GUIADO POR TOMOGRAFÍA DE COHERENCIA ÓPTICALa valoración de la gravedad, la longitud y las características morfológicas de la lesiones antes de una intervención coronaria proporciona información de gran interés. Además, inmediatamente tras implantar un stent, la OCT muestra su grado de expansión y el estado de sus bordes en cuanto a placa residual o disecciones1–3. La mala aposición también se detecta claramente. Habitualmente estos hallazgos son angiográficamente silentes, pero se deben corregir cuando son muy evidentes (figura). Sin embargo, el significado de las alteraciones morfológicas menores todavía es incierto1–3. La mayoría de los investigadores aconsejan no seguir insistiendo con dilataciones agresivas ante grados leves de infraexpansión o mala aposición residual una vez que ya se han realizado intentos de optimización razonables empleando diámetros correctos de balón y altas presiones1–3. De modo similar, hay amplio consenso en no tratar las pequeñas disecciones en los bordes del stent que muy frecuentemente se detectan con esta técnica. Grados leves de prolapso de material dentro del stent (trombo o placa) tampoco requieren un tratamiento específico1–3 (figura).
Aunque ya hay amplia experiencia y se han generado múltiples documentos de consenso sobre la utilización de la OCT, todavía no se dispone de criterios cuantitativos claros, clínicamente validados o al menos ampliamente aceptados, que sirvan como guía para la optimización del implante de stents1–4. Con los excelentes resultados obtenidos con los SLF de última generación, haría falta realizar estudios muy amplios de implante guiado por OCT para lograr demostrar los beneficios clínicos de esta estrategia en cuanto a reducción de la tasa de reestenosis o prevención de trombosis del stent. Baste recordar los ingentes esfuerzos que fue necesario realizar en la pasada década para confirmar la utilidad clínica del uso de IVUS (corrigiendo alteraciones morfológicas mucho más groseras) durante el implante de stents convencionales (con resultados muy inferiores a los de los nuevos SLF).
Sin embargo, ya se dispone de algunos datos de gran interés. En el estudio observacional CLI-OPCI, Prati el al10 compararon los resultados clínicos obtenidos tras implante convencional de stents guiado por angiografía con los obtenidos con una estrategia de implante de stents guiada por OCT. Este estudio multicéntrico y retrospectivo incluyó a un total de 670 pacientes, 335 con guía por OCT y 335 guiados únicamente por angiografía. En el grupo con guía por OCT, el 35% de los pacientes presentaban hallazgos morfológicos desfavorables que hubo que corregir. Al año de seguimiento, el grupo con guía por OCT presentaba menos mortalidad de causa cardiaca (el 1,2 frente al 4,5%; p=0,01), menor tasa combinada de mortalidad cardiaca e infarto de miocardio (el 6,6 frente al 13,0%; p=0,006) y, finalmente, menor tasa del evento adverso compuesto de muerte cardiaca, infarto de miocardio o nueva revascularización (el 9,6 frente al 14,8%; p=0,044), que era el objetivo primario del estudio. Las diferencias clínicas a favor de guiar el procedimiento con OCT se mantuvieron tras un ajuste estadístico convencional, atendiendo a las características basales de los pacientes, y también tras realizar un ajuste con propensity score para intentar soslayar los posibles sesgos inducidos durante la selección de la estrategia terapéutica.
Un pequeño estudio aleatorizado comparó los resultados obtenidos con el implante de stents guidado con OCT (n=35) y los obtenidos con la guía por IVUS (n=35)11. Los resultados de cada estrategia también se valoraron con la otra técnica de imagen, básicamente analizando la aposición con OCT y la expansión con IVUS. En ese estudio la expansión del stent fue significativamente inferior en el brazo guiado por OCT. Sin embargo, estos datos probablemente estuvieron condicionados porque la expansión del stent se guiaba respecto al tamaño total del vaso (no de la luz en los segmentos de referencia), que en muchos casos no se pudo analizar con OCT. Esto podría explicar la menor expansión final lograda en este brazo. Este estudio también está limitado porque únicamente evaluó los resultados agudos (inmediatamente tras la intervención) y no analizó los datos del seguimiento.
Más recientemente, Červinka et al12 han presentado los resultados del ensayo OCT-STEMI. En ese estudio aleatorizado, se han comparado los resultados de la angioplastia primaria guiada por OCT y la guiada por angiografía convencional en pacientes con infarto agudo de miocardio tratados con SLF de segunda generación. En los pacientes con guía por OCT, los resultados subóptimos se corrigieron con mayores presiones, balones más grandes o implante de stents adicionales. En el seguimiento, el brazo guiado por OCT mostró una mejora significativa en el área de estenosis y en el número absoluto de elementos del stent recubiertos, con una tendencia cercana a la significación estadística, en el porcentaje de elementos recubiertos.
Como ya se ha indicado, a pesar de su indudable interés, el reducido tamaño de todos estos estudios limita mucho su potencial aplicabilidad clínica. Por lo tanto, antes de diseñar estudios de gran tamaño con objetivos clínicos de valoración, es importante confirmar, desde un punto de vista tanto mecanicista como fisiopatológico, el beneficio real obtenido al guiar el implante de stents con OCT.
ESTUDIO ACTUALEn su artículo publicado en Revista Española de Cardiología, Kim et al13 presentan un pequeño pero muy interesante estudio aleatorizado que compara los resultados obtenidos tras implante de SLF guiado por OCT frente al implante convencional guiado exclusivamente por angiografía. La hipótesis del estudio es simple y atractiva: una mejor aposición del SLF durante el implante puede facilitar su completa endotelización durante el seguimiento. Se aleatorizó a un total de 101 pacientes, con 105 lesiones, de las cuales 51 se asignaron al brazo guiado por OCT y 54 al brazo guiado por angiografía. Los objetivos primario y secundario del estudio fueron, respectivamente, el porcentaje de elementos del stent no recubiertos y el porcentaje de elementos no adecuadamente apuestos a la pared vascular en el estudio de OCT a los 6 meses de seguimiento. La presencia de ambos parámetros adversos se redujo significativamente en los pacientes con implante guiado por OCT. Además, el número de SLF con más del 6% de los elementos metálicos sin recubrir (el 4 frente al 26%) también fue significativamente menor en el grupo con guía por OCT. Los autores concluyen que el implante de stents guiado por OCT mejora el recubrimiento de los stents en el seguimiento.
En el análisis de este elegante trabajo es necesario destacar algunos aspectos importantes. En primer lugar, en el brazo guiado por angiografía solo se realizó angiografía coronaria cuantitativa a posteriori en un laboratorio centralizado. Es posible, por lo tanto, que la realización de angiografía cuantitativa in situ (por los propios operadores) pudiera haber ayudado a mejorar los resultados obtenidos en este brazo, ya que es bien conocido que la estimación angiográfica visual es más permisiva que la cuantificación automática. Sin embargo, hay que aceptar que la estimación visual sigue siendo el modo habitual de implantar los SLF en la práctica clínica y, en este sentido, constituye un referente apropiado. En segundo lugar, no quedan claros los criterios de OCT utilizados para «optimizar» los resultados del implante. Parece seguro que los investigadores intentaron subsanar problemas morfológicos muy evidentes, pero no se sabe cuánto se insistió (con balones más grandes o presiones más altas) para corregir problemas residuales menores que, siendo frecuentes (mínima mala aposición, ligera infraexpansión, pequeñas disecciones en los bordes), no siempre son fáciles de solventar. De hecho, incluso en el brazo guiado por OCT, tras la intervención un 3,3% de los elementos metálicos no estaban correctamente apuestos y dos tercios de los stents mostraban algún elemento metálico no bien adosado a la pared vascular. La utilización de unos objetivos claros y bien definidos por OCT podría haber ayudado a generalizar los resultados de esta experiencia a operadores de otros centros que de lo contrario podrían emplear criterios o estrategias dispares. Este es un aspecto fundamental, porque perseguir una anatomía ideal puede no ser lo adecuado en todas las lesiones, especialmente en las más desfavorables (vasos muy calcificados o tortuosos), con las que se ha aprendido que hay que «saber parar», ya que los intentos muy agresivos de optimización pueden pagar un precio (aunque sea muy bajo) en complicaciones. En tercer lugar, puede llamar la atención que, a pesar de la mayor frecuencia de posdilatación en el brazo guiado por OCT (el 51 frente al 28%; p<0,05), los diámetros de los balones y las presiones máximas finales fueran similares en ambos grupos. La ligera diferencia en los diámetros de referencia basal entre ambos grupos podría ser una explicación. De hecho, cuando se analizó el cociente diámetro balón/diámetro arteria, se apreció que era superior en el brazo guiado con OCT. En cuarto lugar, aunque no hubo diferencias significativas, el grado de hiperplasia neointimal tendió a ser algo mayor en el brazo guiado por OCT. En realidad, el crecimiento neointimal fue mínimo en ambos grupos, pero serán necesarios nuevos estudios para confirmar que una dilatación más agresiva durante el implante no genera mayor estímulo proliferativo incluso cuando se utilizan SLF. Finalmente, también en este estudio hay un problema de tamaño muestral que limita especialmente la interpretación de sus subanálisis predefinidos (presentación inestable, diabetes mellitus y tamaño del stent). Obviamente, el estudio tampoco tiene potencia para detectar diferencias en la evolución clínica de los pacientes.
También merece la pena comentar otros aspectos metodológicos que, aun siendo menores, suscitan interés. En este estudio solo se utilizaron stents liberadores de zotarolimus. Esto se puede considerar como una fortaleza del diseño, ya que garantiza una población homogénea y permite emplear un criterio uniforme (distancia > 110 μm) de mala aposición. En principio, no hay por qué suponer que los resultados no puedan ser extrapolables a los obtenidos con otro tipo de SLF. También, hay que recordar que un análisis tan exhaustivo de cada elemento del stent no es factible en la práctica clínica, en la que lo habitual es determinar «visualmente» los elementos metálicos que no están bien adosados a la superficie vascular. Este aspecto también podría tener relevancia clínica, ya que algunos estudios han señalado que únicamente la presencia de áreas relativamente importantes de mala aposición tiene implicaciones clínicas7,14,15. Lo mismo ocurre con el grado de recubrimiento. Finalmente, también existe un fenómeno de «agrupamiento» (cluster) de los hallazgos morfológicos adversos con implicaciones no solo en cuanto al análisis estadístico requerido, sino también, y mucho más importante, en sus posibles consecuencias clínicas1,2.
Algunos estudios han asociado la presencia de elementos metálicos no recubiertos o mal apuestos con la visualización de pequeños trombos intracoronarios angiográficamente silentes16. Sin embargo, en este trabajo los hallazgos adversos descritos no se asociaron a la visualización de trombos en zonas sin recubrimiento o con aposición incompleta. Además, existen estudios que correlacionan el grado de mala aposición con el riesgo de trombosis tardía del stent7,14,15. En este sentido, es destacable que este mismo grupo de investigadores publicara recientemente un trabajo en el que se analizaban los mejores puntos de corte de los diferentes parámetros morfológicos desfavorables para predecir la aparición de eventos clínicos adversos durante el seguimiento17. De forma coherente, el mismo criterio (> 6% de elementos sin cobertura) se ha utilizado en el estudio de Kim et al13, en un intento de avalar su posible significado clínico. Por último, en este estudio se seleccionó a pacientes con lesiones sencillas. Cabe esperar que los beneficios de optimizar el implante de stents con OCT sean aún más evidentes en pacientes con lesiones complejas.
CONSIDERACIONES FINALESLa OCT permite identificar la cobertura de los elementos metálicos del stent generalmente con imágenes de un material uniforme brillante que indica una endotelización favorable1–4. No obstante, esta técnica no puede determinar con precisión el tipo de tejido que produce dicho recubrimiento, ya que capas muy finas de trombo laminar podrían generar imágenes muy similares. Actualmente se está investigando sobre métodos de caracterización tisular que permitan determinar las características del tejido que recubre los stents. Solo entonces se podrá usar esta información para tomar decisiones clínicas (p. ej., la necesidad de mantener o no el doble tratamiento antiagregante).
Debemos agradecer a estos investigadores coreanos la importante información generada en su estudio13, que sin duda permite avanzar hacia la realización de intervenciones coronarias de manera cada vez más segura y eficaz. No obstante, la generalización del uso de la OCT para el implante de SLF debe estar avalada por estudios más amplios que demuestren mejoras en los resultados clínicos tardíos y analicen también aspectos de coste-efectividad. Es indudable que la OCT es una técnica muy atractiva para generar nuevas evidencias sobre aspectos morfológicos angiográficamente silentes que ahora ya podemos ver y medir. El avance del conocimiento en esta disciplina no puede basarse en meras creencias, sino en datos y resultados objetivos. En ciencia seguimos necesitando «ver para creer».
CONFLICTO DE INTERESESNinguno.