El implante percutáneo de válvula aórtica (TAVI) mediante la técnica de superposición de senos coronarios (TSSC) ha mostrado una menor tasa de implante de marcapasos a 30 días. El objetivo de este estudio es comparar las alteraciones en el electrocardiograma y los eventos clínicos entre la TSSC y la técnica tradicional (TT) al año de seguimiento.
MétodosEstudio observacional, retrospectivo y no aleatorizado de pacientes consecutivos sometidos a TAVI entre enero de 2015 y enero de 2021. Las características basales se emparejaron por propensión. Se compararon la TT y la TSSC. Los objetivos primarios fueron los cambios electrocardiográficos y un combinado de implante de marcapasos, hospitalización y muerte cardiovascular al año de seguimiento.
ResultadosSe incluyó a 254 pacientes y, tras el emparejamiento por propensión, se evaluó a 184 (92 por grupo). No hubo diferencias estadísticamente significativas en las características basales. Con la TSSC hubo una reducción significativa de la incidencia del bloqueo de rama izquierda del haz de His (el 49 frente al 27%; p=0,002), así como una menor prolongación de la onda P (13,1±21,0 frente a 5,47±12,5 ms; p=0,003) y del QRS (29,77±27,0 frente a 16,38±25,4 ms; p<0,001). La TSSC se asoció con una significativa reducción del objetivo combinado (sHR=0,39; IC95%, 0,21-0,76; p=0,005).
ConclusionesAl año de seguimiento, el TAVI mediante TSSC produce menor incidencia de bloqueo de rama izquierda y un menor ensanchamiento del QRS y la onda P en comparación con la TT. La TSSC se asoció con una reducción estadísticamente significativa del evento primario combinado cardiovascular.
Palabras clave
El implante percutáneo de válvula aórtica (TAVI) se ha convertido en el tratamiento estándar de la estenosis aórtica (EA) grave en pacientes con alto riesgo e inoperables. Tras la publicación de las últimas recomendaciones de la Sociedad Europea de Cardiología, sus indicaciones se han extendido a todos los pacientes mayores de 75 años1. En los últimos años se han reducido las complicaciones del procedimiento y han aumentado las tasas de éxito debido a los avances tecnológicos en el diseño de válvulas y los sistemas de liberación.
Tras un TAVI se producen alteraciones que favorecen el bloqueo auriculoventricular (BAV) completo, sobre todo en los pacientes que ya presentan alteraciones basales en la conducción intraventricular2. La aparición de alteraciones electrocardiográficas es la complicación más frecuente del TAVI3. Se ha demostrado la superposición de senos coronarios (TSSC) reduce la profundidad de implante de la prótesis, así como la necesidad de marcapasos a 30 días4,5. Esta técnica se basa en una proyección fluoroscópica que aísle el seno no coronario y superponga el derecho y el izquierdo, para conseguir implantes menos profundos y que comprometan menos el sistema de conducción. Si bien la mayoría de los estudios se han basado en el estudio del bloqueo de rama izquierda o BAV completo de nueva aparición6, el estudio detallado de los componentes del electrocardiograma basal, posterior al implante y al año es aún escaso. Además, el impacto del implante por TSSC en los eventos clínicos aún no se ha estudiado.
El objetivo es determinar si al año del implante la TSSC produce un impacto menor en las alteraciones electrocardiográficas que la técnica tradicional de implante coplanar de 3 cúspides (TT), así como evaluar si la TSSC se asocia con una menor incidencia de eventos clínicos.
MÉTODOSDiseño del estudioEstudio observacional, unicéntrico y no aleatorizado de pacientes consecutivos sometidos a TAVI.
Población de estudioEl estudio incluyó a los pacientes intervenidos de TAVI con válvulas autoexpandibles entre el 1 de enero de 2015 y el 31 de enero 2021, previa selección por un heart team multidisciplinario, siguiendo las orientaciones de las guías de práctica clínica1. Se excluyó del estudio a los siguientes pacientes: portadores de marcapasos definitivo, con valvulopatía aórtica bicúspide, con electrocardiograma (ECG) previo al TAVI ilegible, con fibrilación auricular (FA) (ya que imposibilita el análisis de la onda P) o con TAVI sobre prótesis aórtica biológica previa (valve-in-valve). Se excluyó del análisis del ECG a los pacientes con ECG de seguimiento ilegibles.
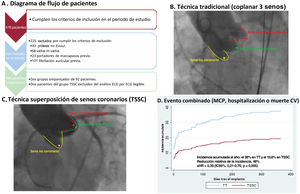
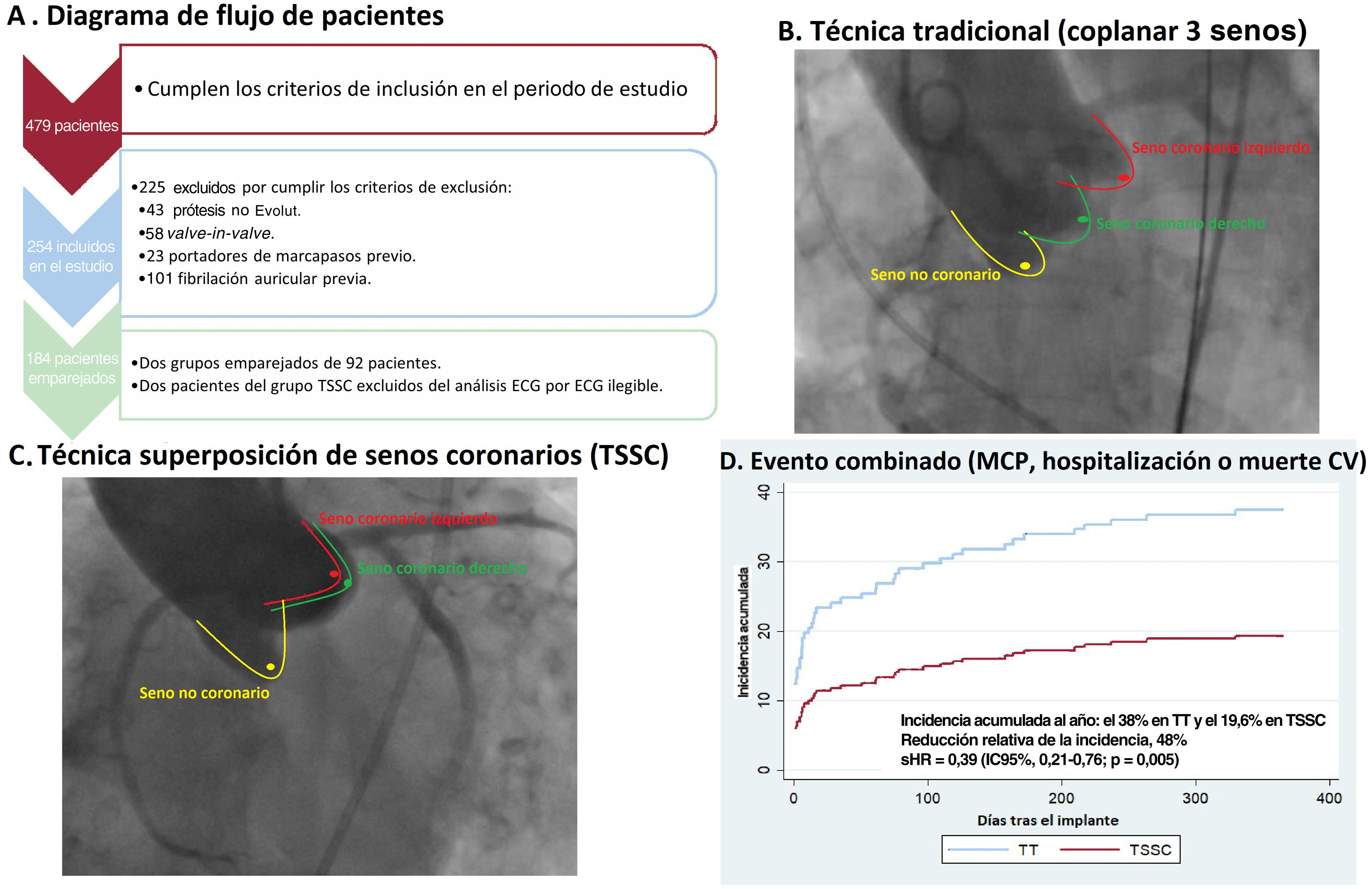
De 478 pacientes, 254 cumplieron los criterios de inclusión/exclusión (figura 1A). Teniendo en cuenta informes anteriores que indicaban una mejora de la profundidad del implante modificando su proyección7,8, a partir del 1 de febrero de 2019, la TT se cambió por TSSC para optimizar la profundidad de los implantes. Nuestro estudio aprovechó esta modificación de la práctica habitual para comparar 2 grupos de pacientes consecutivos: grupo A de 162 pacientes consecutivos (1 de enero 2015-1 febrero de 2019) con TT y grupo B de 92 pacientes consecutivos (2 de febrero de 2019-31 de enero de 2021) con TSSC. El estudio fue aprobado por el comité de ética (aprobación 2022.296) y todos los pacientes firmaron consentimiento informado.
Figura central. A: gráfico de flujo de los pacientes incluidos en el estudio. B: aortografía al momento de la liberación de la prótesis en TT. C: aortografía al momento de la liberación de la prótesis en TSSC. D: gráfico de Kaplan-Meier para el objetivo primario del evento cardiovascular combinado. CV: causa cardiovascular; IC95%: intervalo de confianza del 95%; MCP: implante de marcapasos definitivo; sHR: subhazard ratio de Fine-Gray; TSSC: técnica de superposición de senos coronarios; TT: técnica tradicional de implante coplanar de los 3 senos.
Se registraron las características basales de los pacientes, las variables relacionadas con el procedimiento y las del seguimiento. Se realizó seguimiento clínico durante 1 año, registrando los siguientes eventos cardiovasculares: necesidad de marcapasos definitivo, hospitalización o muerte (tanto cardiovascular como por cualquier causa).
Técnica de implante de prótesis aórtica trasvalvularA todos los pacientes seleccionados para TAVI se les hizo una tomografía computarizada multicorte con contraste y sincronizada con ECG para obtener imágenes de alta calidad del plano valvular aórtico, seguido de posprocesado con software específico (3Mensio StructuralHeart, Pie Medical Imaging, Países Bajos) para determinar las medidas y las proyecciones de trabajo. Se determinó la TSSC mediante el solapamiento de los senos coronarios izquierdo y derecho, aislando el seno no coronario, mientras que la TT se caracterizó por el alineamiento de las 3 cúspides en un mismo plano (figura 1B y C). El procedimiento para el implante y la técnica para medir la profundidad de las prótesis implantadas se ha explicado previamente4. El tamaño de la prótesis se seleccionó para cada paciente individual siguiendo las recomendaciones del fabricante, en función del perímetro del anillo aórtico. El uso de estimulación rápida por marcapasos, predilatación o posdilatación se dejó a juicio del intervencionista.
Objetivos primarios y secundariosLos objetivos primarios fueron los cambios en el ECG y un combinado de necesidad de implante de marcapasos definitivo, hospitalización o muerte por causas cardiovasculares. Los objetivos secundarios fueron los componentes individuales del objetivo combinado y la hospitalización o muerte por cualquier causa.
Análisis del electrocardiogramaSe tomó un ECG de todos los pacientes en las 24 h previas al implante, 24 h tras el implante y al año de seguimiento. Los trastornos de la conducción se clasificaron según la guía de práctica clínica vigente9. Se registraron los datos electrocardiográficos y se determinó la morfología y la duración (en milisegundos) de las ondas y los segmentos. Se comparó el ECG en las 24 h previas al TAVI tanto con ECG en las 24 h tras el TAVI como con el ECG al año. También se comparó el ECG de 24 h tras el TAVI con el ECG al año. Para evitar el sesgo interobservadores, un solo investigador se encargó del análisis exhaustivo del ECG mediante la herramienta compás digital del software IntelliSpace ECG (Koninklijke Philips N.V., Países Bajos), con magnificación de hasta 25×sin pérdida de resolución. Las mediciones consistieron en determinar los milisegundos de duración de la onda P, QRS, Onda T, segmento PR e intervalo QT. El intervalo QT fue corregido (QTc) utilizando la fórmula de Bazzet.
Análisis estadísticoLas variables continuas se expresan como media±desviación estándar. Las variables cualitativas se expresan en frecuencia absoluta (porcentaje). Dado que se trató de un estudio observacional, para controlar las características basales potencialmente no equilibradas se utilizó un emparejamiento por propensión. Los parámetros utilizados fueron los del vecino más cercano, 1:1 y sin reemplazo, estableciéndose un calibre de 0,05. Las variables incluidas en la puntuación de propensión fueron las 24 variables que componen la tabla 1. Dado que el valor de p depende del tamaño muestral, las características basales también se compararon mediante la diferencia de medias estandarizadas. Valores absolutos de 0,1 (sinónimo del 10% de la desviación estándar de esta variable) se consideran diferencias relevantes.
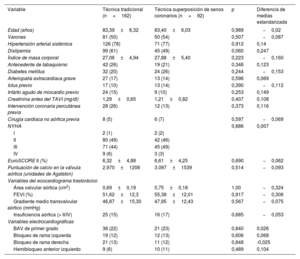
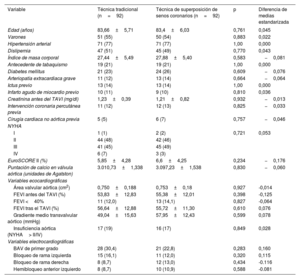
Características basales de los pacientes incluidos en el estudio previas al emparejamiento por propensión
| Variable | Técnica tradicional (n=162) | Técnica superposición de senos coronarios (n=92) | p | Diferencia de medias estandarizada |
|---|---|---|---|---|
| Edad (años) | 83,39±6,32 | 83,40±6,03 | 0,989 | −0,02 |
| Varones | 81 (50) | 50 (54) | 0,507 | −0,087 |
| Hipertensión arterial sistémica | 126 (78) | 71 (77) | 0,912 | 0,14 |
| Dislipemia | 99 (61) | 45 (49) | 0,060 | 0,247 |
| Índice de masa corporal | 27,06±4,94 | 27,88±5,40 | 0,223 | −0,160 |
| Antecedente de tabaquismo | 42 (26) | 19 (21) | 0,346 | 0,123 |
| Diabetes mellitus | 32 (20) | 24 (26) | 0,244 | −0,153 |
| Arteriopatía extracardiaca grave | 27 (17) | 13 (14) | 0,596 | 0,069 |
| Ictus previo | 17 (10) | 13 (14) | 0,390 | −0,112 |
| Infarto agudo de miocardio previo | 24 (15) | 9 (10) | 0,253 | 0,149 |
| Creatinina antes del TAVI (mg/dl) | 1,29±0,65 | 1,21±0,82 | 0,407 | 0,108 |
| Intervención coronaria percutánea previa | 28 (26) | 12 (13) | 0,373 | 0,116 |
| Cirugía cardiaca no aórtica previa | 8 (5) | 6 (7) | 0,597 | −0,069 |
| NYHA | 0,686 | 0,007 | ||
| I | 2 (1) | 2 (2) | ||
| II | 80 (49) | 42 (46) | ||
| III | 71 (44) | 45 (49) | ||
| IV | 9 (6) | 3 (3) | ||
| EuroSCORE II (%) | 6,32±4,88 | 6,61±4,25 | 0,690 | −0,062 |
| Puntuación de calcio en la válvula aórtica (unidades de Agatston) | 2.970±1206 | 3.097±1539 | 0,514 | −0,093 |
| Variables del ecocardiograma trastorácico | ||||
| Área valvular aórtica (cm2) | 0,69±0,19 | 0,75±0,18 | 1,00 | −0,324 |
| FEVI (%) | 51,62±12,3 | 55,38±12,01 | 0,917 | −0,306 |
| Gradiente medio transvalvular aórtico (mmHg) | 46,87±15,30 | 47,95±12,43 | 0,567 | −0,075 |
| Insuficiencia aórtica (> II/IV) | 25 (15) | 16 (17) | 0,685 | −0,053 |
| Variables electrocardiográficas | ||||
| BAV de primer grado | 36 (22) | 21 (23) | 0,840 | 0,026 |
| Bloqueo de rama izquierda | 19 (12) | 12 (13) | 0,606 | 0,068 |
| Bloqueo de rama derecha | 21 (13) | 11 (12) | 0,848 | -0,025 |
| Hemibloqueo anterior izquierdo | 9 (6) | 10 (11) | 0,489 | 0,104 |
BAV: bloqueo auriculoventricular; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: New York Heart Association; TAVI: implante percutáneo de válvula aórtica.
Los valores expresan n (%) o media±desviación estándar.
Para las variables cuantitativas se efectuó análisis de normalidad mediante el test de Shapiro-Wilk. Los cambios cuantitativos en el ECG se evaluaron mediante la prueba de la t de Student para muestras independientes si presentaban distribución normal o la prueba de la U de Mann-Whitney. Las variables cualitativas se compararon mediante la prueba exacta de Fischer. La mortalidad por cualquier causa se analizó mediante el método de Kaplan-Meier y el modelo de regresión de Cox para calcular la hazard ratio (HR). Para los demás objetivos se hizo un análisis de riesgos competitivos, utilizando el método de regresión de Fine y Gray para calcular la subhazard ratio (sHR)10 y calculando funciones de incidencia acumulada. Se tomó como evento competitivo la mortalidad por causa no cardiovascular para el objetivo combinado primario y para el objetivo de mortalidad cardiovascular; para el resto, la mortalidad por cualquier causa.
Se efectuó un análisis de sensibilidad para variables basales que pudiesen actuar como factores de confusión y no mostrasen un ajuste aceptable entre grupos a pesar de la puntuación de propensión.
Se hizo un subanálisis que incluyó la muestra no emparejada (n=254) y a los pacientes con fibrilación auricular (n=101); la muestra total fue de 357 pacientes. Se evaluaron los objetivos del estudio mediante un análisis de riesgos competitivos en esta cohorte. También se realizó un análisis multivariado para conocer el impacto de la fibrilación auricular y la técnica de implante respecto al objetivo primario combinado.
Se utilizó el paquete estadístico SPSS Statistics v27.0.1.0 (SPSS Inc., IBM, Estados Unidos) para todo el análisis estadístico excepto para el emparejamiento por propensión y los análisis por riesgos competitivos (función de incidencia acumulada y Fine-Gray), para los que se empleó el paquete estadístico STATA V14.2 (StataCorp, Estados Unidos).
RESULTADOSPoblaciónSe incluyó a un total de 254 pacientes. De ellos, el 36,2% (n=92) fueron implantes realizados mediante la TSSC. La media de edad fue de 83,4±6,21 años, 131 (52%) eran varones y el EuroSCORE II medio fue del 6,42%±4,66%. No hubo pérdidas de seguimiento. No hubo diferencias estadísticamente significativas entre los grupos de estudio en cuanto a características clínicas basales, de ECG basal o de ecocardiograma; sin embargo, la diferencia estandarizada de medias sí mostró diferencias tangibles (> 0,1 o <–0,1) entre ambos grupos en 12 de las variables de estudio (hipertensión, dislipemia, diabetes, índice de masa corporal, hábito tabáquico, ictus previo, infarto de miocardio previo, creatinina sérica previa, intervención coronaria percutánea previo, área valvular aórtica, fracción de eyección del ventrículo izquierdo [FEVI] y hemibloqueo anterior izquierdo), por lo que se aplicó el emparejamiento por propensión. Las características basales de la muestra no emparejada se muestran en la tabla 1. Para el subanálisis que incluyó a los pacientes con FA y la muestra no emparejada (n=357), la prevalencia de FA fue del 28,4% en el grupo de TT (n=64) y el 29,5% en el de TSCC (n=39), sin diferencias estadísticas entre grupos (p=0,904).
Resultados del emparejamiento por propensiónTras equilibrar ambos grupos por sus características basales, de los 254 pacientes incluidos inicialmente, se obtuvo una muestra emparejada de 184, 92 del grupo de TSSC (de los que se excluyó del análisis del ECG a 2 por ECG ilegible durante el seguimiento, aunque se los incluyó en el análisis de eventos clínicos) y 92 en el de TT. Tras el emparejamiento, la muestra total tenía una media de edad de 83,2±6,2 años, y el 55% eran varones. No hubo diferencias estadísticamente significativas en las características basales de ambos grupos (TT y TSSC). Los datos de las características de ambos grupos emparejados junto con el valor de p y la diferencia de medias estandarizadas se muestran en la tabla 2. Tampoco hubo diferencias significativas en la utilización de los diferentes grupos farmacológicos destinados a la insuficiencia cardiaca ().
Características basales de los pacientes incluidos en el estudio y emparejados por propensión
| Variable | Técnica tradicional (n=92) | Técnica de superposición de senos coronarios (n=92) | p | Diferencia de medias estandarizada |
|---|---|---|---|---|
| Edad (años) | 83,66±5,71 | 83,4±6,03 | 0,761 | 0,045 |
| Varones | 51 (55) | 50 (54) | 0,883 | 0,022 |
| Hipertensión arterial | 71 (77) | 71 (77) | 1,00 | 0,000 |
| Dislipemia | 47 (51) | 45 (49) | 0,770 | 0,043 |
| Índice de masa corporal | 27,44±5,49 | 27,88±5,40 | 0,583 | −0,081 |
| Antecedente de tabaquismo | 19 (21) | 19 (21) | 1,00 | 0,000 |
| Diabetes mellitus | 21 (23) | 24 (26) | 0,609 | −0,076 |
| Arteriopatía extracardiaca grave | 11 (12) | 13 (14) | 0,664 | −0,064 |
| Ictus previo | 13 (14) | 13 (14) | 1,00 | 0,000 |
| Infarto agudo de miocardio previo | 10 (11) | 9 (10) | 0,810 | 0,036 |
| Creatinina antes del TAVI (mg/dl) | 1,23±0,39 | 1,21±0,82 | 0,932 | −0,013 |
| Intervención coronaria percutánea previa | 11 (12) | 12 (13) | 0,825 | −0,033 |
| Cirugía cardiaca no aórtica previa | 5 (5) | 6 (7) | 0,757 | −0,046 |
| NYHA | ||||
| I | 1 (1) | 2 (2) | 0,721 | 0,053 |
| II | 44 (48) | 42 (46) | ||
| III | 41 (45) | 45 (49) | ||
| IV | 6 (7) | 3 (3) | ||
| EuroSCORE II (%) | 5,85±4,28 | 6,6±4,25 | 0,234 | −0,176 |
| Puntación de calcio en válvula aórtica (unidades de Agatston) | 3.010,73±1,338 | 3.097,23±1,538 | 0,830 | −0,060 |
| Variables ecocardiográficas | ||||
| Área valvular aórtica (cm2) | 0,750±0,188 | 0,753±0,18 | 0,927 | -0,014 |
| FEVI antes del TAVI (%) | 53,83±12,83 | 55,38±12,01 | 0,398 | -0,125 |
| FEVI <40% | 11 (12,0) | 13 (14,1) | 0,827 | -0,064 |
| FEVI tras el TAVI (%) | 56,64±12,88 | 55,72±11,30 | 0,610 | 0,076 |
| Gradiente medio transvalvular aórtico (mmHg) | 49,04±15,63 | 57,95±12,43 | 0,599 | 0,078 |
| Insuficiencia aórtica (NYHA> II/IV) | 17 (19) | 16 (17) | 0,849 | 0,028 |
| Variables electrocardiográficas | ||||
| BAV de primer grado | 28 (30,4) | 21 (22,8) | 0,283 | 0,160 |
| Bloqueo de rama izquierda | 15 (16,1) | 11 (12,0) | 0,320 | 0,115 |
| Bloqueo de rama derecha | 8 (8,7) | 12 (13,0) | 0,434 | -0.116 |
| Hemibloqueo anterior izquierdo | 8 (8,7) | 10 (10,9) | 0,588 | -0.081 |
BAV: bloqueo auriculoventricular; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: clase funcional de la New York Heart Association.
Los valores expresan n (%) o media±desviación estándar.
De los pacientes intervenidos para TAVI, se realizó predilatación valvular a 18 (19,6%) del grupo de TT y 13 (14,1%) del grupo de TSSC, sin diferencia estadísticamente significativa (p=0,431). Se realizó posdilatación valvular en 36 pacientes (39,1%) en el grupo de TT y 27 (29,3%) del de TSSC, sin diferencias estadísticamente significativas entre grupos (p=0,214). El tamaño promedio de las prótesis implantadas fue de 28,88±2,69mm en el grupo de TT y 29,62±2,88mm en el de TSSC, sin diferencias estadísticamente significativas entre grupos (p=0,146).
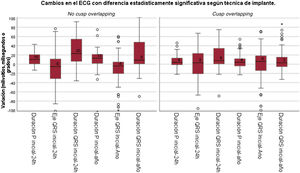
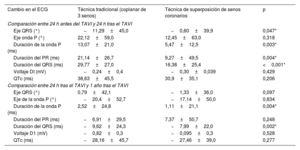
Alteraciones electrocardiográficasSe observó una menor prolongación del QRS y de la onda P en el grupo de TSSC en comparación con el de TT, tanto 24 h tras el implante (p <0,001 y p=0,003 respectivamente) como al año (p=0,002 y p=0,004) (tabla 3 y figura 2). En cuanto al cambio de eje del QRS, fue mayor en el grupo de TT tanto inmediatamente después del procedimiento como al año de seguimiento (p=0,047) (tabla 3 y figura 2).
Cambios en duración o voltaje de las distintas ondas e intervalos del electrocardiograma
| Cambio en el ECG | Técnica tradicional (coplanar de 3 senos) | Técnica de superposición de senos coronarios | p |
|---|---|---|---|
| Comparación entre 24 h antes del TAVI y 24 h tras el TAVI | |||
| Eje QRS (°) | −11,29±45,0 | −0,60±39,9 | 0,047* |
| Eje onda P (°) | 22,12±59,0 | 12,45±63,0 | 0,318 |
| Duración de la onda P (ms) | 13,07±21,0 | 5,47±12,5 | 0,003* |
| Duración del PR (ms) | 21,14±26,7 | 9,27±49,5 | 0,004* |
| Duración del QRS (ms) | 29,77±27,0 | 16,38±25,4 | <0,001* |
| Voltaje DI (mV) | −0,24±0,4 | −0,30±0,039 | 0,429 |
| QTc (ms) | 38,63±45,5 | 30,9±35,1 | 0,206 |
| Comparación entre 24 h tras el TAVI y 1 año tras el TAVI | |||
| Eje QRS (°) | 0,79±42,1 | −1,33±36,0 | 0,097 |
| Eje de la onda P (°) | −20,4±52,7 | −17,14±50,0 | 0,834 |
| Duración de la onda P (ms) | 2,52±24,8 | 1,11±21,1 | 0,004* |
| Duración del PR (ms) | −6,91±29,5 | 7,37±50,7 | 0,248 |
| Duración del QRS (ms) | −9,62±24,3 | −7,99±22,0 | 0,002* |
| Voltaje D1 (mV) | −0,82±0,3 | −0,095±0,3 | 0,528 |
| QTc (ms) | −28,16±45,7 | −27,46±39,0 | 0,277 |
ECG: electrocardiograma; TAVI: implante percutáneo de válvula aórtica.
Los valores expresan media±desviación estándar.
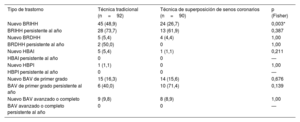
La TSSC redujo de manera estadísticamente significativa la aparición de nuevo bloqueo de rama izquierda del haz de His (BRIHH) (24 casos [27%] frente a 45 [48%] en el grupo de TT; p=0,003). No hubo diferencias estadísticamente significativas en la incidencia de otros trastornos de la conducción intraventricular o auriculoventricular. Al considerar la persistencia de estos trastornos al año (en caso de que se presentara inmediatamente tras el procedimiento y persistiera al año de seguimiento), no hubo diferencias (tabla 4).
Comparación de los trastornos en la conducción intraventricular y auriculoventricular tras el procedimiento y al año
| Tipo de trastorno | Técnica tradicional (n=92) | Técnica de superposición de senos coronarios (n=90) | p (Fisher) |
|---|---|---|---|
| Nuevo BRIHH | 45 (48,9) | 24 (26,7) | 0,003* |
| BRIHH persistente al año | 28 (73,7) | 13 (61,9) | 0,387 |
| Nuevo BRDHH | 5 (5,4) | 4 (4,4) | 1,00 |
| BRDHH persistente al año | 2 (50,0) | 0 | 1,00 |
| Nuevo HBAI | 5 (5,4) | 1 (1,1) | 0,211 |
| HBAI persistente al año | 0 | 0 | — |
| Nuevo HBPI | 1 (1,1) | 0 | 1,00 |
| HBPI persistente al año | 0 | 0 | — |
| Nuevo BAV de primer grado | 15 (16,3) | 14 (15,6) | 0,676 |
| BAV de primer grado persistente al año | 6 (40,0) | 10 (71,4) | 0,139 |
| Nuevo BAV avanzado o completo | 9 (9,8) | 8 (8,9) | 1,00 |
| BAV avanzado o completo persistente al año | 0 | 0 | — |
BAV: bloqueo auriculoventricular; BRDHH: bloqueo rama derecha del haz de His; BRIHH: bloqueo de rama izquierda del haz de His; HBAI: hemibloqueo anterior izquierdo.
Se muestra el valor de significación estadística del test exacto de Fisher.
Los valores expresan n (%).
p <0,05. Para el análisis de persistencia de alteraciones en el electrocardiograma al año hubo las siguientes pérdidas de seguimiento por fallecimiento: grupo de TT con 7 en BRIHH, 1 en BRDHH, 4 en HBAI, 0 en HBPI y BAV primer grado y 9 en BAV avanzado o completo; en el grupo de TSSC, con 3 en BRIHH, 3 en BRDHH, 0 en HBAI y HBPI, 0 en BAV primer grado y 4 en BAV avanzado o completo.
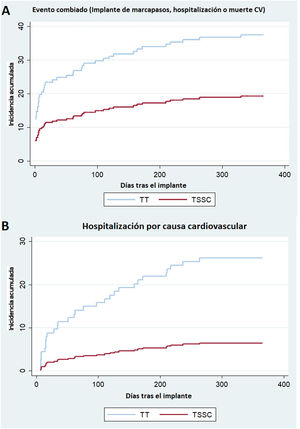
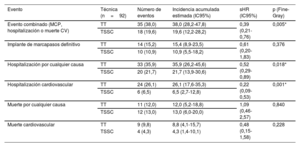
El evento cardiovascular combinado (implante de marcapasos definitivo, hospitalización o muerte de causa cardiovascular) ocurrió en 35 pacientes (38,0%) del grupo de TT, con una incidencia acumulada estimada del 38,0% (28,2-47,8), y en 18 pacientes (19,6%) del grupo de TSSC con una incidencia acumulada estimada del 19,6% (12,2%-28,2), con una diferencia estadísticamente significativa (p=0,005) (figura 1D y figura 3A). El análisis de Fine y Gray demostró una reducción del riesgo del evento cardiovascular combinado (sHR=0,39; intervalo de confianza del 95% [IC95%], 0,21-0,76; p=0,005) con la TSSC frente a la TT. En el análisis de sensibilidad, incluyendo el BAV de primer grado como covariable, se continuó observando un menor riesgo del evento cardiovascular combinado en el grupo de TSSC (sHR=0,457; IC95%, 0,258-0,810; p=0,007).
Incidencia acumulada del evento cardiovascular combinado: necesidad de marcapasos definitivo, hospitalización o muerte cardiovasculares (A) y eventos de hospitalización cardiovascular (B). TSSC: técnica de superposición de senos coronarios; TT: técnica tradicional de implante coplanar de los 3 senos.
El análisis individual de los eventos cardiovasculares del evento combinado y los nuevos episodios de hospitalización y muerte por cualquier causa se muestran en la tabla 5. Hubo una menor incidencia acumulada de la hospitalización por cualquier causa en el grupo de TSSC: 20 eventos (21,7%; IC95%, 13,9-30,6) frente a 33 en el de TT (35,9%; IC95%, 26,2-45,6; p=0,018) y en la hospitalización por causa cardiovascular (6 [6,5%] frente a 24 [26,1%] eventos en el grupo de TT; p <0,001) (figura 3B). De los pacientes con hospitalización de causa cardiovascular, la hospitalización por insuficiencia cardiaca ocurrió en el 16% (n=13) del grupo de TT frente a 2 casos (2,5%) en el grupo de TSSC. En la se muestran por grupos las causas de ingreso cardiovascular.
Comparación al año de eventos en los grupos de TT y TSSC
| Evento | Técnica (n=92) | Número de eventos | Incidencia acumulada estimada (IC95%) | sHR (IC95%) | p (Fine-Gray) |
|---|---|---|---|---|---|
| Evento combinado (MCP, hospitalización o muerte CV) | TT | 35 (38,0) | 38,0 (28,2-47,8) | 0,39 (0,21-0,76) | 0,005* |
| TSSC | 18 (19,6) | 19,6 (12,2-28,2) | |||
| Implante de marcapasos definitivo | TT | 14 (15,2) | 15,4 (8,9-23,5) | 0,61 (0,20-1,83) | 0,376 |
| TSSC | 10 (10,9) | 10,9 (5,5-18,2) | |||
| Hospitalización por cualquier causa | TT | 33 (35,9) | 35,9 (26,2-45,6) | 0,52 (0,29-0,89) | 0,018* |
| TSSC | 20 (21,7) | 21,7 (13,9-30,6) | |||
| Hospitalización cardiovascular | TT | 24 (26,1) | 26,1 (17,6-35,3) | 0,22 (0,09-0,53) | 0,001* |
| TSSC | 6 (6,5) | 6,5 (2,7-12,8) | |||
| Muerte por cualquier causa | TT | 11 (12,0) | 12,0 (5,2-18,8) | 1,09 (0,46-2,57) | 0,840 |
| TSSC | 12 (13,0) | 13,0 (6,0-20,0) | |||
| Muerte cardiovascular | TT | 9 (9,8) | 8,8 (4,1-15,7) | 0,48 (0,15-1,58) | 0,228 |
| TSSC | 4 (4,3) | 4,3 (1,4-10,1) |
CV: cardiovascular; IC95%: intervalo de confianza del 95%; MCP: implante de marcapasos definitivo; sHR: subhazard ratio como resultado del análisis de Fine-Gray; TSSC: técnica de superposición de senos coronarios; TT: técnica tradicional de implante (coplanar de 3 senos).
La muerte por cualquier causa fue el único evento analizado mediante Kaplan-Meier y regresión de riesgos proporcionales de Cox, al no tener un evento competitivo. Los valores expresan n (%) o media±desviación estándar.
Se observó una reducción estadísticamente significativa del evento cardiovascular combinado en el grupo de TSSC comparado con el de TT (sHR=0,54; IC95%, 0,38-0,76) ().
Se mantuvo la reducción de las hospitalizaciones por cualquier causa y por causa cardiovascular y se observó una reducción estadísticamente significativa en la necesidad de implante de marcapasos definitivo (incidencia acumulada ajusta por mortalidad por cualquier causa del 21,3% en el grupo de TT frente al 12,1% en el de TSSC; sHR=0,54; IC95%, 0,31-0,95; p=0,031) ().
En el análisis multivariable se observó que tanto la presencia de FA (factor de riesgo) como la técnica de implante (TSSC como factor protector) fueron variables predictoras del objetivo primario combinado ().
DISCUSIÓNLos hallazgos principales de nuestro estudio demuestran que el uso de la TSSC se asocia con un menor ensanchamiento del QRS y la onda P, una reducción del evento combinado y una reducción de las hospitalizaciones cardiovasculares o por cualquier causa en comparación con la TT. Mediante la TSSC también se redujo de manera estadísticamente significativa la incidencia de BRIHH.
El haz de His es fundamental para mantener la sincronía auriculoventricular e interventricular, transcurre a través de la porción membranosa del septo intraventricular, anatómicamente muy próximo a los senos de Valsalva derecho y no coronariano11. Por su localización anatómica, este componente se puede ver más afectado cuanto más profundo sea el TAVI. La profundidad del TAVI también conlleva cambios hemodinámicos, y se ha observado en estudios in vitro que implantes menos profundos tienen menos estasis sanguínea en los nuevos senos coronarios y, por lo tanto, menor riesgo de trombosis de dichos velos y mejor flujo coronario12.
La profundidad del TAVI es un campo de investigación en crecimiento. Sin embargo, no hay una técnica estandarizada para calcularlo, lo que es una limitación para interpretar la literatura existente. El método del borde más profundo se ha aceptado como el más estricto para establecer la relevancia de sus consecuencias13. Para las prótesis autoinflables se considera óptimo un implante si su profundidad por debajo del anillo aórtico es <6 mm y se asocia con menor necesidad de marcapasos definitivo14. No se ha demostrado que implantes menos profundos reduzcan las fugas paravalvulares15. El TAVI autoinflable mediante TSSC consigue implantes menos profundos en el tracto de salida del ventrículo izquierdo cuando se mide desde el seno no coronariano y con la media del no coronariano y el coronariano izquierdo, pero no cuando se utiliza el método del borde más profundo4.
En esta investigación solo se estudiaron prótesis autoexpandibles, que tienen demostrados mayor incidencia de BRIHH, mayor prolongación del intervalo PR y mayor necesidad de marcapasos pasadas 24 h del implante que las prótesis expandibles con balón16,17. El implante con TSSC de prótesis expandibles con balón es un campo aún en estudio. Un análisis reciente ha determinado que también es factible y seguro consiguiendo implantes con una profundidad de 3,0±1,4mm y una tasa baja de mortalidad e implante de marcapasos a 1 mes del TAVI18, si bien se requerirán estudios comparativos y con seguimiento más prolongado para determinar la incidencia de eventos en ambos grupos.
En nuestro estudio, el TAVI mediante TSSC reduce la incidencia de BRIHH y las prolongaciones de la onda P, el complejo QRS y el intervalo QT. La menor prolongación en la duración de la onda P detectada en la TSSC frente a la TT es un hallazgo novedoso de nuestro estudio. Hasta donde llega el conocimiento de los autores, la comparación de 2 técnicas de implante de válvulas autoexpandibles no se ha publicado antes. En una investigación en la que se incluyó a 52 pacientes (32 con prótesis autoexpandibles y 20 de expandible con balón, sin diferencias en los resultados), el TAVI se asoció con una menor duración de la onda P al comparar los ECG de 24 h y 6 meses tras el TAVI frente al ECG previo al TAVI, si bien hay que destacar que la metodología de medición de la onda P fue distinta, ya que para cada ECG se registraban la derivación de menor duración y la de mayor duración de la onda P19. En nuestra investigación se aprecia una mayor prolongación de la onda P en el ECG de las primeras 24 h, que se hace más estrecha en el ECG del año de seguimiento. La menor prolongación en la onda P tras implante mediante TSSC es un hallazgo relevante, ya que una duración> 120 ms implicaría la existencia de bloqueo interauricular, si bien su clasificación dependerá de la morfología de la onda P en derivaciones inferiores20. La presencia de bloqueo interauricular avanzado se asocia con mayor mortalidad e incidencia de FA e ictus en los pacientes tratados mediante TAVI21. Es necesario aportar nuevos estudios que corroboren este hallazgo y determinen la asociación entre TAVI y la aparición de bloqueo interauricular.
Si bien en la muestra emparejada hubo menor necesidad de marcapasos al año en el grupo de TSSC (10 frente a 14 en el grupo de TT), no se alcanzó diferencia estadísticamente significativa, probablemente debido a una baja potencia estadística. En el subanálisis de la muestra total (n=357), que incluye a los pacientes con fibrilación auricular, sí se obtuvo una reducción estadísticamente significativa de la necesidad de marcapasos definitivo en el grupo de TSSC. Un estudio con seguimiento a 30 días, multicéntrico y con una muestra mayor de pacientes ha publicado los resultados con una reducción de la necesidad de marcapasos definitivo4.
Otro factor que podría influir en estos hallazgos es la mayor prevalencia numérica de BRDHH en el grupo de TSSC (el 13 frente al 8,7% del de TT), pese a no ser estadísticamente significativa. Es ampliamente conocido que los pacientes con mayor riesgo de BAV tras el TAVI son los que presentan BRDHH de base22. En un metanálisis con seguimiento a 30 días se observó una reducción estadísticamente significativa de la necesidad de marcapasos en pacientes sometidos a TAVI mediante TSSC (odds ratio [OR]=0,49; IC95%, 0,36-0,66; p <0,001), pero no se observó una reducción estadísticamente significativa del BRIHH (OR=0,91; IC95%, 0,67-1,25)23. Un segundo metanálisis, tras analizar 11 estudios con una muestra total de 3.207 pacientes, obtuvo resultados muy similares a los nuestros, y demostró una reducción estadísticamente significativa de los implantes de marcapasos definitivo en el grupo de TSSC comparado con el de TT (OR=0,48; IC95%, 0,33-0,70; p=0,001); pese a haber cierta tendencia a una reducción de los BRIHH, no alcanzó diferencias estadísticamente significativas (OR=0,82; IC95%, 0,47-1,45; p=0,418)24.
Con los datos obtenidos en el presente estudio, el TAVI mediante la TSSC consigue reducir el evento combinado cardiovascular, principalmente a expensas de reducir el número de hospitalizaciones por causa cardiovascular, que también presentó una diferencia estadísticamente significativa. Estos hallazgos se mantienen tras incluir en el análisis a los pacientes con fibrilación auricular. Para controlar la posible influencia del tratamiento médico en el pronóstico de los pacientes, se estudió el tratamiento médico con potencial pronóstico (bloqueadores beta, inhibidores de la enzima de conversión de la angiotensina/antagonistas del receptor de la angiotensina II/inhibidores de la neprilisina y el receptor de la angiotensina, antagonistas del receptor de mineralocorticoides o inhibidores del cotransportador de sodio-glucosa 2) que recibieron, sin diferencias estadísticamente significativas entre los grupos ni al alta ni al año del seguimiento (). La reducción de la incidencia de nuevos BRIHH y de implante de marcapasos definitivo (este último sin una diferencia estadísticamente significativa en la muestra emparejada) tiene trascendencia clínica, ya que, al menos en parte, podría explicar las menores incidencias del evento cardiovascular combinado y de hospitalización cardiovascular observadas, pues en estudios observacionales y en un metanálisis se ha visto que los pacientes con nuevos BRIHH tras un TAVI presentan mayor mortalidad al año y que tanto los que requieren implante de marcapasos definitivo como los que presentan un nuevo BRIHH tienen mayor mortalidad por cualquier causa, mayor número de hospitalización por insuficiencia cardiaca25,26 y mayor deterioro de la FEVI25.
Este estudio presenta como limitaciones que es observacional y no aleatorizado. A pesar de incluir a 479 pacientes iniciales, tras aplicar los criterios de exclusión y el emparejamiento por propensión, el número de participantes se redujo sustancialmente. Sin embargo, el emparejamiento de los pacientes por propensión hace que los resultados obtenidos sean de gran calidad y que los grupos comparados sean homogéneos en cuanto a sus características basales. Dado que el objetivo es analizar los cambios en todas las ondas y segmentos del ECG, se excluyó a los pacientes con fibrilación auricular. Por otra parte, a pesar de que hubo tendencia a una menor prolongación del intervalo QTc en el grupo de TSSC (sin diferencias estadísticamente significativas), esta podría verse influida por las diferencias en la incidencia de BRIHH a favor del grupo de TSSC. La ausencia de estudio de disincronía en el ecocardiograma y el hecho de que todos los ECG fueron analizados por un solo investigador también podrían considerarse limitaciones. Además, los resultados serían aplicables exclusivamente a pacientes que reciben prótesis aórticas autoexpandibles.
Con los resultados obtenidos se crean nuevas evidencias a favor de la TSSC frente a la TT. Sería de interés realizar un ensayo clínico aleatorizado que compare ambas técnicas para confirmar los resultados favorables, tanto electrocardiográficos como clínicos.
CONCLUSIONESEl TAVI mediante TSSC produce menores incidencia de BRIHH, ensanchamiento del QRS y prolongación de la onda P, aunque aumenta el cambio de eje del QRS, en comparación con la TT. También se asoció con una reducción estadísticamente significativa del evento combinado cardiovascular, las hospitalizaciones cardiovasculares y las hospitalizaciones por cualquier causa.
FINANCIACIÓNNo recibida.
CONTRIBUCIÓN DE LOS AUTORESConcepto: Y.R. Persia-Paulino, M. Almendárez Lacayo, A. Alperi, C. Morís de la Tassa y P. Avanzas. Diseño: Y.R. Persia-Paulino, M. Almendárez Lacayo, A. Alperi, P. Avanzas e I. Pascual. Supervisión: D. Hernández-Vaquero, P. Avanzas e I. Pascual. Materiales: R. Fernáncez Asensio y J. Cuevas Pérez. Recolección de datos: Y.R. Persia-Paulino, M. Almendárez Lacayo, A. Alperi, A. Adeba, P. Flórez, M. Vigil-Escalera, R. Álvarez Velasco, A. Renilla y R. del Valle Fernández. Análisis e interpretación: Y.R. Persia-Paulino, M. Almendárez Lacayo, A. Alperi, D. Hernández-Vaquero, A. Renilla, R. del Valle Fernández, P. Avanzas y C. Morís de la Tassa. Revisión de la literatura: Y.R. Persia-Paulino, M. Almendárez Lacayo, A. Alperi, R. Fernáncez Asensio, J. Cuevas Pérez, P. Flórez, M. Vigil-Escalera, P. Avanzas e I. Pascual. Redacción: Y.R. Persia-Paulino, M. Almendárez Lacayo, A. Alperi y R. Álvarez Velasco. Revisión crítica: A. Adeba, C. Morís de la Tassa, P. Avanzas e I. Pascual. Los autores Y.R. Persia-Paulino, M. Almendárez Lacayo, A. Alperi han contribuido por igual al manuscrito.
CONFLICTO DE INTERESESP. Avanzas es editor asociado de Revista Española de Cardiología; se ha seguido el procedimiento editorial establecido en la Revista para garantizar la gestión imparcial del manuscrito. Los demás autores no declaran conflictos de intereses.
- –
El implante percutáneo de válvula aórtica se asocia con trastornos en la conducción auriculoventricular e intraventricular. La aparición de nuevo bloqueo de rama izquierda o necesidad de marcapasos tras el procedimiento se asocia con mayor incidencia de efectos adversos durante el seguimiento. La técnica de superposición de senos coronarios reduce la necesidad de marcapasos a 30 días.
- –
La técnica de superposición de senos coronarios reduce la incidencia inmediata de bloqueo de rama izquierda y produce menor ensanchamiento del QRS y el QTc. Estos beneficios se mantienen tras 1 año de seguimiento electrocardiográfico. La técnica de superposición de senos coronarios reduce el combinado cardiovascular de necesidad de marcapasos, hospitalización o muerte cardiovasculares tras 1 año de seguimiento, principalmente a expensas de menos hospitalizaciones cardiovasculares.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2023.04.007