El shock cardiogénico continúa siendo uno de los principales retos de la medicina cardiovascular de nuestro tiempo. El trasplante cardiaco urgente es el tratamiento de reemplazo cardiaco más empleado en España para los pacientes candidatos sin recuperación cardiaca. Esta estrategia tiene importantes connotaciones relacionadas con el principio de equidad y ligadas a las características del receptor y el donante y la accesibilidad de los órganos. Por un lado, en la selección del receptor es clave superar la fase de fracaso multiorgánico antes de plantear el trasplante. Por otro, es necesario ampliar el total de donantes a través de diferentes estrategias que permitan dar respuesta al mayor número de candidatos, incluso empleando órganos subóptimos. El uso de dispositivos de asistencia ventricular de larga duración como alternativa al trasplante ha de considerarse ante la escasez de donantes y los buenos resultados. Por último, el diseño de los criterios de distribución de órganos continúa siendo un reto en constante evolución dado que no existe un sistema universal capaz de dar respuesta a todos los problemas que se plantean. La adjudicación de órganos a los pacientes más críticos puede proporcionar un gran beneficio individual siempre que no afecte significativamente al bien común.
Palabras clave
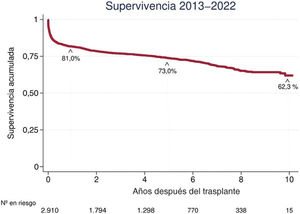
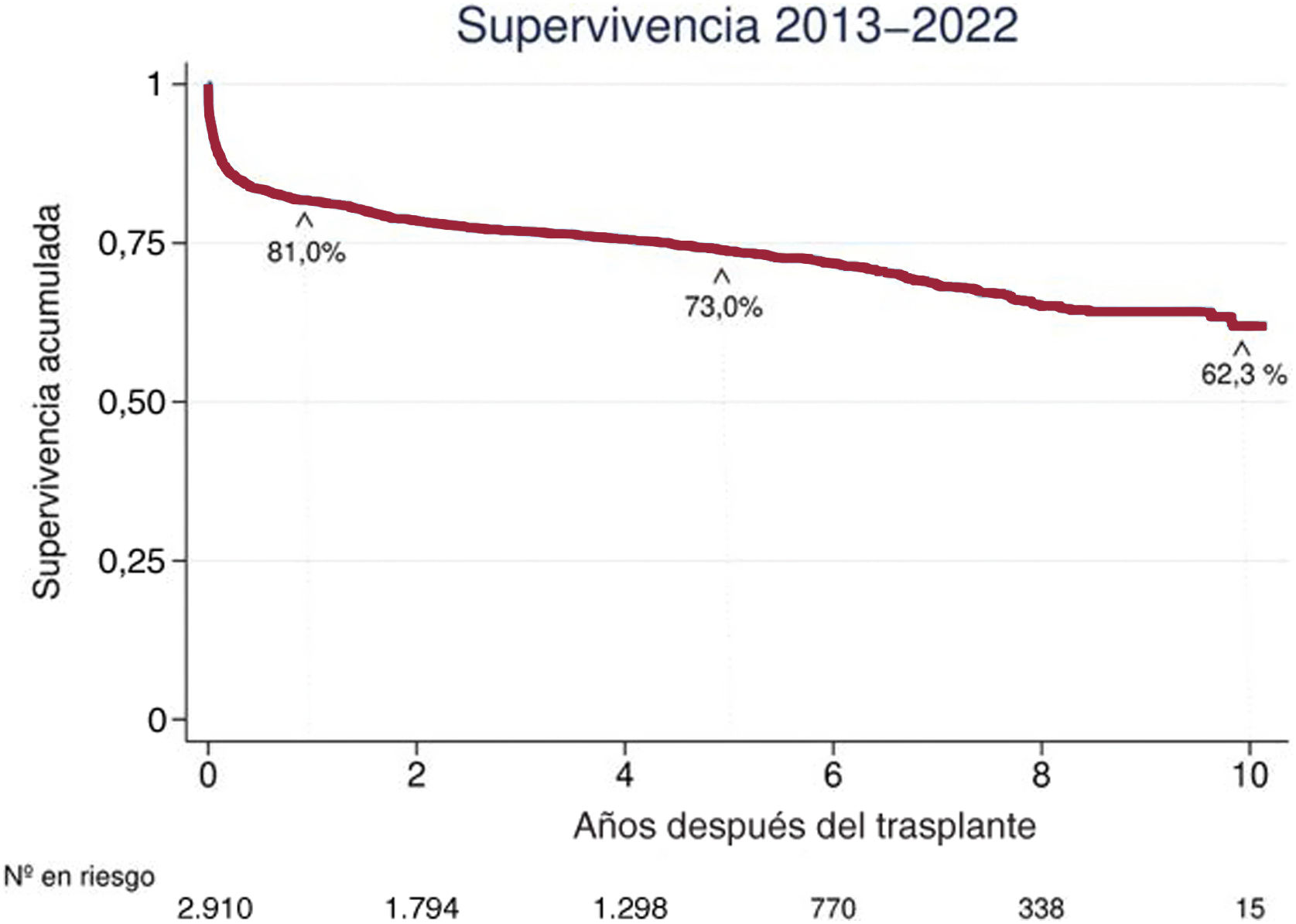
Sin lugar a dudas, el trasplante cardiaco (TxC) ha cambiado drásticamente el pronóstico de las cardiopatías terminales. Desde aquel histórico primer TxC realizado por el Dr. Christiaan Barnard en 1967 en Sudáfrica hasta hoy, son miles los pacientes que se han beneficiado de este procedimiento1. En las últimas décadas se han producido numerosos avances en este campo, entre los que destacan: la creación de las organizaciones reguladoras de los trasplantes, el reconocimiento de las características del donante y el receptor que aumentan los riesgos del TxC2, la mejora en las técnicas de conservación de los órganos durante su trasporte, la utilización precoz de sistemas de soporte circulatorio mecánico (SCM) en los casos de fracaso precoz del injerto, los avances en la inmunología del trasplante y el conocimiento, la prevención y el tratamiento de las complicaciones a largo plazo de los pacientes trasplantados, entre otros3. Gracias a todas estas mejoras, la supervivencia del TxC se ha incrementado progresivamente. Datos del Registro Español de Trasplante Cardiaco muestran que en la actualidad el 73% de los trasplantados siguen vivos a los 5 años y el 62%, a los 10 años (figura 1)4.
Aun así, estamos lejos de considerar este abordaje la solución definitiva para la insuficiencia cardiaca (IC) avanzada, entre otros motivos por la limitación de suficientes donantes disponibles. Por ejemplo en España, en 2022 cada paciente tuvo que esperar una mediana de 100 días desde su inclusión en lista de espera electiva para llegar al trasplante5. Para aumentar el número de donantes cardiacos, en los últimos años se han desarrollado diferentes estrategias. Entre ellas destacan la aceptación de donantes con infección por virus de la hepatitis C, que puede tratarse en el receptor tras el TxC6, la aceptación de donantes añosos tras descartar enfermedad coronaria y, sobre todo, en los últimos años, la utilización de corazones procedentes de donantes en muerte circulatoria, que en 2023 supusieron hasta el 14% de todos los TxC realizados en Estados Unidos7 y el 18% de los practicados en España5. Sin embargo, la tasa de TxC en nuestro país ha variado poco en la última década, siempre alrededor de 300 procedimientos anuales.
Para conseguir que la mayoría de los pacientes candidatos a un TxC puedan llegar a trasplantarse con éxito y de manera equitativa, un grupo de profesionales españoles expertos en este campo se reúnen periódicamente para analizar los resultados y definir los criterios de distribución de los órganos dentro de la lista de espera. Con pequeñas variaciones, en los últimos años ha existido una categoría de TxC electivo para el paciente con IC avanzada en situación estable, y otra de TxC urgente que prioriza a los pacientes críticos, la mayoría en shock cardiogénico (SC) mantenidos con algún dispositivo de SCM temporal8. El porcentaje de pacientes que acceden al TxC en código urgente cada año en España se sitúa alrededor del 40% del total de los TxC realizados.
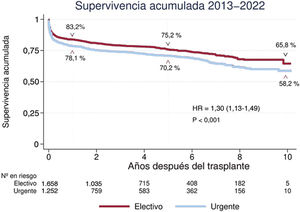
El dilema fundamental que se plantea al trazar unas directrices generales para la distribución de órganos es cómo equilibrar el bien común y asignar la mayor parte de los órganos a los pacientes más estables con potenciales mejores resultados globales, frente al bien individual de los pacientes en situación crítica, con una mortalidad a priori muy elevada, cuya única salida en ocasiones es el TxC. Dicho de otra forma, ¿cuánto riesgo es razonable asumir en favor de un individuo en situación crítica penalizando los resultados generales de un bien común, tan valioso y escaso como es el conjunto de injertos cardiacos disponibles? Cuanto más se aproximan los resultados entre el TxC electivo y el urgente, menor es el dilema. En España, en los últimos 10 años se ha observado una supervivencia de los pacientes electivos a 1 año del TxC del 83%, frente al 78% de los pacientes trasplantados en situación de urgencia, diferencias estadísticas significativas pero de poca relevancia clínica (figura 2). Estas diferencias se mantienen estables en el seguimiento a 5 y 10 años. ¿Son asumibles estos resultados?
EL RETO DE LA ATENCIÓN A PACIENTES EN SHOCK CARDIOGÉNICOLa atención de los pacientes en shock cardiogénico (SC) continúa siendo uno de los grandes retos de la medicina cardiovascular de nuestro tiempo. El tratamiento básico de estos pacientes se dirige a frenar el deterioro hemodinámico derivado de una afección cardiaca grave que conduce a una espiral de alteración metabólica caracterizada por hipoperfusión de múltiples órganos, de la que es difícil rescatar al paciente. Para ello, se emplean fármacos vasopresores e inotrópicos en primera línea y, en casos seleccionados refractarios a lo anterior, dispositivos de SCM de corta duración. La utilización de estos SCM ha crecido exponencialmente en los últimos años9. La complejidad del tratamiento de pacientes con SCM junto con otros cuidados críticos (asistencia respiratoria, renal, etc.) ha aumentado de forma significativa y hace muy recomendable disponer de unidades especializadas en SC, formadas por equipos multidisciplinarios de profesionales con medios técnicos apropiados para tratar adecuadamente estos procesos y sus complicaciones. Un mayor volumen de pacientes atendidos y la disponibilidad de una unidad de cuidados agudos cardiológicos se asocian con mejores resultados en el pronóstico de los pacientes en SC10. No obstante, pese a la utilización creciente de diversos dispositivos de SCM a lo largo de los últimos 15 años, la publicación del primer ensayo clínico aleatorizado que ha demostrado beneficio con uno de estos dispositivos no ha llegado hasta 2024. El estudio DanGer Shock11 evaluó el empleo sistemático del dispositivo Impella CP (una bomba de flujo continuo microaxial percutánea y transaórtica de Abiomed, Estados Unidos) en el contexto del SC tras un infarto agudo de miocardio. El grupo de control permitía el uso indiscriminado de cualquier otro dispositivo de SCM distinto del estudiado además del tratamiento médico habitual. Los resultados fueron significativamente favorables al grupo de intervención, con una reducción del riesgo relativo de mortalidad a 180 días del 26%, una reducción absoluta del 12% y un número de pacientes que es necesario tratar para evitar 1 muerte de 8. Pese a estos esperanzadores resultados, continuamos moviéndonos en un terreno con más incertidumbres que certezas, donde serán necesarios nuevos estudios para conocer el potencial beneficio de estos tratamientos en cada situación y con diferentes perfiles de pacientes11.
Además de los resultados del estudio DanGer Shock, existen otros argumentos que invitan a la esperanza en el futuro a medio y largo plazo en este campo. En primer lugar, en la comunidad cardiovascular hay un notable interés en buscar estrategias y tratamientos para el SC, reflejado en el enorme crecimiento de publicaciones científicas en revistas de alto impacto, su presencia en reuniones y sociedades científicas y en el interés que suscita hoy la subespecialidad de cuidados agudos cardiovasculares e IC entre los cardiólogos en formación. La IC y el SC como máximo exponente suponen hoy una de las principales cargas asistenciales de este tipo de unidades y desplaza afecciones clásicas como el síndrome coronario agudo12.
En segundo lugar, se están sentando las bases para mejorar la definición del perfil clínico de los pacientes en SC. El SC es una entidad cuya determinación no se basa en pruebas sencillas como el electrocardiograma o un biomarcador aislado. Se trata de un síndrome complejo con un espectro de gravedad que va desde situaciones previas al shock en las que todavía no hay datos de hipoperfusión claros hasta situaciones críticas cercanas o equivalentes a la parada cardiaca. La Society of Cardiovascular Angiography and Interventions (SCAI) ha contribuido a difundir y validar una clasificación de la gravedad del SC en 5 estadios (desde SCAI A —en riesgo— hasta SCAI E —SC refractario extremo—)13. Entre las virtudes de esta clasificación figuran la sencillez de su obtención en distintos momentos de la evolución del paciente, la excelente capacidad predictiva de mortalidad hospitalaria (validada en distintas series), la utilidad para homogeneizar la comunicación entre profesionales y la inclusión de pacientes con SC en futuros ensayos clínicos, aspectos que suponen un notable avance en el conocimiento de esta entidad.
Por último, y ante la dificultad de diseñar y llevar a cabo ensayos clínicos aleatorizados en el SC por motivos bien conocidos (dilemas éticos, posibilidad de retraso de tratamiento por la necesidad de consentimiento informado, el sesgo de exclusión de los pacientes más graves, etc.)14, se está tratando de demostrar beneficio en la protocolización del tratamiento de estos pacientes, tanto hospitalaria como en la creación de redes de SC que den cobertura a una determinada área sanitaria. Este tipo de organizaciones se están generalizando en muchos países y sus resultados son prometedores15–18.
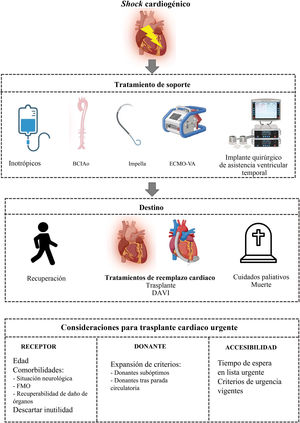
Los pacientes en SC tienen 3 posibles salidas del proceso: a) la recuperación de la función cardiaca y el destete de los dispositivos de asistencia; b) los tratamientos de reemplazo cardiaco (TRC): dispositivos de asistencia ventricular izquierda de larga duración (DAVI) o TxC para los pacientes candidatos sin recuperación cardiaca, y c) los cuidados paliativos para pacientes que no logran la recuperación cardiaca y no son candidatos a las anteriores (figura 3). Clásicamente, el SC tras infarto agudo de miocardio ha sido el más prevalente en las unidades de críticos cardiológicos, de ahí que la mayor parte de la evidencia en este campo provenga de estudios en SC de esta etiología19. En los pacientes con SC tras infarto agudo de miocardio, la proporción que acaba precisando o siendo candidata a TRC es baja, rara vez superior al 10% y en muchas ocasiones es anecdótica20–22. Sin embargo, la epidemiología del SC está cambiando, y cada vez son más frecuentes otras causas aglutinadas como SC por IC, bien sea en casos de novo o como agudización de una IC crónica17,22,23. En esta etiología la utilización de TRC es mayor, y puede oscilar en función del país y su accesibilidad entre un 7 y un 39%20,22,24.
Figura central. Pilares de tratamiento de los pacientes en shock cardiogénico (SC) y posibles salidas del proceso. Consideraciones del trasplante cardiaco urgente. El SC es un síndrome complejo en el que predomina la hipoperfusión celular por una afección cardiaca grave. Los fármacos inotrópicos y los dispositivos de soporte circulatorio mecánico (SCM) de corta duración son el tratamiento inicial para asistir a estos pacientes. En la evolución, existen 3 posibles salidas del proceso: a) recuperación de la función cardiaca y destete de los medios de asistencia; b) tratamiento de reemplazo cardiaco para pacientes candidatos sin recuperación cardiaca, y c) cuidados paliativos para pacientes sin recuperación cardiaca que no sean candidatos a las otras dos. El trasplante cardiaco como tratamiento de reemplazo cardiaco para los pacientes en SC tiene importantes consideraciones relacionadas con el receptor, el donante y el acceso a los órganos. BCIAo: balón de contrapulsación intraaórtico; DAVI: dispositivo de asistencia ventricular izquierda de larga duración; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; FMO: fallo multiorgánico.
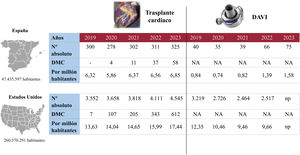
En nuestra unidad de shock, creada a finales de 201417, se ha atendido a más de 290 pacientes con SC. Si se excluye a los pacientes en SC tras cardiotomía, más de la mitad (58%) presentaban SC por IC. En el global de la serie, el 27% de los pacientes recibieron un TRC, cifra que aumenta al 45% en los casos de SC por IC. Es destacable en nuestro caso que 9 de cada 10 TRC fueron TxC. Nuestros datos contrastan en gran medida con otras series de países desarrollados. Así, en Estados Unidos, país con una accesibilidad al TxC similar o superior a la nuestra, los DAVI son el destino mayoritario de los pacientes en SC que precisan un TRC25. En la cohorte de más de 700 pacientes con SC por IC del Cardiogenic Shock Working Group, solo se realizaron 26 TxC de los 277 TRC empleados, lo que supone un 9%20. Por otro lado, el trabajo de Varshney et al. sobre datos de la Society of Thoracic Surgeons norteamericana refleja que aproximadamente un tercio de los pacientes que acceden a 1 de los 6.000 TRC/año lo hacen en situación de SC, y un 90% de ellos tienen una etiología diferente del SC tras infarto agudo de miocardio25. El análisis de esos pacientes que no están en SC tras infarto agudo de miocardio muestra que 2 tercios de estos TRC son DAVI y solo 1 tercio son TxC. Estas diferencias en la utilización de las 2 formas de TRC en el SC son seguramente multifactoriales, pero reflejan en gran medida el desarrollo de cada uno de estos tratamientos en los distintos medios (figura 4).
Comparación de los últimos 5 años entre España y Estados Unidos en cuanto al número total de trasplantes cardiacos, número de donantes en muerte circulatoria, implante de dispositivo de asistencia ventricular izquierda de larga duración (DAVI) y tasas por millón de habitantes5,7. DMC: donante en muerte cardiaca; NA: no aplica; np: no publicado.
Como vimos, aproximadamente el 40% de los TxC en España se realizan en código urgente4. El acceso relativamente rápido al TxC puede ser una de las claves de este elevado porcentaje, ya que la mediana de tiempo desde la entrada en lista de espera hasta la intervención en estos casos es de 5-6 días desde el año 201026. Sin embargo, el TxC urgente tiene un mayor riesgo de mortalidad que el electivo, con una razón de riesgos de 1,3 (1,2-1,5; p<0,001)4. Este hecho se repite en otras series internacionales, y podría ser una de los principales motivos de la disminución de la supervivencia total a 1 año observada en Estados Unidos (el 92,1 frente al 87,5%; log-rank test, p<0,001) tras el cambio en los criterios de distribución de órganos llevado a cabo en 2018, que favorece el acceso al TxC desde dispositivos de SCM de corta duración27.
También existen notables diferencias en cuanto a los tipos de SCM empleados en los distintos periodos estudiados. En España, el balón de contrapulsación intraaórtico fue la asistencia de elección en el 11% de los TxC entre 2014 y 2016, pero solo el 0,9% en 2023. En cambio, el acceso desde un oxigenador extracorpóreo de membrana venoarterial (ECMO-VA) se ha mantenido más estable, entre el 8 y el 14%4. Esto difiere de otros registros internacionales en los que el acceso al TxC desde un ECMO-VA es residual, y varía entre el 0,4 y el 1,1%28–30. Las diferencias se deben, entre otros motivos, a los cambios en los criterios de urgencia a lo largo del tiempo (figura 5)8.
Resumen evolutivo de los criterios de distribución de órganos de la Organización Nacional de Trasplantes del trasplante cardiaco en España (adultos) en las últimas 2 décadas. BCIAo: balón de contrapulsación intraaórtico; DAVI: implante de dispositivo de asistencia ventricular izquierda de larga duración; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; FMO: fallo multiorgánico; PRAc: panel reactivo de anticuerpos calculado; SCM: soporte circulatorio mecánico; VD: ventrículo derecho.
aPacientes con PRAc >50% y posibilidad de prueba cruzada virtual.
bIncluirían CentriMag (Abbott, Estados Unidos) con o sin oxigenador de membrana, Impella 5.0, Impella 5.5, Impella RP e Impella CP (todos de Abiomed, Estados Unidos) en pacientes con un área de superficie corporal <1,70 m2.
cCon o sin necesidad de tratamiento de desensibilización y sin límite de tiempo que tengan un PRAc >80% en 2 determinaciones consecutivas separadas al menos 1 mes, considerando solamente una intensidad de fluorescencia media (MFI) >5.000, en los que se pueda hacer prueba cruzada virtual.
El tipo de dispositivo de SCM parece influir en los resultados del TxC urgente. En todas las series, los pacientes trasplantados desde un ECMO-VA tienen mayor mortalidad que quienes lo hacen desde otros dispositivos de SCM, como el balón de contrapulsación intraaórtico o las bombas tipo Impella. A su vez, estos últimos tienen más mortalidad y fracaso primario del injerto que los que llegan al TxC desde fármacos vasoactivos. Probablemente estas diferencias no puedan atribuirse solo al tipo de dispositivo de SCM, sino también a las características clínicas de los pacientes que los reciben. De esta manera, los pacientes que llegan al TxC con un ECMO-VA suelen ser más jóvenes, aunque con un perfil de mayor gravedad, lo que hace que en los análisis ajustados las desigualdades se atenúen, al menos parcialmente25.
En datos de nuestra unidad de shock, la supervivencia de los pacientes tras el TxC fue del 83% al alta hospitalaria, significativamente superior a la del resto de los pacientes en SC (el 83 frente al 47%; p<0,001). Las principales características distintivas de los pacientes en SC cuya salida fue el TxC fueron una edad más joven (46 frente a 53 años; p<0,05) y el uso sistemático de dispositivos de SCM (el 100 frente al 78%; p<0,05). Los dispositivos más usados fueron las asistencias ventriculares temporales tipo Centrimag (el 53% de los casos), seguidos del ECMO-VA en el 31% y el Impella en el 17%. La mediana del tiempo en lista de espera fue de 6 días, y 3 pacientes fallecieron estando en lista. Los pacientes con mayor mortalidad hospitalaria tras el TxC fueron, de nuevo, los que llegaron con ECMO-VA (el 22 frente al 14% con otros tipos de SCM).
Los datos de nuestra unidad de shock son similares a los registrados en España. El estudio ASIST-TC analizó los resultados del TxC urgente en pacientes con SCM en los 16 centros con TxC de adultos en España desde 2010. La supervivencia 1 año después del TxC fue del 76%, con una mortalidad a los 90 días que oscilaba entre el 15 y el 25% en función del año. La media de edad de los pacientes en SC que recibieron un TxC fue 53 años (mayor que en nuestra serie) y la distribución en función del tipo de SCM empleado en el momento del TxC fue similar: el 35% de los pacientes tenían una asistencia ventricular temporal tipo Centrimag, seguidos del ECMO-VA en el 28% de los casos y, por último, dispositivos tipo Impella en el 8% de los casos. De nuevo, este estudio muestra que la supervivencia al año del TxC de los pacientes asistidos con ECMO-VA fue significativamente menor que con el resto de dispositivos (el 68% tras ECMO-VA frente al 79% en el caso del balón de contrapulsación intraaórtico, el 85% en dispositivos tipo Impella y un 74-80% para asistencias tipo Centrimag univentricular o biventricular respectivamente; log rank test, p=0,001). Además, el ECMO-VA previo al TxC fue predictor independiente de mortalidad en el análisis multivariante26.
La equidad en el acceso al TxC es un principio angular de cualquier sistema nacional de trasplante, de modo que la revisión periódica de los criterios de acceso siempre persigue un equilibrio para que el órgano acabe en el paciente que más lo necesite y en el que más probabilidad de supervivencia tenga tras el procedimiento. La selección de candidatos en SC que se van a beneficiar de un TxC no es tarea sencilla: a la edad y las comorbilidades, factores limitantes en cualquier grado de prioridad, se suman las consecuencias del fracaso multiorgánico secundario al deterioro hemodinámico del paciente y las complicaciones inherentes de los dispositivos de SCM (figura 3). La respuesta inflamatoria sistémica desmesurada y el estrés oxidativo que se producen en los pacientes en SC son mecanismos fisiopatológicos adversos que condicionan la afección de órganos clave en este proceso, como el hígado y los riñones. Esta afección multiorgánica se asocia en el periodo posoperatorio precoz con mayor tasa de hemorragias, trabajo respiratorio y fracaso primario del injerto. Por esta causa, se considera primordial esperar hasta la recuperación, al menos parcial, del daño multiorgánico. Aun sabiendo que la ventana de oportunidad puede ser estrecha antes de que surjan complicaciones asociadas con el proceso de SC o su tratamiento, se debe diferir la entrada del paciente en lista de espera urgente hasta que la fase inicial de vasoplejía haya pasado y la función de los principales órganos y sistemas esté recuperada. En este sentido, en España se ha constatado en los últimos años un ligero aumento en la media del tiempo entre el implante del dispositivo de SCM de corta duración y la entrada en lista de espera, que ha pasado de 2 a 4 días. Esto refleja los esfuerzos de todos los grupos por estabilizar al paciente antes de plantear la entrada en lista de TxC26.
Por otro lado, la urgencia provocada por la inestabilidad del proceso de SC hace que, en ocasiones, la selección del donante haya de ser menos exigente en estas situaciones. A este respecto, cabe destacar el trabajo de Han et al., que analizaron los resultados de pacientes trasplantados con SCM temporal, asumiendo criterios más permisivos para la selección del donante, como una fracción de eyección del ventrículo izquierdo <50%, edad >55 años, isquemia de más de 4 h o disparidad (missmatch) de la masa cardiaca <0,86 entre donante-receptor, y concluyeron que la mortalidad no aumentaba significativamente con respecto a los pacientes trasplantados con donantes óptimos31. Estos datos ayudan a los clínicos en la toma de decisiones ante la oferta de órganos subóptimos en situación de urgencia.
RESULTADOS DE LOS DISPOSITIVOS DE ASISTENCIA VENTRICULAR IZQUIERDA EN EL SHOCK CARDIOGÉNICOEl último y prácticamente único DAVI disponible en la actualidad es el HeartMate 3 (Abbott, Estados Unidos). Este dispositivo está basado, entre otras tecnologías, en una bomba con levitación magnética de flujo centrífugo, y se ha demostrado su clara superioridad en comparación con sus predecesores, tanto en supervivencia total (el 86 y el 64% frente al 79 y el 44% a 1 y 5 años respectivamente) como en supervivencia libre de complicaciones a 5 años del implante (trombosis de bomba [el 83 frente al 54%], ictus [el 87 frente al 67%] o hemorragias [el 72 frente al 60%])32. En países como Estados Unidos, el uso de TxC y DAVI, las 2 formas de TRC, obedece al principio de vasos comunicantes. Allí se realizan desde hace varios años unos 6.000 TRC anuales, aproximadamente la mitad de cada modalidad. En los últimos años, el número de TxC ha aumentado y, como consecuencia, ha habido una disminución del implante de DAVI, todo ello probablemente debido al cambio en los criterios de distribución de órganos llevado a cabo en 201832.
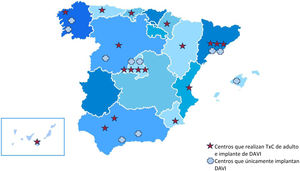
La experiencia en España es bastante menor en cuanto al número de DAVI implantados. En la actualidad existen 18 centros con TxC de adultos e implante de DAVI y 10 que solo implantan DAVI (figura 6). Mientras que la tasa de TxC por millón de habitantes en Estados Unidos es el doble de la española, la tasa de implantes de DAVI es unas 10 veces superior (figura 4). Es significativo que en España los resultados globales del implante de DAVI, publicados en el registro REGALAD, muestran supervivencias del 80 y el 75% a 1 y 2 años respectivamente, similares a las de las mejores series internacionales33.
Como cualquier intervención clínica, los resultados del implante de un DAVI pueden estar influidos, en buena parte, por la situación clínica del paciente34. En el último registro STS-INTERMACS32 publicado, el porcentaje de pacientes que recibieron un DAVI en situación de SC fue superior al 50% a lo largo de la última década (asumiendo que el SC es equivalente a los grados 1 y 2 de la escala INTERMACS)32. De esta manera, la probabilidad de sobrevivir de los pacientes más graves en INTERMACS 1 fue del 80 y el 58% a 1 y 5 años; en INTERMACS 2, del 86 y el 65%, y en INTERMACS 3, del 88 y el 66%32. Sin embargo, existen otros estudios con menor número de pacientes en lo que no se han observado estas diferencias en pacientes en SC que accedían al implante de un DAVI en función de si lo hacían con un dispositivo de SCM temporal, una vez habiéndolo retirado o si nunca lo habían tenido (supervivencia a 30 días, el 81 frente al 91 frente al 83%; log rank test, p=0,245)35.
En cualquier caso, el implante de un DAVI o la realización de un TxC en situación de SC parecen ser intervenciones con riesgos similares, como muestran datos cruzados de los registros INTERMACS y UNOS (United Network for Organ Sharing). Este estudio comparó retrospectivamente la realización de estas 2 intervenciones en pacientes que tenían un ECMO-VA por SC. No se hallaron diferencias estadísticamente significativas en mortalidad a corto y medio plazo (mortalidades a 1, 2, 5 años, del 29, el 33 y el 38% en TxC frente al 29, el 33 y el 35% en DAVI), si bien es cierto que las poblaciones no eran del todo comparables, ya que la que accedió al TxC era más joven y tenía mayor porcentaje de mujeres29. Estos datos indican que, aunque el TxC probablemente sea la mejor opción desde un punto de vista individual por durabilidad y calidad de vida, los resultados a corto y medio plazo del implante de un DAVI en SC podrían representar una alternativa igualmente válida para pacientes seleccionados atendidos en centros con experiencia29.
REFLEXIONES FINALESSe están realizando numerosos esfuerzos para lograr que mejore el pronóstico de los pacientes en SC: protocolización local del abordaje y el tratamiento, utilización del catéter de arteria pulmonar en casos complejos, mejora en los dispositivos de SCM, la creación de redes asistenciales, etc. Entre los eslabones finales que componen la cadena del abordaje y el tratamiento de estos pacientes, se encuentra el TxC, que a lo largo de su historia ha pasado por diferentes etapas dentro del algoritmo de tratamiento de estos pacientes.
La utilización del TxC para el tratamiento del SC conlleva controversias relevantes. En primer lugar, por la utilización de donantes para pacientes con resultados potencialmente inferiores que en los pacientes electivos. Como ya se ha descrito, el incremento del riesgo de mortalidad en el TxC urgente es real, pero de escasa magnitud. Por otro lado, el beneficio del TxC en un paciente en SC sin recuperación cardiaca ni otra alternativa es muy alto (entendido como diferencia entre los resultados del TxC frente a la historia natural de la enfermedad cardiaca) y es muy superior al que obtienen los pacientes sometidos a un TxC electivo. Para no comprometer la equidad en la distribución de los donantes, es clave una estricta selección de los receptores para evitar la inutilidad del procedimiento.
En segundo lugar, la creación de normas o criterios de distribución de órganos supone un reto en constante evolución. El sistema actual en España supone que, para acceder a la lista de TxC con prioridad nacional, los pacientes adultos deben haber recibido un dispositivo de SCM prácticamente en el 100% de los casos. Esto puede hacer que, de manera consciente o inconsciente, se empleen estos dispositivos para priorizar el TxC de pacientes que no alcanzan su oportunidad en lista electiva. Las posibles soluciones para evitar esta situación pasarían por: a) perfeccionar los criterios de distribución de órganos, probablemente utilizando un puntaje de diferentes características clínicas del receptor, proceso de SC, donante, etc., como se ha propuesto en otros países como Francia36; b) relacionado con lo anterior, podría incluirse el «factor tiempo» como modificador para regular las opciones en lista tanto de los pacientes que permanecen en urgencia sin recibir ofertas, con el consiguiente deterioro, como aquellos en lista electiva que, tras cierto tiempo sin recibir ofertas, podrían ver priorizada su situación entre los criterios de distribución, y c) fomentar el empleo de DAVI para dar salida a los pacientes candidatos con la intención de no saturar y bloquear los programas de TxC con procedimientos urgentes que resten oportunidades a los pacientes electivos con mejores resultados. Las diferencias expuestas entre Estados Unidos y España en el empleo de DAVI deberían motivar una reflexión sobre el empleo de estos tratamientos para pacientes en SC.
CONCLUSIONESEn los últimos años se están produciendo importantes avances para la mejora del tratamiento de los pacientes en SC. El TxC urgente continúa siendo uno los principales pilares para dar salida a estos pacientes en SC sin recuperación cardiaca y es una estrategia utilizada con frecuencia en España con resultados favorables. Sin embargo, es fundamental una adecuada selección de los receptores para no poner en riesgo el principio de equidad de este tratamiento. Los DAVI pueden ser una aceptable alternativa al TxC urgente en este contexto, que amplía las opciones de tratamiento de muchos de estos pacientes. El diseño de unos adecuados criterios de distribución de órganos es todavía un reto, con notables diferencias entre los distintos países y organizaciones de TxC.
FINANCIACIÓNEl presente manuscrito no ha recibido financiación.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se ha empleado inteligencia artificial para la elaboración de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORESF.J. Hernández-Pérez, A. Martín-Centellas, M. Rivas-Lasarte, C. Mitroi y M. Gómez-Bueno han contribuido en la redacción del manuscrito. F.J. Hernández-Pérez, A. Martín-Centellas y J. Segovia-Cubero han revisado el manuscrito. Todos los autores han leído y están de acuerdo con su última versión.
CONFLICTO DE INTERESESLos autores declaran que no existe conflicto de intereses en el desarrollo de la presente revisión.