El trasplante renal mejora la supervivencia y la calidad de vida de los pacientes con enfermedad renal terminal. La enfermedad cardiovascular es la principal causa de morbimortalidad durante el trasplante renal. La relación bidireccional entre enfermedad renal y cardiaca presenta un escenario clínico único que requiere un abordaje integral y personalizado. El objetivo de este consenso de expertos de la Sociedad Española de Trasplante, la Sociedad Española de Cardiología y la Sociedad Española de Nefrología es evaluar la práctica habitual y las estrategias sugeridas para el tratamiento cardiológico en los receptores de trasplante renal. Un panel de nefrólogos y cardiólogos españoles expertos en trasplante renal y cardiaco revisó la evidencia científica en relación con el tratamiento actual de la cardiopatía en trasplantados renales. Posteriormente, se crearon aseveraciones consensuadas mediante una metodología Delphi de 2 rondas. Se elaboraron 30 aseveraciones que abarcaban temas clave como la identificación de candidatos a trasplante renal, el tratamiento de la cardiopatía en los receptores de trasplante renal y la candidatura para trasplante cardiorrenal combinado en pacientes con insuficiencia renal terminal y cardiopatía. Las aseveraciones consensuadas del presente manuscrito proporcionan una orientación adicional a los expertos para el tratamiento cardiológico de los receptores de trasplante renal, en quienes la evidencia clínica publicada es escasa.
Palabras clave
Se ha demostrado que el trasplante renal (TR) mejora la calidad de vida y la supervivencia de pacientes con insuficiencia renal terminal (IRT)1. Sin embargo, las enfermedades cardiovasculares son la principal causa de muerte después del TR (un 35-55% de las causas de muerte de los trasplantados renales)2. Los factores de riesgo convencionales (diabetes, hipertensión y dislipemia) y los específicos del trasplante (cifras elevadas de homocisteína, inflamación sistémica, infecciones e inmunodepresores) intensifican la interacción cardiorrenal y precisan un enfoque integral y personalizado3.
Esta relación bidireccional entre enfermedades renales y cardiacas requiere la colaboración de nefrólogos y cardiólogos con la finalidad de tratar a pacientes con cardiopatía avanzada e IRT. Los trasplantados renales pueden notar cambios en la dinámica cardiovascular después de la recuperación de la función renal4, aunque continúan teniendo un gran riesgo de eventos cardiovasculares como enfermedad coronaria, insuficiencia cardiaca y arritmias4. Por lo tanto, una evaluación cardiológica y vascular más exhaustiva y frecuente antes y después del TR podría contribuir a la mejora de los resultados de supervivencia. El tratamiento óptimo de esta población es especialmente difícil a causa de las lagunas en la evidencia científica.
En este trabajo, nefrólogos y cardiólogos expertos en trasplante, con la colaboración de la Sociedad Española de Trasplante (SET), la Sociedad Española de Cardiología (SEC) y la Sociedad Española de Nefrología (SEN), estudiaron los retos asociados con la cardiopatía en trasplantados renales, analizaron las estrategias de tratamiento actuales que pueden utilizarse para consultas en España y prepararon declaraciones de consenso sobre el tratamiento cardiorrenal en este entorno.
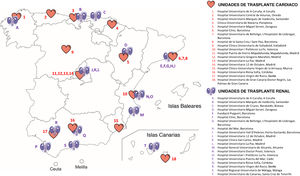
MÉTODOSEn este consenso de expertos participaron nefrólogos y cardiólogos especializados en trasplantes, con participantes de todas las unidades de trasplante cardiaco (TxC) y un número equivalente de unidades de TR de gran volumen asistencial de España (figura 1).
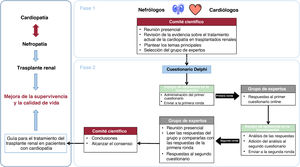
El consenso se gestó en 2 fases (figura 2). La fase 1 consistió en una revisión de la evidencia existente sobre temas relacionados con el TR. En la fase 2 se aplicó la metodología Delphi de 2 rondas (descrita en otro lugar)5,6 para tratar los temas más controvertidos (o aquellos con menos evidencia que los respalde) identificados en la fase 1. El proceso fue coordinado por 2 nefrólogos (D. Hernández Marrero y J.M. Cruzado) y 2 cardiólogos (M.D. García-Cosío y M. Farrero) y contó con la participación de un comité científico compuesto por 6 nefrólogos y 6 cardiólogos ().
Figura central. Esquema de desarrollo del consenso. El trasplante renal mejora la supervivencia y la calidad de vida de los pacientes con insuficiencia renal terminal, pero la enfermedad cardiovascular es la principal causa de morbimortalidad durante el trasplante renal. Dada la relación bidireccional entre nefropatías y cardiopatías, se necesita un enfoque integral y personalizado. Para guiar el tratamiento del trasplante renal en pacientes con cardiopatía, se alcanzó un consenso de expertos entre nefrólogos y cardiólogos españoles con experiencia en trasplante renal y cardiaco, en 2 fases. La fase 1 consistió en una revisión de la evidencia existente sobre temas relevantes relacionados con el trasplante renal, realizada por el comité científico en una reunión presencial para plantear los temas principales. La fase 2 implicó una metodología Delphi de 2 rondas para tratar los temas más controvertidos (o aquellos con menos evidencia de respaldo) identificados en la fase 1.
En la fase 1, el comité científico revisó temas no abordados por las guías de práctica clínica vigentes7,8, entre los cuales: a) valoración cardiológica de los candidatos a TR; b) tratamiento de la cardiopatía en el TR, y c) criterios para el TxC en pacientes con IRT. La evidencia se presentó en una reunión presencial en septiembre de 2023. Se aprobaron las declaraciones con pleno acuerdo del comité científico, y las consideradas más controvertidas se sometieron al proceso Delphi. Se asignó a las declaraciones basadas en la evidencia un nivel de evidencia y un grado de recomendación conforme a la escala de la Scottish Intercollegiate Guidelines Network (SIGN) ()9.
En octubre de 2023, el primer cuestionario Delphi (primera ronda), compuesto por 30 declaraciones, se envió a un grupo de 15 expertos en TR y 14 expertos en TxC (). Se seleccionó a estos expertos en función de su especialidad (nefrólogos y cardiólogos) y su experiencia en la atención de trasplantados tanto renales como cardiacos (mínimo de 5 años), así como por sus publicaciones científicas relacionadas con TR o TxC.
Los especialistas expresaron su grado de acuerdo o desacuerdo con cada declaración utilizando una escala ordinal de tipo Likert de 9 puntos5 estructurada en 3 grupos: 1-3, desacuerdo; 4-6, sin acuerdo o desacuerdo, y 7-9, acuerdo. Se obtuvieron puntuaciones medias de cada declaración. Se dedujo el consenso de desacuerdo si la mediana estaba en 1-3 puntos y si el 66,7% de los encuestados o más habían dado su puntuación dentro de ese intervalo; se dedujo el consenso de acuerdo si la mediana estaba en 7-9 puntos y si el 66,7% de los encuestados o más habían dado su puntuación dentro de ese intervalo. Las declaraciones con una mediana de 4-6 puntos se consideraron inciertas para la mayoría del grupo. En casos de desacuerdo o desacuerdo parcial con la declaración, se pidió a los miembros del grupo que explicaran brevemente su razonamiento y se les invitó a reescribir la declaración. Se trataron las declaraciones reformuladas y se llevó a cabo una votación en una reunión presencial con el grupo de expertos (noviembre de 2023) utilizando el segundo cuestionario Delphi.
RESULTADOS Y DISCUSIÓN DEL CONSENSOEvaluación cardiológica de los candidatos a TRLa evidencia clínica respaldó 5 declaraciones sobre la valoración cardiológica de los candidatos a TR (tabla 1) y se presentaron 3 declaraciones al proceso Delphi (tabla 2). Todas ellas alcanzaron el consenso (82,2-91,1%) en la primera ronda.
Declaraciones con acuerdo del comité sobre el estudio cardiológico de los candidatos a TR
| Estudio cardiológico de candidatos a TR | Nivel de evidencia | Grado de recomendación |
|---|---|---|
| El TR es el tratamiento de elección para pacientes con cardiopatía concomitante a IRT10,11 | 1+ | A |
| El TR ofrece una ventaja importante de supervivencia sobre otras opciones de tratamiento para pacientes con cardiopatía concomitante a IRT10,11 | 1+ | A |
| Los pacientes en lista de espera para TR con insuficiencia cardiaca avanzada y una FEVI continuamente baja (< 30%) a pesar del tratamiento adecuado de los líquidos en diálisis deben ser evaluados para trasplante cardiorrenal combinado (simultáneo o secuencial)8,12-14 | 2+ | C |
| Los candidatos a TR con insuficiencia cardiaca y fracción de eyección reducida deben recibir tratamiento cuádruple con IECA/ARA-II/sacubitrilo-valsartán, bloqueadores beta (preferiblemente carvedilol), ARM e iSGLT212,15–17 | 2+ | C |
| Se debe priorizar la diálisis peritoneal o hemodiálisis con sesiones más cortas o mayor frecuencia semanal para pacientes con disfunción ventricular candidatos a TR porque son tratamientos más fisiológicos18 | 1+ | A |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; IRT: insuficiencia renal terminal; iSGLT2: inhibidores del cotransportador 2 de sodio y glucosa; TR: trasplante renal.
Declaraciones controvertidas sobre el estudio cardiológico de candidatos a TR presentadas al consenso Delphi
| Estudio cardiológico de candidatos a TR | Acuerdo, %(ronda Delphi) |
|---|---|
| 1. Se debe evaluar a todos los candidatos a TR en función de la historia clínica, la exploración física, el electrocardiograma, los biomarcadores cardiacos y el ecocardiograma | 91,1(1R) |
| 2. En presencia de enfermedad coronaria crónica confirmada, la revascularización habitual (percutánea o quirúrgica) para reducir el riesgo perioperatorio no está justificada, pero debe evaluarse caso por caso | 91,1(1R) |
| 3. Para los pacientes con insuficiencia cardiaca y fracción de eyección reducida sin causa cardiológica evidente, así como IRC avanzada en diálisis peritoneal o hemodiálisis intermitente, se debe valorar un programa intensivo de hemodiálisis (con mayor frecuencia y parámetros optimizados) para evaluar un posible componente urémico y reversible de la cardiopatía | 82,2(1R) |
1R: primera ronda; IRC: insuficiencia renal crónica; TR: trasplante renal.
Según las guías de práctica clínica de la Sociedad Europea de Cardiología (ESC)19 y la Kidney Disease Improving Global Outcomes (KDIGO)8, los candidatos a TR sin síntomas cardiológicos deben ser valorados para detectar enfermedades cardiovasculares mediante evaluación clínica, electrocardiograma y radiografía de tórax. A quienes han estado o están en diálisis durante 2 o más años o tienen factores de riesgo de hipertensión pulmonar (p. ej., hipertensión portal, enfermedad del tejido conjuntivo, enfermedad pulmonar obstructiva crónica o cardiopatía congénita), también debe realizárseles un ecocardiograma. Con todo, el momento oportuno para esta evaluación no está claramente establecido20 y se necesita más investigación para dilucidar esta cuestión.
Hubo acuerdo (91,1%) en que debe evaluarse a todos los candidatos a TR con un electrocardiograma junto con la historia clínica, la exploración física, los biomarcadores cardiacos (p. ej., fracción aminoterminal del propéptido natriurético cerebral [NT-proBNP], troponina) y un ecocardiograma (tabla 2). Los biomarcadores pueden estar alterados en la insuficiencia renal crónica (IRC) y en los pacientes en diálisis, y deben utilizarse como punto de referencia para el seguimiento, teniendo muy en cuenta los cambios dinámicos que pueden producirse con el tiempo. Aun así, se requiere más investigación.
Insuficiencia cardiaca y fracción de eyección reducidaSe dispone de datos sólidos sobre el tratamiento cuádruple para candidatos a TR con insuficiencia cardiaca y fracción de eyección reducida (≤ 40%) con inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II o sacubitrilo-valsartán, bloqueadores beta, antagonistas del receptor de mineralocorticoides (ARM) e inhibidores del cotransportador 2 de sodio-glucosa (iSGLT2)12,15-17. La mayoría de las clases de fármacos son seguras y eficaces en pacientes con insuficiencia cardiaca, fracción de eyección reducida e IRC hasta el estadio 3b (tasa de filtrado glomerular estimada [TFGe] mínima de 30ml/min/1,73 m2)15. Sin embargo, hay pocos datos de aquellos con IRC en estadio 4-5, ya que se excluye de los ensayos clínicos a la mayoría de estos pacientes15. En pacientes con IRC grave (estadio 4), hay alguna evidencia de la seguridad y la eficacia15 de los iSGLT2 y, en menor medida, de los inhibidores de la enzima de conversión de la angiotensina, vericiguat, digoxina y omecantiv mecarbilo, pero se necesita más investigación clínica. En pacientes en diálisis con miocardiopatía dilatada, se ha demostrado que el carvedilol aumenta la supervivencia 2 años y reduce la morbimortalidad16. También se ha demostrado que el sacubitrilo-valsartán mejora la función sistólica y diastólica del ventrículo izquierdo de los pacientes con insuficiencia cardiaca, fracción de eyección reducida e IRT17.
Dado el decisivo impacto de la fracción de eyección del ventrículo izquierdo (FEVI) en los criterios para el TR, el grupo de expertos elaboró un protocolo clínico para ajuste al alza de la medicación para la insuficiencia cardiaca (figura 3). La adopción de esta estrategia puede dar lugar a una mejor distribución de órganos debido a la reducción de la necesidad de TxC y TR combinados (TCRC) y también puede aumentar la aptitud para el TR de pacientes no aptos para el TxC si se logra una mejora de la FEVI.
Protocolo para el tratamiento de la insuficiencia cardiaca en la insuficiencia renal crónica en diferentes etapas. ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; FC: frecuencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina y del receptor de la angiotensina; iSGLT2: inhibidores del cotransportador 2 de sodio y glucosa; PA: presión arterial; TFG: tasa de filtrado glomerular.
En las últimas 2 décadas ha habido una tendencia a plantearse el tratamiento de diálisis peritoneal para pacientes con IRT, disfunción ventricular e insuficiencia cardiaca siempre que fuera posible, en función de su potencial de mejorar la calidad de vida del paciente y la tolerancia hemodinámica y de reducir los ingresos hospitalarios18. Sin embargo, no hay estudios aleatorizados que comparen la diálisis peritoneal con la hemodiálisis en pacientes con IRT, insuficiencia cardiaca y FEVI reducida. Según el comité científico, aunque la diálisis domiciliaria (diálisis peritoneal o hemodiálisis domiciliaria) puede valorarse como la opción de primera línea21, la hemodiálisis convencional puede ser necesaria para una mejor reposición volumétrica o en casos de eficacia subóptima de la diálisis con otras técnicas, siempre que se eviten cambios repentinos en el volumen sanguíneo.
Aunque la existencia de cardiopatía urémica no se ha caracterizado claramente, hay informes de pacientes con hipertrofia excéntrica del ventrículo izquierdo e importante disfunción sistólica que pueden ser reversibles con hemodiálisis18. En este sentido, hubo consenso entre los especialistas (82,2%) sobre la utilidad de la hemodiálisis intensiva en pacientes con insuficiencia cardiaca, FEVI reducida e IRC avanzada (tabla 2).
Tratamiento de la coronariopatía en candidatos a TRDespués de la publicación de la guía de la KDIGO de 20208 tras los resultados del ensayo ISCHEMIA-CKD22, parece que en el subgrupo de pacientes con TFGe <30ml/min/1,73 m2 o en diálisis una estrategia invasiva es más favorable que una estrategia conservadora en caso de isquemia basal grave22. Hubo consenso (91,1%) entre los especialistas de que en pacientes con coronariopatía crónica demostrada la revascularización no debería ser sistemática, sino individualizada (tabla 2).
Tratamiento de cardiopatías en trasplantados renalesLa evidencia clínica respaldó 10 declaraciones sobre el tratamiento de las cardiopatías en TR (tabla 3) y se presentaron 20 declaraciones al proceso Delphi. De estas, 17 alcanzaron consenso en la primera ronda y 3 en la segunda, después de la modificación (tabla 4).
Declaraciones con acuerdo del comité sobre el tratamiento de las cardiopatías en el TR
| Tratamiento de cardiopatías en trasplantados renales | Nivel de evidencia | Grado de recomendación |
|---|---|---|
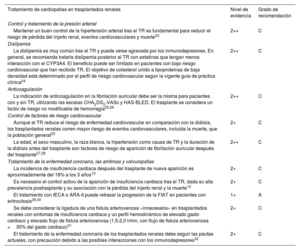
| Control y tratamiento de la presión arterial | ||
| Mantener un buen control de la hipertensión arterial tras el TR es fundamental para reducir el riesgo de pérdida del injerto renal, eventos cardiovasculares y muerte23 | 2++ | C |
| Dislipemia | ||
| La dislipemia es muy común tras el TR y puede verse agravada por los inmunodepresores. En general, se recomienda tratarla dislipemia posterior al TR con estatinas que tengan menos interacción con el CYP3A4. El beneficio puede ser limitado en pacientes con bajo riesgo cardiovascular que han recibido TR. El objetivo de colesterol unido a lipoproteínas de baja densidad está determinado por el perfil de riesgo cardiovascular según la vigente guía de práctica clínica24 | 2++ | C |
| Anticoagulación | ||
| La indicación de anticoagulación en la fibrilación auricular debe ser la misma para pacientes con y sin TR, utilizando las escalas CHA2DS2-VASc y HAS-BLED. El trasplante se considera un factor de riesgo no modificable de hemorragia25,26 | 2++ | C |
| Control de factores de riesgo cardiovascular | ||
| Aunque el TR reduce el riesgo de enfermedad cardiovascular en comparación con la diálisis, los trasplantados renales corren mayor riesgo de eventos cardiovasculares, incluida la muerte, que la población general25 | 2+ | C |
| La edad, el sexo masculino, la raza blanca, la hipertensión como causa de TR y la duración de la diálisis antes del trasplante son factores de riesgo de aparición de fibrilación auricular después del trasplante27,28 | 2++ | C |
| Tratamiento de la enfermedad coronaria, las arritmias y valvulopatías | ||
| La incidencia de insuficiencia cardiaca después del trasplante de nueva aparición es aproximadamente del 18% a los 3 años12 | 2+ | C |
| Es necesario el control activo de la aparición de insuficiencia cardiaca tras el TR, dada su alta prevalencia postrasplante y su asociación con la pérdida del injerto renal y la muerte12 | 2+ | C |
| El tratamiento con IECA o ARA-II puede retrasar la progresión de la FIAT en pacientes con eritrocitosis29,30 | 1+ | A |
| Se debe considerar la ligadura de una fístula arteriovenosa «innecesaria» en trasplantados renales con síntomas de insuficiencia cardiaca y un perfil hemodinámico de elevado gasto cardiaco y elevado flujo de fístula arteriovenosa (1,5-2,0 l/min, con flujo de fístula arteriovenosa >30% del gasto cardiaco)31 | 2+ | C |
| El tratamiento de la enfermedad coronaria de los trasplantados renales debe seguir las pautas actuales, con precaución debido a las posibles interacciones con los inmunodepresores32 | 2+ | C |
ARA-II: antagonistas del receptor de la angiotensina II; FIAT: fibrosis intersticial y atrofia tubular; IECA: inhibidores de la enzima de conversión de la angiotensina; TR: trasplante renal.
Declaraciones controvertidas sobre el tratamiento de la cardiopatía en TR presentadas al consenso Delphi
| Tratamiento de cardiopatías en trasplantados renales | Acuerdo, %(ronda Delphi) |
|---|---|
| Control y tratamiento de la presión arterial | |
| 4. Después del TR (no peritransplante), la evaluación de la presión arterial mediante control ambulatorio y/o automedición de la presión arterial es fundamental para descartar un patrón sin descenso nocturno y/o hipertensión enmascarada | 77,8(1R) |
| 5. Después del TR, se debe tomar la presión arterial en cada visita | 71,1(1R) |
| 6. Si la presión arterial sistémica es ≥160/100 mmHg durante el periodo perioperatorio del TR, se debe iniciar un tratamiento hipotensor para reducir el riesgo de hemorragia | 86,7(1R) |
| 7. Los pacientes con hipotensión crónica durante el periodo peritransplante corren mayor riesgo de fracaso primario y retraso de la función del injerto y pueden requerir tratamiento con vasoconstrictores | 75,6(1R) |
| 8. En el seguimiento a largo plazo de los pacientes con TR, el control de la presión arterial debe apuntar a cifras <140/90 mmHg o incluso <130/80 mmHg si el tratamiento se tolera bien | 100(1R) |
| 9. El tratamiento con IECA o ARA-II puede contribuir a retrasar la progresión de la FIAT en pacientes con bajas concentraciones de tacrolimus (5-6 ng/ml) | 68,9(1R) |
| 10. Las tiacidas son una opción útil para la hipertensión inducida por inhibidores de la calcineurina, pero pueden aumentar el riesgo de cáncer de piel debido a su efecto fotosensibilizador y deben reservarse para el tratamiento de tercera línea (después de los inhibidores del sistema renina-angiotensina y los antagonistas del calcio) | 77,8(1R) |
| 11. Después del TR, la decisión de modificar el tipo de tratamiento inmunodepresor para mejorar el control de un factor de riesgo cardiovascular específico debe sopesarse frente al riesgo potencial de rechazo, el empeoramiento de otros factores de riesgo y la escasez de datos sobre la reducción de eventos cardiovasculares | 90,7(2R) |
| 12. En casos de cifras excesivamente altas de inhibidores de la calcineurina en pacientes hipertensos, la dosis del inhibidor de la calcineurina puede optimizarse antes de intensificar el tratamiento antihipertensor | 75,6(1R) |
| 13. Se debe establecer un protocolo de tratamiento para los pacientes en tratamiento antiagregante plaquetario que reciben TR debido al mayor riesgo de hemorragia peritransplante | 93,3%(1R) |
| Dislipemia | |
| 14. Los inhibidores de PCSK9 no interfieren en el metabolismo de los inmunodepresores y pueden utilizarse en pacientes de TR con alto riesgo cardiovascular que no han alcanzado los valores lipídicos objetivo con estatinas/ezetimiba y/o que no los toleran | 93,3(1R) |
| 15. El tipo y la dosis de estatinas tanto en TxC como en TR deben seleccionarse según la función renal del paciente y las posibles interacciones farmacológicas, sobre todo con ciclosporina. Se recomienda comenzar con dosis más bajas y ajuste hasta alcanzar el objetivo, aumentando a dosis máximas si se toleran bien | 97,6(2R) |
| 16. En pacientes con alto riesgo cardiovascular e intolerancia confirmada a grandes dosis de estatinas que no alcanzan el objetivo de lipoproteínas bajas en lípidos, se recomiendan tratamientos combinados (estatina a una dosis inferior más ezetimiba y/o ácido bempedoico y/o anticuerpos monoclonales/ARNpi anti-PCSK9). | 97,6(2R) |
| 17. El control de la albuminuria después del TR es importante para clasificar el riesgo cardiovascular | 93,3(1R) |
| Anticoagulación | |
| 18. Los anticoagulantes orales de acción directa no están aprobados actualmente para diálisis y su uso en pacientes en lista de espera de trasplante no es aconsejable por posibles dificultades con su antagonismo | 75,6(1R) |
| 19. Los anticoagulantes orales de acción directa son alternativas razonables a los antagonistas de la vitamina K para trasplantados renales adultos, pero la evidencia en cohortes de trasplante de órganos sólidos es escasa. Se prefieren aquellos con el menor aclaramiento renal | 86,7(1R) |
| Tratamiento de enfermedad coronaria, arritmias y valvulopatías | |
| 20. El tratamiento médico, quirúrgico o percutáneo del síndrome coronario agudo y crónico en trasplantados renales sigue las mismas indicaciones que para la población general | 97,8(1R) |
| 21. La aparición de insuficiencia cardiaca el primer año después del TR requiere descartar la estenosis de la arteria renal en el injerto | 88,9(1R) |
| 22. El diagnóstico de insuficiencia cardiaca de reciente aparición en trasplantados es el mismo que para la población general: manifestaciones clínicas, péptidos natriuréticos y evaluación de la cardiopatía subyacente | 88,9(1R) |
| 23. El tratamiento de la insuficiencia cardiaca de reciente aparición en trasplantados renales es el mismo que para la población general, mediante medicamentos que mejoran el pronóstico y evaluando la posible reducción de la tasa de filtrado glomerular y la hiperpotasemia asociada | 100(1R) |
1R: primera ronda; 2R: segunda ronda; ARA-II: antagonistas del receptor de la angiotensina II; ARNpi: ARN pequeño de interferencia; FIAT: fibrosis intersticial y atrofia tubular; IECA: inhibidores de la enzima de conversión de la angiotensina; PCSK9: proproteína convertasa subtilisina/kexina tipo 9; TR: trasplante renal.
Se identificaron varios factores importantes relacionados con el control de la presión arterial de los trasplantados renales (tabla 4). Actualmente no hay objetivos óptimos de presión arterial establecidos para los periodos peritransplante o de seguimiento, pero la hipotensión crónica puede dificultar la recuperación de la función renal33. La fisiopatología de este problema clínico, en el cual no se detectan pericarditis, derrame pericárdico, amiloidosis u otras causas de hipotensión, no se comprende bien. El uso de fármacos vasoactivos para conservar una presión sistólica >100mmHg (y cerca de 110 o 120mmHg) puede ser beneficioso en el periodo posoperatorio inmediato34. En cambio, la presión arterial elevada puede aumentar la hemorragia quirúrgica por TR y poner en peligro la supervivencia a largo plazo del paciente y del injerto23. Se necesitan ensayos clínicos aleatorizados para aclarar esta duda.
Respecto al tratamiento antihipertensivo óptimo, al parecer los inhibidores de la enzima de conversión de la angiotensina/antagonistas del receptor de la angiotensina II no tienen ningún papel destacado (excepto en situaciones especiales), pero existe amplio consenso sobre el uso de antagonistas del calcio. No hubo consenso para recomendar ninguna modificación de la inmunodepresión después del TR para mejorar el control de la presión arterial sistémica o reducir los eventos cardiovasculares. A pesar de ello, para los trasplantados renales con altas dosis de inhibidores de la calcineurina, sería aconsejable optimizar la dosis antes de intensificar el tratamiento antihipertensivo (el 75,6% de acuerdo).
En algunos estudios sobre trasplantados renales no se publica ninguna modificación en el riesgo de eventos cardiovasculares al cambiar de inhibidores de la calcineurina a inhibidores de la diana de rapamicina en células de mamífero35,36. Teniendo en cuenta esta evidencia, hubo un acuerdo del 90,7% entre los especialistas sobre la necesidad de equilibrar los potenciales beneficios cardiovasculares que implicaría modificar la inmunodepresión frente a los riesgos de rechazo y el empeoramiento de otros factores de riesgo cardiovascular.
DislipemiaNo hubo consenso para modificar la dosis máxima de estatinas en pacientes con TR tratados con inhibidores de la calcineurina (ciclosporina y tacrolimus), ya que el riesgo de rabdomiolisis es pequeño. Es importante tener en cuenta el riesgo de interacciones farmacológicas cuando se utilizan estatinas y seleccionar las que menos interfieren con el citocromo P450 3A4 (CYP3A4)37. Aunque la administración de ciclosporina junto con estatinas específicas puede requerir una reducción de la dosis de estas, no es necesario ningún ajuste cuando se combina con tacrolimus38. En varios estudios se ha publicado una disminución importante de las tasas de eventos cardiovasculares y mortalidad cuando se utilizan estatinas en trasplantados renales39,40. En trasplantados cardiacos que reciben tacrolimus, las estatinas de gran potencia son una opción segura para el tratamiento de la hiperlipemia resistente41. Por lo tanto, entre los especialistas hubo un acuerdo del 97,6% de que la elección de estatinas tanto en TxC como en TR debe tener en cuenta la función renal de los pacientes y las posibles interacciones farmacológicas.
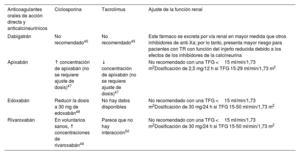
Fibrilación auricularEn el caso de pacientes con TR y fibrilación auricular, no hay evidencia sobre el uso de la ablación, y sobre los anticoagulantes es escasa42. Aunque hay poca evidencia respecto a los anticoagulantes orales de acción directa en el TR, los especialistas coincidieron en que estos tratamientos son una alternativa razonable a los antagonistas de la vitamina K. Se ha publicado que la ciclosporina aumenta la concentración de rivaroxabán43. Sin embargo, en un estudio se publicó que no se produjo ningún aumento de los eventos hemorrágicos al combinar ciclosporina con anticoagulantes orales de acción directa en pacientes con fibrilación auricular44. Todos los anticoagulantes orales tienen un porcentaje variable de eliminación renal, por lo que pueden acumularse e incrementar el riesgo de hemorragia si se toman junto con medicamentos que disminuyen su eliminación. Por ello, su administración conjunta con inmunodepresores, como los inhibidores de la calcineurina o los inhibidores de la diana de rapamicina en células de mamífero (sirolimus y everolimus), requiere un control riguroso45. No son necesarios ajustes específicos de la dosis de anticoagulantes orales de acción directa, aunque se debe controlar con más frecuencia la función renal (1-3 meses después del inicio y cada 6-12 meses a partir de entonces, o con mayor frecuencia en función de las características específicas del paciente). Deben evitarse los fármacos que inducen un aclaramiento renal menor (p. ej., antiinflamatorios no esteroideos, grandes dosis de diuréticos o inmunodepresores) si hay cierto grado de insuficiencia renal (TFG <50ml/min/1,73 m2)42,46. La tabla 5 muestra las posibles combinaciones e interacciones entre los anticoagulantes orales de acción directa y los anticalcineurínicos.
Combinación de anticoagulantes orales de acción directa con anticalcineurínicos
| Anticoagulantes orales de acción directa y anticalcineurínicos | Ciclosporina | Tacrolimus | Ajuste de la función renal |
|---|---|---|---|
| Dabigatrán | No recomendado45 | No recomendado45 | Este fármaco se excreta por vía renal en mayor medida que otros inhibidores de anti-Xa; por lo tanto, presenta mayor riesgo para pacientes con TR con función del injerto reducida debido a los efectos de los inhibidores de la calcineurina |
| Apixabán | ↑ concentración de apixabán (no se requiere ajuste de dosis)47 | ↓ concentración de apixabán (no se requiere ajuste de dosis)47 | No recomendado con una TFG <15 ml/min/1,73 m2Dosificación de 2,5 mg/12 h si TFG 15-29 ml/min/1,73 m2 |
| Edoxabán | Reducir la dosis a 30 mg de edoxabán48 | No hay datos disponibles | No recomendado con una TFG <15 ml/min/1,73 m2Dosificación de 30 mg/24 h si TFG 15-50 ml/min/1,73 m2 |
| Rivaroxabán | En voluntarios sanos, ↑ concentraciones de rivaroxabán49 | Parece que no hay interacción50 | No recomendado con una TFG <15 ml/min/1,73 m2Dosificación de 30 mg/24 h si TFG 15-50 ml/min/1,73 m2 |
TFG: tasa de filtrado glomerular; TR: trasplante renal.
Falta evidencia para descartar la enfermedad coronaria en los trasplantados renales asintomáticos25. Los factores de riesgo asociados con la aparición de infarto de miocardio tras el TR son la edad, los antecedentes de angina, la vasculopatía periférica, la dislipemia, el infarto previo al trasplante, la disminución de la hemoglobina tras el trasplante, las pruebas no invasivas de isquemia positivas antes del trasplante y las arritmias27,28. Las cifras continuamente elevadas de troponina T, sin normalización tras el restablecimiento de la función renal, se asociaron con un riesgo elevado de muerte y eventos cardiovasculares a los 5 años51. Sin embargo, no hay evidencia que respalde el uso de marcadores como la troponina T en el seguimiento de pacientes con TR.
No hay evidencia específica respecto al tratamiento de la enfermedad coronaria en trasplantados renales. Las directrices de KDIGO indican que el tratamiento debe ser al menos tan intensivo como para la población general52, lo cual recibió el respaldo del grupo de expertos. Además, las guías de práctica clínica se centran, sobre todo, en el tratamiento médico y el uso de estatinas y ácido acetilsalicílico en la enfermedad cardiovascular52. Se propone la prevención primaria de la diabetes con ácido acetilsalicílico en función de la evaluación de riesgos y las preferencias individuales. Se requieren más estudios bien diseñados para aclarar esta cuestión.
Insuficiencia cardiacaLos péptidos natriuréticos (péptido natriurético cerebral [BNP] y NT–proBNP) son importantes para el cribado de la insuficiencia cardiaca de nueva aparición en trasplantados renales. Los aumentos en el BNP plasmático después del TR están asociados con la disfunción del aloinjerto, mientras que las cifras de NT-proBNP antes y después del trasplante se han relacionado con disfunción diastólica y complicaciones cardiacas graves53,54. Sin embargo, la capacidad del NT-proBNP predictiva de los resultados cardiacos es dudosa debido a numerosos factores de confusión (p. ej., el grado de función renal).
Existen pocos estudios sobre el tratamiento de la insuficiencia cardiaca en trasplantados renales. En un pequeño ensayo clínico aleatorizado de trasplantados renales con hipertrofia ventricular izquierda, el lisinopril redujo el índice de masa ventricular izquierda frente a placebo55. Se necesitan con urgencia estudios clínicos aleatorizados para establecer un tratamiento eficaz de la insuficiencia cardiaca después del TR.
A pesar de ello, todos los expertos estuvieron de acuerdo en que el tratamiento de la insuficiencia cardiaca de nueva aparición en trasplantados renales debe ser el mismo que para la población general56,57. Con todo, el tratamiento puede inducir hiperpotasemia en los trasplantados renales, especialmente aquellos con acidosis tubular renal por anticalcineurínicos y con función subóptima del injerto. A falta de recomendaciones claras, los tratamientos como el patirómero y el ciclosilicato de sodio y circonio requieren evaluación en trasplantados renales debido a la interferencia con la absorción del fármaco12. Informes breves han indicado que, si bien el ciclosilicato de circonio no modifica la concentración de tacrolimus58, el patirómero puede requerir un aumento de la dosis de tacrolimus59.
Candidatos a trasplante cardiorrenal combinadoLa evidencia clínica respaldó 2 declaraciones sobre el estudio de candidatos a TCRC (tabla 6) y se presentaron al proceso Delphi 7 declaraciones; 4 declaraciones lograron consenso en la primera ronda y 3 declaraciones modificadas, en la segunda ronda (tabla 7).
Declaraciones con acuerdo del comité sobre el estudio de los candidatos a TR y TxC
| Estudio de candidatos a TCRC | Nivel de evidencia | Grado de recomendación |
|---|---|---|
| Los pacientes estables (programados y optimizados hemodinámicamente) en diálisis y aquellos con una TFG <30 ml/min/1,73 m2 se benefician más del trasplante cardiorrenal, con cifras de supervivencia similares a las de los pacientes con TxC solo. Esta estrategia ofrece una mayor supervivencia del injerto cardiaco y una menor necesidad de diálisis/TR durante el seguimiento13,60 | 2+ | C |
| El pronóstico de los pacientes con cardiopatía grave e insuficiencia renal es peor debido a la falta de evidencia científica sobre el tratamiento médico óptimo y otros dispositivos, ya que se los excluye sistemáticamente de los estudios15 | 2+ | C |
TCRC: trasplante cardiorrenal combinado; TFG: tasa de filtrado glomerular; TR: trasplante renal; TxC: trasplante cardiaco.
Declaraciones controvertidas sobre el estudio de candidatos a TCRC presentadas al consenso Delphi
| Estudio de candidatos a TCRC | Acuerdo, %(ronda Delphi) |
|---|---|
| 24. Los pacientes con una indicación de TxC que tienen IRC con una TFG <45 ml/min/1,73 m2, una relación albúmina/creatinina >30 mg/g o albuminuria >50 mg/día deben ser evaluados por un equipo multidisciplinario para el trasplante cardiorrenal, especialmente si están en riesgo de progresión de la nefropatía a corto plazo (diabetes, hipertensión a largo plazo, lesión renal estructural, retransplante cardiaco con exposición prolongada a inhibidores de la calcineurina) | 97,8(1R) |
| 25. Para decidir sobre la indicación de TCRC, puede ser necesario ampliar el estudio con ecografía renal, Doppler renal o angiografía por tomografía computarizada de arterias renales, o incluso biopsia renal | 100(1R) |
| 26. Para los candidatos a TCRC que requieran asistencia circulatoria mecánica a corto plazo debido a la inestabilidad cardiaca, el trasplante debe ser secuencial (no simultáneo) debido al riesgo de pérdida del injerto renal | 83,3(2R) |
| 27. Los pacientes que permanecen en diálisis 3-6 meses después del TxC tienen un alto riesgo de mortalidad. Se deben considerar estrategias de trasplante temprano, como las opciones de donantes vivos | 90,5(2R) |
| 28. Se debe considerar para TR temprano (preferiblemente de donante vivo) a los pacientes con insuficiencia renal grave que tienen una TFG <20 ml/min/1,73 m2 12 meses después del TxC solo a pesar de la reducción de los inmunodepresores con inhibidores de la calcineurina y la optimización metabólica, para reducir su mortalidad | 95,2(2R) |
| 29. El riesgo inmunológico en el trasplante combinado simultáneo debe basarse en los criterios utilizados para el TxC (realizar una prueba cruzada virtual de histocompatibilidad en pacientes sensibilizados) | 86,7(1R) |
| 30. Los pacientes candidatos a TCRC simultáneo no requieren ninguna prueba cruzada virtual de histocompatibilidad previa al trasplante en ausencia de anticuerpos HLA circulantes | 75,6(1R) |
1R: primera ronda; 2R: segunda ronda; HLA: antígeno leucocitario humano; IRC: insuficiencia renal crónica; TCRC: trasplante cardiorrenal combinado; TFG: tasa de filtrado glomerular; TR: trasplante renal; TxC: trasplante cardiaco.
Hay poca evidencia sobre el pronóstico de los pacientes con cardiopatía grave e IRT. Tras un metanálisis, se ha comunicado un aumento de la mortalidad cardiovascular de los pacientes con TFG <60-75ml/m/1,73 m2 y proteinuria61. La insuficiencia cardiaca se reconoce como una causa importante de morbimortalidad en pacientes con IRC, con un riesgo de aparición de 12 a 36 veces superior para aquellos en diálisis que para la población general; cada aumento de 1 punto en la FEVI se asocia con una disminución del 2,5% de la mortalidad entre los pacientes en lista de espera para TR62.
Los datos clave sobre la indicación actual de TxC para pacientes en diálisis provienen de los registros de la United Network for Organ Sharing (UNOS)13 y la International Society for Heart and Lung Transplantation (ISHLT)63. En el registro de la UNOS, los trasplantados cardiorrenales tuvieron menos riesgo ajustado de muerte que los sometidos solo a TxC, sobre todo aquellos en diálisis antes del trasplante13. Estos datos indican que el TCR debe valorarse en candidatos a TxC con IRT que requieren diálisis y aquellos con TFG <30ml/min/1,73 m2. Es importante destacar que los pacientes en diálisis y aquellos con TFG <30ml/min/1,73 m2 con solo TxC tenían más inestabilidad y más dispositivos de asistencia ventricular que aquellos con trasplante combinado13.
Según las recomendaciones establecidas en varios consensos, se considera candidatos a TCR combinado a los pacientes con TFG <30ml/min/1,73 m2, aunque algunos grupos14,60,64 consideran el trasplante combinado para pacientes con TFG <45ml/min/1,73 m2. En una conferencia de consenso sobre TCR, Kobashigawa et al.14 evaluaron las indicaciones para el trasplante según la función renal. Se recomienda el trasplante combinado para candidatos de TCRC con TFG <30ml/min/1,73 m2, pero a los pacientes con TFG de 30-45ml/min/1,73 m2 se los debe evaluar de forma individual. A los pacientes con TFG >45ml/min/1,73 m2 se los debe considerar para TxC solo. De manera similar, Ahsan et al.60 han desarrollado un algoritmo para seleccionar a pacientes que se beneficiarían del TCRC. Se puede seleccionar a pacientes con TFGe <30ml/min/1,73 m2 con criterios hemodinámicos optimizados para el TCRC. Se recomienda TCRC para los pacientes con TFGe de 30-45ml/min/1,73 m2 si tienen lesión renal aguda sin recuperación completa de la función renal, es decir, si permanecen en tratamiento de sustitución renal o tienen una TFG <30ml/min/1,73 m2 después de la optimización. También se puede considerar para TCRC a los pacientes con TFGe de 30-45ml/min/1,73 m2 si padecen IRC establecida con un tamaño renal pequeño o proteinuria >0,5g/dl60. La American Heart Association ofrece criterios similares a los de Ahsan et al.60 respecto al TCRC64.
Aunque el número de pacientes sometidos a TCRC ha aumentado en los últimos años, se ha publicado que tienen una mortalidad hasta 4,7 veces superior que los que reciben TR después del TxC65. La pérdida de injerto renal por la inestabilidad hemodinámica en el periodo inmediatamente posterior al trasplante es un problema clave con el TCRC. En el registro UNOS, la tasa de fracaso primario del injerto a los 5 años fue del 4% en los receptores de TCRC y del 2% en los receptores solo de riñón contralateral13. Además, aunque la incidencia de rechazo agudo es menor en el trasplante combinado, los pacientes que reciben TR después del TxC tienen la posibilidad de recibir un trasplante de donante vivo, lo que ofrece ventajas en cuanto a supervivencia y aumento de la calidad de vida relacionada con la salud65.
Casi todos los especialistas (97,8%) estuvieron de acuerdo en que se debe evaluar para el TCRC a los pacientes con indicación de TxC que tienen IRC y lesión renal estructural. Sin embargo, aunque el TCRC mejora el pronóstico de los pacientes con IRC avanzada y una indicación de TxC, la existencia de lesión cardiorrenal funcional (p. ej., reversible con mejoría cardiaca) es difícil de medir. Por lo tanto, se recomienda la estabilización hemodinámica para mejorar la evaluación de la función renal siempre que sea posible.
TR después de TxC soloSegún el grupo de expertos, los pacientes que requieren asistencia circulatoria mecánica a corto plazo por inestabilidad cardiaca deben recibir trasplante cardiorrenal secuencial para paliar el riesgo de pérdida del injerto. El grupo reconoció el elevado riesgo de mortalidad de los pacientes con TxC e IRT que están en diálisis a largo plazo y la necesidad de implantar estrategias tempranas de TR. El registro canadiense de trasplantes indica que los trasplantados cardiacos con IRT tienen mayores tasas de supervivencia cuando reciben un TR que los que siguen en lista de espera66. Además, los datos del registro UNOS muestran que los pacientes que recibieron trasplantes no renales y luego presentaron IRT también tuvieron mayor supervivencia cuando recibieron un TR que los que siguieron en lista de espera. El riesgo de muerte o exclusión de la lista de espera de TR también fue mayor entre los candidatos a TR después de TxC que entre quienes recibieron solo TR67. Es importante destacar que es difícil predecir la tardanza de la recuperación de la lesión renal aguda en trasplantados cardiacos, y puede llevar varios meses.
Sin embargo, priorizar el TR para los trasplantados cardiacos en diálisis puede reducir las posibilidades de otros pacientes en la lista de espera. Actualmente no hay estudios que hayan comparado la mortalidad de los trasplantados cardiacos y los no trasplantados cardiacos en diálisis.
Los trasplantados cardiacos reciben mayores dosis de inhibidores de la calcineurina los primeros meses tras el trasplante, lo que puede afectar negativamente a la función renal. La mayoría de los especialistas (95,2%) estuvieron de acuerdo en que debe valorarse el TR temprano, preferiblemente de donante vivo, para los trasplantados cardiacos con insuficiencia renal grave, incluso con el uso adecuado de inhibidores de la calcineurina y optimización metabólica. Sin embargo, los tiempos de espera para el TR y el acceso a los programas de trasplante en vivo varían según el centro. Por lo tanto, en los casos de IRC con TFG <20ml/min/1,73 m2, que confieren mayor riesgo de mortalidad a los trasplantados cardiacos, es razonable considerar el TR temprano si es posible. Un consenso estadounidense sobre el TCR estableció una red de seguridad para el TR en que se priorizaba a los pacientes en diálisis después del TxC y a aquellos con una TFG ≤ 20ml/min/1,73 m2 constante durante 6 semanas desde el día 30 hasta 365 después del TxC14. Navarro-Manchón et al. publicaron que la supervivencia de los pacientes con una TFG <30ml/min/1,73 m2 1 año después del TxC fue considerablemente inferior que en aquellos con una TFG más elevada68. En particular, los pacientes que recibieron un TR tuvieron una supervivencia mayor que los que siguieron en lista de espera67, como se ha demostrado en pacientes con IRC avanzada después del TxC69.
El riesgo inmunológico en el trasplante combinado debe basarse en los criterios del TxC. Se requiere una prueba cruzada virtual de histocompatibilidad para los pacientes sensibilizados, pero no debe realizarse en ausencia de anticuerpos contra antígenos leucocitarios humanos (HLA). Según el grupo de expertos, a todos los candidatos a TCRC se les deben realizar pruebas periódicas de anticuerpos HLA.
CONCLUSIONESDespués de 2 rondas de discusiones y aclaraciones, todas las declaraciones propuestas recibieron el respaldo con un amplio grado de consenso. Sin embargo, algunos puntos necesitaron aclaración o ajuste, muchos relacionados con casos específicos o perspectivas diferentes entre nefrólogos y cardiólogos. No obstante, el elevado nivel de acuerdo indica que, a pesar de la falta de evidencia o la existencia de controversias en torno a algunos temas, los profesionales sanitarios que tratan a pacientes con TR comprenden claramente la importancia de un tratamiento adecuado, una colaboración multidisciplinaria y más estudios clínicos bien diseñados para mejorar la atención al paciente, lo que afectará a la supervivencia y la calidad de vida.
FINANCIACIÓNAgradecemos el apoyo del Instituto de Salud Carlos III (ISCIII), RICORS2040, RD21/0005/0001, RD21/0005/0010, RD21/0005/0012, RD21/0005/0022 «financiado por la Unión Europea – NextGeneration EU», Mecanismo para la Recuperación y la Resiliencia (MRR).
Este estudio fue financiado por una subvención no condicionada de AstraZeneca, CSL Vifor, Astellas y Chiesi, que no influyeron ni participaron en la elaboración de este proyecto, y por la Sociedad Española de Trasplante, la Sociedad Española de Cardiología y la Sociedad Española de Nefrología.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se ha utilizado inteligencia artificial en la preparación de este artículo.
CONTRIBUCIÓN DE LOS AUTORESM.D. García-Cosío, J.M. Cruzado, M. Farrero y D. Hernández Marrero contribuyeron por igual a este artículo. M.D. García-Cosío, J.M. Cruzado, M. Farrero y D. Hernández Marrero fueron los responsables de la concepción, la redacción-revisión, la edición y la revisión final del artículo. M.T. Blasco Peiró, M. Crespo, J.F. Delgado Jiménez, B. Díaz Molina, C. Fernández Rivera, I.P. Garrido Bravo, V. López Jiménez, E. Melilli, S. Mirabet Pérez, M.L. Pérez Tamajón, D. Rangel Sousa y E. Rodrigo Calabia realizaron la revisión bibliográfica, la recopilación de datos, la redacción-revisión, la edición y la revisión final del artículo. Todos los autores han leído y aceptado la versión publicada del original.
CONFLICTO DE INTERESESM.D. García-Cosío ha recibido honorarios como conferenciante y subvenciones para viajes de Astellas, AstraZeneca, Rovi, Abbott, Epycardio y Chiesi. M. Farrero ha recibido honorarios como conferenciante y subvenciones para viajes de Novartis, AstraZeneca, Rovi, Abbott y Chiesi. S. Mirabet Pérez ha recibido financiación de Chiesi para participar en una conferencia, asesoramiento y asistencia a un congreso. Los demás autores declaran no tener ningún conflicto de intereses.
AGRADECIMIENTOSAgradecemos a los equipos de trasplante cardiaco y renal de los hospitales implicados en este artículo y a AstraZeneca, CSL Vifor, Astellas y Chiesi, y agradecemos el apoyo de la Sociedad Española de Trasplante, la Sociedad Española de Cardiología y la Sociedad Española de Nefrología.
Los autores desean agradecer a Ian Marshall en nombre de Springer Healthcare por prestar su ayuda en la redacción médica.