En este artículo se hace una puesta al día sobre los tratamientos no farmacológicos de la fibrilación auricular. En primer lugar, se revisa el estado actual de la ablación repasando técnicas, indicaciones y resultados. En segundo lugar, se revisan las indicaciones, las precauciones y los resultados de la cardioversión eléctrica. Se analiza asimismo el papel de los marcapasos en pacientes con fibrilación auricular, tanto en el control de la frecuencia cardiaca de los pacientes con fibrilación auricular permanente y difícil control farmacológico como aquellos con fibrilación auricular paroxística y síndrome de bradicardia/taquicardia. Por último, se revisa el estado actual de los dispositivos de cierre de orejuela izquierda para pacientes con factores de riesgo tromoboembólico y limitaciones para el tratamiento con anticoagulantes orales.
Palabras clave
antagonistas de la vitamina K
cardioversión eléctrica
fibrilación auricular
frecuencia cardiaca
marcapasos
venas pulmonares
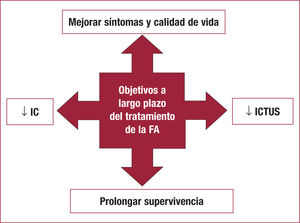
Los objetivos del tratamiento a largo plazo de la fibrilación auricular (FA) son: a) reducir los síntomas y mejorar la calidad de vida; b) reducir la incidencia de ictus; c) disminuir la incidencia de insuficiencia cardiaca, y d) prolongar la supervivencia (figura 1). El tratamiento farmacológico de la FA tiene importantes limitaciones, derivadas de los frecuentes efectos adversos y la eficacia limitada para cada uno de los objetivos descritos.
A continuación se describen sumariamente los avances producidos en los últimos años en relación con el tratamiento no farmacológico de la FA.
Ablación de fibrilación auricularLos ensayos aleatorizados han sido incapaces de demostrar la superioridad de la estrategia de mantenimiento del ritmo sinusal con fármacos antiarrítmicos y cardioversión eléctrica (CVE) frente al control de la frecuencia cardiaca (FC) para incrementar la supervivencia y reducir las hospitalizaciones1. Esto se debe a que, si bien la presencia de ritmo sinusal se asocia a una reducción de los síntomas y mejor pronóstico vital, los fármacos antiarrítmicos disponibles actualmente no solo no mejoran la mortalidad, sino que en algunos casos podrían incrementarla2,3. Sin embargo, estos estudios no evaluaron el uso de estrategias de tratamiento no farmacológicas dirigidas a lograr los objetivos antes mencionados.
La ablación de FA se ha mostrado superior al tratamiento antiarrítmico para el mantenimiento del ritmo sinusal en pacientes seleccionados, con distintos métodos de ablación. La evidencia actual sobre la eficacia y la seguridad de la ablación comparada con el tratamiento antiarrítmico deriva principalmente de estudios observacionales, estudios multicéntricos aleatorizados de tamaño pequeño-mediano y metanálisis4. En su conjunto, estos estudios demuestran que la ablación de FA tiene una eficacia del 78 frente al 23% del tratamiento antiarrítmico y reduce la recurrencia de FA en un 71%5. Estos resultados son muy similares a los del metanálisis más amplio realizado hasta la fecha, que incluyó tanto estudios aleatorizados como observacionales6. Este estudio demostró que la eficacia de la ablación tras un solo procedimiento sin antiarrítmicos era del 57% (intervalo de confianza del 95% [IC95%], 50-64) y el 71% (IC95%, 65-77) tras varios procedimientos, frente a una eficacia del tratamiento con fármacos antiarrítmicos del 52% (IC95%, 47-57). Si bien la eficacia de la ablación está peor establecida en pacientes con FA persistente y de larga duración (el 47% de promedio utilizando distintas técnicas de ablación)7en comparación con la FA paroxística, un reciente metanálisis ha mostrado que la ablación en pacientes con FA persistente reduce el riesgo de recurrencias en un 32% comparado con el tratamiento médico habitual (odds ratio [OR] = 0,32; IC95%, 0,20-0,53; p < 0,001)8.
Indicaciones de la ablación de fibrilación auricularLa mayoría de los estudios aleatorizados que evaluaron la eficacia de la ablación de FA realizados hasta la fecha incluyeron a pacientes jóvenes, sin comorbilidades ni cardiopatía estructural, con FA paroxística recurrente a pesar del tratamiento previo con al menos un fármaco antiarrítmico4. En este contexto, con la ablación se ha demostrado una reducción significativa de los síntomas y una mejora significativa de la calidad de vida4,5. Así pues, tal como consta en las últimas guías de tratamiento de la FA de la American Heart Association/American College of Cardiology/Heart Rhythm Society9 y la Sociedad Europea de Cardiología/European Heart Rhythm Association/European CardiacArrhythmia Society10, la ablación de FA está indicada para pacientes con FA sintomática refractaria al tratamiento antiarrítmico, paroxística (indicación de clase I; nivel de evidencia A) o persistente (clase lia; nivel de evidencia A). Debido a que se trata de un procedimiento complejo y no exento de riesgos, las guías hacen énfasis en que los procedimientos de ablación deben realizarlos operadores experimentados en centros de alto volumen, teniendo siempre en cuenta las preferencias del paciente.
Recientemente se han publicado 2 estudios que evalúan la eficacia de la ablación como primera línea de tratamiento para pacientes con FA paroxística. El estudio MANTRA-PAF11 demostró que la proporción de pacientes libres de FA y libres de FA sintomática era mayor entre los sometidos a ablación, como también su calidad de vida, aunque no hubo diferencias en la carga total de FA. El estudio RAAFT II mostró resultados similares12. Estos datos respaldan la recomendación de las guías de aconsejar la ablación de FA como primera línea de tratamiento para pacientes con FA paroxística sintomática y bajo riesgo de complicaciones derivadas del procedimiento (clase IIa, nivel de evidencia B)9,10. Sin embargo, hasta que concluyan los estudios EAST9 y CABANA10, todavía no hay evidencia para recomendar la ablación con catéter para pacientes con FA asintomática, como tampoco existen datos que respalden la utilidad de la ablación de FA para reducir la mortalidad total, el ictus o la insuficiencia cardiaca.
Técnicas de ablación de fibrilación auricularEl aislamiento eléctrico de las venas pulmonares (VP) es la pieza clave de la estrategia de ablación de FA utilizada actualmente. Aunque se han empleado distintos métodos para lograrla (aislamiento segmentario, aislamiento circunferencial con un solo catéter, etc.), estudios aleatorizados demuestran que el aislamiento circunferencial amplio de las VP con demostración de bloqueo de la conducción bidireccional mediante catéter circular es la técnica más eficaz y con menor tasa de complicaciones para pacientes con FA tanto paroxística como persistente4,13,14. Esto puede lograrse creando una corona de lesiones de radiofrecuencia alrededor del antro de las VP homolaterales, habitualmente asistida por un sistema de navegación, así como usando criobalones de ablación, que permiten lograr unos resultados similares4,15.
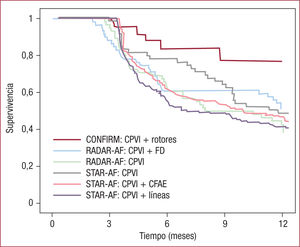
Con la intención de incrementar la eficacia del procedimiento, especialmente en pacientes con FA persistente, y reducir la tasa de complicaciones, se han diseñado distintas técnicas de ablación: a) ablación de sustrato creando líneas de ablación en distintas zonas de la aurícula izquierda (AI) (techo, istmo mitral, aislamiento de la pared posterior) o la ablación de electrogramas fraccionados complejos (CFAE) (figura 2); b) la ablación de desencadenantes o triggers de la FA; c) la ablación de rotores o mantenedores de FA, y d) la ablación ganglionar. Algunos metanálisis y estudios de reducido tamaño indicaban que la adición de líneas en la AI o la ablación de CFAE al aislamiento circunferencial convencional pueden incrementar la eficacia a largo plazo del procedimiento de ablación de FA persistente4. Sin embargo, el estudio STAR-AF II16, que incluyó a 589 pacientes, ha demostrado recientemente una eficacia del aislamiento circunferencial (59%) similar (p = 0,16) a la de la ablación circunferencial más líneas (46%) o la ablación circunferencial más CFAE (49%)17. Por otra parte, hasta un tercio de los pacientes con FA paroxística presentan desencadenantes de los episodios, como taquicardia por reentrada nodular, vías accesorias o extrasístoles auriculares. Aunque la eliminación de algunos de estos desencadenantes se asocia a un pronóstico muy favorable, la ablación de extrasístoles espontáneas es compleja y laboriosa18; además, la ablación empírica de las zonas donde estas extrasístoles son más frecuentes tampoco supone un valor incremental añadido19.
Finalmente, las técnicas de ablación de rotores han mostrado resultados prometedores, aunque la tecnología necesaria para llevarlas a cabo todavía no está disponible de manera generalizada20,21. Por un lado, el estudio RADAR-AF20 mostró que la identificación y ablación de puntos de alta frecuencia dominante en pacientes con FA paroxística era igual de eficaz y tenía menos complicaciones que la ablación circunferencial empírica. Sin embargo, en pacientes con FA persistente, la ablación combinada de puntos de frecuencia dominante y VP no incrementó la eficacia del procedimiento y se asoció a mayor tasa de complicaciones20. Por otra parte, la identificación de rotores mediante mapeo de fases y su eliminación fue más eficaz a largo plazo (3 años) que la ablación convencional de FA dirigida a la eliminación de triggers21.
Una muy elevada proporción de las recurrencias de FA tras la ablación se debe a reconexión de la conducción de las VP, por lo que es fundamental la creación de lesiones continuas, transmurales y permanentes que permitan obtener un aislamiento persistente de las VP. Algunos estudios de reducido tamaño apuntaban cierta utilidad de la administración de adenosina para desenmascarar la conducción «durmiente» de las VP y la reablación de las venas reconectadas. Sin embargo, el estudio aleatorizado UNDER-ATP22, que incluyó a 2.113 pacientes, no encontró diferencias significativas entre la estrategia de ablación convencional y el uso de adenosina en la tasa de recurrencias a 1 año. Por otra parte, estudios en animales han demostrado que la fuerza de contacto del catéter de ablación con el tejido es un determinante del tamaño de la lesión y de la transmuralidad.
Recientemente se han publicado los resultados de 2 estudios multicéntricos que han evaluado la seguridad y la eficacia de los catéteres de ablación con sensor de contacto en pacientes con FA paroxística. Tanto el estudio prospectivo observacional SMART-AF23 como el estudio aleatorizado TOCCASTAR24 demuestran que la utilización de catéteres con sensor de contacto es igual de segura y eficaz que la ablación convencional y que la eficacia del procedimiento aumenta de manera directamente proporcional al tiempo que el catéter se mantiene estable dentro de los parámetros de fuerza de contacto considerados óptimos. El uso de balones asociados a fuentes de energía alternativas podría ser útil para simplificar el procedimiento y mejorar la calidad de las lesiones. En un estudio reciente, la utilización de criobalones de segunda generación se asoció con una elevada tasa de aislamiento persistente de VP a largo plazo (69%), y el punto de reconexión preferencial es el cuadrante posteroinferior de la VP inferior derecha25. Por último, la ablación con catéter láser se ha demostrado igual de segura y eficaz que la ablación punto a punto con radiofrecuencia, aunque se asoció con una tasa superior de parálisis frénica26.
Cardioversión eléctrica externaCuando se opta por una estrategia de control del ritmo para pacientes con FA persistente, la CVE combinada con la administración de fármacos antiarrítmicos suele ser el método inicialmente utilizado (recomendación de clase I, nivel de evidencia B)9,10. Aunque la tasa de conversión a ritmo sinusal (aunque sea transitoria) es muy alta (90%), su eficacia puede incrementarse aumentando la intensidad de la descarga inicial, administrando choques bifásicos, modificando la posición de los parches o administrando fármacos antiarrítmicos durante el procedimiento9,10,27. Además, los antiarrítmicos administrados antes del procedimiento incrementan la probabilidad de mantener el ritmo sinusal a largo plazo28.
La CVE se asocia a un riesgo de tromboembolia del 1-2%, que se reduce en pacientes previamente anticoagulados o si se excluye la presencia de trombos intracavitarios mediante ecocardiografía transesofágica antes del procedimiento. El riesgo tromboembólico pericardioversión es máximo en las primeras 72 h tras el procedimiento, la mayoría de los eventos ocurren en los primeros 10 días y este riesgo es mayor en pacientes con insuficiencia cardiaca y diabetes mellitus29. Por este motivo, se ha venido recomendando la anticoagulación con antagonistas de la vitamina K (AVK) (razón internacional normalizada [INR] 2-3) durante al menos 3 semanas antes y 4 semanas después de la CVE (recomendación de clase I B)9,10. Los análisis post-hoc de estudios fundamentales realizados con los nuevos anticoagulantes orales de acción directa muestran que la cardioversión es segura en pacientes tratados crónicamente con estos fármacos30,31. Hasta la fecha, el X-VeRT es el único estudio prospectivo y aleatorizado que ha comparado la eficacia y la seguridad de rivaroxabán con los AVK en pacientes sometidos a CVE32. En este estudio, que incluyó a 1.504 pacientes, las tasas de ictus, accidente isquémico transitorio, embolia sistémica, infarto de miocardio y muerte cardiovascular fueron similares en ambos grupos (el 0,51% con rivaroxabán frente al 1,02% con AVK; riesgo relativo [RR] = 0,50; IC95%, 0,15-1,73). Igualmente, la tasa de sangrados mayores fue similar en ambos grupos (el 0,6 y el 0,8% respectivamente; RR = 0,76; IC95%, 0,21-2,67). Además, la administración de rivaroxabán se asoció a un tiempo hasta CVE más corto (p < 0,001) y una mayor proporción de pacientes cardiovertidos en la fecha prevista, comparado con el grupo en tratamiento con AVK, en el que frecuentemente hubo que posponer el procedimiento por valores de INR inadecuados.
Para pacientes sin anticoagulación previa, se ha demostrado que realizar un ecocardiograma transesofágico para excluir la presencia de trombos, seguido de anticoagulación con heparina o un nuevo anticoagulante oral durante al menos 4 semanas, es una estrategia segura (recomendación de clase I, nivel de evidencia B en la guía de la ESC/EHRA y clase IIa, nivel de evidencia B en la de ACC/AHA/HRS)9,10,32.
Estimulación cardiacaEn los pacientes con FA permanente, ya sea por imposibilidad de mantener el ritmo sinusal o por decisión médica o del paciente, se plantea lo que se conoce como estrategia de control de la FC1,33,34. En la estrategia de control de la FC hay 2 aspectos que considerar; el primero, definir cuáles son los objetivos de esta estrategia y el segundo, cómo conseguir esos objetivos.
Objetivos del control de la frecuencia cardiacaSegún la mayoría de los estudios que analizan distintas estrategias de control de la FC en pacientes con FA, se ha establecido un valor de corte de FC de 80 lpm en reposo y 110 lpm en ejercicio moderado1,35. Estos valores tienen varias limitaciones. La primera es que, por un lado, la estimación de la FC en reposo de un paciente con FA puede variar en diferentes momentos y, por otro, la definición de ejercicio moderado es poco clara. Además, recientemente se ha mostrado que mantener estos límites con tratamiento farmacológico no solo es difícil, sino que frecuentemente no se consigue y en no pocas ocasiones puede estar limitado por la inducción de bradicardias extremas y sintomáticas; además, no se ha demostrado efecto beneficioso en la supervivencia, la hospitalización por insuficiencia cardiaca y las tasas de ictus, embolia sistémica, hemorragias, eventos arrítmicos potencialmente mortales o la necesidad de implante de marcapasos (MCP), y además conlleva la necesidad de más visitas de control35. Por ello, actualmente, más que plantearse un valor crítico de FC para considerar buen o mal control de la FC en pacientes con FA permanente, se debería tener en cuenta criterios clínicos como la presencia de síntomas, la presencia de insuficiencia cardiaca desencadenada o agravada por FC elevadas o la sospecha de taquimiocardiopatía35.
Papel de la estimulación en el control de la frecuencia cardiacaComo ya se ha comentado en el apartado anterior, los fármacos antiarrítmicos solos pueden ser insuficientes o causar bradiarritmias importantes y sintomáticas en algunos pacientes.
En estos casos puede ser necesario implantar un marcapasos (MCP), ya sea para poder administrar dosis plenas de fármacos frenadores o, en caso de que con fármacos no se logre controlar la FC, realizar una ablación del nódulo auriculoventricular (NAV) que permita controlar la FC.
Así pues, un primer concepto que hay que tener en cuenta es que el implante de un MCP en pacientes con FA y dificultad en el control de la FC con fármacos no siempre implica realizar una ablación del NAV, ya que en un porcentaje variable de pacientes el MCP permitirá el control de la FC y los síntomas, optimizando las dosis de fármacos frenadores sin riesgo de provocar bradicardias.
No está claro cuál es el porcentaje de pacientes que precisan implante de MCP para el control de la FC entre la población de pacientes con FA permanente. Si bien en el estudio RACE II35 solo el 1,4% de los pacientes precisaron implante de MCP por bradicardia sintomática, en el estudio AFFIRM36, un 7,3% de los pacientes recibieron MCP por bradicardia, sin necesidad de ablación del NAV, y un 5,3% adicional se sometió a ablación del NAV tras el implante de un MCP.
En cualquier caso, tal y como se ha comentado, para los pacientes con FA permanente —para los que, por lo tanto, se ha optado por control de la FC— la indicación de MCP, ya sea para optimizar el tratamiento frenador o realizar posteriormente una ablación del NAV, no se debería tomar basándose en un valor de FC en reposo o en ejercicio, sino en la presencia de síntomas relacionados con una FC elevada, ya sean palpitaciones, clínica de insuficiencia cardiaca o porque se sospeche que la FC elevada puede contribuir al deterioro de la función ventricular (taquimiocardiopatía)37. En un metanálisis que incluyó a 1.181 pacientes de 21 estudios, se observó que, en pacientes seleccionados con estos criterios, la ablación del NAV y el implante de un MCP mejoraban los parámetros de capacidad de ejercicio, función ventricular, calidad de vida, síntomas relacionados con la FA y las visitas y los ingresos hospitalarios38.
Selección del modo de estimulaciónUno de los aspectos que se ha discutido en los últimos años es la selección del modo de estimulación para pacientes a los que se va a implantar un MCP en el contexto del control de la FC, con o sin ablación del NAV. Dado que se trata de pacientes que van a tener una alta tasa de estimulación (especialmente aquellos que se vayan a someter a ablación del NAV) cercana al 100%, se ha planteado la duda de si deben recibir una estimulación cardiaca biventricular o una estimulación convencional en el ventrículo derecho. Dos metanálisis relativamente recientes39,40 han mostrado que, en general, la estimulación biventricular no disminuye la mortalidad, no mejora la capacidad de ejercicio y no muestra diferencias en la tasa de eventos adversos, mientras que sí que hay un pequeño aumento de la fracción de eyección que, si bien respecto a los pacientes sometidos a estimulación convencional es estadísticamente significativa, cuantitativamente es poco relevante, ya que es de 2-2,5 puntos. Acordes con estos datos, las recientes guías de estimulación cardiaca41 recomiendan implantar un sistema de resincronización cardiaca a los pacientes con disfunción ventricular sometidos a ablación del NAV, mientras que sobre los que tienen fracción de eyección conservada la evidencia es menor y pueden ser candidatos a estimulación ventricular derecha convencional.
Papel de los marcapasos en el control del ritmo de pacientes con síndrome de bradicardia-taquicardiaEl síndrome de bradicardia-taquicardia se caracteriza por episodios de FA paroxística, habitualmente rápida, seguidos de pausas largas en el momento en que la FA cede y antes de retomar el ritmo sinusal. Estos pacientes suelen tener síntomas relacionados tanto con el inicio de la FA, en forma de palpitaciones e inestabilidad, como secundarios a las pausas al final de la FA, habitualmente en forma de episodios presincopales o sincopales. El tratamiento farmacológico de estos pacientes suele estar limitado por el hecho de que los fármacos que pueden ser útiles para evitar las crisis de FA o controlar una FC elevada durante las crisis pueden agravar la bradicardia en el momento del cese de la FA. Diversos estudios clásicos mostraron que la estimulación bicameral en estos pacientes era superior a la estimulación del ventrículo derecho en la reducción de las recidivas de FA, así como en la mejoría de los síntomas42, de modo que durante muchos años se ha recomendado evitar el implante de MCP VVI en estos pacientes. Recientemente se ha comparado la estimulación unicameral AAI con la DDD y se ha observado que la estimulación en modo DDD disminuye la tasa de FA43 sin aumento de la tasa de pacientes que contraen insuficiencia cardiaca o evolucionan a deterioro de la función ventricular.
Actualmente, con el desarrollo de las técnicas de ablación de aislamiento de VP en pacientes con FA paroxística, se ha podido observar que, tras la ablación de VP y con la disminución de la tasa de recurrencias de FA paroxística, mejoran los síntomas relacionados con la disfunción sinusal, de modo que se puede evitar el implante de MCP en la mayoría de ellos. Así pues, en el momento actual, para los pacientes con FA paroxística y síndrome de bradicardia-taquicardia sintomático candidatos a la ablación de VP, se debe plantear la ablación antes de implantar un MCP para mejorar sus síntomas.
Cierre de orejuelaUno de los mayores problemas de la FA es la formación de trombos en la AI y el riesgo consiguiente de ictus o embolia sistémica. Los anticoagulantes orales se han demostrado útiles en la prevención de ictus y embolia sistémica y superiores al uso de antiplaquetarios44. Durante muchos años, la única alternativa disponible han sido los fármacos AVK, con todos los inconvenientes que tienen de necesidad de controles periódicos, la variabilidad de efecto por el estrecho rango terapéutico y las interacciones con fármacos y alimentos. Recientemente se han desarrollado los anticoagulantes de acción directa que, si bien han mostrado que no son inferiores a los AVK en la prevención de ictus isquémico y embolia sistémica y que incluso tienen una tasa menor de ictus hemorrágicos —y algunos de ellos, reducción de la mortalidad—, no están exentos de cierto riesgo hemorrágico por su propio efecto anticoagulante, pueden tener efectos secundarios y además tienen limitaciones para los pacientes con insuficiencia renal45–48.
Por todo ello, se han buscado alternativas no farmacológicas para la prevención del ictus y la embolia sistémica, especialmente para pacientes que tengan complicaciones o contraindicaciones para el tratamiento anticoagulante oral. Diversos estudios han mostrado que la principal fuente de trombos en pacientes con FA no valvular es la orejuela izquierda49, por lo que se ha planteado que su exclusión, ya sea mediante escisión quirúrgica aprovechando una cirugía cardiaca o mediante técnicas percutáneas, puede reducir la tasa de eventos embólicos e incluso permitir la eliminación del tratamiento anticoagulante.
Exclusión quirúrgica de la orejuela izquierdaEl cierre quirúrgico de la orejuela se viene realizando desde hace varios años. Entre los problemas más importantes a la hora de analizar el resultado del cierre quirúrgico, no hay una estandarización de las técnicas, su realización no está exenta de complicaciones y en el seguimiento tras el cierre quirúrgico de la orejuela se ha observado que un porcentaje no bajo de estos pacientes presentan flujo residual50,51. Por todo ello, actualmente tanto la guía de la AHA/ACC/HRS9 como la última actualización de la guía de la ESC52 recomiendan la exclusión quirúrgica de la orejuela con indicación de clase IIB y nivel de evidencia C.
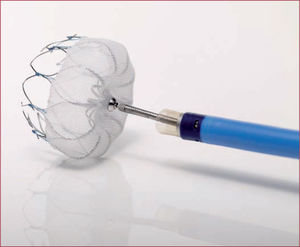
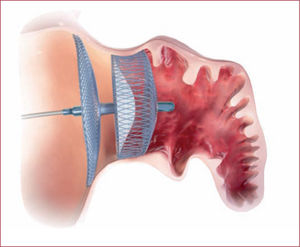
Cierre percutáneoActualmente hay 2 dispositivos en uso en nuestro país, el sistema Watchman de Boston Scientific y el sistema Amplatzer Amulet de St. Jude Medical. En ambos casos, se trata de dispositivos que se implantan por vía percutánea mediante punción en vena femoral y a través de punción transeptal (figuras 3 y 4).
Con el sistema Watchman se han publicado 2 estudios aleatorizados de no inferioridad frente a warfarina53,54, y más recientemente se han publicado los resultados del seguimiento a 4 años de los pacientes incluidos en el estudio PROTECT AF55. En estos estudios se ha incluido a pacientes sin contraindicación para warfarina, por lo que los pacientes que recibieron el dispositivo mantuvieron el tratamiento con esta al menos los primeros 45 días, y después se fue retirando en función de los datos del flujo en la orejuela a los 45 días, los 6 meses y los 12 meses, de modo que a los 45 días el 88% de los pacientes dejaron de tomar warfarina y a los 6 meses, el 92%. Ambos estudios mostraron que no hay diferencias entre el grupo aleatorizado a warfarina y el grupo al que se implantó el dispositivo en cuanto a la tasa de ictus isquémico o hemorrágico y la mortalidad. Los pacientes a los que se implantó el dispositivo tuvieron una tasa de derrame pericárdico periprocedimiento del 4,7% en el primero de los estudios, publicado en 200954, que se redujo al 0,37% en el estudio publicado en 201454. Los datos de seguimiento a 4 años muestran que la estrategia de cierre de orejuela cumple los criterios de no inferioridad e incluso de superioridad con respecto a la de warfarina en cuanto al objetivo combinado de ictus, embolia sistémica y mortalidad, y que la tasa de complicaciones en el seguimiento es similar en ambos grupos, el grupo de cierre mostró una mayor tasa de derrame pericárdico ligado al implante y el grupo de warfarina, una mayor tasa de hemorragia mayor en el seguimiento55.
Respecto al sistema Amplatzer, se ha publicado un estudio observacional que incluyó a 1.047 pacientes de 22 centros, sin uso de AVK, tratados con el dispositivo y ácido acetilsalicílico, con una tasa de éxito en el implante del 97,3%, una tasa de complicaciones relacionadas con el implante del 4,9% y una tasa de ictus en el seguimiento de 1 año del 0,9%. Recientemente se ha publicado una pequeña experiencia en España, que incluía a 20 pacientes con tratamiento antiagregante, con una tasa de éxito del implante agudo del 100% y sin complicaciones agudas56.
Ha habido experiencias recientes que indican la posibilidad de realizar en el mismo tiempo ablación de VP y cierre de orejuela57,58. Si bien se ha demostrado que es técnicamente factible, por el momento no hay datos que avalen su uso, ya que en estos casos se ha descrito un aumento de las complicaciones agudas57 o de recidiva de FA en la fase precoz del seguimiento58.
Hay que reconocer que no hay datos comparativos del uso de estos dispositivos con los nuevos anticoagulantes de acción directa, que actualmente tiene cada vez mayor implementación en la práctica clínica. Un reciente estudio de revisión sistemática y metanálisis de estudios aleatorizados con los anticoagulantes y estudios observacionales con los dispositivos de cierre de orejuela indica que el uso de dispositivos de cierre puede asociarse con disminución de eventos tromboembólicos y, especialmente, hemorrágicos59. Estos datos, debido a que no se trata de comparaciones directas, deben tomarse con cautela.
Así pues, con los datos disponibles, la actualización de 2012 de la guía de la ESC recomienda que se puede considerar el cierre percutáneo de la orejuela (indicación de clase IIb) para pacientes con alto riesgo de ictus y contraindicaciones para el tratamiento anticoagulante oral crónico52 (nivel de evidencia B).
Dado que se trata de una técnica invasiva no exenta de riesgo, especialmente el derrame pericárdico en el momento del implante, esta técnica se debe reservar a centros con experiencia o, al menos en sus fases iniciales, realizarla bajo supervisión de operadores experimentados.
Conflicto de interesesF. Atienza ha recibido honorarios por consultoría de Medtronic, Sorin, Bayer y Daiichi Sankyo.