La hipercolesterolemia es uno de los más importantes factores de riesgo de enfermedades cardiovasculares, y no siempre es posible controlarla con los tratamientos convencionales: dieta, ejercicio y fármacos hipolipemiantes. La inhibición de la proteína PCSK9 mediante anticuerpos monoclonales aumenta el número de receptores de colesterol unido a lipoproteínas de baja densidad (cLDL) en el hepatocito y, por lo tanto, contribuye a su destrucción. Con estos fármacos, empleados solos o añadidos a estatinas o ezetimiba, se ha observado una reducción del colesterol muy importante que permite mantener las cifras de cLDL de la mayoría de los pacientes en lo recomendado por las guías de práctica clínica. Para averiguar su eficacia clínica, se han diseñados 3 estudios multicéntricos de morbimortalidad con alirocumab, evolocumab y bococizumab. En el estudio del evolocumab, un anticuerpo monoclonal 100% humano, se demostró una reducción significativa del objetivo primario de eficacia, que incluía mortalidad cardiovascular, infarto agudo de miocardio, ictus, angina inestable o revascularización miocárdica. Por el contrario, en el estudio con bococizumab, un anticuerpo humanizado, no 100% humano, no se observó beneficio clínico, lo que se atribuye a una disminución de la eficacia secundaria a la creación de anticuerpos contra el fármaco. Esta nueva opción terapéutica ya está disponible en la práctica clínica y supone un nuevo avance en la prevención de las enfermedades cardiovasculares.
Palabras clave:
Los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (iPCSK9) constituyen una nueva oportunidad para el tratamiento de las dislipemias en general, y en particular de los pacientes con alto riesgo y concentraciones de colesterol unido a lipoproteínas de baja densidad (cLDL) fuera de los límites recomendados por falta de mayor eficacia de los tratamientos convencionales: dieta, ejercicio físico, estatinas y ezetimiba. Situaciones especialmente relevantes son las de los enfermos con hipercolesterolemia familiar, los que presentan cifras de cLDL muy elevadas y los que no toleran las estatinas. En estos casos, es muy difícil o incluso imposible conseguir el control adecuado del cLDL con los medios disponibles y el riesgo de eventos cardiovasculares es muy alto.
El desarrollo de investigación básica y clínica, la aprobación por las autoridades reguladoras y la comercialización de los iPCSK9 se realizó en un tiempo récord. En el año 2003, la hipercolesterolemia familiar se asoció con una mutación de la proteína PCSK91, cuya estructura quedó determinada en 20072, lo que permitió iniciar el proceso de generar anticuerpos monoclonales contra la proteína3 y comenzar la investigación para demostrar su posible eficacia clínica. Los estudios iniciales, que incluían un número significativo de pacientes pero tratados durante poco tiempo (semanas o meses), ofrecieron unos resultados sorprendentes, ya que se observó una reducción del cLDL hasta cifras sin precedentes y un perfil de eficacia y seguridad prometedor4. Por este motivo, el evolocumab y el alirocumab recibieron la aprobación de agencias reguladoras para su uso clínico en 20155-8, a la espera de datos definitivos de eficacia clínica explorados en 3 estudios multicéntricos de morbimortalidad y seguridad a largo plazo con evolocumab9, bococizumab10 y alirocumab11. El alirocumab y el evolocumab se comercializaron en 2016 y se incluyeron en múltiples guías de práctica clínica12, y en 2017 se publicaron los primeros resultados de 2 de los estudios multicéntricos de morbimortalidad y seguridad: el estudio FOURIER9 con evolocumab y el estudio SPIRE10 con bococicumab; el estudio de morbimortalidad con alirocumab está en curso.
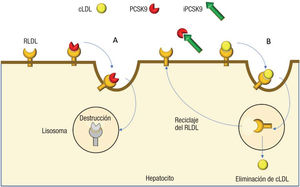
Mecanismo de AcciónReceptores hepatocelulares de cLDL y proteína PCSK9El cLDL circulante tiene un potente efecto aterogénico, y el organismo dispone de un sistema de destrucción de LDL en el hígado y simultáneamente de un sistema, en cierto modo, ahorrador de LDL13-15.
En el núcleo del hepatocito se producen receptores específicos del cLDL, que son liberados a la superficie celular. Estos receptores específicos capturan el LDL circulante y lo internalizan en el hepatocito mediante un proceso de endocitosis; este LDL se destruye en los lisosomas, liberando el receptor del LDL, que se recicla y vuelve a desplazarse a la superficie del hepatocito, donde puede capturar otra molécula de LDL (figura). Este proceso de reciclado puede repetirse hasta 100 veces.
En el núcleo del hepatocito se produce otra proteína, la PCSK9, que también se secreta al exterior celular, donde se une a los receptores del cLDL. Este complejo formado por el receptor de LDL y la proteína PCSK9 sufre el mismo proceso de endocitosis, pero se degrada en su conjunto en el interior de los lisosomas; es decir, no se realiza el reciclado del receptor de LDL a la superficie del hepatocito. En cierto modo, la proteína PCSK9 es un mediador de la degradación de los receptores del cLDL, con el fin de ahorrar LDL.
La mayor o menor producción de proteína PCSK9 está determinada por varios factores, especialmente mutaciones genéticas, y puede estar aumentada o disminuida. Cuando está aumentada, como en el caso de la hipercolesterolemia familiar, se reduce el número de receptores de LDL en la membrana del hepatocito, por lo que aumentan la concentración plasmática de LDL y las manifestaciones clínicas de ateroesclerosis16. Cuando la expresión de la proteína PCSK9 está disminuida, como sucede en personas con mutaciones (142X y 679X) en los genes reguladores de la PCSK9, los receptores del LDL no se destruyen, sino que se reciclan después de transportar una molécula de LDL y vuelven a la superficie del hepatocito para capturar otra molécula de LDL. En esta situación, disminuyen la concentración plasmática de cLDL y las manifestaciones clínicas de ateroesclerosis17,18. Curiosamente, el tratamiento con estatinas aumenta la expresión de la proteína PCSK9, en una especie de mecanismo de retroalimentación secundario a la disminución de cLDL19.
Estas observaciones convierten la proteína PCSK9 en un objetivo clave en el tratamiento de las dislipemias con aumento de cLDL y en la prevención de la ateroesclerosis y sus consecuencias clínicas. Aunque este es el mecanismo principal que relaciona la proteína PCSK9 con la ateroesclerosis y las enfermedades cardiovasculares, en estudios en animales y en humanos, se ha podido comprobar que la proteína PCSK9 desempeña una función molecular relevante en otros procesos relacionados con la ateroesclerosis y las enfermedades cardiovasculares, entre ellos el metabolismo de la glucosa, la hipertensión arterial, la adipogénesis, la apoptosis endotelial y la inflamación, por lo que su papel fisiopatológico es múltiple15.
Existen 3 posibilidades de disminuir la producción de proteína PCSK9 o su funcionamiento:
- •
Manipulación genética a través de la inhibición del ARN encargado de la formación de la proteína PCSK9 (Gene silencing RNA) 14,15,20,21.
- •
Utilización de péptidos miméticos que compiten con la PCSK9 en la unión con los receptores de LDL22,23.
- •
El empleo de anticuerpos monoclonales de la PCSK9; los denominados iPCSK9, que la bloquean y permiten que los receptores de cLDL puedan transportarlo al interior del hepatocito, donde se destruye, y se reciclen para capturar nuevas moléculas de LDL en la superficie del hepatocito13-15.
De los 3 mecanismos posibles de interferencia con la PCSK9, el más desarrollado y ya disponible en la práctica clínica es la inhibición directa de la proteína mediante anticuerpos monoclonales. De los múltiples anticuerpos desarrollados15, 3 llegaron a la fase de investigación en estudios en fase 3 que incluían un número adecuado de pacientes y un seguimiento suficiente para valorar su impacto en la morbimortalidad cardiovascular: evolocumab, alirocumab y bococicumab. Con los 3 se ha logrado una reducción inédita del cLDL, hasta un 80% de los valores basales, tanto en estudios en animales como en voluntarios sanos y pacientes con diversas enfermedades: hipercolesterolemia familiar con o sin múltiples factores de riesgo cardiovascular, que toleraban las estatinas y que no, y en la mayoría de los estudios, en tratamiento con diferentes estatinas combinadas o no con ezetimiba4.
Con diferentes dosis de los 3 fármacos, se consigue reducir la concentración plasmática de PCSK9 hasta hacerla indetectable, efecto que se acompaña de una reducción paralela del cLDL que se prolonga durante semanas y permite administrar el anticuerpo vía parenteral (subcutánea) cada 2-4 semanas23-25.
Aunque los 3 fármacos ofrecen un mecanismo de acción prácticamente idéntico, existe una diferencia que ya se puede considerar un factor diferencial determinante, aparentemente solo detectable cuando la administración del anticuerpo se prolonga cierto tiempo. Existen varios tipos de modelos de anticuerpos monoclonales según su origen y su estructura proteica: murino, quimérico, humanizado y 100% humano. Su capacidad para inducir anticuerpos contra ellos mismos es máxima en los modelos murinos y mínima en los 100% humanos. El alirocumab y el evolocumab son anticuerpos 100% humanos, mientras que el bococizumab es en parte murino (aunque más del 90% humanizado) y tiene mayor capacidad de generar anticuerpos contra sí mismo, con lo que el fármaco va perdiendo efectividad, al menos en un porcentaje de pacientes que se convierten en no respondedores9. Esto se ha demostrado en los estudios SPIRE-1 y 2 y SPIRE Outcomes25,26, en los que se incluyó a más de 27.000 pacientes. Este estudio, así como el programa de investigación del fármaco, se suspendieron prematuramente por la falta de eficacia clínica suficiente y los efectos secundarios.
Eficacia y Seguridad de Los Inhibidores de la Pcsk9Reducción del cLDLEn un metanálisis de 20 estudios iniciales4 que incluyeron a 10.159 pacientes tratados con alirocumab y evolocumab o placebo/ tratamiento convencional y con seguimiento a corto y medio plazo, se observó de manera constante una reducción del cLDL del 50% con ambos fármacos analizados (tabla 1). También se observó una reducción uniforme de las cifras de colesterol total (31%) y de lipoproteína(a) (26%) y un aumento pequeño pero estadísticamente significativo del colesterol unido a lipoproteínas de alta densidad (cHDL) (6%).
Reducción del cLDL con los ?PCSK9. Metanálisis de estúdios publicados hasta 20154
| Metanálisis | Reducción de cLDL, % (1C95%) | p |
|---|---|---|
| iPCSK9 frente a no iPCSK9 | -47,5 (69,6-25,3) | < 0,001 |
| iPCSK9 frente a placebo | -58,8 (61,0-56,5) | < 0,001 |
| iPCSK9 frente a ezetimiba | -36,17 (39,3-33,1) | < 0,001 |
cLDL: colesterol unido a lipoproteínas de baja densidad; IC95%: intervalo de confianza del 95%; iPCSK9: inhibidores de la PCSK9.
En el estudio FOURIER8 se incluyó a 27.564 pacientes con enfermedad cardiovascular ateroesclerótica y cifras de cLDL > 70 mg/dl en tratamiento con estatinas. Se aleatorizó a los pacientes a recibir evolocumab subcutáneo (150 mg cada 15 días o 420 mg cada mes) o placebo. La reducción del cLDL de los pacientes que recibieron evolocumab alcanzó el 59%, efecto que se observó desde el primer mes de evolución y se mantuvo constante durante el seguimiento (mediana, 2,2 años).
Sin embargo, los datos son discrepantes cuando se analiza el efecto del bococizumab, el anticuerpo monoclonal no 100% humano. En el estudio SPIRE10,26, la reducción del cLDL con bococizumab fue disminuyendo, en estrecho paralelismo con la concentración plasmática de anticuerpos contra el bococicumab y el aumento de la concentración de PCSK9.
Reducción de la morbimortalidadEn el metanálisis de Navarese et al.4, se observó una reducción significativa (65%) de las muertes por cualquier causa (tabla 2), pero las cifras absolutas de mortalidad de estos pacientes, con riesgo relativamente bajo y un seguimiento muy corto, fueron muy bajas (el 0,31 y el 0,53% con o sin iPCSK9 respectivamente), lo que justifica la necesidad de amplios estudios de morbimortalidad a largo plazo. Lo mismo puede decirse del efecto en la reducción de la mortalidad cardiovascular o el infarto de miocardio.
Mortalidad cardiovascular en estúdios con iPCSK9 (evolocumab o alirocumab)
| Grupos con iPCSK9 | Grupos de control | OR (1C95%) | p |
|---|---|---|---|
| 19/6.187 (0,31%) | 21/3.792 (0,55%) | 0,45 (0,23-0,86) | 0,015 |
IC95%: intervalo de confianza del 95%; iPCSK9: inhibidores de la PCSK9; OR: odds ratio. Metanálisis sin inclusión de los estudios de morbimortalidad FOURIER y SPIRE4.
En el ya mencionado estudio FOURIER9 de morbimortalidad, se analizaron como objetivo principal las diferencias en mortalidad cardiovascular, infarto agudo de miocardio, ictus, angina inestable o revascularización miocárdica en los 2 grupos de tratamiento: evolocumab y placebo. Este parámetro de eficacia combinado se redujo un 15% a las 48 semanas de tratamiento y, aparentemente, el beneficio es mayor cuanto más se prolonga el seguimiento (tabla 3). Los resultados concordaron entre los subgrupos analizados, incluidos los grupos con cifras de cLDL más bajas. Entre los componentes del objetivo principal de eficacia, se observó una reducción significativa en infarto agudo de miocardio, ictus y necesidad de revascularización. Sin embargo, no se observaron diferencias significativas en la mortalidad total, la cardiovascular y el ingreso por angina inestable.
Eficacia clínica del evolocumab frente a placebo en el estudio FOURIER
| Tiempo de tratamiento | OR (IC95%) | |||
|---|---|---|---|---|
| 18 meses | 24 meses | 36 meses | ||
| Evolocumab, % | 3,1 | 5,5 | 7,9 | 0,8 (0,73-0,88) |
| Placebo, % | 3,7 | 6,8 | 9,9 | - |
IC95%: intervalo de confianza del 95%; OR: odds ratio.
Eficacia clínica: mortalidad cardiovascular, infarto de miocardio, ictus o angina inestable. Las diferencias entre los 2 grupos aumentan progresivamente durante el periodo de tratamiento8.
Por el contrario, en el estudio SPIRE Outcomes10 no se observó beneficio clínico significativo, si bien se suspendió prematuramente y el seguimiento fue de solo 9 meses. Curiosamente, el estudio SPIRE Outcomes incluyó 2 estudios, el SPIRE-1, en pacientes con cLDL < 70 mg/dl, y el SPIRE-2, en pacientes con cifras basales de cLDL > 130 mg/dl y mayor riesgo cardiovascular. Como puede observarse en la tabla 4, los resultados de estos 2 estudios ofrecen resultados diferentes: nulo efecto en el SPIRE-1 y reducción significativa de la morbimortalidad en el SPIRE-2.
Eficacia clínica del bococizumab frente a placebo en el estudio SPIRE
| Estudio | HR (IC95%) | p |
|---|---|---|
| SPIRE-1 | 9,99 (0,80-1,22) | 0,94 |
| SPIRE-2 | 0,79 (0,65-0,97) | 0,02 |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; LDL: lipoproteínas de baja densidad.
El estudio SPIRE es el conjunto de 2 estudios paralelos con los mismos objetivos y con pacientes de riesgo diferente. En el SPIRE-1 se incluyó a pacientes con LDL < 70 mg/dl y en el SPIRE-2, a pacientes con LDL > 130 mg/dl. La eficacia clínica (mortalidad cardiovascular, infarto de miocardio, ictus o angina inestable) solo se observó en el SPIRE-29.
Los resultados del estudio de morbimortalidad con alirocumab ODYSSEY Outcomes10 no se conocerán hasta dentro de unos meses, pero en un estudio previo de morbimortalidad, el ODYSSEY LONG TERM27, se incluyó a 2.341 pacientes que recibieron alirocumab o placebo durante 78 semanas. El objetivo principal del estudio era cuantificar la reducción de cLDL a las 24 semanas en el grupo de alirocumab frente a placebo. La reducción del colesterol alcanzó el 62% y se mantuvo desde la cuarta semana (primer control analítico) hasta el final del periodo de seguimiento. En este estudio, la incidencia de complicaciones cardiovasculares (mortalidad por cardiopatía isquémica, infarto de miocardio no mortal, ictus mortal y no mortal y angina inestable con ingreso hospitalario) fue significativamente menor en el grupo de alirocumab (el 1,7 frente al 3,3%).
SeguridadCuando se inició la investigación con anticuerpos monoclonales, había cierta preocupación por los posibles efectos secundarios, en especial por posibles reacciones alérgicas secundarias a la administración parenteral del anticuerpo monoclonal, daño muscular secundario a la disminución del cLDL y problemas de origen cognitivo, potencialmente atribuidos a una reducción del cLDL «excesiva» y prolongada a cifras nunca alcanzadas previamente en estudios a gran escala.
En el ya mencionado metanálisis de Navarese et al.4, las reacciones adversas fueron similares en los grupos de tratamiento activo y los grupos de control (tabla 4). En otro metanálisis más reciente28, que incluye solo los estudios con más de 6 meses de evolución excepto los estudios FOURIER y SPIRE Outcomes, no disponibles en la fecha de la publicación, tampoco se encontraron diferencias en los efectos adversos entre los pacientes tratados con y sin iPCSK9 (tabla 5), pero en ese metanálisis de estudios con un seguimiento más largo se observó una posible tendencia al aumento de los efectos adversos neurocognitivos en los pacientes tratados con alirocumab. En cualquier caso, la crítica a los estudios incluidos en este análisis fue la falta de seguimiento durante periodos más largos que reflejasen mejor lo que sería la administración clínica después de su aprobación, lo que resalta la importancia de estudios amplios y de mayor seguimiento.
Efectos adversos graves en los estudios con evolocumab y alirocumab, excluidos los estudios de morbimortalidad específicos (FOURIER y SPIRE)4
| Grupos con iPCSK9, n/N (%) | Grupos de control, n/N (%) | OR (IC95%) | p |
|---|---|---|---|
| 741/6.760 (10,9) | 403/3.896 (10,3) | 1,00 (0,88-1,15) | 0,015 |
IC95%: intervalo de confianza del 95%; iPCSK9: inhibidores de la PCSK9; OR: odds ratio.
Los efectos secundarios a largo plazo ya se han analizado en 2 estudios de morbimortalidad, y hay un tercero en curso. En el estudio FOURIER9, con una mediana de seguimiento de 2,2 años, no se encontraron diferencias en los efectos adversos entre los 2 grupos (evolucomab y placebo), como reacciones alérgicas, inicio de diabetes, problemas musculares, rabdomiolisis, aumento de transaminasas, cataratas y alteraciones neurocognitivas, que fueron en todos los casos idénticos en los 2 grupos9.
Efectos adversos neurocognitivos en los estudios con evolocumab y alirocumab, excluidos los estudios de morbimortalidad específicos (FOURIER y SPIRE)27
| Grupos con iPCSK9, n/N (%) | Grupos de control, n/N (%) | OR (IC95%) | p |
|---|---|---|---|
| 56/6.760 (0,8) | 20/3.896 (0,5) | 1,29 (0,64-2,59) | 0,47 |
IC95%: intervalo de confianza del 95%; iPCSK9: inhibidores de la PCSK9; OR: odds ratio.
En el estudio EBBINGHAUS29, un subestudio del FOURIER, se analizó con más detalle el aspecto relacionado con la capacidad cognitiva en 1.974 pacientes incluidos en el estudio FOURIER. La media de edad era 63 años y el 25% eran mujeres. Se excluyó del estudio a los pacientes con diagnóstico de demencia previo y enfermedades mentales o neurológicas con relevancia clínica. En el estudio se emplearon tests aprobados para la valoración de la memoria funcional, la memoria de trabajo y la capacidad de atención y de reacción, así como la capacidad cognitiva general y episodios cognitivos adversos. No se observaron diferencias entre los grupos de tratamiento. Tampoco se observaron diferencias cuando se analizó al grupo de pacientes con cifras de colesterol < 25 mg/dl29.
En el estudio SPIRE26, con un seguimiento promedio de 9 meses (se suspendió prematuramente), el número de efectos adversos fue superior en el grupo de bococizumab que en el de placebo, aunque los únicos destacables fueron las reacciones cutáneas en el lugar de las inyecciones subcutáneas del fármaco (el 10,4 frente al 1,3%) y el aumento de la glucemia basal (el 4,4 frente al 3,1%). Sin embargo, no se observaron alteraciones en las enzimas hepáticas y las transaminasas ni alteraciones cognitivas.
En el estudio ODYSSEY LONG TERM26, el único efecto secundario observado en el grupo de alirocumab fue un aumento de las mialgias. Las alteraciones cognitivas fueron similares en los grupos de alirocumab y de tratamiento convencional.
Indicaciones Aprobadas y Recomendaciones en las guÍas de Práctica clínicaLas agencias reguladoras, incluidas la Food and Drug Administration (FDA) en Estados Unidos y la European Medicines Agency (EMA) en Europa, basándose en la demostrada reducción del cLDL, aprobaron el uso clínico del alirocumab y el evolocumab en 2015, 2 años antes de conocerse los resultados de los estudios de morbilidad5-7. Después de la aprobación por las agencias reguladoras, las principales guías de práctica clínica establecieron las primeras recomendaciones de uso. En general, las recomendaciones se basan en 3 condiciones: a) alto riesgo cardiovascular; b) colesterol elevado a pesar de la dieta y el ejercicio adecuados y la máxima dosis de estatinas tolerable, y c) en algunas guías se añade además el tratamiento con ezetimiba para intentar un control del cLDL antes de establecer la indicación de los iPCSK9. Las recomendaciones aprobadas por la EMA incluyen las siguientes7,8:
- •
El alirocumab y el evolocumab están indicados para pacientes con hipercolesterolemia primaria (heterocigótica, familiar o no) y dislipemias mixtas, en combinación con dieta y estatinas u otros agentes hipolipemiantes cuando con estas medidas no sea posible alcanzar los objetivos de reducción de colesterol (se entiende que los objetivos son los recomendados en las guías de práctica clínica).
- •
El evolocumab está indicado, además, para pacientes con hipercolesterolemia familiar homocigótica mayores de 12 años.
- •
En este sentido, la Sociedad Europea de Cardiología12 (y, por consiguiente, también la Sociedad Española de Cardiología30) considera muy alto riesgo cardiovascular la presencia de enfermedad cardiovascular previa o diabetes con lesiones en órgano diana y otro factor de riesgo cardiovascular. La concentración de cLDL necesaria para la recomendación de iCPSK9 es > 100 mg/dl (supuestamente para alcanzar la cifra de cLDL óptima, establecida en < 70 mg/dl), a pesar del uso de la máxima dosis de estatinas tolerada y ezetimiba.
Resumen de las indicaciones actuales de los iPCSK9 recomendadas por diferentes organismos en Europa y Espana
| Riesgo | cLDL | Fármacos adicionales | |
|---|---|---|---|
| EMA5-7 | • Hipercolesterolemia familiar• Dislipemia mixta | Hipercolesterolemia “sin alcanzarse objetivos terapêuticos” | Máxima dosis de estatinas tolerada u otros hipolipemiantes |
| ESC11 | • Hipercolesterolemia familiar• Enfermedad CV establecida• Diabetes con dano en òrgano diana y otro factor de riesgo CV | > 100 mg/dl. Objetivo < 70 | Máxima dosis de estatinas tolerada y ezetimiba |
| AEM30,31 | • Hipercolesterolemia familiar• Enfermedad CV establecida | > 100 mg/dl | Máxima dosis de estatinas tolerada |
| Hospitales* | • Hipercolesterolemia familiar• Enfermedad CV establecida | > 100 mg/dl | Máxima dosis de estatinas tolerada y ezetimiba |
La Agencia Española del Medicamento, en sus informes de posicionamiento terapéutico31,32, establece que el evolocumab y el alirocumab se financian para pacientes con hipercolesterolemia familiar y pacientes con enfermedad cardiovascular establecida (cardiopatía isquémica, enfermedad cerebrovascular isquémica y enfermedad arterial periférica), en ambos casos con cifras de cLDL > 100 mg/dl y la máxima dosis de estatinas tolerada.
En España, algunas comunidades autónomas han añadido limitaciones a las indicadas por la Agencia Española del Medicamento. Las más frecuentes son comprobar los criterios en informes clínicos detallados (especialmente en la demostración de intolerancia a estatinas) y añadir la administración de ezetimiba antes de aprobar individualmente la prescripción gratuita del iPCSK9.
Dado el precio de estos fármacos, es muy poco probable que se extiendan prescripciones que no se financien a través del sistema público de salud.
Las guías deberán actualizarse basándose en las recientes publicaciones de los primeros estudios de mortalidad publicados en marzo de 2017.
Conclusiones- •
Los iPCSK9 permiten reducir el cLDL hasta valores no alcanzados con los fármacos hipolipemiantes habituales, estatinas y ezetimiba.
- •
La reducción del cLDL a una media de 30 mg/dl se asocia a un beneficio clínico, fundamentalmente la reducción de infarto de miocardio, lo que apoya la hipótesis de que «el cLDL, cuanto más bajo, mejor». Este efecto parece ser más manifiesto cuanto más se prolonga el tratamiento.
- •
El beneficio clínico demostrado hasta ahora en los estudios de morbimortalidad es pequeño, probablemente por la inclusión de pacientes sin alto riesgo de eventos cardiovasculares.
- •
En términos generales, el riesgo de mortalidad y eventos cardiovasculares de los pacientes con cardiopatía isquémica estable sin insuficiencia cardiaca es muy bajo cuando se usan todas las estrategias de tratamiento disponibles. Es necesario redefinir el riesgo cardiovascular de los posibles candidatos a nuevos tratamientos y estrategias terapéuticas.
- •
Aparentemente, los iPCSK9 son seguros, sin efectos secundarios importantes, al menos durante el tiempo de tratamiento, que es inferior al que se utilizará en la práctica clínica.
- •
Es necesario ampliar los periodos de seguimiento (farmacovigilancia) para comprobar la seguridad a largo plazo.
- •
Es necesario establecer mejor la dosis recomendada (las dosis recomendadas de alirocumab son 75 o 150 mg durante 15 días; las de evolocumab, 140 mg durante 2 semanas o 420 mg/4 semanas, hasta un máximo de 420 mg/2 semanas).
- •
Considerando su beneficio potencial, el inmenso número de candidatos potenciales al tratamiento y el elevado coste, es muy importante continuar la investigación para determinar cuáles son los grupos de pacientes con mejor relación coste-efectividad. Entre los grupos de población que se debería estudiar específicamente, se incluyen: pacientes con infarto de miocardio reciente, enfermedad arterial periférica, ictus aterotrombótico, episodios sucesivos de síndromes coronarios agudos, prevención primaria para pacientes con cifras de cLDL muy altas (con o sin hipercolesterolemia familiar) e imposibles de reducir con las estrategias habituales, pacientes con alto riesgo en general e intolerancia absoluta a las estatinas.
- •
Quizá la indicación principal según el conocimiento actual no sea la población incluida hasta ahora en los ensayos clínicos de morbimortalidad, que puede alcanzar cifras de cLDL extraordinariamente bajas. La población teóricamente con más beneficio sería aquella con muy alto riesgo: prevención secundaria para pacientes con enfermedad cardiovascular múltiple y cifras de cLDL muy superiores a las recomendadas en las guías de práctica clínica, especialmente en caso de intolerancia a las estatinas.
Esta publicación ha sido financiada por Amgen. Las conclusiones, interpretaciones y opiniones expresadas en ella corresponden exclusivamente a sus autores. Amgen declina cualquier responsabilidad sobre el contenido de la misma.
Conflicto de InteresesJ. López-Sendón: consultoría clínica de AstraZeneca, Daiichi Sankyo, Boehringer-Ingelheim, Sanofi y Amgen; honorarios por conferencias y cursos de AstraZeneca, Daiichi Sankyo y Boehringer-Ingelheim; becas de investigación de Sanofi, Pfizer, AstraZeneca, MERK, Glaxo y Boehringer-Ingelheim.