Palabras clave
INTRODUCCIÓN
Una de las complicaciones más temidas del tratamiento quirúrgico o intervencionista de la coartación aórtica y de cualquier angioplastia sobre las ramas pulmonares es la aparición de un aneurisma. A continuación describimos 2 casos que ocurrieron en nuestra unidad y que requirieron el uso de esta novedosa alternativa terapéutica.
CASOS CLÍNICOS
Caso 1
Paciente de 18 años de edad, operado de coartación aórtica (CoAo) en el período neonatal con técnica de Waldhausen (aortoplastia con autoinjerto de arteria subclavia izquierda) y buena evolución hasta los 5 años de edad, en la que presentó signos de recoartación, estenosis mitral moderada y estenosis aórtica leve. En ese momento se realizó una angioplastia con balón de la recoartación, que fue efectiva. A los 15 años de edad, en un estudio de control se encontró un aneurisma en el extremo distal del istmo aórtico, de 1 cm de longitud y recoartación leve. En el control con resonancia magnética (RM) al año se observó el crecimiento del aneurisma, por lo que se derivó al paciente a cirugía. El procedimiento consistió en el cierre de la boca aneurismática con puntos protegidos, exclusivamente.
Durante el seguimiento, a los 18 años de edad, la RM mostró nuevamente una recoartación importante, por lo que se indicó un nuevo cateterismo cardíaco.
La angiografía mostró un aneurisma de 7,2 mm, una zona compatible con una pequeña disección y una recoartación aórtica moderada con gradiente de 40 mmHg, un diámetro del segmento coartado de 8 mm, un istmo aórtico de 13,6 mm y una aorta descendente de 20 mm. Se propuso, como alternativa a una tercera intervención quirúrgica, el implante de un stent recubierto para el tratamiento combinado de ambas lesiones.
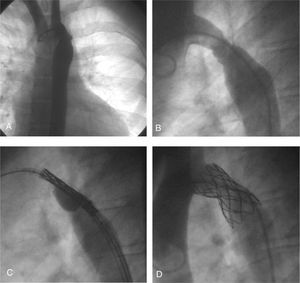
La técnica utilizada fue la siguiente: se utilizó la vía percutánea arterial femoral, en la que se insertó una guía Amplatz extrarrígida en «J» de 0,035 pulgadas, que se posicionó en la aorta ascendente, y una vaina de Mullins de 14 F de 65 cm. A través de ella se implantó un stent recubierto de politetrafluoroetileno expandido (PTFE) (Covered CP stent) de 34 mm de longitud, premontado sobre un balón BIB® de 18 mm de diámetro de balón externo y 9 mm de interno. Se reforzó el stent con crimping manual y se protegió el complejo balón-stent con un trozo de tubo plástico, para atravesar la válvula hemostática de la vaina de Mullins e impedir el desplazamiento posterior del stent. El stent se posicionó sin problemas, con ayuda de angiografías manuales a través de la vaina. El inflado del balón fue manual, primero el inner balloon y luego el outer balloon. En la angiografía de control se observaba la exclusión del aneurisma y una discreta cintura en el stent, sin repercusión hemodinámica. Los datos angiográficos y de presión se muestran en la tabla 1 y en la figura 1. A las 48 h el paciente fue dado de alta con un pequeño gradiente residual y sin ninguna complicación.
Fig. 1. A y B: aneurisma y recoartación. C: stent posicionado en la zona de coartación de la aorta y el aneurisma (apertura de inner balloon) D: stent ya posicionado; se observa la exclusión del aneurisma y el aumento de diámetro de la zona coartada.
Caso 2
Paciente con tetralogía de Fallot que había sido operado a los 2 años de edad realizándose cirugía correctora, ampliación de tracto de salida del ventrículo derecho con parche transanular de Gore-Tex (ventriculotomía ampliada hasta origen de arteria pulmonar izquierda [API]) y cierre de la comunicación interventricular (CIV) con parche de dacrón. En el seguimiento a largo plazo se objetivó una estenosis progresiva en el origen de ambas ramas pulmonares, que era predominante en la API. A los 10 años de edad, con el paciente asintomático, se detectó un gradiente transestenótico ecocardiográfico de 60 mmHg, por lo que se decidió realizar un cateterismo terapéutico y el implante de stents. Su peso era de 43 kg y la superficie corporal de 1,26 m2.
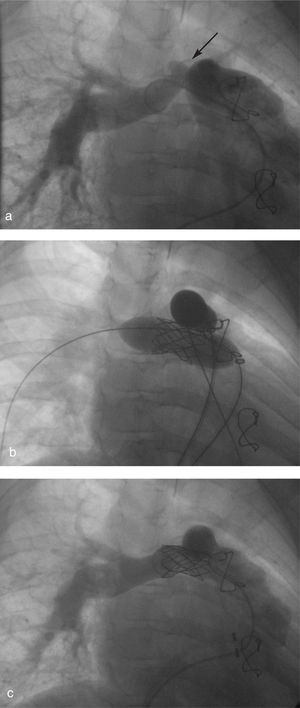
El estudio angiográfico de ambas ramas reveló, además de una doble estenosis en el origen de ambas ramas, un saco aneurismático en la pared superior de la rama pulmonar derecha, de 7 mm de base y 4 mm de altura, por lo que se decidió implantar un stent recubierto. En la figura 2 se observan las imágenes angiográficas del implante de ambos stents.
Fig. 2. Angiografía en la que se observa, en el siguiente orden: a) aneurisma en la arterial pulmonar derecha (APD) (flecha); b) implantación simultánea de Covered Stent y stent de ITi; c) angiografía posterior con exclusión del aneurisma y aumento de diámetro de las arterias pulmonares.
La técnica utilizada fue la siguiente: se posicionaron 2 vainas de Mullins (12 y 11 Fr) en las venas femorales derecha e izquierda. A través de la vaina de 12 Fr se posicionó en la arteria pulmonar derecha (APD), en el lugar de la estenosis, un CP Stent (Numed®) recubierto de Gore-Tex, de 28 mm de largo, montado sobre un BIB balón de 16 x 4 mm que cubría el aneurisma. Debido a un ligero desplazamiento proximal del stent sobre el balón (causado por resistencia y angulación de la vaina al atravesar el tracto de salida del ventrículo derecho), antes del inflado fue necesario reposicionar el stent. Para ello se hicieron coincidir el borde proximal del stent con la punta de la vaina de Mullins. En ese momento, y sujetando firmemente el complejo balón-stent, se empujó la vaina hasta centrar el stent sobre las marcas radioopacas del balón.
En la API se introdujo un stent ITi MEGA (EV3®) de 26 mm, montado sobre un BIB balón de 16 x 3 mm, posicionándolo en la región estenosada. Una vez verificada la posición de ambos stents mediante angiografías manuales a través de la vaina, se procedió al inflado simultáneo y manual de ambos stents.
Como se muestra en la tabla 2, se logró una clara disminución de la presión del ventrículo derecho además de un significativo aumento de los diámetros de ambas arterias pulmonares, quedando excluido el aneurisma en la angiografía pulmonar selectiva.
Actualmente, 1 año después de la implantación de los stents, el paciente realiza vida normal y en el control ecocardiográfico mantiene similares presiones del ventrículo derecho y no hay evidencia de aneurisma.
REVISIÓN Y DISCUSIÓN
La base anatómica-histológica sobre la cual se sustenta el desarrollo de un aneurisma se puede inferir de la observación en el microscopio de los segmentos de coartación aórtica resecados en cirugía. Se observa una severa disminución y desorden (disarray) del tejido elástico de la pared vascular y en dos tercios de los casos, una alteración histológica llamada «necrosis quística de la capa media» de la pared vascular. Este hecho sería el causante del debilitamiento de la pared de la aorta y un factor favorable para la formación de un aneurisma, después del daño vascular postangioplastia o cirugía1. Es importante destacar que esta lesión histológica es muy similar a la descrita en la dilatación idiopática de la aorta en pacientes con síndrome de Marfán1,2. Si bien este hallazgo no es apoyado por otros autores, resulta muy interesante.
Al realizar la angioplastia se produce un daño de las capas íntima y media que debería traducirse en una alta incidencia de aneurismas. Sin embargo, ésta suele ser variable; Rao et al3, mediante un estudio angiográfico posterior a dilatación con balón, han visualizado un proceso de remodelamiento del contorno aórtico que, de alguna manera, podría ser un factor determinante en la formación de aneurismas.
Incidencia
Se han comunicado incidencias bastante elevadas de aneurismas, que en las series antiguas llegan hasta el 43 y el 50%4,1. Parks et al4 encontraron 20 aneurismas en 39 pacientes operados entre 1976 y 1987 (50%). Probablemente hay cierta influencia del aprendizaje de la técnica con los años, ya que en las series más recientes su incidencia es menor, tanto poscirugía como postangioplastia, y alcanza frecuencias muy bajas, del 2-10%. Fletcher et al5 encontraron 2 entre 102 pacientes (1,9%) y Mendelsohn et al6, 3 entre 59 pacientes que recibieron angioplastia de la coartación aórtica nativa (5%). Suárez de Lezo et al7 obtuvieron una incidencia del 10% en coartaciones con cirugía o angioplastia. Puede considerarse un factor limitante del estudio, que no es sistemático en el seguimiento a largo plazo, la angiografía de control de los pacientes con angioplastia. No obstante, Rao et al3 efectuaron un estudio angiográfico de control en el seguimiento de un grupo de pacientes y hallaron una incidencia del 5% (3 aneurismas en 58 pacientes). La frecuencia de aparición de aneurismas en pacientes tratados con stents en la CoAo es más baja aún8,9.
Para algunos autores3,10, la disminución de esta alta incidencia está relacionada con el énfasis aplicado a la técnica de dilatación del balón, evitando la sobredistensión del segmento coartado. En este sentido, las recomendaciones actuales aconsejan, para la elección del balón, no sobrepasar el diámetro del istmo aórtico o el diámetro de la aorta en el diafragma, y no exceder en 3 veces el diámetro del segmento coartado11. Por otro lado, una cuidadosa manipulación del catéter y la guía en la región recientemente dilatada disminuye el riesgo de daño en el segmento tratado y, por consiguiente, la posibilidad de formación de aneurismas. Por último, la aparición de nuevas técnicas no invasivas, como la resonancia magnética (RM), ha contribuido al seguimiento de estos pacientes.
En este sentido, ha sido necesario definir qué imagen se considera aneurisma en la RM. La mayor parte de los estudios define la presencia de un aneurisma cuando se observa una deformación del contorno de la pared, cuyo diámetro es 1,5 veces el diámetro de la aorta en el diafragma1. La RM puede considerarse, pues, un adecuado examen no invasivo para buscar los aneurismas y su uso ha sido recomendado en todos los pacientes para el seguimiento de esta enfermedad, tratada mediante cirugía o cateterismo terapéutico1,11.
En estudios realizados en adultos12 se ha intentado encontrar factores pronósticos de formación de aneurisma poscirugía de coartación. Según este grupo, un tercio de los aneurismas se encuentran en la aorta ascendente, por lo que no tendrían relación con la cirugía. Asimismo, se observó una clara asociación con la presencia de válvula aórtica bicúspide presente a menudo en esta enfermedad.
En nuestros casos hemos utilizado el stent de Cheatham (CP Stent) recubierto con una membrana de PTFE. El CP Stent está fabricado con una aleación de 90% de platino y 10% de iridio. Teóricamente, esta combinación es más maleable y tendría una fuerza radial adecuada, favorecida también por el diseño de sus «zig». El CP Stent tiene bordes romos que disminuyen el riesgo de rotura del balón o daño de la pared vascular, y es más radioopaco debido a su composición de platino13. El stent está cubierto con PTFE, fijado por fuera en 4 puntos en cada borde del stent mediante un adhesivo de cianoacrilato. En uno de nuestros casos, el CP Stent estaba premontado en un BIB balón.
La utilidad del CP Covered Stent se basa en las características de su pared. Al estar recubierta, ocluye el orificio de entrada en la pared y excluye el aneurisma.
En la bibliografía se han descrito casos similares con stent recubierto con buenos resultados14-16, lo que nos anima a enfocarla como una buena alternativa. La comunicación reciente de un caso fatal17 en un paciente de 65 años, con aneurisma y coartación, ha motivado que algunos autores recomienden como primera alternativa el stent recubierto11,18,19 en la coartación nativa y en pacientes de mayor edad, con mayor riesgo de aneurisma o rotura aórtica.
Sin embargo, debemos mencionar algunas limitaciones del stent recubierto: a) la edad, ya que su uso está limitado en niños pequeños; b) el acceso vascular, por la necesidad de utilizar una vaina de gran tamaño, de 13, 14 o 16 Fr; c) el riesgo de excluir vasos colaterales emergentes, como las arterias subclavia, espinal u otras, en el caso de la aorta abdominal, y d) aún no sabemos con certeza si la redilatación del Covered Stent será efectiva en un futuro. Los detalles anteriormente mencionados nos obligan a tener gran cautela e iniciar estos procedimientos en laboratorios hemodinámicos con gran experiencia y con posibilidades de resolver sus potenciales complicaciones.
Correspondencia: Dr. R. Bermúdez-Cañete.
Servicio de Cardiología Pediátrica. Hospital Ramón y Cajal.
Carretera de Colmenar Viejo, km 9,100. 28034 Madrid. España.
Correo electrónico: r_bermudez@terra.es