La insuficiencia cardiaca con fracción de eyección conservada (ICFEc) es un reto para la cardiología moderna. Aunque este síndrome, de prevalencia cada vez mayor, se asocia a resultados desfavorables, los ensayos de tratamientos no han logrado establecer terapias eficaces. Actualmente se investigan soluciones a este problema, como categorizar y caracterizar a los pacientes de manera más diversificada en un intento de individualizar los tratamientos. En este campo, las nuevas técnicas de imagen aportan información importante. La disfunción diastólica es la piedra angular del diagnóstico y la fisiopatología de la ICFEc, y se considera que puede tener origen en la fibrosis instersticial y la rigidez del miocardio secundaria a inflamación sistémica. Las técnicas de mapeo de T1 mediante resonancia magnética cardiaca (RMC) constituyen una nueva herramienta que permite el diagnostico no invasivo de la fibrosis miocárdica difusa en el espacio extracelular. Esta revisión ofrece una visión general sobre el potencial de caracterizar mediante RMC con mapeo T1 el miocardio de los pacientes con ICFEc, subrayar sus implicaciones diagnósticas y pronósticas y tratar de las direcciones futuras. Se concluye que la técnica de mapeo T1 mediante RMC podría ser un instrumento eficaz para la caracterización de los pacientes en estudios epidemiológicos, diagnósticos y terapéuticos amplios sobre ICFEc.
Palabras clave
La prevalencia de pacientes con insuficiencia cardiaca (IC) y fracción de eyección conservada (IC–FEc) está aumentando y estos suponen ya la mitad del total de la población con IC1,2. Contrariamente a la creencia inicial de que se trataba de una entidad bastante benigna, actualmente se sabe que la aparición de IC–FEc se asocia con morbilidad y mortalidad significativas, similares a las de los pacientes con insuficiencia cardiaca y fracción de eyección reducida (IC–FEr)3.
Mientras que en las 3 últimas décadas las estrategias terapéuticas para este último grupo de pacientes han tenido múltiples avances, y en ensayos clínicos amplios se han demostrado efectos beneficiosos en cuanto a la mortalidad4, en los pacientes con IC–FEc no se ha podido validar todavía una opción de tratamiento efectiva.
La escasez de ensayos con resultados positivos en la IC–FEc se ha atribuido a la heterogeneidad de los pacientes incluidos5. Aunque se ha propuesto que la disfunción diastólica del ventrículo izquierdo (VI) es la piedra angular en la fisiopatología del síndrome de IC–FEc, solo recientemente se han establecido unos criterios de consenso para el diagnóstico de estos pacientes6. Es importante señalar que estos criterios incluyen la evidencia morfológica de un deterioro de la función diastólica del VI, basada principalmente en un examen ecocardiográfico. En cambio, en los ensayos clínicos en la IC–FEc solo un tercio de los pacientes incluidos tenían función diastólica normal7,8, mientras que hasta 2 tercios tenían deteriorada la función sistólica9. Se han identificado muchos otros deterioros de la función cardiaca, vascular y periférica, que pueden coexistir y conducir finalmente a varios de los principales desencadenantes de los síntomas de IC10–17.
Para el establecimiento de tratamientos personalizados para cada paciente, es imprescindible abordar con éxito la complejidad del síndrome de IC–FEc. Se ha propuesto una solución para este problema mediante una estratificación según la forma de presentación clínica18, las comorbilidades existentes5 o incluso mapas fenotípicos más complejos creados con algoritmos de aprendizaje automático14.
En la práctica clínica, el diagnóstico por imagen cardiaca es indispensable para el diagnóstico y la evaluación de los pacientes con IC–FEc, así como para la exclusión de otros trastornos en el diagnóstico diferencial19. Las nuevas técnicas de imagen podrían aportar la posibilidad de caracterizar mejor a los pacientes con IC–FEc. La imagenología por resonancia magnética cardiaca (RMC) está disponible cada vez más, y esta técnica está bien establecida en la evaluación de la morfología y la función cardiacas. La función diastólica puede evaluarse con mediciones del flujo, el strain (deformación) y la curva de tiempo-volumen, de manera similar a lo que ocurre con otras técnicas de imagen, como la ecocardiografía y la gammagrafía. A diferencia de lo que ocurre con otras técnicas de imagen, la RMC puede proporcionar también información sobre la composición del tejido miocárdico, dada su elevada resolución espacial y el origen molecular de la señal de la imagen20. Se ha demostrado de manera convincente que la técnica de realce tardío de gadolinio (RTG) es capaz de delimitar y cuantificar la fibrosis miocárdica focal. La presencia de RTG ha resultado útil para evaluar el pronóstico en diversos trastornos cardiovasculares21–23. Sin embargo, el RTG muestra principalmente las lesiones focales, pero es menos apropiado para evaluar alteraciones difusas como la fibrosis. La determinación de los tiempos de relajación T1 mediante el mapeo de T1 en la RMC es una nueva técnica emergente para la caracterización tisular cuantitativa, que permite detectar la fibrosis miocárdica intersticial/difusa y se ha validado histológicamente en una gran variedad de trastornos24,25.
El concepto actual del síndrome de IC–FEc se basa en que múltiples comorbilidades crean un estado inflamatorio sistémico26. Esta inflamación (subclínica) afecta a múltiples sistemas orgánicos. En el miocardio, una cascada de señalización conduce a una fibrosis intersticial reactiva y una alteración de la comunicación paracrina entre las células endoteliales y los miocardiocitos circundantes. Como resultado de ello, aumenta la rigidez del miocardio, lo cual a su vez implica disfunción diastólica con elevación de las presiones de llenado del VI27.
En consecuencia, la cuantificación de la fibrosis de los pacientes con IC–FEc tiene gran interés, y ello implica que las imágenes de RMC pueden aportar información sobre la composición del tejido miocárdico e identificar a los pacientes que podrían obtener un efecto beneficioso del tratamiento antitrombótico. Una cuantificación exacta de la fibrosis miocárdica difusa brinda la posibilidad de guiar el diagnóstico y el seguimiento de la IC–FEc, a la vez que puede servir de medida del éxito de futuras estrategias de tratamiento.
En esta revisión se presenta una perspectiva general de la caracterización no invasiva del tejido miocárdico de los pacientes con IC–FEc empleando del mapeo de T1 mediante RMC, y se describen sus consecuencias diagnósticas y pronósticas a la vez que se comentan las perspectivas futuras.
INSUFICIENCIA CARDIACA CON FRACCIÓN DE EYECCIÓN CONSERVADASe está reconociendo cada vez más que la IC–FEc es un síndrome complejo, que se produce en relación con la edad avanzada y comorbilidades cardiovasculares, metabólicas y proinflamatorias26. En última instancia, los pacientes con IC–FEc presentan un deterioro de la relajación y un aumento de la rigidez diastólica del VI28.
El aumento de la rigidez del VI indica una rigidez miocárdica pasiva atribuible a la fibrosis y la alteración de la función de los miocardiocitos. Los estudios de biopsia endomiocárdica en la IC–FEc ponen de manifiesto hipertrofia de los miocitos, fibrosis intersticial, relajación incompleta y aumento de la rigidez del miocardio, así como signos de inflamación sistémica y estrés oxidativo29–33. Estas observaciones condujeron a un nuevo paradigma de la fisiopatología de la IC–FEc. Esta teoría sostiene que las comorbilidades crean un medio proinflamatorio sistémico, inflamación endotelial microvascular coronaria, producción de citocinas profibróticas y la consecuente aparición de fibrosis intersticial. Además, el estrés oxidativo limita la biodisponibilidad de óxido nítrico y reduce los procesos celulares que se producen a través de la acción de la proteincinasa G. Esto da lugar a una hipofosforilación de las proteínas que influyen en la relajación y la rigidez de las miofibrillas, con lo que se agrava el deterioro de la función diastólica del VI26. Recientemente, en un estudio muy amplio de autopsias (124 pacientes con IC–FEc y 104 individuos de control), se han obtenido datos objetivos que respaldan este concepto, puesto que Mohammed et al.34 observaron que los pacientes con IC–FEc mostraban hipertrofia y fibrosis miocárdicas significativamente mayores, y ello estaba relacionado con una rarificación microvascular, más que con la hipertensión arterial.
Aunque la disfunción diastólica tiene su máxima prevalencia y produce las alteraciones fisiopatológicas características en los pacientes con IC–FEc, el deterioro que se produce en múltiples sistemas hace que sea un síndrome complejo. Las anomalías de la función sistólica del VI, la función del corazón derecho, los vasos sanguíneos, el endotelio y la periferia (incluido el músculo esquelético) desempeñan un papel importante. Además, los pacientes con IC–FEc presentan una reducción de la función de reserva cardiaca, es decir, de la capacidad de aumentar con el ejercicio la función arterial, cronotrópica y sistólica y diastólica del VI10–17. La elevación crónica de las presiones de llenado del VI da lugar a remodelado y disfunción de la aurícula izquierda (AI), hipertensión pulmonar mixta y, finalmente, remodelado y disfunción del ventrículo derecho (VD). De hecho, la disfunción sistólica del VD es un importante factor predictivo de la evolución clínica en la población con IC–FEc, mientras que serán necesarios nuevos estudios para esclarecer las repercusiones de la disfunción del VD para los pacientes con función sistólica biventricular conservada16,17. Sin embargo, el modelo de progresión de la enfermedad en la IC–FEc está menos claro que en la IC–FEr, con una significativa heterogeneidad de la expresión fenotípica.
La ecocardiografía es una técnica ampliamente disponible y con una relación coste-efectividad favorable, que tiene gran resolución temporal y proporciona una herramienta útil para las evaluaciones iniciales26. Sin embargo, muchos de los parámetros que proporciona dependen de la carga y pueden confundir el juicio clínico35.
El patrón de referencia para medir las presiones de llenado diastólico sigue siendo el cateterismo cardiaco invasivo. Usando catéteres de conductancia de alta fidelidad, se puede medir simultáneamente la presión y el volumen del VI. Este método permite determinar diversos parámetros funcionales sistólicos y diastólicos. La constante de tiempo, tau, de la reducción de presión durante la relajación isovolumétrica caracteriza la relajación diastólica temprana. La constante de rigidez pasiva, beta, caracteriza la relación presión-volumen telediastólicos13,36.
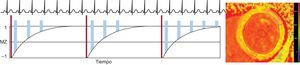
Mientras que se cree que la primera es consecuencia de un deterioro del proceso activo de inactivación muscular, una contracción asincrónica o unas condiciones de carga patológicas37, la segunda se atribuye a un aumento de la rigidez miocárdica, como ya se ha detallado. Se ha demostrado que ambos mecanismos desempeñan un papel importante en la aparición de la IC–FEc y posiblemente apunten a objetivos de tratamiento diferentes28 (figura 1).
Curvas de la relación presión-volumen del ventrículo izquierdo (VI) de los pacientes de control (A) y de los pacientes con insuficiencia cardiaca con fracción de eyección conservada (B) en reposo (líneas continuas) y durante el ejercicio (líneas discontinuas), en las que se observa un aumento de la elastancia arterial (pendiente de las líneas discontinuas azules), como indicador indirecto de la rigidez arterial, y una pendiente elevada de la relación de presión-volumen telediastólica, que indica la rigidez arterial (línea roja gruesa). El marcado aumento de la poscarga con el ejercicio conduce a que se prolongue la disminución de la presión del VI durante la relajación isovolumétrica en los pacientes con insuficiencia cardiaca con fracción de eyección conservada (C, flecha negra). Conjuntamente con un aumento de la rigidez ventricular, esto da lugar a un aumento de las presiones telediastólicas y un aumento patológico de las relaciones de presión-volumen telediastólicas (A y B, flechas rojas). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Un principio fundamental de la resonancia magnética es que la intensidad de señal de los píxeles se basa en la relajación de los protones de los núcleos de hidrógeno en un campo magnético estático, lo cual proporciona un sensible contraste de imagen de los tejidos blandos que corresponde a la composición del tejido, y ello puede reflejar la fisiología y la fisiopatología19. Los tiempos de relajación T1 reflejan la evolución de la recuperación de la magnetización longitudinal tras haberla desplazado de su estado de equilibrio aplicando un pulso de radiofrecuencia para invertir la magnetización. Tradicionalmente, las propiedades de relajación de T1 se codifican en las intensidades de píxeles de las imágenes y pueden identificar afecciones focales en el miocardio, como el infarto agudo, o las áreas de sustitución por fibrosis en comparación con el tejido de referencia circundante (ponderación de T1). Algunos avances recientes permiten realizar ahora una cuantificación numérica de los tiempos de relajación T1 en el corazón. Los mapas de T1 resultantes pueden codificarse con códigos de colores y contienen información sobre los tiempos T1 en cada vóxel, lo cual hace posible la detección y la cuantificación de variaciones incluso relativamente pequeñas de los tiempos T1 en el interior del miocardio para mostrar la afección del tejido38. Con la incorporación de la administración de un medio de contraste paramagnético extracelular (gadolinio), es posible mejorar aún más la detección de las anomalías tisulares (extracelulares)39. Además, puede calcularse la fracción de volumen extracelular (VEC), lo cual aporta información sobre la expansión relativa de la matriz extracelular y proporciona una alternativa no invasiva a los estudios de biopsia del miocardio24.
TÉCNICASLa rapidez con que la magnetización de spin recupera su estado de equilibrio depende de las características del tejido y la presencia de medios de contraste. La evolución temporal de la relajación en T1 se aproxima generalmente mediante una función exponencial. El principio general del mapeo de T1 consiste en la adquisición de múltiples imágenes en diferentes momentos tras la inversión o la anulación de la magnetización de equilibrio con pulsos de radiofrecuencia para ajustar la curva de T1 a las intensidades de señal de un vóxel de las imágenes con objeto de determinar la ecuación para la relajación de T138.
Se han utilizado múltiples variedades de estas secuencias básicas de recuperación de inversión (IR), como la secuencia LL (look-locker) estándar40, la secuencia de inversión-recuperación LL modificada (MOLLI)41 y la secuencia MOLLI acortada (shMOLLI)42. Otra posibilidad es usar técnicas de recuperación de saturación (SR), como la secuencia de adquisición de un solo disparo de recuperación de saturación (SASHA), que se basan en la anulación activa de la magnetización longitudinal en diferentes momentos para estimar el ajuste de la curva de relajación de T143. Existen, además, secuencias combinadas IR-SR (SAPPHIRE). Aunque se ha demostrado que todas estas técnicas son reproducibles y que su uso es viable para el diagnóstico, difieren por lo que respecta a la duración de la apnea, la sensibilidad a los artefactos de movimiento, la dependencia de la frecuencia cardiaca, el cociente señal/ruido, la exactitud y la precisión44. Con menos frecuencia se han utilizado otras secuencias o modificaciones para el mapeo de T1, como la lectura continua mediante Fast Low Angle SHot (FLASH-IR), las imágenes de spin y eco-planares simuladas (ss-SESTEPI), el muestreo de espacio k variable (VAST), y la inversión-recuperación tridimensional sensible a la fase (PSIR)45–48. A modo de ejemplo, se describe aquí la técnica clínica más utilizada hasta la fecha para el mapeo de T1, la secuencia MOLLI (figura 2). Durante el disparo único en diástole, se adquieren imágenes de manera intermitente durante 3 latidos cardiacos después de los primeros 2 pulsos de IR y 5 latidos después del tercer pulso de IR, con 3 latidos de recuperación entre ambos, lo cual se expresa también como 3(3)3(3)5 —número de imágenes adquiridas (número de latidos de recuperación)—. Así pues, pueden adquirirse múltiples puntos a lo largo de la curva de recuperación de T1. Se ha demostrado que la técnica MOLLI y sus variaciones, como 3(3)5 o 5(3)3(3)3, son muy reproducibles y proporcionan unas imágenes iniciales con un cociente señal/ruido alto, y con menos dependencia de la frecuencia cardiaca utilizando 5(3)3(3)3 que con el enfoque de 3(3)549.
Estrategia de adquisición para el mapeo de T1 utilizando una secuencia MOLLI. Después de un pulso de inversión (barras finas), las lecturas de la imagen (barras anchas) se realizan en la diástole durante 3 latidos cardiacos, seguido de un periodo de reposo de 3 latidos. Después se realiza otra inversión con lecturas con una compensación diferente durante otros 3 latidos cardiacos. Por último, se adquieren las lecturas durante 5 latidos después de un periodo de recuperación de 3 latidos. Este esquema de MOLLI se denomina, pues, 3(3)3(3)5. Mediante el ajuste de la intensidad de señal de cada píxel a la curva de recuperación de T1, puede generarse un mapa de T1 (derecha). MOLLI: secuencia de inversión-recuperación look-locker modificada.
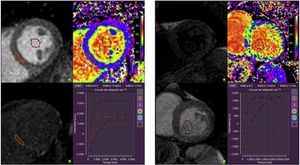
Al dividir el miocardio en volumen intracelular y VEC, el compartimento intracelular incluye los miocitos, fibroblastos, células endoteliales y células de músculo liso, mientras que el VEC puede subdividirse a su vez en un componente vascular (sangre) y el espacio intersticial residual, que incluye tejido conjuntivo fibroso, edema e infiltración inflamatoria. En general, se cree que los cambios del VEC se deben predominantemente a cambios en el espacio intersticial38. Se ha demostrado que la administración de un contraste extracelular basado en gadolinio es sensible al aumento del VEC asociado con la fibrosis miocárdica difusa. Sin embargo, el empleo de una sola determinación del T1 después de la administración del contraste tiene limitaciones debido a diversos factores de confusión, como la rapidez de eliminación del gadolinio, el tiempo de medición, la dosis inyectada, la composición corporal y el hematocrito21. Se puede superar estas limitaciones en parte mediante la medición directa de los cambios del T1 del miocardio, que están relacionados con cambios del T1 de la sangre antes y después de la administración del contraste39. Si se introduce una corrección para el hematocrito, la distribución fraccional extracelular miocárdica puede cuantificarse como VEC con la siguiente fórmula (figura 3):
Mapas de volumen extracelular obtenidos mediante cuantificación del cambio de los tiempos T1 en el miocardio y en la sangre antes y después de la administración de contraste de gadolinio, con una corrección según el hematocrito. Izquierda: un control sano presenta una fracción de volumen extracelular total de un 22%. Derecha: paciente con insuficiencia cardiaca con fracción de eyección conservada en el que se observan cambios difusos de la señal T1 con una fracción de volumen extracelular total elevada, de un 36%. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Al interpretar los tiempos T1 para la detección de la enfermedad cardiaca difusa, es preciso tener presentes algunas consideraciones. La señal de RMC para los tiempos T1 sin contraste (nativos) depende de factores tanto intracelulares como extracelulares, de tal manera que a más fibrosis miocárdica e inflamación se producen valores más altos, mientras que la acumulación de hierro y grasa en el miocardio acorta los tiempos T1 nativos. Los tiempos T1 posteriores al contraste reflejan predominantemente los cambios que se producen en el espacio extracelular, ya que la acumulación extracelular del medio de contraste acorta los tiempos T138. Es importante señalar que otras características morfológicas distintas de la fibrosis podrían influir en las determinaciones del T1 en un grado variable, como una inflamación miocárdica con edema intravascular o extravascular e hiperemia50,51.
No obstante, se ha descrito una relación uniforme entre los 3 índices de T1 (T1 nativo, T1 después del contraste y VEC) y el grado de fibrosis miocárdica difusa demostrado en la biopsia, en diversos trastornos, como la estenosis aórtica, la miocardiopatía hipertrófica y la IC. En conjunto, hay una notable variación entre las relaciones observadas, de tal manera que el VEC es el parámetro que muestra mejor correlación con la fibrosis (r de Pearson, 0,49-0,98)24.
La determinación de los índices de T1 proporciona también información pronóstica en diversas enfermedades cardiovasculares por lo que respecta a la predicción de la mortalidad por cualquier causa y los objetivos combinados que incluyen los ingresos por IC46,52–56. Estos estudios ponen de relieve la capacidad de las imágenes de RMC para caracterizar de manera no invasiva el miocardio y facilitar la cuantificación de la carga de enfermedad difusa, que está relacionada con los resultados clínicos adversos.
Lamentablemente, que las técnicas de mapeo con RMC sean susceptibles de cambios apenas sutiles en las técnicas de obtención de imágenes y en las normas de los proveedores dificulta las comparaciones directas de los resultados de distintos ensayos y hace necesario establecer una gama de valores de referencia del T1 en cada centro según su protocolo específico49. Sin embargo, se está trabajando en la estandarización de las mediciones del T157,58.
MAPEO DE T1 EN LA INSUFICIENCIA CARDIACA CON FRACCIÓN DE EYECCIÓN CONSERVADAComo ya se ha descrito, en la IC–FEc las comorbilidades fomentan un estado inflamatorio sistémico que conduce a rigidez celular y aparición de fibrosis intersticial reactiva, que finalmente da lugar a disfunción diastólica26.
En consonancia con estas consideraciones, se han constatado valores anormales de T1 en trastornos de conocida asociación con la fibrosis miocárdica (miocardiopatía hipertrófica, amiloidosis y miocardiopatía diabética), y en relación con los índices de deterioro de la función diastólica determinados mediante ecocardiografía59–61.
No es de extrañar que se esté prestando mayor atención al mapeo de T1 mediante RMC en los pacientes con IC–FEc, si bien los datos globales al respecto son todavía escasos.
Su et al.62 evaluaron con mapeo de T1 mediante un esquema MOLLI a 62 pacientes con IC–FEc, 40 con IC–FEr y 22 controles hipertensos. Dado que su objetivo era investigar la tasa de fibrosis difusa, se excluyeron manualmente las áreas de cicatrización local, lo cual es una consideración importante, dado que un porcentaje significativo de los pacientes del grupo de IC–FEr tenían cardiopatías isquémicas. Esos autores observaron que el VEC estaba significativamente elevado en los pacientes con IC–FEc (mediana del 29%) en comparación con los pacientes de control (mediana del 28%), pero era significativamente menor que el de los pacientes con IC–FEr (mediana del 31%). La función ventricular se evaluó con el método de la curva de volumen-tiempo derivada del estudio con cine-RMC, que aporta información sobre la eyección máxima y las velocidades de llenado máximas de la función sistólica y diastólica respectivamente. Las velocidades de llenado máximas estaban significativamente reducidas en los pacientes con IC–FEr y se habían reducido en menor medida en los pacientes con IC–FEc. Tiene interés señalar que el VEC se correlacionaba con las velocidades de llenado máximas en el grupo de IC–FEc, pero no en los controles ni en los que tenían IC–FEr. Además, los índices de la función ventricular sistólica estaban correlacionados con el VEC de los pacientes con IC–FEc. Aunque los tiempos T1 nativos no diferían, los de después del contraste mostraron una distribución similar a la del VEC en los distintos grupos. Las limitaciones estaban en los criterios de inclusión, que no son representativos de la definición actual de los pacientes con IC–FEc, la falta de datos ecocardiográficos y el uso de índices de la función ventricular con gran dependencia de la carga que, por lo tanto, rara vez se utilizan. Sin embargo, el estudio indica de manera elegante la fuerte conexión entre la cuantificación de la fibrosis miocárdica por RMC y la alteración de la función ventricular en la IC–FEc.
La información sobre el valor pronóstico del mapeo de T1 en los pacientes con IC–FEc procede de los estudios de Mascherbauer et al.46,63. En 1 estudio, se tuvo sospecha clínica de IC–FEc en 100 individuos y se confirmó en 63 mediante un algoritmo recomendado en las guías, que incluye ecocardiografía, determinaciones del péptido natriurético cerebral y un cateterismo cardiaco derecho46. Se realizó a todos los pacientes un cateterismo no invasivo con mapeo de T1 en secuencia FLASH-IR y administración de contraste de gadolinio; en los 61 con IC–FEc confirmada y también imágenes de T1 interpretables, se produjeron 16 eventos del criterio de valoración cardiaco combinado (3 muertes de causa cardiovascular y 13 hospitalizaciones por IC) durante un seguimiento medio de 22,9 ± 5,0 meses. Los tiempos T1 determinados tras la administración del contraste (hazard ratio [HR] = 0,99; intervalo de confianza del 95% [IC95%], 0,98-0,99]; p = 0,046), el área de AI > mediana (HR = 1,08; IC95%, 1,03-1,13; p < 0,01) y la resistencia vascular pulmonar (HR = 1,00; IC95%, 1,00-1,01; p = 0,03) se asociaron de manera independiente con los eventos del objetivo de valoración combinado. Se obtuvo información adicional mediante las biopsias endomiocárdicas de 9 pacientes. Tiene interés señalar que la matriz de VEC cuantificada de manera semiautomática mostró una correlación extraordinariamente buena con los tiempos T1 obtenidos tras la administración de contraste a los pacientes con IC–FEc (r = 0,98; p < 0,01). En cambio, no se pudo identificar relación alguna entre los tiempos T1 y el contenido de colágeno. Estos resultados resaltan nuevamente que la estimación de T1 del VEC puede sobrestimar la fibrosis difusa, ya que también se modula por otros factores aparte de la fibrosis. La comparación de los pacientes con IC–FEc y los pacientes no clasificados como afectados de IC–FEc mostró unos tiempos T1 tras el contraste más cortos (p < 0,01) y una fracción de eyección del VI ligeramente inferior (aunque normal). Es de destacar que los tiempos T1 también tenían correlación con la resistencia vascular pulmonar y con la FEVD, lo cual indica que hay relación entre el depósito en la matriz extracelular y el desarrollo de un remodelado hemodinámico pulmonar adverso en la IC–FEc.
En el trabajo más reciente del mismo grupo, se estudió minuciosamente a 117 pacientes diagnosticados según los criterios de consenso actuales de la Sociedad Europea de Cardiología6, con cateterismo cardiaco derecho, ecocardiografía, prueba de la marcha de 6 min y biopsia miocárdica del VI en 18 pacientes63. Se realizó un mapeo de T1 con contraste y determinación del VEC mediante una secuencia MOLLI 5(3)3 antes de la administración del contraste y 4(1)3(1)2 después. Se observó que los pacientes con IC–FEc (n = 117) tenían valores de VEC superiores (29 ± 4%) a los del grupo de referencia local (n = 35; 25 ± 3%; p < 0,01) formado por individuos de control sanos. En la cohorte de IC–FEc, el VEC mostró una correlación bastante buena con la matriz extracelular demostrada histológicamente (r = 0,49; p = 0,04) y una correlación baja pero significativa con parámetros clínicamente importantes asociados con la IC–FEc, como el cociente E/A (r = 0,25), la presión auricular derecha (r = 0,21), el volumen de eyección (r = −0,20), la fracción aminoterminal del propéptido natriurético cerebral (r = 0,37) y la prueba de la marcha de 6 min (r = −0,28). Durante una mediana de seguimiento de 24 meses, se produjeron 34 eventos cardiacos del parámetro de valoración combinado (30 hospitalizaciones por IC y 4 muertes cardiacas). Los pacientes con un VEC superior a la mediana tenían mayor probabilidad de sufrir un evento cardiaco, y el VEC se asoció de manera independiente con los resultados clínicos en un análisis multivariable de regresión de Cox de los parámetros de imagen (HR = 1,01; IC95%, 1,01-1,20; p = 0,049). Mientras que el VEC estaba notablemente elevado en los pacientes que habían sufrido un evento cardiaco (el 31,0 ± 4,6% frente al 28,5 ± 3,4%; p > 0,01), los tiempos T1 nativos no diferían (p = 0,13), en comparación con los pacientes que no sufrieron ningún evento del objetivo de valoración combinado. Según lo indicado por el análisis de Kaplan-Meier, la potencia pronóstica del VEC parecía ser máxima en los primeros 6 meses de seguimiento. Al incluir los parámetros clínicos y hemodinámicos de interés en un modelo multivariable, el volumen telediastólico del ventrículo derecho (p < 0,001) y la resistencia vascular pulmonar (p = 0,002), pero no el VEC (p = 0,978), mostraron valor predictivo de los resultados.
Ellims et al.45 establecieron la existencia de una relación entre las alteraciones hemodinámicas asociadas a la disminución de la distensibilidad del VI y la fibrosis miocárdica difusa. Esos autores examinaron a 20 pacientes portadores de trasplante cardiaco remitidos por indicación clínica a un cateterismo cardiaco para medición invasiva de la curva de relación de presión-volumen, un mapeo de T1 mediante RMC con secuencias VAST y una ecocardiografía. Tanto el tiempo T1 después de la administración del contraste (r = −0,71; p < 0,01) como el VEC (r = 0,58; p = 0,04) mostraron una correlación significativa con la constante de rigidez miocárdica independiente de la carga (β). Tras introducir una corrección por otros parámetros, la correlación del tiempo T1 después del contraste y la constante beta persistía en el análisis multivariable. La relación causal entre la cantidad de fibrosis y la rigidez que ello implica se refuerza por la correlación demostrada mediante biopsias de los tiempos T1 después de la administración del contraste con la presencia real de fibrosis en los trasplantados cardiacos64.
Es de destacar que ningún otro parámetro clínico, hemodinámico o ecocardiográfico mostró asociación con la rigidez pasiva derivada de la curva de la relación presión-volumen. De manera análoga, la constante de tiempo de relajación isovolumétrica (τ) no mostró correlación alguna con los parámetros medidos en la RMC ni con otros parámetros relacionados con las características del paciente, la hemodinámica o las exploraciones por imagen. Aunque parece sencillo el concepto de cambios en la estructura cardiaca causantes alteraciones funcionales que se ha propuesto, la posibilidad de extrapolarlo a una población con IC–FEc parece como mínimo problemática, puesto que los pacientes examinados eran predominantemente trasplantados cardiacos varones, relativamente jóvenes, con apenas síntomas de IC o signos de disfunción diastólica y unas presiones de llenado solo ligeramente elevadas.
Más recientemente, nuestro grupo ha descrito la relación existente entre la hemodinámica y los parámetros determinados por RMC en pacientes con IC–FEc identificados de manera rigurosa mediante los criterios de consenso europeos13. Se comparó a 24 pacientes con IC–FEc contra 12 controles que acudieron para la evaluación de un dolor torácico atípico y tenían un perfil de alto riesgo cardiovascular, pero sin síntomas de IC. Se obtuvieron curvas basales de relación presión-volumen, durante un ejercicio de prensa manual y con una reducción transitoria de la precarga mediante oclusión con balón de la vena cava inferior. Asimismo se determinaron, en la situación basal y en respuesta al ejercicio de prensión manual, la rigidez diastólica miocárdica independiente de la carga y la elastancia telesistólica, que son medidas de la relajación activa (τ), la elastancia arterial y las relaciones de presión-volumen telediastólicos (RPVTD). Se realizó un mapeo de T1 con determinación del VEC, utilizando la técnica MOLLI con evaluación del T1 nativo (antes de la administración de contraste), y el T1 tras la administración del contraste se obtuvo 15 min después de la inyección de gadolinio, lo cual permitió el cálculo del VEC.
En general, el VEC mostró gran correlación con la rigidez miocárdica (r = 0,75; p < 0,01) y los pacientes con IC–FEc presentaron unos valores de VEC elevados (el 33 ± 3% frente al 29 ± 3%; p < 0,01), mientras que el tiempo T1 nativo (p = 0,20) y el tiempo T1 tras la administración del contraste (p = 0,08) no presentaron diferencias entre los grupos. Con un ajuste respecto a otros parámetros de imagen (E/E’ y volumen de la AI), el VEC continuó siendo el único predictor independiente del valor de beta en un modelo multivariable, lo cual indica la utilidad diagnóstica del VEC en la IC–FEc, independientemente de la evaluación ecocardiográfica. Los tiempos T1 nativos, pero no el VEC, mostraron correlación con el valor de tau durante el ejercicio, lo cual indica que la fibrosis probablemente esté más relacionada con una reducción de la distensibilidad del miocardio que con un deterioro de la relajación miocárdica.
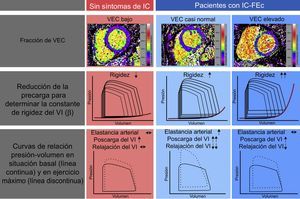
Los pacientes con IC–FEc tenían una hemodinámica más desfavorable, con presiones de llenado superiores, una relajación diastólica prolongada y un mayor cambio de la RPVTD basal a la de ejercicio. Además, el VEC permitió la identificación de 2 grupos de pacientes, que presentaban mecanismos subyacentes a la disfunción diastólica y la intolerancia al ejercicio distintos (figura 4). Al dividir la cohorte de IC–FEc en función de la mediana de VEC, no se observaron diferencias entre los grupos en las características basales, la prueba de esfuerzo o los parámetros ecocardiográficos de la función diastólica. Sin embargo, los pacientes con un VEC mayor que la mediana presentaron unos valores de rigidez del miocardio significativamente superiores, mientras que, en los pacientes con un VEC menor que la mediana, una mayor carga vascular con deterioro de la relajación activa produjo similares cambios desfavorables de la RPVTD con el ejercicio.
Cuadro general de los resultados del ensayo Left Ventricular Stiffness vs Fibrosis Quantification by T1 mapping in Heart Failure With Preserved Ejection Fraction (STIFFMAP)12. Aunque los pacientes con IC–FEc presentaron un VEC total superior, se observó una constante de rigidez ventricular izquierda aumentada, una relajación prolongada y un aumento patológico de las relaciones de presión-volumen telediastólicos durante el ejercicio. Después de una estratificación según la mediana del VEC, en el grupo de IC–FEc con valores de VEC próximos a los normales, se observó que la causa era predominantemente una rigidez arterial aumentada, una intensa reacción hipertensiva al ejercicio y una relajación activa prolongada. En el grupo de IC–FEc con el valor de VEC más alto, una rigidez ventricular pronunciada determinaba la respuesta hemodinámica patológica al ejercicio. IC: insuficiencia cardiaca; IC–FEc: insuficiencia cardiaca con fracción de eyección conservada; VEC: volumen extracelular; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Así pues, se ha propuesto que el VEC no solo predece el aumento de la rigidez miocárdica, sino que también permite identificar a los pacientes con mayor probabilidad de tener otro mecanismo para la disfunción diastólica. En este contexto específico, estos pacientes mostraron un aumento de la carga vascular muy probablemente como consecuencia de la rigidez arterial y las ondas de reflejo sistólico tardías65.
CONCLUSIONESLa técnica emergente del mapeo de T1 mediante RMC ha introducido la opción de una caracterización no invasiva del tejido miocárdico en un grado que anteriormente solo podía alcanzarse con biopsias miocárdicas. Tiene especial interés la posibilidad de cuantificar los cambios extracelulares del miocardio. El aumento de la fibrosis miocárdica difusa, que generalmente no es detectable con otras técnicas de imagen, es la piedra angular de la fisiopatología de la IC–FEc y, en consecuencia, la caracterización de los pacientes mediante mapeo de T1 parece especialmente atractiva en este grupo de pacientes. Los datos existentes respaldan este concepto, ya que se ha establecido una relación de los tiempos T1 medidos y la función diastólica evaluada ecocardiográficamente con trastornos cardiovasculares de conocida asociación con la fibrosis miocárdica. En especial en la IC–FEc, los parámetros medidos tras la administración de contraste, que se sabe que son más específicos del espacio extracelular, parecen ser los de más valor diagnóstico. En consecuencia, se ha observado que los pacientes con IC–FEc tienen un VEC mayor que el de los pacientes sin IC, pero menor que el de aquellos con IC–FEr. Se ha señalado también que los tiempos T1 determinados después de la administración del contraste están aumentados en la IC–FEc y tienen relación con un remodelado hemodinámico pulmonar adverso. Se observó que los tiempos T1 obtenidos tras el contraste y el VEC se asociaban de manera independiente con los resultados clínicos en este grupo de pacientes. En cuanto a la hemodinámica, se observó que el VEC se correlaciona con un llenado diastólico del VI más lento. Además, tanto el VEC como los tiempos determinados tras el contraste se correlacionan con la rigidez del miocardio evaluada por las relaciones de presión-volumen, que aportan una información complementaria a la de la ecocardiografía. Por último, en 1 estudio se pudo estratificar a los pacientes con IC–FEc por su VEC para diferenciar de manera no invasiva la rigidez miocárdica por un lado y la carga arterial elevada con deterioro de la relajación activa por otro, como determinante principal de su disfunción diastólica.
La estratificación de los pacientes según su VEC podría ser un enfoque apropiado para revelar, en parte, la heterogeneidad de la cohorte de pacientes con IC–FEc, un concepto que cada vez resulta más atractivo si se tiene en cuenta que se podría disponer de opciones de tratamiento viables para los subgrupos identificados (p. ej., una modulación neurohormonal antifibrótica con espironolactona o sacubitrilo).
Hasta la fecha, los datos del mapeo de T1 en la IC–FEc siguen siendo escasos y los ensayos existentes tienen limitaciones importantes, como el pequeño tamaño muestral, los diseños unicéntricos y la falta de pruebas de estrés diastólico en la inclusión de la mayoría de los estudios. Aunque existe una relación fisiológicamente plausible entre las medidas del T1 y la fibrosis intersticial en la IC–FEc, el papel de los factores miocárdicos que introducen confusión en esta relación sigue sin estar suficientemente claro. Las comparaciones entre los estudios se ven dificultadas por las diferencias existentes en los protocolos y las técnicas de imagen. En conclusión, el T1 determinado mediante RMC puede ser una herramienta eficaz para la caracterización del paciente en los ensayos a gran escala epidemiológicos, diagnósticos y terapéuticos en la IC–FEc, más allá de los parámetros de imagen tradicionales. Serán necesarios nuevos esfuerzos para estandarizar las técnicas de imagen con objeto de sentar las bases para una aplicación universal de este método.
CONFLICTO DE INTERESESNinguno.