La rápida evolución tecnológica producida en los últimos años ha permitido la aparición de nuevos procedimientos en electrofisiología que no habrían sido posibles sin el desarrollo en paralelo de las técnicas de imagen que sirven para planificar, guiar y monitorizar el resultado posterior de dichos procedimientos. Entre las intervenciones con mayor necesidad de apoyo con técnicas de imagen, se encuentra la ablación de la fibrilación auricular. La ecocardiografía permite seleccionar a los candidatos y detectar trombos que contraindicarían la intervención, y la resonancia cardiaca y la tomografía computarizada son también básicos para su planificación a través del estudio detallado de la anatomía de las venas pulmonares. Por otra parte, en la terapia de resincronización cardiaca la ecocardiografía tiene un papel central tanto para la selección de pacientes como posteriormente para el ajuste del dispositivo y evaluar la efectividad de la técnica. Más recientemente, la ablación de taquicardias ventriculares se ha consolidado como una alternativa de tratamiento que no habría sido posible sin planificarla mediante estudio con resonancia magnética cardiaca de las cicatrices en el miocardio.
Palabras clave
En los últimos años, la electrofisiología ha experimentado una rápida expansión con aumento de la complejidad y el número de técnicas realizadas. Esto no habría sido posible sin el desarrollo en paralelo de las técnicas de imagen cardiovascular no invasivas que permiten el estudio preciso de la anatomía cardiaca y el complejo funcionamiento cardiaco. Las técnicas de imagen cardiaca permiten mejorar la selección de pacientes, planificar los procedimientos de manera individualizada, guiar su realización detectando precozmente posibles complicaciones y, por último, comprobar los resultados de la terapia en el seguimiento a largo plazo. Esta revisión se centra en la utilidad de las técnicas de imagen en algunos de los procedimientos más complejos, como la ablación de la fibrilación auricular (FA), la terapia de resincronización cardiaca (TRC) y la ablación de taquicardias ventriculares.
IMAGEN CARDIOVASCULAR DE PACIENTES CON FIBRILACIÓN AURICULAR TRATADOS CON ABLACIÓNLa FA es la arritmia más frecuente en la población general, y su prevalencia aumenta con la edad1. En la patogenia de la FA suele estar implicado un foco ectópico en las venas pulmonares. Asimismo existe un sustrato anatómico que favorece la génesis y la perpetuación de la arritmia, que es detectable por técnicas de imagen y básicamente se reconoce por la dilatación2 y la disfunción auriculares3. La ecocardiografía transtorácica es la primera técnica de imagen utilizada para la identificación de dicho sustrato y, por lo tanto, la selección de los pacientes candidatos al tratamiento de ablación. Permite evaluar la existencia de enfermedad cardiaca estructural asociada (enfermedad valvular, hipertrofia ventricular izquierda, disfunción ventricular, etc.) y tiene implicaciones terapéuticas, pues indica el riesgo de recurrencia (según la función y el tamaño auriculares4) y determina la posibilidad de un enfoque terapéutico combinado en caso de enfermedad estructural asociada (p. ej., ablación quirúrgica y reparación mitral).
Para la estimación del tamaño de la aurícula izquierda (AI), la ecocardiografía bidimensional (2D) es la técnica de imagen que se utiliza de manera más extensa en la práctica clínica por su mayor disponibilidad; sin embargo, subestima el volumen de la AI en comparación con las técnicas tridimensionales (3D): ecocardiografía 3D y resonancia magnética cardiaca (RMC)5. Se ha demostrado que el tamaño de la AI (diámetro y volumen) es un factor predictor de aparición de FA idiopática2 y recurrencia tras la cardioversión6. En cuanto al éxito de la ablación de FA, aunque la hipertensión arterial y un diámetro anteroposterior de la AI > 45 mm se han demostrado predictores independientes del éxito7, se ha demostrado que el volumen auricular medido por técnicas 3D (ecocardiografía4 y tomografía computarizada [TC]8) predece la recurrencia de FA tras la ablación mejor que las medidas de AI determinadas por ecocardiografía convencional 2D. Otro parámetro de reciente introducción es el índice de esfericidad determinado mediante RMC9: el remodelado esférico de la AI aumenta el riesgo de recurrencia de FA y discrimina mejor que el tamaño auricular.
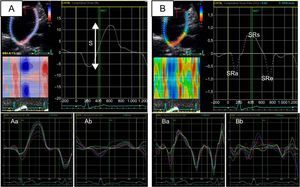
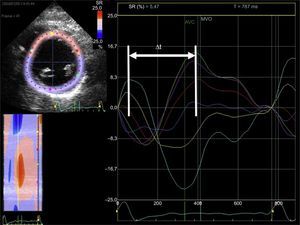
La función de la AI puede dividirse en tres fases (reservorio, conducto y bomba) que se pueden estudiar mediante ecocardiografía tanto con medidas volumétricas (2D y 3D) como con imagen de deformación miocárdica (strain y strain-rate)10 (figura 1). La reducción tanto de la función reservorio4,11 como de la función contráctil o de bomba12 de la AI se han relacionado con la aparición de FA y con el éxito de la ablación. La capacidad de predecir en qué pacientes la ablación va a poder eliminar la arritmia mediante el estudio de la función de la AI se ha demostrado tanto en pacientes con FA tratados con una primera ablación como en los tratados con un segundo procedimiento13.
Estudio de la función auricular izquierda mediante deformación miocárdica derivada de ecocardiografía bidimensional (speckle-tracking strain). A: strain auricular izquierdo (a: paciente con strain auricular izquierdo normal; b: paciente con strain auricular izquierdo reducido). B: strain-rate auricular izquierdo (a: paciente con strain-rate auricular izquierdo normal; b: paciente con strain-rate auricular izquierdo reducido). S: strain global de la aurícula izquierda; SRa: strain-rate durante la contracción auricular (función contráctil); SRe: strain-rate durante la fase de llenado precoz ventricular (función de conducción); SRs: strain-rate durante la sístole ventricular (función reservorio).
Por otro lado, la RMC con realce tardío está despertando un interés creciente para la detección de fibrosis auricular, considerada indicadora del sustrato arritmogénico en la FA. Un estudio prospectivo multicéntrico (estudio DECAAF)14 mostró asociación entre el grado de fibrosis y la recurrencia de la FA después de la ablación de FA. Se clasificó a los pacientes según el grado de fibrosis (estadios Utah), y se observó que las recurrencias estaban significativamente asociadas al grado de fibrosis inicial (estadio I, el 15,3%; estadio II, el 32,6%; estadio III, el 45,9%, y estadio IV, el 51,1%). La detección de la fibrosis mediante RMC podría ser de gran utilidad para estratificar el riesgo de presentar FA o recurrencia de FA tras la ablación15, pero no se puede olvidar que aún hay algunas limitaciones técnicas para su estandarización. La RMC tiene una resolución espacial limitada y la pared auricular es muy fina; además, se necesita una buena segmentación de la pared auricular, y actualmente hay distintos algoritmos para definir los umbrales de intensidad de señal que definen la fibrosis16.
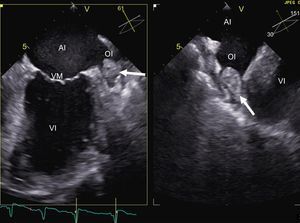
Las técnicas de imagen también permiten detectar posibles fuentes de complicación que contraindiquen la técnica. La detección de trombo en la orejuela izquierda mediante ecocardiografía transesofágica es una de las contraindicaciones más conocidas para el procedimiento (figura 2); existen factores de riesgo de trombosis, como el sexo femenino, la presencia de cardiopatía estructural, la dilatación de la AI o la FA no paroxística; su presencia incrementa de forma sumatoria el riesgo de trombo en la orejuela izquierda17. De la misma manera, la puntuación CHADS2 (insuficiencia cardiaca congestiva, hipertensión, edad, diabetes, ictus [doble]) es directamente proporcional a la probabilidad de su aparición18. Está en discusión la necesidad de realizar una ecocardiografía transesofágica a los pacientes sin factores de riesgo; sin embargo, hasta en un 24% de los pacientes con puntuación CHADS2 0 se detectó ecocontraste espontáneo en la orejuela, lo que indica estasis sanguínea y se considera equivalente de trombo intraauricular18. Por lo tanto, su realización previamente a la ablación permite aumentar la seguridad del procedimiento. La orejuela izquierda también se puede visualizar de manera no invasiva mediante la TC con contraste centrada en la AI; distintos estudios avalan su buena precisión diagnóstica para la detección de trombos19. Así, en pacientes con contraindicación o intolerancia a la ecografía transesofágica, la TC puede ser una buena alternativa.
Una vez indicada la ablación, las técnicas de imagen permiten su planificación. En el caso de la ablación de FA, presenta especial interés el conocimiento de la anatomía de las venas pulmonares20. Aunque su anatomía también se puede estudiar mediante ecocardiografía transesofágica, la mayor resolución y la visualización 3D con TC y RMC hacen que estas se realicen en la mayoría de los centros sistemáticamente antes del procedimiento, especialmente para obtener imágenes de fusión con los sistemas de navegación electroanatómicos que permiten realizar de manera más rápida y sencilla las aplicaciones de radiofrecuencia. Además, permiten conocer la presencia de variantes anatómicas como una vena pulmonar intermedia derecha o un tronco común izquierdo que podrían asociarse con más recurrencias de la FA21,22.
En algunos centros se utiliza la ecocardiografía intracardiaca como guía del procedimiento23; esta es útil como guía de punción transeptal, posición de los catéteres y anatomía. Sin embargo, su uso aumenta la complejidad y el coste del procedimiento.
Por otra parte, la ablación de la FA no está exenta de riesgos. La ecocardiografía permite el rápido diagnóstico del taponamiento cardiaco que puede ocurrir hasta en el 5% de las intervenciones24.
Seguimiento (impacto de la terapia)La función auricular presenta cambios a largo plazo tras la ablación de FA, y se objetiva reducción de los volúmenes auriculares estudiados tanto por ecocardiografía 3D25 como por RMC26 o TC27. En un metanálisis28 se describió que, tras la ablación, las dimensiones de la AI solo se redujeron de manera significativa en los pacientes sin recurrencia de la arritmia; en cambio, la función auricular medida como fracción de eyección o fracción de vaciado activo de la AI no mostraron diferencias en los pacientes sin recurrencia, pero sí se redujo en los pacientes con recurrencia de la FA. Diferentes estudios resumidos en dicho metanálisis muestran que la cicatriz y la retracción volumétrica de la AI inducida por la lesión producida durante la ablación se contrarrestan por el efecto beneficioso de la recuperación del ritmo sinusal. Así, aunque se produzca reducción de volumen de la AI en pacientes con y sin ablación efectiva en cuanto a restauración del ritmo sinusal, solo en aquellos que se mantiene el ritmo sinusal no empeora o incluso mejora la función de la AI28.
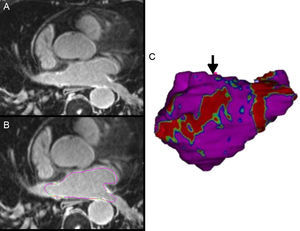
En pacientes con recurrencia de su FA, las discontinuidades en las líneas de ablación son uno de los mecanismos principales de la reconexión de las venas pulmonares. La RMC con realce tardío puede localizar estas discontinuidades y guiar el segundo procedimiento de ablación29 (figura 3).
A: resonancia magnética cardiaca con realce tardío en tres dimensiones de la aurícula izquierda de un paciente con ablación previa. B: se trazan los márgenes epicárdicos y endocárdicos para la segmentación de la aurícula izquierda; en este caso, a partir de la intensidad de señal del realce normalizada por la intensidad de señal de la sangre, se obtiene una razón de intensidad de señal y el tejido fibroso se detecta y se cuantifica. C: imagen tridimensional volume rendering a partir de la segmentación de la aurícula izquierda donde el tejido fibroso se proyecta a la superficie del modelo; en rojo, zona con cicatriz y zona de discontinuidad, gap anatómico (flecha) que servirá de guía para el catéter de ablación. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
A largo plazo, una de las complicaciones más importantes de la ablación de la FA es la estenosis de venas pulmonares, que puede darse hasta en un tercio de los casos30, sobre todo la vena pulmonar izquierda (incidencia de estenosis grave de hasta el 1%30,31). La TC sería la técnica de elección para confirmar el diagnóstico, pero la RMC proporciona la misma información sin radiación ni contraste yodado. Los pacientes de más edad, con venas de mayor tamaño y las venas inferiores izquierdas tienen mayor probabilidad de dicha estenosis30.
La tabla 1 resume las principales aportaciones de la imagen cardiaca a la ablación de la FA.
Utilidad de las técnicas de imagen en la ablación de la fibrilación auricular
| Selección de candidatos | |
| Evaluación clínica | Cardiopatía de base (ecocardiografía, TC, RMC) |
| Predicción de éxito | Tamaño de la aurícula izquierda – Ecocardiografía 2D7 – Ecocardiografía 3D4 – TC8 – RMC5 |
| Función auricular izquierda – Ecocardiografía 3D4 – Speckle-tracking strain13 | |
| Fibrosis auricular izquierda – RMC14 | |
| Geometría auricular izquierda – Esfericidad por RMC9 | |
| Contraindicación | Trombo en orejuela izquierda – Ecografía transesofágica18 – TC19 |
| Guía para la ablación | |
| Anatomía | TC22, RMC21, ecografía intracardiaca23 |
| Complicaciones | Durante el procedimiento – Ecografía 2D |
| Seguimiento | |
| Impacto de la terapia | Reducción del volumen auricular izquierdo – Ecocardiografía25 – TC27 – RMC26 |
| Mejora de la función auricular izquierda – RMC26 | |
| Complicaciones | Largo plazo (estenosis pulmonar) – RMC31 |
2D: bidimensional; 3D: tridimensional; RMC: resonancia magnética cardiaca; TC: tomografía computarizada.
La descoordinación de la mecánica cardiaca secundaria a la presencia de asincronía eléctrica tiene efecto deletéreo en la función cardiaca debido a la reducción de los tiempos de llenado y eyección, con ineficiencia en la contracción ventricular y auricular, desarrollo de insuficiencia mitral y aumento de las presiones de llenado del ventrículo izquierdo (VI)32. La TRC pretende la corrección de estos mecanismos (corrección de la disincronía mecánica) mediante la estimulación eléctrica que detiene el remodelado adverso causado por ellos e incluso consigue revertirlo; como consecuencia de ello, se ha demostrado una mejora significativa en la calidad de vida, el número de hospitalizaciones y la mortalidad de los pacientes con insuficiencia cardiaca y disfunción ventricular izquierda tratados con TRC33. La respuesta a la TRC está determinada por múltiples factores, que pueden resumirse en la existencia de un mecanismo de descoordinación mecánica corregible eléctricamente a la vez que un miocardio capaz de responder (con reserva contráctil)34.
Selección de candidatosLa asincronía mecánica corregible eléctricamente incluye varias situaciones clínicas que se puede identificar con ecocardiografía. De las asincronías interauricular35, auriculoventricular36, interventricular e intraventricular32, las últimas tres pueden mejorar mediante la TRC con el implante de marcapasos tricamerales, y existe ya alguna experiencia inicial de estimulación biauricular para corregir la asincronía interauricular37.
Según la última guía europea38, la TRC está indicada para pacientes que, pese a terapia médica óptima, persisten al menos en clase funcional II de la New York Heart Association y electrocardiograma con bloqueo de rama izquierda y duración del QRS > 120 ms y fracción de eyección del ventrículo izquierdo ≤ 35%39. Por lo tanto, como premisa básica para el implante, es necesaria una técnica de imagen para determinar la fracción de eyección del ventrículo izquierdo, que suele ser la ecocardiografía 2D. Pese a que la indicación de la TRC se base en estos criterios, hasta un 30-45% de los pacientes no responden a esta terapia40. Por ello, se ha intentado seleccionar a los pacientes con un perfil más favorable para la TRC aplicando técnicas de imagen, especialmente la ecocardiografía.
La asincronía auriculoventricular se puede estudiar mediante la duración del Doppler pulsado transmitral (tiempo de llenado del VI) respecto a la duración total del ciclo cardiaco, de forma que si es < 40%, se considera que hay asincronía auriculoventricular. Para la asincronía interventricular, el Doppler pulsado aplicado en el tracto de salida de los ventrículos permite medir el periodo preeyectivo (tiempo desde el inicio del QRS al inicio del flujo en cada ventrículo). Una diferencia entre los tiempos del ventrículo derecho y el VI > 40 ms o un periodo preeyectivo del VI > 140 ms se consideran indicadores de asincronía interventricular41.
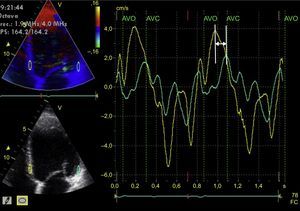
La asincronía intraventricular izquierda es la más ampliamente estudiada, y se han propuesto multitud de parámetros para evaluarla. La ecocardiografía en modo M del VI (plano paraesternal en eje largo)42 es la manera más simple de analizarla (método de Pitzalis). Una diferencia entre la contracción máxima septal y posterior ≥ 130 ms predice disminución del diámetro telesistólico tras la TRC43. Sin embargo, destaca su limitación en presencia de anomalías en la motilidad segmentaria (p. ej., cardiopatía isquémica) y la gran variabilidad en su interpretación44. El Doppler tisular permite determinar el pico de velocidad miocárdica de segmentos contralaterales durante la fase de eyección (entre la apertura y el cierre de la válvula aórtica)45. Para ello se requiere un correcto alineamiento con el haz de ultrasonido (técnica dependiente del ángulo) y gran resolución temporal. Una diferencia ≥ 65 ms entre los picos de velocidad miocárdica de los segmentos basales de la pared septal y lateral del VI en el plano apical de cuatro cámaras (figura 4) se ha relacionado con respuesta a la TRC46, según la experiencia de algunos autores, aunque es un método muy controvertido. De modo similar, el índice de Yu47 analiza los 12 segmentos miocárdicos estudiados a partir de los planos apicales de dos, tres y cuatro cámaras. Por último, la diferencia temporal entre los picos máximos de deformación miocárdica determinada a partir de ecocardiografía 2D (speckle-tracking strain) también se ha mostrado útil para predecir la respuesta a la TRC. El strain radial parece ser superior al longitudinal o circunferencial para la predicción de la respuesta48; una diferencia ≥ 130 ms entre el pico de deformación del segmento septal del VI respecto al posterior predice remodelado inverso del VI tras la TRC49 (figura 5). La combinación del Doppler tisular pulsado con el strain radial determinado por speckle-tracking podría aumentar la capacidad predictiva50. El speckle-tracking strain también podría ser útil para determinar el segmento con activación miocárdica más tardía, que sería el lugar donde el implante del electrodo del VI tendría su máxima eficiencia51. Por último, la ecocardiografía 3D también permite determinar el índice de disincronía sistólica (desviación estándar de los intervalos requeridos por los diversos segmentos del VI para alcanzar el mínimo volumen al final de la sístole). Se expresa como porcentaje, y se ha propuesto un punto de corte del 9,8% para la predicción de respuesta a la TRC52. Como limitación, este método no diferencia las alteraciones segmentarias de la contractilidad o zonas necróticas de las zonas mecánicamente retrasadas por un transtorno eléctrico, que sí son susceptibles de TRC53. El Doppler tisular pulsado también es aplicable a la ecocardiografía 3D y permite comparar simultáneamente el retraso de velocidades de los diferentes segmentos del VI54. El speckle-tracking strain a partir de ecocardiografía 3D permitiría diferenciar entre miocardio viable y cicatriz55, pero es aún una técnica con baja resolución temporal que, por lo tanto, no permite una adecuada aplicación para estudiar fenómenos tan rápidos como los que ocurren en un ciclo cardiaco.
Estudio de la sincronía intraventricular izquierda con Doppler tisular. A partir de la imagen apical de cuatro cámaras del ventrículo izquierdo (paneles izquierdos) adquirida con Doppler tisular codificado en color, se posprocesa la imagen y se obtienen curvas de velocidad miocárdica a lo largo de dos ciclos cardiacos consecutivos del segmento lateral basal (línea verde) y del segmento septal basal (línea amarilla) (panel central). Puede verse que las dos curvas no están superpuestas y que hay una diferencia temporal entre los dos picos de velocidad máxima de cada segmento miocárdico (flecha). AVC: cierre de la válvula aórtica; AVO: apertura de la válvula aórtica; FC: frecuencia cardiaca. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Estudio de la sincronía intraventricular izquierda con imagen ecocardiográfica de deformación miocárdica (strain). A partir de la imagen en eje corto del ventrículo izquierdo a nivel de los músculos papilares obtenida con ecocardiografía bidimensional (panel izquierdo), se traza el endocardio y, con un software dedicado, se obtienen curvas de deformación miocárdica en dirección radial (valores positivos) para cada segmento del ventrículo izquierdo (seis segmentos) a lo largo del ciclo cardiaco (panel central). Se calcula la diferencia temporal entre la deformación máxima de los segmentos septales (trazos turquesa y amarillo) y del segmento inferolateral (trazo verde). Puede verse que las curvas no están superpuestas y que hay una diferencia temporal entre los picos de deformación miocárdica máxima de cada segmento miocárdico (flecha). Δt: diferencia temporal; AVC:; MVO: apertura de la válvula mitral; SR: strain radial. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
La tabla 2 resume las principales medidas ecocardiográficas propuestas para la selección de candidatos a TRC.
Detección de asincronía cardiaca corregible con terapia de resincronización cardiaca mediante ecocardiografía
| Asincronía auriculoventricular | |
| Doppler pulsado | Duración del Doppler pulsado transmitral respecto al total del ciclo cardiaco < 40% |
| Asincronía interventricular | |
| Doppler pulsado | Medición del periodo preeyectivo a nivel de los tractos de salida del VI y el VD. Hay asincronía si es > 40 ms entre ellos o si el periodo preeyectivo del VI es > 140 ms41 |
| Asincronía intraventricular | |
| Modo M | Método de Pitzalis. Diferencia entre la contracción máxima septal y posterior ≥ 130 ms42 |
| Doppler tisular | En plano apical de cuatro cámaras, diferencia entre pico de velocidad miocárdica de segmento basal de pared septal y lateral del VI ≥ 65 ms46 |
| Índice de Yu. Análisis de los 12 segmentos miocárdicos (cuatro, tres y dos cámaras), desviación estándar ≥ 33 ms47 | |
| Deformación miocárdica (speckle-tracking strain) | Strain radial. Diferencia ≥ 130 ms entre pico de deformación del segmento septal y posterior49 |
| Ecocardiografía 3D | Desviación estándar de los segmentos > 9,8%52 |
| Otras | Doppler tisular pulsado en ecocardiografía 3D54 |
| Deformación miocárdica aplicada a ecocardiografía 3D55 | |
3D: tridimensional; VD: ventrículo derecho; VI: ventrículo izquierdo.
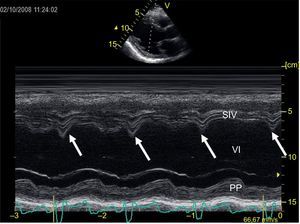
El estudio multicéntrico PROSPECT56 intentó validar dichas técnicas de imagen para la predicción de respuesta a la TRC, pero los resultados fueron claramente negativos. Los parámetros previamente presentados, de manera individual y en centros únicos, habían demostrado valor pronóstico en cuanto a predicción de respuesta a TRC, pero no confirmaron su valor cuando se trasladaron al ámbito multicéntrico. Esto generó gran controversia sobre el papel del estudio ecocardiográfico de la asincronía mecánica previo al implante de TRC. Los resultados del estudio PROSPECT se justificaron en parte por la baja reproducibilidad de las medidas y la gran dificultad para definir de manera precisa la respuesta positiva a la TRC; en realidad, todos los estudios que intentan demostrar la utilidad pronóstica de un determinado parámetro para predecir la respuesta a la TRC utilizan una variable dicotómica para definir respuesta o falta de respuesta; sin embargo, la realidad clínica es diferente, puesto que la respuesta a la TRC es variable e incluye una gama de respuestas que van desde la mejoría clínica sin remodelado inverso hasta el remodelado inverso extenso (superrespondedores)57. Por ello, la indicación de la TRC no debería basarse en único parámetro, ya que la función cardiaca es compleja y hay múltiples parámetros implicados en la respuesta a la TRC34. Por otro lado, las metodologías anteriormente descritas tienen muchas limitaciones técnicas y no siempre expresan un problema de disincronía mecánica corregible eléctricamente (es decir, no diferencian necrosis de retraso mecánico por activación eléctrica enlentecida). En pacientes con función ventricular normal, hay buena correlación entre los tiempos mecánicos y eléctricos, pero se pierde en pacientes con disfunción ventricular. La TRC mejora dicha correlación, pero en los pacientes con cicatriz miocárdica no siempre es posible corregir las alteraciones mecánicas58. Así, algunos autores han propuesto un enfoque multimodal59 que incluya parámetros clínicos y ecocardiográficos. En este sentido, objetivar por ecocardiografía convencional una anormalidad corregible por TRC se ha relacionado con respuesta a la TRC y mejora de la supervivencia; por orden de valor predictivo: el movimiento anómalo septal durante la contracción isovolumétrica (septal flash), las alteraciones en el llenado ventricular como la presencia de onda A truncada (intervalo auriculoventricular corto), fusión de ondas E y A (intervalo auriculoventricular largo) y, por último, la interdependencia ventricular exagerada60. Estos parámetros son fácilmente identificables con ecocardiografía convencional. Así, el septal flash se identifica en el ecocardiograma 2D o en un simple modo M (figura 6) como un movimiento rápido del septo hacia la cavidad ventricular durante la fase de contracción isovolumétrica (dentro del QRS del electrocardiograma) y un rápido retroceso por la contracción activa y retrasada de la pared lateral. Las alteraciones del llenado (fusión de ondas E y A o interrupción precoz de la onda A) son también fácilmente reconocibles con el Doppler pulsado del flujo de entrada del VI. Finalmente, la interacción ventricular exagerada se reconoce tanto en el examen 2D como por la diferencia de periodos preeyectivos entre el ventrículo derecho y el VI. Siguiendo un algoritmo de determinación de estos parámetros, puede establecerse la probabilidad de respuesta a la TRC con base en la existencia de una alteración mecánica que puede corregirse eléctricamente. La extensión o el grado de respuesta, además, estarán determinados por el estado de base de la cardiopatía subyacente y otros factores clínicos como la insuficiencia renal60. A pesar de que cada vez hay más evidencia de que en manos experimentadas un enfoque integral del paciente con QRS ancho y disfunción ventricular puede mejorar la tasa de respuesta a la TRC, las guías38,39 siguen indicando únicamente la anchura del QRS como el criterio para indicarla.
Imagen de registro en modo M de ecografía transtorácica a nivel ventricular izquierdo en eje paraesternal largo. Las flechas verticales señalan la presencia de septal flash, que es un rápido movimiento del septo hacia la cavidad ventricular durante la duración del QRS. PP: pared posterior del ventrículo izquierdo; SIV: septo interventricular; VI: ventrículo izquierdo.
Por otro lado, la RMC ofrece información del tamaño y la función del VI y presencia de cicatriz miocárdica en pacientes candidatos a TRC. Además, también puede informar de la disincronía del VI. Utilizando la secuencia de cine y a partir del análisis del acortamiento radial de los segmentos de la pared, se realizan mapas polares y se calcula el índice de sincronización tisular61. También permite el análisis de deformación miocárdica mediante el seguimiento de marcas específicas (tagging) en el miocardio62. Con ambas técnicas, algunos autores han demostrado que se puede predecir la respuesta a la TRC61,62. También se ha descrito el uso de la RMC con codificación de la velocidad para el estudio de la disincronía midiendo el movimiento de la pared miocárdica a lo largo del ciclo cardiaco, lo que proporciona curvas de tiempo en función de la velocidad similares a las de la imagen de Doppler tisular63, pero aún no hay datos que prueben la utilidad de esta metodología para predecir la respuesta a largo plazo tras la TRC. La aplicación de técnicas de RMC al estudio de la sincronía cardiaca está limitada tanto por el procesamiento complejo de las imágenes como por su baja resolución temporal. Sin embargo, la RMC con realce tardío aporta información relevante sobre presencia de cicatriz, su localización y transmuralidad, todos ellos predictores independientes de respuesta a la TRC. La carga total de cicatriz surge como predictor independiente de respuesta a la TRC; aunque aún no hay consenso sobre el valor de corte a partir del cual no se debería indicar esta terapia, oscila entre el 10 y el 15%64. En cuanto a la trasmuralidad (presencia de realce tardío > 51% del grosor de la pared), se demuestra que tiene una relación inversamente proporcional con la respuesta a la TRC65. Finalmente, la localización de la cicatriz en la cara posterolateral, sobre todo si es transmural, se asocia a menor respuesta a la TRC66. La presencia, el tamaño y la heterogeneicidad de la cicatriz evaluada con RMC también predicen la incidencia de arritmias ventriculares en pacientes portadores de TRC, por lo que podría ser de utilidad a la hora de decidir si asociar o no un desfibrilador a la TRC67.
Por otro lado, la TC es una alternativa no invasiva a la venografía que se suele realizar en el mismo momento del procedimiento para evaluar la anatomía de las venas cardiacas con vistas al implante del electrodo en el VI. Las imágenes de TC permiten ver si existen venas apropiadas para el implante del electrodo y planificar adecuadamente la intervención68.
Mediante técnicas de medicina nuclear, también es posible determinar la función sistólica del VI, la presencia de cicatrices y la disincronía mecánica69, así como el punto de activación más tardía para guiar el implante del electrodo del VI70. Sin embargo, es una técnica de baja resolución espacial, con radiación y procesado complejo, por lo que se utiliza escasamente en la práctica clínica.
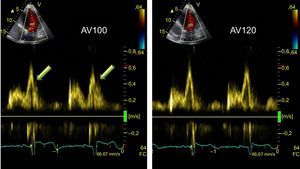
OPTIMIZACIÓN DE DISPOSITIVOSLa optimización del intervalo auriculoventricular e interventricular puede ser útil para algunos pacientes con falta de respuesta a la TRC, aunque no se recomienda su uso sistemático38. En la optimización del intervalo auriculoventricular, el método iterativo es el más utilizado. Mediante el Doppler pulsado del llenado del VI, se calcula el tiempo de llenado diastólico desde el inicio de la onda E hasta el final de la onda A; se parte de un intervalo largo que se va reduciendo hasta que aparece la onda A truncada; luego se aumenta lentamente hasta que desaparece la onda A truncada, lo cual se considera como el intervalo óptimo (figura 7). Para la optimización del intervalo interventricular, se utiliza también un método empírico que busca el intervalo VV que proporcione la mayor integral velocidad-tiempo del flujo en el tracto de salida del VI como indicador del volumen latido71. Asimismo puede optimizarse el intervalo entre ambos ventrículos buscando el que genera mayor sincronía mediante el Doppler tisular aplicado a paredes opuestas del VI; ambos métodos de optimización muestran una buena correlación y mejora en el gasto cardiaco72. La optimización de los dispositivos de TRC induce mejoría clínica de los pacientes tratados con TRC73, aunque su impacto en la supervivencia aún está por demostrarse.
Optimización del intervalo auriculoventricular. Registro de Doppler pulsado espectral del flujo de llenado del ventrículo izquierdo en función del ajuste del intervalo auriculoventricular. Izquierda: con intervalo auriculoventricular de 100 ms, se observa onda A truncada (flechas) al inicio de la sístole. Derecha: tras alargar el intervalo auriculoventricular a 120 ms, se observa desaparición de la onda A truncada. AV: auriculoventricular; FC: frecuencia cardiaca.
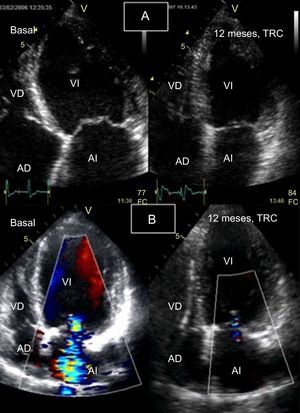
En el seguimiento de pacientes tratados con TRC, la ecocardiografía es la técnica de imagen cardiaca más empleada, ya que, debido al implante del dispositivo de TRC, el uso de RMC está limitado. La reversión del remodelado cardiaco que se observa en el seguimiento de los pacientes que responden a la TRC se relaciona de manera significativa con la mejoría clínica y la disminución de eventos clínicos en el seguimiento33. Mediante la ecocardiografía convencional (2D), se ha demostrado que la TRC reduce los volúmenes del VI y mejora la función sistólica74 y diastólica57 de ambos ventrículos75. Asimismo la TRC puede mejorar la insuficiencia mitral, dada la mejora aguda de la sincronía en la contracción de músculos papilares y la mejora a largo plazo del remodelado inverso ventricular76 (figura 8).
Monitorización de respuesta a la terapia de resincronización cardiaca mediante ecocardiografía bidimensional con Doppler color. A: ventrículo izquierdo en telesístole (desde plano apical de cuatro cámaras), basal (izquierda) y control a los 12 meses (derecha); se objetiva una reducción significativa del volumen telesistólico del ventrículo izquierdo. B: plano apical de cuatro cámaras durante la diástole con Doppler color basal (izquierda), en el que se objetiva insuficiencia mitral grave, y de control a los 12 meses (derecha), que muestra resolución de la insuficiencia mitral y reducción del volumen del ventrículo izquierdo. AD: aurícula derecha; AI: aurícula izquierda; FC: frecuencia cardiaca; TRC: terapia de resincronización cardiaca; VD: ventrículo derecho; VI: ventrículo izquierdo.
En algunos pacientes con taquicardia ventricular (TV) sostenida recurrente pese a tratamiento médico, la ablación de la TV se ha convertido en una de las opciones terapéuticas que mejora los síntomas y el pronóstico de los pacientes77. Las técnicas de imagen cardiaca también contribuyen a optimizar los resultados de esta terapia.
Selección de candidatosEn el estudio de pacientes con TV, es importante discriminar entre aquellos con corazón estructuralmente normal y los que tienen enfermedad miocárdica (saber si existe cicatriz/fibrosis), ya que esta se asocia a TV peor toleradas y que pueden derivar en fibrilación ventricular. La primera aproximación se hará mediante ecocardiografía convencional pero, ya en los últimos años, distintos estudios se han centrado en la utilización de la RMC con realce tardío para identificar la zona necrótica/fibrótica, estratificar el riesgo de TV, planificar procedimientos de ablación y guiar el procedimiento78.
Es muy importante identificar el origen de la TV antes de la ablación. La presencia de áreas de necrosis/fibrosis con zonas de tejido viable circundantes es la base de la formación de los circuitos de reentrada de las TV79. La RMC con realce tardío se ha convertido en la técnica de elección para identificar y caracterizar este tejido necrótico/fibrótico. La presencia y sobre todo el grado de heterogenicidad de la cicatriz estudiada por RMC con realce tardío se asocian con la incidencia de arritmias ventriculares y con peor pronóstico tanto en pacientes con infarto de miocardio como en aquellos con cardiomiopatías no isquémicas67,80. Además, la distribución del realce tardío en las imágenes de RMC permite diferenciar el origen endocárdico y/o epicárdico de las TV, lo que facilita la planificación y la aproximación (epicárdica, endocárdica o ambas) de la ablación81.
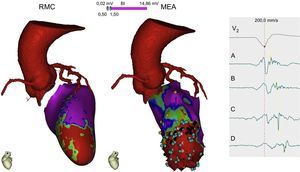
Guía intraprocedimientoDe la misma manera que pasa en la ablación de la FA, las imágenes posprocesadas de la RMC con realce tardío se pueden integrar dentro de los sistemas de navegación para guiar la ablación de la TV y han mostrado buena correlación con los mapeos electroanatómicos82. Se ha podido identificar por RMC con realce 3D canales de conducción entre las células viables de la cicatriz para poder guiar los procedimientos de ablación83 (figura 9). Sin embargo, hay aún algunas limitaciones técnicas (escasa resolución espacial) y falta estandarizar los algoritmos de posprocesado de la señal que definan la zona perinfarto (borderzone) y la fibrosis/necrosis. Cabe añadir que muchos de estos pacientes ya son portadores de dispositivos automáticos implantables en el momento que se plantea la ablación de la TV, lo cual actualmente dificulta el estudio por RMC, a pesar de las constantes mejoras tecnológicas84. Otra alternativa es realizar una TC cardiaca que permita visualizar la cicatriz y fusionar las imágenes en 3D con el sistema de mapeo para guiar la ablación85.
Imagen multimodal con una tomografía computarizada cardiaca para delimitar el trayecto de las arterias coronarias cuando se plantea un abordaje epicárdico de la ablación y con una resonancia magnética cardiaca que demuestra una cicatriz anteroseptal apical (rojo) con un zona de tejido viable en su interior (verde). El mapa electroanatómico endocárdico demuestra una zona de cicatriz densa apical, donde se detectan unos puntos (azules) que crean un canal de conducción lenta desde A hasta D, con retraso progresivo en el electrograma. Será este canal el sustrato y objetivo de la ablación. MEA: mapa electroanatómico; RMC: resonancia magnética cardiaca. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En cuanto el seguimiento de estos pacientes, el papel de las técnicas de imagen estaría relegado a detectar complicaciones durante el procedimiento, como el taponamiento cardiaco, que se diagnosticarían con la ecocardiografía transtorácica. Después de la ablación se podría realizar una RMC para detectar alguna complicación poco frecuente, como el steampop (daño miocárdico por excesivo calentamiento secundario a la radiofrecuencia) o el grado de lesión tras la ablación (su transmuralidad), aunque hay poca bibliografía al respecto.
En cuanto a las líneas futuras en este campo, la RMC en tiempo real sería una alternativa para guiar los estudios elecrofisiológicos, sin exposición a radiación y con monitorización directa de la lesión que se está generando, en contraposición a los procedimientos estándares con fluoroscopia86.
CONFLICTO DE INTERESESNinguno.