La ablación con catéter se ha establecido como alternativa o complemento a los fármacos antiarrítmicos en pacientes seleccionados con fibrilación auricular. Aunque el aislamiento de las venas pulmonares es muy eficaz en pacientes con fibrilación auricular paroxística, todavía no somos capaces de identificar el sustrato arritmogénico que origina la fibrilación en un gran número de pacientes, sobre todo aquellos con fibrilación auricular persistente. Este hecho probablemente condicione la ablación de zonas de la anatomía auricular que podrían no ser fundamentales para el inicio y el sostenimiento de la fibrilación auricular. Hasta que conozcamos mejor la fisiopatología de las diferentes etapas de la fibrilación auricular, sería deseable tratar la arritmia precozmente, sin esperar a que evolucione el deterioro anatómico y eléctrico de las aurículas.
Palabras clave
Aun sabiendo que la fibrilación auricular (FA) es la arritmia sostenida más frecuente, los resultados iniciales recientemente comunicados del estudio OFRECE (Observación de la fibrilación auricular y enfermedad coronaria en España) han sido sorprendentes: la prevalencia de FA en nuestro país es del 4% de las personas mayores de 55 años y puede llegar a ser del 15% entre los mayores de 70 años1. Otros estudios han estimado que la probabilidad de desarrollar FA a lo largo de la vida es del 24% para los varones y del 22% para las mujeres2. Teniendo en cuenta que esta arritmia deteriora la calidad de vida, incrementa la mortalidad y conlleva un riesgo significativo de embolias, en la mayoría de los casos cerebrales, es fácil entender que el coste sociosanitario que ocasiona sea enorme y de ahí la importancia de prevenirla y tratarla3.
La prevención de la FA y sus consecuencias se basa en los mismos principios que la prevención de la enfermedad cardiovascular, aunque aquí cobran especial protagonismo dos tipos de fármacos: los anticoagulantes, cuando el riesgo de embolias se considera elevado, y los fármacos antiarrítmicos. El objetivo de utilizar fármacos antiarrítmicos es frenar la respuesta ventricular o recuperar y mantener el ritmo sinusal. Para controlar la respuesta ventricular disponemos de bloqueadores beta y antagonistas del calcio (fármacos eficaces y seguros). Por el contrario, para recuperar y mantener el ritmo sinusal, los fármacos antiarrítmicos disponibles distan mucho de ser perfectos. En términos generales, su eficacia, definida como ritmo sinusal que se mantiene estable durante más de 1 año, se sitúa sólo en torno al 50%, con efectos indeseables en hasta un 30%4. Estos datos han llevado incluso a cuestionar la conveniencia de tratar a los pacientes con fármacos antiarrítmicos para recuperar y mantener el ritmo sinusal. Dados su escasa eficacia y sus frecuentes efectos secundarios, se concluyó que, para determinadas poblaciones, podría ser mejor simplemente controlar la respuesta ventricular más que luchar por recuperar y mantener el ritmo sinusal (la denominada controversia del control del ritmo frente al control de la frecuencia)5, 6. Hoy sabemos que, siendo preferible estar en ritmo sinusal, este beneficio se puede contrarrestar por la relativa falta de eficacia y por los efectos indeseables del tratamiento con fármacos antiarrítmicos7. Por este motivo, en los últimos años se han buscado nuevas alternativas terapéuticas, como la ablación con catéter. Aunque se trata de una técnica todavía poco conocida, el número de pacientes tratados con ella ha aumentado considerablemente. En 2010 se realizaron en España 1.309 procedimientos de ablación de FA en 40 laboratorios de electrofisiología8.
Evolución histórica del conocimiento de la fibrilación auricularHacia 1950 se intentó explicar el origen y mantenimiento de la FA por la existencia de focos ectópicos que descargaban a unas frecuencias tan rápidas que el frente de activación se fragmentaba al transmitirse por las aurículas, lo que impedía que el tejido auricular se activara de manera homogénea; se denominó a este fenómeno «conducción fibrilatoria»9. Una década más tarde, se impuso la idea de que la causa no eran focos ectópicos, sino que la FA dependía de la coexistencia de varios frentes simultáneos de reentrada en ambas aurículas10. En los años ochenta, los estudios de cartografía auricular realizados durante la FA en un modelo animal apoyaron esta hipótesis y llegaron a determinar que el número de frentes de onda que podían coexistir dependía de la masa auricular, la velocidad de conducción y el periodo refractario auricular11. De esta manera se dedujo que, para impedir el mantenimiento de la FA, había que evitar que coexistieran muchos frentes de activación creando barreras al impulso eléctrico, es decir, «compartimentalizando» las aurículas.
Primeros intentos de ablaciónCox y su equipo fueron pioneros en compartimentalizar las aurículas con cicatrices quirúrgicas utilizando la denominada técnica del laberinto (maze), con buenos resultados12, 13. A finales de los años noventa ya se intentó realizar estas líneas de bloqueo auricular con catéteres intracardiacos introducidos por vía percutánea. Los resultados iniciales no fueron buenos, con tasas de éxito a corto plazo menores del 30%, pero de ahí surgió la evidencia de que las líneas de ablación que podían resultar más efectivas eran las realizadas en la aurícula izquierda14. Unos años más tarde, a finales de los noventa, Haissaguerre y su grupo propiciaron una revolución conceptual al comunicar la «curación» de varios pacientes que sufrían FA paroxística mediante la ablación de focos ectópicos localizados en el interior de las venas pulmonares15. Renacía el concepto de «FA focal» propuesto en los años cincuenta.
Clasificación de la fibrilación auricularLa clasificación de la FA recientemente propuesta considera, además de la FA de duración indeterminada, la FA paroxística, la FA persistente y la FA permanente. Esta clasificación es importante porque de alguna manera se relaciona con la complejidad de los mecanismos subyacentes16. La FA paroxística se atribuye a focos ectópicos activos que, en un 90% de los pacientes, se encuentran en las proximidades de la inserción auricular de las venas pulmonares y que pueden estar «modulados» por las terminaciones nerviosas vegetativas que inervan estas zonas del corazón17. En aproximadamente un 10% de los casos, estos focos pueden ser «extrapulmonares» y pueden estar localizados, entre otros lugares de la pared auricular, en el seno coronario, la vena cava superior o las orejuelas izquierda o derecha. Se conoce peor los mecanismos que subyacen a la FA persistente. Parece ser una forma de enfermedad más avanzada en la que concurren, además de focos ectópicos activos, otros fenómenos como los gradientes eléctricos entre las aurículas derecha e izquierda y los rotores, una especie de huracanes eléctricos capaces de provocar una activación muy rápida y anclarse en determinadas zonas anatómicas auriculares16.
Simplificando, podríamos decir que la FA paroxística sería una afección predominantemente «venosa» (vena pulmonar, de vena cava o de seno coronario) y con actividad eléctrica focal, mientras que las formas más avanzadas de FA serían una afección «auricular», con actividad eléctrica más compleja. Esto se constata clínicamente con la observación de que muchos de los pacientes que sufren FA paroxística tienen corazones estructuralmente «normales». En algunos casos se trata de enfermos muy jóvenes en quienes se evidencia una enfermedad exclusivamente debida a uno o varios focos de descarga dentro de las venas pulmonares. En el extremo opuesto estarían las aurículas deterioradas por todas las situaciones clínicas (hipertensión, obesidad, insuficiencia cardiaca, miocardiopatías, valvulopatías) que se asocian a la aparición y la persistencia de la FA. Además, se ha demostrado que la propia fibrilación auricular per se, cuando se mantiene, causa alteraciones eléctricas y estructurales en las aurículas (el llamado remodelado auricular) que favorecen la perpetuación de la arritmia. Es decir, la FA favorece la FA18. Una FA paroxística puede evolucionar a peor y convertirse, por lo tanto, en una FA persistente. En la práctica clínica, todavía no conocemos bien este proceso, ya que esta transición no siempre sucede y, cuando ocurre, no lo hace de la misma forma ni en el mismo periodo de tiempo en todos los enfermos.
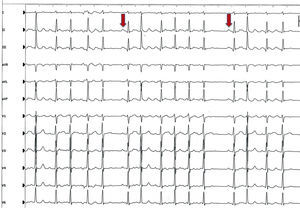
Técnicas de ablaciónEl paciente ideal para la ablación sería el que tiene episodios de FA de origen focal. Clínicamente lo podríamos detectar por la existencia de mucha actividad eléctrica monotópica, en forma de extrasístoles auriculares muy frecuentes de la misma morfología y rachas de taquicardia o fibrilación auricular (Figura 1). Cuando esto sucede, una vez que los catéteres electrodo se encuentran en el interior del corazón, se puede reconocer el lugar de inicio de la activación eléctrica y proceder a su ablación. El éxito del procedimiento dependerá entonces, fundamentalmente, de nuestra habilidad para aislar permanentemente el foco sin tener complicaciones. Por desgracia para los electrofisiólogos, estos pacientes son raros y en la mayoría de los procedimientos entran en el laboratorio en ritmo sinusal sin mucha actividad eléctrica espontánea, por lo que hay que proceder a infundir isoprenalina, adenosina o aplicar extraestímulos eléctricos con el fin de provocar las descargas del foco o los focos anómalos19. Aun así, en la mayor parte de los casos no suele ser posible documentar el origen de la FA y hay que optar por un tratamiento a ciegas, asumiendo que la mayoría de los focos anormales se localizan en las inmediaciones de las venas pulmonares. Hay que recordar que si el paciente entra en FA, espontáneamente o tras la administración de fármacos, sólo nos interesa su inicio, ya que cuando la arritmia se establece, la activación auricular es tan caótica que no nos permite descubrir cuál ha sido su lugar de origen.
Figura 1. Electrocardiograma de 12 derivaciones característico de una paciente con fibrilación auricular focal, en el que se observan latidos intercalados en ritmo sinusal (flechas).
Aislamiento de venas pulmonaresCuando se realiza la ablación de FA, actualmente se acepta que las venas pulmonares deben aislarse eléctricamente de forma bidireccional en todos los pacientes. Y cuanto más proximal (antral) se lleve a cabo este aislamiento, mejor, ya que se incluirá en él una mayor cantidad de tejido potencialmente arritmogénico20, 21. Hasta hace unos años, no todos los electrofisiólogos creían que el aislamiento eléctrico fuera imprescindible, y por ello los resultados de algunas series pueden haber sido peores que lo que se podría haber obtenido aislando por completo las venas pulmonares22.
Para llevar a cabo el aislamiento eléctrico de las venas pulmonares, se utiliza un catéter con punta irrigada que permite transmitir la energía de radiofrecuencia a la vez que se irriga con suero fisiológico la zona de contacto del electrodo con el endocardio23. De esta forma se puede entregar más energía y aumentar la extensión y la profundidad de la lesión sin producir carbonización alrededor de la punta del electrodo (lo que podría favorecer las microembolias). Otras técnicas, como el frío (crioablación), los ultrasonidos o el láser, están, hoy por hoy, menos extendidas y probadas.
Creación de líneas de bloqueo y ablación de potenciales fragmentadosEn algunos casos de FA paroxística, pero sobre todo cuando el paciente presenta FA persistente de larga evolución, el aislamiento de las venas pulmonares no suele ser suficiente para evitar las recurrencias de FA. En estos casos el enfermo puede entrar en el laboratorio en FA o en ritmo sinusal. En la mayor parte de los centros, cuando el procedimiento se inicia en FA, se intenta cardiovertir eléctricamente, ya que la valoración eléctrica del resultado, tanto del aislamiento de venas pulmonares como de las líneas de ablación, resulta mucho más sencilla si se realiza en ritmo sinusal24. Si el paciente recurre inmediatamente, es importante observar en qué estructura cardiaca se origina la FA, aunque para ello sea necesario disponer de suficientes registros en el interior del corazón. Si no es posible mantener el ritmo sinusal durante el procedimiento, se procede al aislamiento de las venas pulmonares durante la FA y se reintenta la cardioversión. Tras este paso, un número importante de pacientes mantiene el ritmo sinusal de manera más estable. Y en este momento es cuando aparece una de las controversias actuales: se termina el procedimiento y se observa la evolución clínica del paciente o se continúa con la ablación25, 26, 27, 28, 29, 30, 31, 32. Algunos investigadores defienden, incluso en pacientes con FA paroxística si la arritmia persiste, continuar realizando líneas de ablación o yendo a la caza de potenciales fragmentados. Estos potenciales se pueden encontrar preferentemente en zonas en las que hay entrecruzamientos de las fibras miocárdicas auriculares, y se ha especulado con que señalarían las zonas de anclaje de los rotores. Otros investigadores creen conveniente realizar también líneas de bloqueo en la aurícula izquierda, en el istmo mitral o en el interior del seno coronario. Otros incluso han propuesto aislar también sistemáticamente la vena cava superior y realizar líneas de ablación en la aurícula derecha. Finalmente, algunos investigadores proponen aplicar todas estas técnicas de manera escalonada hasta conseguir un ritmo sinusal estable, incluso tras las maniobras de provocación de la FA33. En resumen, no existe un objetivo final uniformemente definido y aceptado, lo que se traduce en una gran variabilidad en la metodología de la ablación en los diferentes laboratorios34.
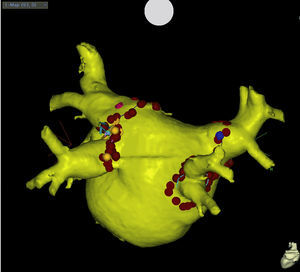
Para llevar a cabo estas técnicas complejas de ablación, se está imponiendo la utilización de sistemas que permiten sincronizar las imágenes de la anatomía auricular obtenidas con tomografía computarizada o resonancia magnética con las obtenidas cartografiando las aurículas de cada paciente. Utilizando estas evoluciones tecnológicas, se puede realizar con más facilidad aplicaciones puntuales sucesivas, dirigidas a crear líneas de bloqueo alrededor de las venas (para llevar a cabo su aislamiento) y en las demás localizaciones (Figura 2). Dejar puntos de conducción, o gaps, en estas líneas supone facilitar las taquicardias por reentrada auricular35. Recientemente también se han desarrollado sistemas dirigidos a localizar los potenciales fragmentados.
Figura 2. Proyección posteroanterior de la imagen obtenida mediante tomografía computarizada de una aurícula izquierda en la que se observan las lesiones de radiofrecuencia aplicadas para aislar eléctricamente las cuatro venas pulmonares.
Resultados de la ablación de la fibrilación auricular paroxísticaEn pacientes con FA paroxística, el aislamiento de las venas pulmonares consigue mantener el ritmo sinusal en tasas que oscilan entre el 60 y el 85%36. Algunos estudios han apuntado que añadiendo la ablación de potenciales fragmentados o líneas en distintos istmos se puede incrementar este porcentaje de éxito, si bien otros autores no han observado este hallazgo26, 32.
La definición de éxito generalmente se refiere a la supresión de episodios documentados electrocardiográficamente, lo cual tiene sus limitaciones, o a la ausencia de episodios de FA en los registros Holter o de telemonitorización, que se realizan con una frecuencia variable. Aunque cada vez hay más sistemas de monitorización electrocardiográfica a distancia, por desgracia muy pocos estudios han decidido utilizar medios como los dispositivos Holter implantables, que permiten sin lugar a dudas un conocimiento mucho mejor de lo que sucede en cada instante con el ritmo cardiaco de estos pacientes. Independientemente de todas estas limitaciones, cuando el éxito se refiere a la mejoría sintomática —no olvidemos que se trata de uno de los principales objetivos de la ablación—, el resultado es siempre mucho mejor37.
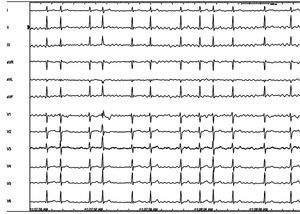
¿Pero a qué se debe la variabilidad en los resultados de la ablación en los pacientes con FA paroxística? Las FA paroxísticas no son todas iguales. Las probabilidades de éxito más altas se obtienen en pacientes jóvenes, sin cardiopatía, con aurícula izquierda pequeña y mucha actividad eléctrica (extrasistolia auricular o rachas de taquicardia auricular monotópica o FA), lo que facilita localizar su origen. En los casos en que se documenta un foco causante, el éxito puede acercarse al 100% y sólo falla por la imposibilidad de aislarlo, hecho muy infrecuente, o por reconexión eléctrica de la vena responsable, que suele ser la causa más común de las recurrencias (Figura 3). Clínicamente, este hecho se observa en pacientes que tenían muchos episodios de FA antes de la ablación, que permanecen «curados» varios meses tras ella y después vuelven a tener crisis de FA. Muchas veces estas crisis son más cortas e incluso se pueden controlar con fármacos antiarrítmicos que antes de la ablación eran claramente ineficaces. Como ya se ha comentado, la mejoría sintomática de los pacientes tras la ablación es muy notable, aunque con el paso del tiempo se incremente el riesgo de recurrencias. En pacientes con FA paroxística, los datos obtenidos a los 5 años de la ablación reflejan recurrencias; en algunas series, en casi la mitad de los pacientes tratados38, 39. Las razones de estas recurrencias no son bien conocidas, aunque en la mayoría de los casos coincide que las venas pulmonares reconducen eléctricamente. De ahí que los últimos esfuerzos se concentren en mejorar la «calidad» de las lesiones para evitar la reconexión de las venas pulmonares. Técnicamente hay que conseguir lesiones seguras, que sean eficaces como barreras cicatriciales a largo plazo, sin dañar tejidos adyacentes o perforar la pared del corazón. Recientemente se ha hallado40 que la administración de adenosina o derivados tras el aislamiento de las venas podría anticiparnos, antes de finalizar el procedimiento, las venas en que no se ha realizado suficiente ablación y tendrían altas probabilidades de reconducir eléctricamente durante el seguimiento.
Figura 3. Paciente joven, sin cardiopatía estructural con FA persistente de 6 meses de evolución refractaria a fármacos antiarrítmicos. A: electrocardiograma de 12 derivaciones. B: trazados obtenidos en el laboratorio de electrofisiología durante FA, a velocidad de 100 mm/s, correspondientes a las derivaciones II, III, aVF, aVL y V1 del ECG de superficie y a un catéter de 24 polos que registra electrogramas de seno coronario (1-10) y aurícula derecha (11-24); en la imagen radiológica obtenida tras infundir contraste en la aurícula izquierda, se observa el tronco común de las venas pulmonares izquierdas (flecha blanca), que también se observa en la imagen cenital de la resonancia magnética (flecha negra). C: una vez aislado con radiofrecuencia el tronco pulmonar izquierdo (puntos rojos), se observa que las descargas eléctricas del foco persistían en su interior, aunque no podían transmitirse a la aurícula (obsérvese el ritmo sinusal en las derivaciones del ECG); una aplicación adicional en el techo de la aurícula con el catéter de ablación (flecha blanca) abolió el foco. ABLd: ablación distal; ABLp: ablación proximal; FA: fibrilación auricular; L: polos del 1 al 10 del catéter circular introducido en el tronco venoso pulmonar izquierdo.
No obstante, no siempre las recurrencias se deben a esta causa, ya que en algunos casos se ha observado simplemente una progresión de la enfermedad. De ahí la importancia de tratar los posibles factores precipitantes de los procesos degenerativos vasculares que alterarían las propiedades eléctricas auriculares, tales como la hipertensión y el resto de los factores de riesgo cardiovascular.
Resultados de la ablación de la fibrilación auricular persistenteLos resultados inmediatos y a medio plazo de la ablación de la FA en pacientes con FA persistente son ligeramente peores que los observados en FA paroxística, con tasas de éxito en torno al 60%36. Parece lógico pensar que cuanto más evolucionada se encuentre la enfermedad arrítmica, más difícil será conseguir un buen resultado. Sin embargo, tenemos que reconocer que la frontera que delimita a la FA paroxística de la FA persistente no está completamente definida desde el punto de vista de su fisiopatología, lo que supone una importante dificultad a la hora de analizar los resultados de la ablación en las distintas series.
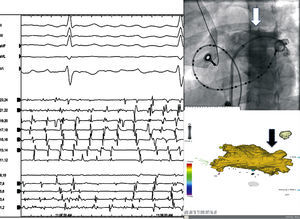
En la mayor parte de los casos de FA persistente, además de una «enfermedad de las venas pulmonares», coexisten diferentes grados de «enfermedad auricular», con aurículas dilatadas y afectadas por la propia fibrosis, consecuencia de la edad avanzada o factores concomitantes como hipertensión, diabetes mellitus, insuficiencia cardiaca o valvulopatías. Sin embargo, también se encuentra a pacientes con FA persistente en los que la arritmia aparentemente se localiza en las venas pulmonares (Figura 4). Por desgracia, hoy por hoy, a priori, no somos capaces de distinguir a estos enfermos. De la misma forma y como ya se ha comentado, aunque la FA sea paroxística, si es de larga evolución y la aurícula izquierda está dilatada, el aislamiento de las venas pulmonares en muchos casos tampoco es suficiente para impedir las recurrencias arrítmicas. En estos pacientes, el desconocimiento fisiopatológico obliga a que, además de aislar las venas pulmonares, se practique la ablación de potenciales fragmentados y se realicen líneas de ablación auriculares. Es probable que en un número considerable de enfermos, si dispusiéramos de un conocimiento patogénico sólido de la FA, se podría reducir considerablemente la extensión de la ablación y evitar cicatrices innecesarias41.
Figura 4. Varón de mediana edad con historia de 5 años de episodios de FA persistente refractaria a fármacos con aurícula izquierda ligeramente dilatada, sin otras alteraciones. Sin recurrencias de FA hasta 1 mes después de un procedimiento de aislamiento de venas pulmonares. En la reintervención se observó un punto de conducción (gap) en la unión de las venas pulmonares derechas (superior e inferior). Tras proceder a la ablación en ese punto, se aisló de nuevo la vena pulmonar superior derecha y se observó que la FA permanecía en el interior de dicha vena, como se observa en el catéter circular que se encontraba introducido en ella (flechas pequeñas), mientras que el corazón recuperó el ritmo sinusal (flecha grande). A: trazados obtenidos en el laboratorio de electrofisiología a velocidad de 100 mm/s, correspondientes a las derivaciones II, III, aVF, aVL y V1 del ECG de superficie, catéter de ablación y catéter circular en el interior de la vena pulmonar superior derecha (Laso 1-10) y a un catéter de 24 polos que registra electrogramas de seno coronario (1-10) y aurícula derecha (11-24). B: imagen posteroanterior de la resonancia de la aurícula izquierda. Se han señalado los puntos en los que tres aplicaciones de radiofrecuencia desconectaron las venas en el segundo procedimiento. FA: fibrilación auricular.
Comparación de fármacos y ablaciónEn todos los estudios aleatorizados llevados a cabo, la ventaja de la ablación sobre los fármacos antiarrímicos ha sido manifiesta, tanto en la FA paroxística (más del doble de probabilidades de recurrencia con fármacos que con la ablación) como en la FA persistente (más del triple de probabilidades de recurrencia con fármacos que con ablación)41, 42, 43, 44, 45, 46, 47, 48, 49, 50.
Es cierto que para conseguir estos resultados es fundamental seleccionar muy bien a los pacientes, así como disponer de un equipo con experiencia y medios técnicos adecuados. En España, como ya se ha comentado, en 2010 se realizaron 1.309 procedimientos de ablación de FA en 40 laboratorios de electrofisiología. Estos datos suponen una media de 32 procedimientos por centro, si bien sólo en 9 de ellos se realizaron más de 50 procedimientos ese año8. Si queremos obtener buenos resultados, es fundamental incrementar el número de procedimientos por centro.
La experiencia también es fundamental para reducir complicaciones. Los resultados de las últimas series y los registros demuestran una probabilidad de complicaciones tras un procedimiento de ablación de FA en torno al 4%, complicaciones que generalmente ocurren en el periprocedimiento, la inmensa mayoría de ellas son solucionables, sin secuelas importantes para el paciente34. Con los fármacos antiarrítmicos, las complicaciones son más frecuentes aunque menos visibles y, si bien generalmente a corto plazo no ponen en riesgo la vida del paciente, los efectos proarrítmicos pueden llegar a ser extremadamente graves. En un estudio reciente que analizó 63 publicaciones y comparó series de pacientes con FA tratados con fármacos antiarrítmicos o ablación, a los 14 meses de seguimiento el 30% de los pacientes había sufrido complicaciones con los fármacos antiarrítmicos y sólo un 5% tuvo complicaciones relacionadas con la ablación49.
ConclusionesLa ablación con catéter se ha incluido en las guías clínicas como alternativa o complemento de los fármacos antiarrítmicos en pacientes seleccionados con FA50, 51, 52. Aunque sus resultados pueden ser brillantes, todavía no somos capaces de identificar el sustrato arritmogénico que causa la FA en un gran número de pacientes. Esto condiciona que se realicen ablaciones de zonas de la anatomía auricular que podrían no ser fundamentales para el inicio y el sostenimiento de la FA. Generalmente esto sucede en las formas más avanzadas de la enfermedad arrítmica, que a su vez son de las que peor conocemos su fisiopatología y las que peor responden a cualquier tratamiento (ablación o fármacos). De ahí la importancia de tratar la FA precozmente, sin esperar a que evolucione53. Cuanto antes se trate, mejor.
Conflicto de interesesNinguno
Autor para correspondencia: Unidad de Arritmias, Hospital Clínico San Carlos, Prof. Martín Lagos s/n, 28040 Madrid, España. jvillacastin@secardiologia.es