La hipertensión pulmonar primaria es una enfermedad de carácter progresivo, más frecuente en mujeres jóvenes y de mediana edad. Su etiología se desconoce, aunque existe una predisposición familiar hasta en un 6% de los casos. Las teorías patogénicas actuales se centran en la existencia de disfunción endotelial y fallos en los canales iónicos de las fibras musculares lisas del vaso. Las pruebas diagnósticas se dirigen a descartar las causas secundarias y a evaluar la gravedad de la enfermedad. El test vasodilatador agudo es imprescindible para la elección del tratamiento más adecuado. La anticoagulación oral está indicada en todos los pacientes. El trasplante de pulmón queda reservado a aquellos casos en los que fracasa el tratamiento médico. La septostomía auricular es un procedimiento paliativo útil en casos seleccionados. La hipertensión pulmonar tromboembólica crónica es una forma especial de hipertensión pulmonar secundaria; aunque indistinguible clínicamente de la hipertensión pulmonar primaria, su diagnóstico resulta crucial, ya que es posible su curación mediante la realización de tromboendarterectomía pulmonar.El tromboembolismo pulmonar es frecuente en pacientes hospitalizados, presentando elevadas tasas de mortalidad (el 30% en pacientes no tratados). El diagnóstico es difícil, ya que puede acompañar o simular otras enfermedades cardiopulmonares. Las pruebas diagnósticas no invasivas tienen una baja sensibilidad y especificidad. Nuevas alternativas como la determinación de dímero D o la TAC helicoidal incrementan la precisión diagnóstica. El tratamiento estándar consiste en la administración de heparina durante 5-10 días y posteriormente anticoagulantes orales durante 3-6 meses. La prevención con heparinas o dextranos en los pacientes de alto riesgo ha demostrado claros beneficios.
Palabras clave
Hipertensión pulmonar
Embolismo pulmonar
Guías clínicas
Palabras clave
Hipertensión pulmonar
Embolismo pulmonar
Guías clínicas
Palabras clave
Hipertensión pulmonar
Embolismo pulmonar
Guías clínicas
Palabras clave
Hipertensión pulmonar
Embolismo pulmonar
Guías clínicas
HIPERTENSIÓN PULMONAR
La hipertensión pulmonar (HP) se define como la existencia de una presión media en la arteria pulmonar (PAPm) mayor de 25 mmHg en reposo o de más de 30 mmHg durante el ejercicio 1.
Se han propuesto múltiples formas de clasificación de la hipertensión pulmonar. En la última reunión mundial sobre HP realizada en Evian en septiembre de 1998 2, avalada por la OMS, se propuso una nueva clasificación más descriptiva que la anteriormente aceptada (tabla 1).
Tradicionalmente se han descrito una serie de factores asociados a un mayor riesgo de desarrollar HP. El mecanismo exacto por el que estos factores producen HP no se ha establecido con exactitud. Teniendo en cuenta que el riesgo absoluto es generalmente bajo, es muy probable que la susceptibilidad individual desempeñe un papel importante.
En la tabla 2 se describen los factores de riesgo asociados a HP de acuerdo con su probable papel causal 2. Se clasifican en «establecidos» (demostrados por grandes estudios, desempeñando un papel importante en el desarrollo de HP); «muy probable» (en estudios de grandes series de casos que han demostrado su asociación con HP); «posible» (se basa en series de casos, registros u opiniones expertas), e «improbable» (incluye factores de riesgo que se han propuesto, pero para los que no se ha encontrado asociación cuando se han realizado estudios controlados).
HIPERTENSIÓN PULMONAR PRIMARIA (HPP)
Es una enfermedad poco frecuente y de causa desconocida. Su incidencia anual en la población general se estima entre un 1 y 2 casos por un millón de habitantes y año 3. La mayor prevalencia ocurre en la tercera y cuarta décadas de la vida (edad media al diagnóstico 36 años), aunque hasta un 9% de los casos comienzan pasada la sexta década. La distribución por razas es homogénea. Es más frecuente en el sexo femenino, tanto en la forma de presentación de los adultos como en la forma infantil.
La enfermedad se produce por afección de los vasos pulmonares de pequeño calibre (enfermedad vascular pulmonar), siendo la lesión plexiforme el hallazgo histopatológico típico, sin que sea patognomónico ni constante, ya que pueden producirse hallazgos clínicos y patológicos similares en algunos tipos de HP secundaria (hipertensión portal, infección por el virus de la inmunodeficiencia humana, adictos a cocaína por vía inhalatoria y en aquellos pacientes que toman fármacos anorexígenos). En la práctica clínica, una definición útil es la presencia de presión pulmonar elevada, con presión de enclavamiento pulmonar normal y ausencia de causas secundarias.
Hipertensión pulmonar primaria familiar
La incidencia en el registro del NIH fue del 6% de todos los casos de HPP 4. Los hallazgos clínicos e histopatológicos de la forma familiar de la enfermedad son idénticos a los de la forma esporádica, aunque el diagnóstico suele hacerse a edades más tempranas en la forma familiar debido a un mayor nivel de sospecha. La forma de herencia es autosómica dominante con penetrancia incompleta, es decir, que puede saltar generaciones y simular casos esporádicos.
El curso clínico de la HP familiar, su gravedad hemodinámica y sus hallazgos histopatológicos son similares a los de los casos esporádicos.
Patogenia
La etiología de la HPP se desconoce. Su patogenia es compleja, y en ella concurren factores genéticos (que explican la susceptibilidad individual) y factores exógenos (fármacos, virus, tóxicos, etc.). En los últimos años se han producido avances importantes en el conocimiento de la patobiología de la HPP que explican los procesos moleculares que subyacen en los cambios complejos del vaso pulmonar. De forma esquemática, los aspectos más interesantes sobre los que se trabaja en la actualidad son los siguientes 2:
1.Cambios del fenotipo de las células endoteliales y fibras musculares lisas, con proliferación celular y disbalance de sustancias vasoconstrictoras.
2. Alteraciones de la regulación de la matriz proteica intercelular.
3. Implicación de los fenómenos de apoptosis en los cambios vasculares.
4. Alteraciones de los canales iónicos de la membrana de las fibras musculares lisas (canales de K +).
Clínica
Los síntomas más frecuentes se describen en la ta-bla 3. En la mayoría de los casos el síntoma inicial es la disnea de esfuerzo de aparición gradual, disnea que no suele ser específica. Por ello no es raro que el diagnóstico de la HPP suela retrasarse hasta 2 años desde el inicio de los síntomas. La angina y el síncope o presíncope, particularmente con el ejercicio, indican una limitación más intensa del gasto cardíaco. Aproximadamente el 10% de los pacientes, normalmente mujeres, refieren fenómeno de Raynaud, que se asocia a un peor pronóstico 5.
La exploración física a veces sugiere la presencia de una enfermedad sistémica asociada a HP secundaria y, por tanto, descarta la HPP. Los signos de HP van a depender de la gravedad del proceso (tabla 4).
Diagnóstico y valoración de la hipertensión pulmonar primaria
El objetivo de las pruebas diagnósticas en los pacientes con sospecha de HPP es excluir causas secundarias y valorar la gravedad de la HP.
Determinaciones analíticas
Deben incluirse pruebas funcionales hepáticas y análisis para anticuerpos del VIH, así como serologías para intentar excluir enfermedades del tejido conectivo. Los pacientes con HPP pueden presentar títulos bajos de anticuerpos antinucleares sin que existan otros signos de afectación reumatológica.
Radiografía de tórax
Aparecen unas arterias pulmonares centrales prominentes con disminución de la vascularización periférica, junto con crecimiento de aurícula y ventrículo derechos. En el 6% de los casos la radiografía de tórax es normal.
Ecocardiografía
Descarta enfermedades congénitas, valvulares y miocárdicas, y puede proporcionar una estimación de la presión sistólica pulmonar, útil para valorar de forma no invasiva la respuesta al tratamiento. Se recomienda determinar los siguientes parámetros 2:
1.Velocidad pico de la insuficiencia tricúspide.
2. Tiempo de aceleración del flujo pulmonar.
3. Período eyectivo del ventrículo derecho (VD).
4.Dimensiones y volúmenes del VD.
5. Tiempo de desaceleración mesosistólica del pe-ríodo eyectivo del VD.
Pruebas funcionales respiratorias
Descartan trastornos significativos del parénquima pulmonar o de las vías respiratorias. En la mayoría de los casos la gasometría arterial presenta una hipoxemia con hipocapnia causada por un desequilibrio de ventilación-perfusión 4.
Pruebas de esfuerzo cardiopulmonar
Revelan un patrón de función cardíaca alterada, con reducción del consumo máximo de oxígeno, elevación de la ventilación minuto, un umbral anaeróbico bajo y un pulso de oxígeno reducido. Existe buena correlación entre la distancia recorrida en el test de los 6 min caminando y el pronóstico de la HP. Es la prueba que mejor evalúa la situación funcional en la HP permitiendo realizar una monitorización no invasiva de la respuesta al tratamiento. En general, se recomienda realizar una prueba basal y posteriormente durante el seguimiento 5.
Gammagrafía de ventilación-perfusión pulmonar
Es normal, o presenta defectos subsegmentarios, particularmente en la enfermedad venooclusiva, en contraste con los grandes y múltiples defectos de perfusión típicos de la HP de origen tromboembólico 4.
Arteriografía pulmonar
Es útil cuando la gammagrafía de perfusión pulmonar no es concluyente y es de obligada realización cuando existen defectos de perfusión segmentarios o subsegmentarios en la gammagrafía que sugieren enfermedad tromboembólica crónica de grandes vasos 4.
Tomografía computarizada (TC)y resonancia nuclear magnética
La evaluación de los siguientes parámetros puede ser útil en el diagnóstico 2:
1.Morfología del VD.
2. Morfología de la aurícula derecha.
3.Morfología de las arterias pulmonares.
4. Función ventricular derecha.
En general se recomienda realizar una TC de alta resolución cuando la capacidad pulmonar total es igual o inferior al 70% o el coeficiente de difusión es igual o inferior al 50% para evaluar el parénquima pulmonar y descartar la presencia de enfermedad intersticial pulmonar y enfermedad venooclusiva.
Biopsia pulmonar
En general se considera que conlleva un riesgo elevado sin que exista evidencia de que aporte información clínica adicional. No se recomienda realizarla de rutina, y está justificada sólo en determinadas situaciones específicas individualizadas, como el diagnóstico de vasculitis activa 2.
Cateterismo cardíaco
Existe una alteración importante de la hemodinámica pulmonar con un aumento de la presión pulmonar hasta tres veces o más su valor normal, aumento de la presión de la aurícula derecha y un gasto cardíaco bajo. Las presiones del lado izquierdo del corazón habitualmente son normales, aunque cuando se produce una dilatación grave de las cavidades derechas pueden llegar a comprimir las cavidades izquierdas hasta un grado que limite el llenado produciendo un aumento ligero en las presiones diastólicas 4,5. La presión de enclavamiento pulmonar es generalmente normal, incluso en la enfermedad venooclusiva, debido a la permeabilidad de las grandes venas pulmonares y a la naturaleza parcheada de la enfermedad en las venas 5. Sin embargo, en la enfermedad venooclusiva, la determinación de la presión de enclavamiento pulmonar en varios sitios puede revelar presiones anormalmente elevadas en algunos segmentos vasculares 5.
Test agudo con vasodilatadores
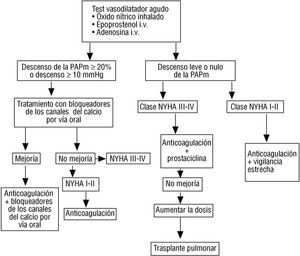
Predice la respuesta a largo plazo con tratamiento vasodilatadores orales. Se recomienda realizarlo a todos los pacientes para determinar la capacidad de respuesta al tratamiento vasodilatador 2. Los fármacos recomendados son: el epoprostenol intravenoso, el óxido nítrico inhalado y la adenosina intravenosa. Aunque no existe consenso en la definición de los pacientes que se consideran respondedores, se puede aceptar la siguiente división según los hallazgos objetivados durante el test 3,5:
1. Respondedores: reducción de PAPm igual o superior al 20% o una disminución de la PAPm igual o superior a 10 mmHg, con aumento o mantenimiento del gasto cardíaco (GC). Suponen aproximadamente un 20% de todos los pacientes con HPP, y presentan una alta probabilidad de mejoría clínica y hemodinámica tras tratamiento vasodilatador oral, junto con una mayor supervivencia.
2.Respondedores de resistencia: reducción de las RVP superior al 20% sin reducción significativa de la PAPm (la reducción se produce a expensas de un aumento del GC). No se conoce su significado. No se benefician del tratamiento vasodilatador por vía oral.
3. No respondedores: reducción de las RVP inferior al 20% sin reducción significativa de la PAPm. No se recomienda el tratamiento vasodilatador con antagonistas del calcio por vía oral ya que no altera el curso clínico ni la supervivencia.
4. Respuesta desfavorable: descenso de la presión arterial sistémica media superior al 20% con mantenimiento o disminución del GC. El tratamiento vasodilatador está contraindicado.
CRIBADO DE LA HIPERTENSIÓN PULMONAR
Actualmente las principales recomendaciones están dirigidas a intentar identificar la hipertensión pulmonar en una fase más precoz de la enfermedad, cuando los pacientes están asintomáticos o con mínimos síntomas, ya que tal vez de esta forma el tratamiento se iniciaría en un momento más temprano de la evolución, cuando los mecanismos patogénicos presentes son aún dinámicos o reversibles, lo que aumentaría las probabilidades de éxito 2. Las pruebas de cribado deberían ser no invasivas, con bajo riesgo, y con una sensibilidad y especificidad elevadas.
Estas pruebas están especialmente recomendadas en aquellas subpoblaciones con un riesgo elevado de desarrollar HP. Actualmente la prueba que se recomienda es el ecocardiograma transtorácico 2.
1. Pacientes asintomáticos:
a) Esclerodermia: dada la alta prevalencia de HP se aconseja realizarlo cada año.
b) Enfermedades hepáticas/hipertensión portal: de realización obligada en todos los pacientes que vayan a ser evaluados para trasplante hepático.
c)Familiares de primer grado de paciente con HPP (en el momento del diagnóstico).
2.Pacientes con síntomas indicativos de HP que pertenecen a grupos de riesgo (VIH, anorexígenos, hepatopatía, etc.).
EVALUACIÓN DE LA HIPERTENSIÓN PULMONAR MODERADA
Debido al extendido uso de la ecocardiografía en la evaluación de síntomas no específicamente cardiovasculares se ha producido un aumento en el número de diagnósticos de HP moderada, que se define como una presión sistólica pulmonar de 40-50 mmHg. Actualmente se han aceptado las siguientes recomendaciones para la evaluación de estos pacientes 2.
1. Pacientes asintomáticos (hallazgo casual): repetir el estudio en 6 meses junto con una historia clínica y exploración física detalladas.
2.Pacientes sintomáticos: realización de cateterismo para confirmación de los hallazgos hemodinámicos. Si los resultados en reposo no confirman los hallazgos, se recomienda hacer determinaciones hemodinámicas durante el ejercicio. Aquellos pacientes con HP moderada en reposo, o con el ejercicio, deberían ser tratados como el resto de pacientes con HP.
3. Pacientes de alto riesgo para HP: se recomienda repetir el estudio a los 6 meses, y si se confirma el hallazgo, manejo diagnóstico y terapéutico igual al de los pacientes con HP sintomática.
TRATAMIENTO
Aunque la HPP no tiene cura, se han producido avances importantes tanto en el tratamiento médico como en el quirúrgico. Se debe limitar la actividad física y evitar aquellos fármacos que puedan agravar la hipertensión pulmonar: descongestionantes vasoactivos, antihipertensivos cardiodepresores como los bloqueadores beta, y los AINE, ya que posiblemente empeoran la HP 4. Es importante insistir en una contracepción efectiva en las mujeres, debido a que las sobrecargas hemodinámicas del embarazo, sobre todo del posparto inmediato, son mal toleradas 4.
Vasodilatadores
La razón para el uso de vasodilatadores se basa en la observación de que la vasoconstricción es un factor importante en la enfermedad. La respuesta al tratamiento vasodilatador en un determinado paciente es impredecible, por lo que es obligado llevar a cabo el test agudo durante el cateterismo con agentes de corta duración, antes de iniciar el tratamiento a largo plazo 2. Los fármacos empleados para el test agudo son la prostaciclina intravenosa, la adenosina intravenosa o el óxido nítrico inhalado (fig. 1) 2,3,5.
Fig. 1. Algoritmo de tratamiento del paciente con hipertensión pulmonar primaria.
Bloqueadores de los canales del calcio
Sólo están recomendados en aquellos pacientes que responden al test agudo, sin que se haya demostrado su utilidad en el resto de pacientes. Los fármacos que han sido utilizados más ampliamente a largo plazo son el nifedipino y el diltiazem, que producen una mejoría sostenida en un 25 a un 30% de los pacientes 2. Las dosis requeridas para obtener efectos beneficiosos en la HPP son más altas que las que se utilizan en el tratamiento de la hipertensión arterial o en la enfermedad coronaria, aunque los requerimientos y la tolerancia varían considerablemente. El uso de verapamilo no está recomendado, debido en parte a sus efectos inotrópicos negativos (tabla 5).
Los efectos sistémicos del tratamiento a largo plazo con antagonistas del calcio incluyen hipotensión, edemas e hipoxemia. Esta última puede aparecer por tres circunstancias: un empeoramiento de la ventilación perfusión debido a aumento de la perfusión en zonas de pulmón pobremente ventiladas; hipoxemia venosa mixta debido a un deterioro del GC inducido por el tratamiento, y secundaria a shunt a través de un foramen oval permeable cuando se produce vasodilatación sistémica.
Prostaciclina
Se ha comprobado que el epoprostenol (prostaciclina, PGI 2) en perfusión intravenosa continúa la mejora en la hemodinámica y aumenta la tolerancia al ejercicio alargando la supervivencia en la HPP grave (clase funcional III-IV de la NYHA) de los pacientes que no han respondido al test vasodilatador agudo 3. Debe ser administrado en infusión intravenosa continua, debido a su corta vida media (3-5 min) y a que es inactivado por el pH bajo del estómago. El fármaco es liberado mediante un sistema de bomba de perfusión conectada a un catéter venoso central permanente. Los efectos adversos mayores relacionados con el tratamiento se derivan principalmente del método de administración, que incluye mal funcionamiento de la bomba, infecciones en relación con el catéter y trombosis venosa. La interrupción de la perfusión de forma brusca puede ser mortal 3. Los efectos secundarios del tratamiento farmacológico son frecuentes e incluyen dolor de mandíbula, eritema cutáneo, diarrea y artralgias. El tratamiento con epoprostenol está contraindicado en la enfermedad venooclusiva pulmonar porque puede provocar un edema pulmonar agudo al incrementar el flujo sanguíneo anterógrado. El desarrollo de tolerancia es frecuente, por lo que las dosis deben ir incrementándose de forma escalonada durante el primer año para evitar su desarrollo.
Otras propiedades del fármaco distintas a su actividad vasodilatadora, que incluyen la inhibición de la agregación plaquetaria y los efectos en el remodelado vascular, pueden ser las responsables de los beneficios a largo plazo. Puede ser usado como primera opción de tratamiento o como puente al trasplante. Existe experiencia en grupos de pacientes con beneficios clínicos y hemodinámicos mantenidos.
Anticoagulación
Estaría indicada en todos los pacientes, ya que existe evidencia suficiente de que produce un aumento de la supervivencia en todos los grupos de pacientes con HPP, especialmente en aquellos que no responden al test vasodilatador agudo. La anticoagulación oral es la de elección 2, a dosis suficientes para mantener un INR en torno a 1,5-2.
Otras medidas de soporte
Los diuréticos son de utilidad para reducir la precarga en pacientes con fallo derecho, particularmente cuando se producen congestión hepática y ascitis, no recomendándose su uso cuando no existe insuficiencia cardíaca derecha. Los pacientes con hipoxemia, en reposo o inducida con el esfuerzo, pueden experimentar mejoría sintomática con oxígeno suplementario. Algunos recomiendan el uso de glucósidos cardíacos, como la digoxina, cuando se administran antagonistas del calcio, dirigidos a contrarrestar el efecto inotrópico negativo de los bloqueadores de los canales del calcio.
TRATAMIENTO QUIRÚRGICO
Tanto el trasplante pulmonar uni o bilateral como el trasplante combinado corazón-pulmón se realizan para el tratamiento de la HPP; los rangos de supervivencia son similares en los dos procedimientos. La supervivencia al año tras el trasplante pulmonar en la HPP oscila de un 65 a un 70% 6. El trasplante pulmonar debería reservarse para aquellos pacientes con HPP en clase funcional III-IV que no responden al tratamiento médico óptimo, que incluye prostaciclinas, sin que exista consenso actualmente sobre cuál es el momento más adecuado para realizarlo 2. Los rangos de mortalidad del trasplante pulmonar son significativamente más elevados entre los pacientes con HPP que para aquellos con otras indicaciones para el trasplante. La bronquiolitis obliterante, la complicación mayor a largo plazo del trasplante, también se produce con mayor frecuencia en los pacientes con HPP. No se ha descrito recurrencia de la HP tras el trasplante.
SEPTOSTOMÍA AURICULAR
La creación de un shunt derecha-izquierda mediante la realización de una septostomía auricular disminuye las presiones de llenado del corazón derecho en pacientes con insuficiencia cardíaca derecha grave que no responden al tratamiento médico 3. Aunque se basa en observaciones experimentales y clínicas, y se ha realizado en cerca de 60 pacientes, debe considerarse todavía en fase de investigación, y representa una alternativa sólo en determinados pacientes. En general se considera indicado en 2: a) síncope recurrente y/o fallo ventricular derecho a pesar de un tratamiento médico adecuado que incluye el tratamiento con prostaciclinas; b) como puente al trasplante si se produce deterioro clínico a pesar del tratamiento, y c) cuando no existe otra opción terapéutica en aquellos países que no pueden disponer del tratamiento con prostaciclinas por su elevado coste. Factores que se han relacionado con un mal resultado o muerte incluyen una presión de AD superior a 20 mmHg, un índice de resistencias vasculares pulmonares superior a 55 UM 2, y una supervivencia estimada al año inferior al 40% según la fórmula desarrollada por el Instituto Nacional de la Salud de los EE.UU 6.
PRONÓSTICO
El pronóstico de la HPP no tratada es malo. La media de supervivencia tras el diagnóstico es de 2,5 años, aunque hay pacientes que pueden sobrevivir más tiempo, particularmente con el uso de los nuevos fármacos. Hoy día las recomendaciones se dirigen principalmente hacia un diagnóstico precoz de la enfermedad para una instauración del tratamiento en una fase más temprana de la enfermedad, hecho que se cree podría influir favorablemente en el pronóstico a largo plazo 2. La anticoagulación casi duplica el rango de 3 años de supervivencia, y los pacientes que responden al tratamiento con antagonistas del calcio presentan una supervivencia a los 5 años del 95%. El epoprostenol aumenta la supervivencia de los pacientes que no responden a los vasodilatadores orales y se asocia a una supervivencia a los 5 años similar a la del trasplante de pulmón o incluso mejor.
Los predictores de supervivencia a largo plazo en la HPP incluyen los indicadores de gravedad de la enfermedad: datos hemodinámicos basales (PAPm, presión de AD, índice cardíaco o saturación de oxígeno de sangre venosa mixta), clase funcional, tolerancia al ejercicio (test de 6 min caminando), tratamiento anticoagulante, fenómeno de Raynaud y la respuesta a vasodilatadores 2,3,5 (tabla 6).
Las causas principales de muerte son el fallo derecho progresivo (63%), la muerte súbita (7%) y la neumonía (7%) 5.
FUTURO
Los nuevos enfoques terapéuticos se dirigen a identificar los mecanismos patogénicos y mejorar la terapéutica farmacológica 2. Entre los tratamientos actualmente en desarrollo estaría la posibilidad de nuevas vías de administración para la prostaciclina (subcutánea e inhalada), así como nuevas sustancias: inhibidores de la endotelina 1, inhibidores del tromboxano A 2 y de la angiotensina, e inhibidores de la fofodiesterasa que degrada el NO. También se postula el empleo de tratamientos combinados (p. ej., prostaciclina y bloqueadores de los canales del calcio). Otras vías de investigación se dirigen a la producción de sustancias que modulan los canales de K + de la fibra muscular lisa (responsables de la vasoconstricción), así como al bloqueo de la angiogénesis y los factores de crecimiento celular.
HIPERTENSIÓN PULMONAR TROMBOEMBÓLICA CRÓNICA (HPTC)
La hipertensión pulmonar tromboembólica crónica (HPTC) ocurre en un pequeño porcentaje de los pacientes que presentan una embolia de pulmón 7. Hasta tiempos muy recientes esta enfermedad no se diagnosticaba, y ello se debe a diversas razones: a) el episodio inicial, la trombosis venosa profunda y el embolismo pulmonar agudo (TEP), cursa frecuentemente de forma subclínica, y no es identificable en la anamnesis retrospectiva del paciente; b) tras el evento agudo se sucede un período bastante largo libre de síntomas, y c) hasta hace relativamente poco tiempo, el tratamiento quirúrgico de esta afección estaba limitado a unos pocos centros en el mundo, y con unas tasas de mortalidad operatoria elevadas.
Los avances recientes en el tratamiento quirúrgico han convertido esta enfermedad en una forma quirúrgicamente tratable de HP grave, lo que obliga a un correcto diagnóstico y diferenciación de otras formas incurables 8.
Etiología y epidemiología
En la mayoría de los episodios de TEP el trombo causante se resuelve por completo. Esto no ocurre en un pequeño porcentaje de los casos, probablemente debido a factores diversos (defectos de la capacidad fibrinolítica intrínseca, anomalías funcionales del endotelio pulmonar, etc.), pero fundamentalmente a la ausencia de tratamiento anticoagulante y la existencia de TEP repetidos. La HTPC es consecuencia de episodios de embolización pulmonar recurrentes, lo que ocurre con frecuencia: en el Urokinase Pulmonary Embolism Trial 9, un 20% de los pacientes tuvieron una recurrencia en las dos primeras 2 semanas tras el tratamiento, siendo el factor causal más importante una incorrecta anticoagulación. Una minoría de los pacientes con HTPC son portadores de un síndrome de hipercoagulabilidad. Se calcula que aproximadamente el 0,1% de los pacientes que presentan un TEP desarrollarán HPTC.
Clínica y diagnóstico
La historia clínica del paciente es, por lo general, de escasa ayuda en el diagnóstico de HTPC, ya que los pacientes con un claro episodio de TEP rara vez de-sarrollan HTPC porque el tratamiento anticoagulante precoz evita el proceso crónico. Igualmente rara es la existencia de trombos en el sistema venoso. La enfermedad se inicia siempre con disnea de esfuerzo, aunque puede existir síncope, angina, etc., siendo clínicamente indistinguible de la HP primaria 7. Los hallazgos de la exploración física son similares a los de otras formas de HP, y se han descrito soplos continuos o sistólicos en los campos pulmonares originados por la obstrucción arterial, como hecho diferencial de la HTPC.
La gammagrafía pulmonar de ventilación-perfusión es la prueba que marca el punto a partir del cual el diagnóstico se orienta hacia el origen tromboembólico de la enfermedad, si bien en la mayoría de los casos la gammagrafía pulmonar infraestima el grado de obstrucción real del árbol vascular. La arteriografía pulmonar confirma definitivamente el diagnóstico, además de delimitar la extensión de la enfermedad y evaluar la accesibilidad quirúrgica de los trombos. Más recientemente la angioscopia y la tomografía helicoidal han sido utilizadas con éxito en la localización de trombos en el árbol pulmonar.
Tratamiento
Anticoagulación
Como es lógico, la anticoagulación oral crónica está indicada en la HP de origen tromboembólico.
Tromboendarterectomía pulmonar
Las indicaciones de la tromboendarterectomía pulmonar (TEDP) están en la actualidad bien definidas 10: a) existencia de un trombo obstructivo crónico en el árbol pulmonar quirúrgicamente accesible; b) ausencia de enfermedades asociadas graves, y c) resistencias vasculares pulmonares superiores a 300 dinas/s/cm 2.
La intervención se realiza mediante esternotomía media, en condiciones de hipotermia profunda y paradas circulatorias intermitentes con cardioplejía y enfriamiento del VD. La técnica quirúrgica comprende apertura de los vasos pulmonares y disección cuidadosa de la íntima arterial y el trombo adherido. Es imprescindible la monitorización hemodinámica y electroencefalográfica. La mortalidad operatoria se ha reducido de forma importante en los últimos años, situándose en la serie de la Universidad de San Diego en un 8,7% sobre un total de 150 intervenciones 11. Las complicaciones postoperatorias más frecuentes se relacionan con la necesidad de realizar parada circulatoria. Así, alrededor de un 10% de los pacientes desarrollan un estado confusional postoperatorio cuya aparición está claramente ligada al tiempo total de parada circulatoria, si bien en ningún caso aparecieron secuelas neurológicas permanentes en la serie anteriormente mencionada. El edema pulmonar por reperfusión es el problema postoperatorio más frecuente (dos tercios de los pacientes) y ocurre siempre en los segmentos endarterectomizados en las primeras 72 h tras la cirugía. Tras la intervención debe instaurarse tratamiento anticoagulante lo antes posible y mantenerlo de por vida; en algunos centros se administran prostaglandina E1 y corticoides de forma rutinaria en el postoperatorio 11.
La mejoría clínica tras la cirugía es generalmente espectacular, y muchos pacientes perciben un notable alivio de la disnea ya en los primeros días de la convalecencia. La cianosis y los signos de fracaso derecho desaparecen rápidamente. Se produce una normalización precoz de la geometría ventricular derecha en el ecocardiograma, así como de los parámetros hemodinámicos del cateterismo derecho. La gammagrafía pulmonar tras la cirugía se transforma en una «imagen en espejo» de la obtenida antes de la operación, con hiperperfusión de las áreas previamente hipoperfun-didas.
Vasodilatadores
Una minoría de pacientes con HTPC no puede tratarse quirúrgicamente debido a la localización distal de los trombos. En estos pacientes el tratamiento con prostaciclina intravenosa crónica produce una mejoría clínica y hemodinámica a largo plazo, aunque la experiencia actual está limitada a un pequeño número de pacientes.
TROMBOEMBOLISMO PULMONAR
INTRODUCCIîN
Según datos de los EE.UU. la incidencia de tromboembolismo venoso (trombosis venosa profunda [TVP] y tromboembolismo pulmonar [TEP]) es de 1/1.000/año. Extrapolando se puede concluir que más de 250.000 pacientes son ingresados anualmente en los EE.UU. por tromboembolismo venoso 12. Como la capacidad de diagnosticar los tromboembolismos venosos es limitada, se estima que la incidencia real es de más de 600.000 pacientes/año. La mortalidad a los 3 meses, según el International Cooperative Pulmonary Embolism Registry (2.454 pacientes), fue del 17,5%. En el Prospective Investigation of Pulmonary Embolism Diagnosis (PIOPED) la mortalidad global a los 3 meses, fue del 15%, pero sólo el 10% de fallecimientos a lo largo del primer año se atribuyeron al embolismo pulmonar 13. El 75-90% de los fallecimientos tienen lugar en las primeras horas de producirse el TEP. La causa de muerte en los 10-25% restantes probablemente sean los embolismos recurrentes que tienen lugar en las 2 semanas siguientes 14.
FISIOPATOLOGÍA
El TEP y la TVP deben considerarse parte de un mismo proceso fisiopatológico. El 90% de los TEP se originan en el sistema venoso de las extremidades inferiores. Otros orígenes posibles son la vena cava inferior, las cavidades cardíacas derechas, el sistema venoso pélvico profundo, las venas renales y las venas axilares 15. Los trombos distales de las extremidades inferiores (pantorrillas) son una causa infrecuente de embolismo clínicamente significativo y casi nunca producen un TEP mortal. Sin embargo, sin tratamiento, un 20-25% de estos trombos progresan hasta el sistema iliofemoral que constituye la fuente de émbolos más frecuente de los pacientes con TEP 15,16.
El espectro del embolismo pulmonar varía desde un embolismo clínicamente insignificante hasta un embolismo masivo con muerte súbita dependiendo del tamaño del émbolo y de la reserva cardiorrespiratoria del paciente 15. La circulación pulmonar tiene gran capacidad para reclutar vasos que se hallan poco perfundidos en respuesta a estímulos como el ejercicio. Este reclutamiento vascular pulmonar permite a la mayoría de los pacientes con TEP permanecer estables hemodinámicamente. Sin embargo, cuando tiene lugar un embolismo masivo, este reclutamiento no puede compensar por mucho tiempo la gran pérdida de vascularización pulmonar. Se produce, por tanto, un aumento repentino de las resistencias vasculares pulmonares que puede producir HP, disfunción del ventrículo derecho y disminución del GC. Cuando esto sucede se producen hipotensión, taquipnea, taquicardia y aumento de la presión venosa yugular. En pacientes con enfermedad pulmonar de base, incluso pequeños émbolos pueden producir HP grave e insuficiencia aguda del VD debido a la existencia de una limitada capacidad de reclutamiento vascular pulmonar.
En los pulmones, las consecuencias del TEP incluyen un aumento del espacio muerto alveolar, broncoconstricción, hiperventilación, atelectasias, infarto pulmonar e hipoxia:
1. Al obstruir un vaso pulmonar, disminuye el flujo sanguíneo a la región correspondiente, creando una zona de alta relación V/Q o espacio muerto alveolar. Esto produce hipocapnia que estimula la broncoconstricción aumentando la resistencia de la vía aérea.
2.La obstrucción arterial pulmonar y la liberación plaquetaria de agentes vasoactivos como la serotonina aumentan la resistencia vascular pulmonar.
3. Es frecuente que aparezca hiperventilación cuyo mecanismo no es bien conocido. Puede ser responsable en parte la estimulación de los receptores «J». También son frecuentes las atelectasias debido a que la ausencia de perfusión conlleva una depleción de surfactante que produce colapso alveolar.
4. Sólo un 10% de pacientes con TEP presentan infarto pulmonar ya que el tejido pulmonar recibe oxígeno de tres fuentes diferentes: las vías aéreas, la circulación pulmonar y la circulación bronquial.
5. Es frecuente la hipoxia en pacientes con TEP debido a:
a) Redistribución del flujo sanguíneo hacia zonas con relación V/Q normal creando zonas con baja relación V/Q.
b) Creación de áreas de cortocircuito pulmonar por atelectasias.
c) Cortocircuitos derecha-izquierda a través de foramen oval permeable si la presión de la cavidades derechas supera a la de las izquierdas.
d) Descenso del GC si se produce hipertensión pulmonar y fallo del VD por dilatación, disfunción e isquemia.
PRONÓSTICO
Según los datos del PIOPED 13, que siguió prospectivamente la evolución clínica de 399 pacientes durante un año, la mortalidad global del TEP fue del 23,8% siendo la intrahospitalaria del 9,5%. Sin embargo, sólo el 2,5% de los pacientes falleció directamente a causa del TEP. Los factores predictivos de mortalidad fueron edad superior a 60 años, antecedentes de insuficiencia cardíaca izquierda congestiva, enfermedad pulmonar crónica y cáncer. De los fallecidos a causa del TEP, el 90% presentó embolismos recurrentes y el 90% falleció en las primeras 2 semanas de su inclusión en el estudio. El porcentaje de recurrencia del TEP fue del 8,3% en un año. La mitad de las recurrencias ocurrieron durante la primera semana de inclusión 14.
El hallazgo de hipocinesia ventricular derecha en el ecocardiograma predice un pronóstico adverso, con una mortalidad entre 1,5 y tres veces mayor que la de los pacientes sin hipocinesia ventricular derecha 12.
FACTORES PREDISPONENTES
La predisposición genética sólo explica una quinta parte de los casos de TEP 12. El TEP en este grupo se debe a la deficiencia hereditaria de factores que inhiben o regulan los procesos de coagulación o fibrinólisis (tabla 7). Se caracterizan por antecedentes familiares de TEP, presentación a una edad más temprana y episodios repetidos de TEP. Otro grupo más amplio comprende a los pacientes con condiciones adquiridas favorecedoras de TEP (tabla 8). Los factores de riesgo más frecuentes para el TEP extraídos del estudio PIOPED 13 fueron: antecedentes de inmovilización, cirugía en los 3 meses previos, cáncer, tromboflebitis y traumatismo de extremidades inferiores. El tratamiento con anticonceptivos orales en mujeres no se asoció a un aumento en la frecuencia de TEP excepto en las mujeres que los tomaban y habían sido sometidas a una intervención quirúrgica en los 3 meses previos 13,17. Las mujeres de 50 años o menos tenían una incidencia menor de TEP que los varones de dicho grupo de edad; sin embargo esta diferencia desaparecía para los pacientes de más de 50 años de edad 17.
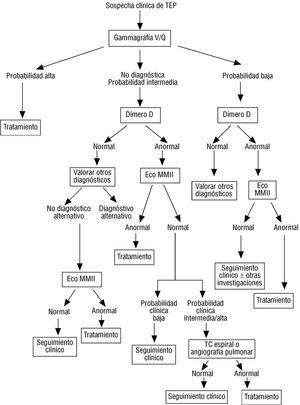
VALORACIÓN DIAGNÓSTICA (FIG. 2)
Fig. 2. Algoritmo diagnóstico del tromboembolismo pulmonar.
Manifestaciones clínicas
El diagnóstico de TEP es difícil y el diagnóstico diferencial es amplio, por lo que es frecuente tanto infradiagnosticarlo como sobrediagnosticarlo. La estrategia óptima es una aproximación diagnóstica que incluya una historia clínica metódica y una exploración física suplementadas por determinados tests cuando sea preciso.
Clínica
Los trombos pequeños producen manifestaciones pulmonares inespecíficas como dolor pleurítico, taquipnea, tos o hemoptisis. Émbolos mayores pueden producir hipoxia, fracaso hemodinámico y fallo del VD. La situación cardiovascular basal del paciente también condiciona las manifestaciones clínicas del TEP. Así, en un individuo con enfermedad pulmonar obstructiva crónica grave incluso pequeños émbolos pueden producir signos y síntomas significativos 18.
Síntomas y signos
Los síntomas más frecuentes en pacientes con TEP son disnea, dolor pleurítico, tos, aumento del diámetro del miembro inferior, dolor en un miembro inferior, hemoptisis y palpitaciones. Los signos más frecuentes son taquipnea, estertores, taquicardia, cuarto tono y refuerzo del componente pulmonar del segundo tono 18.
Gasometría arterial
El hallazgo de hipoxemia o hipocapnia puede incrementar la sospecha diagnóstica de TEP pero estos hallazgos no son específicos. Unos gases arteriales normales tampoco descartan la existencia de TEP. Sin embargo, diversos estudios han comprobado que el 95% de los pacientes con TEP tienen un gradiente alveoloarterial (A-a) de O 2 anormal; por tanto un gradiente A-a de O 2 normal hace poco probable el diagnóstico de TEP, aunque no lo excluye totalmente 12,18.
Radiografía de tórax
Los hallazgos más frecuentes en pacientes con TEP son atelectasias o anormalidades del parénquima pulmonar, derrame pleural, opacidad basal pleural (joroba de Hampton), elevación del hemidiafragma, disminución de la vascularización pulmonar, aumento del tamaño de la arteria pulmonar en el hilio y cardiomegalia. El signo de Westermark (hilio pulmonar prominente con disminución de los vasos pulmonares periféricos) es poco frecuente (en el 7% de los pacientes con TEP en el estudio PIOPED) 13,18.
Electrocardiograma
Las alteraciones más frecuentes en los pacientes con TEP son alteraciones inespecíficas del segmento ST y los cambios de la onda T, especialmente inversión de la onda T en V1-V4 (en el 49% de los pacientes del estudio PIOPED). Los signos de sobrecarga derecha (pulmonar, hipertrofia de ventrículo derecho, desviación del eje a la derecha o bloqueo de rama derecha) o la aparición de fibrilación auricular son poco frecuentes (un 6% en el estudio PIOPED) 12,13,18.
Exámenes complementarios
Sospecha clínica y gammagrafía de ventilación-perfusión
La gammagrafía de perfusión es el test de cribado más útil para descartar un TEP significativo. Si tanto la sospecha clínica como la gammagrafía indican que existe alta probabilidad de TEP, en el 96% de los pacientes éste será confirmado en la angiografía. Si tanto la sospecha clínica como la gammagrafía indican que existe baja probabilidad de TEP, el 96% de los pacientes no tendrán signos de TEP en la angiografía. Finalmente, cuando la gammagrafía es normal o casi normal, el riesgo de TEP es muy bajo a pesar de la sospecha clínica. En el estudio PIOPED sólo el 27% de los pacientes reunía una de estas tres condiciones, el resto precisaron más pruebas diagnósticas 13.
Dímeros D
El dímero D es un producto de degradación de la fibrina que puede estar elevado en situaciones como TEP, TVP, infarto de miocardio, coagulación intravascular diseminada, neumonía, insuficiencia cardíaca, neoplasia o pacientes sometidos a cirugía. Se define su determinación mediante ELISA como positiva cuando se alcanzan valores mayores de 500 mg/l. Según diversos estudios la sensibilidad y especificidad del dímero D son del 98-100% y del 35-39%, respectivamente, y los valores predictivos negativo y positivo del 98-100% y del 36-44%, respectivamente. Por tanto el dímero D es útil para descartar el TEP, pero no para confirmar su presencia. Dada su alta sensibilidad y valor predictivo negativo, algunos investigadores han sugerido que cuando los valores de dímero D sean inferior a 500 mg/l, sería innecesario realizar más pruebas diagnósticas, incluso cuando la gammagrafía de V-Q no fuera concluyente. No obstante, esta actitud se encuentra a la espera de futuras valoraciones prospectivas. Debido a su baja especificidad no puede ser utilizado para confirmar el diagnóstico de TEP 12,19-21.
Angiografía pulmonar
Sigue siendo el patrón oro para el diagnóstico del TEP, aunque un 3% de las realizadas en el estudio PIOPED fueron no diagnósticas y la autopsia reveló la existencia de TEP en el 1% de los pacientes en los que la angiografía se había interpretado como negativa. Un resultado negativo en la angiografía prácticamente excluye la posibilidad de TEP clínicamente significativo. Los porcentajes de muerte y complicaciones mayores asociadas con el procedimiento fueron del 0,5 y del 1%, respectivamente 22.
TAC espiral con contraste
Es una alternativa a la gammagrafía de ventilación-perfusión y a la angiografía. Menos del 10% de estudios no son concluyentes en comparación con más del 50% de las gammagrafías de V/Q. Comparada con la arteriografía, tiene una sensibilidad del 75-100% para detección de émbolos en grandes arterias y arterias segmentarias y una especificidad del 76-100%. Sin embargo, es incapaz de detectar émbolos en arterias subsegmentarias, por lo que si la sospecha clínica es alta y el resultado de la TAC es normal debe realizarse arteriografía dirigida a explorar el lecho vascular pulmonar distal. En pacientes con insuficiencia renal y alta probabilidad de TEP es preferible realizar directamente arteriografía evitando así la doble exposición a contraste 12,23.
Angiorresonancia con gadolinio
Es una técnica prometedora que permite ver la anatomía del árbol vascular pulmonar y objetivar la contractilidad de la pared del VD.
Eco-Doppler de miembros inferiores
Su exactitud es elevada en pacientes sintomáticos con sospecha de TVP, pero un resultado normal no excluye el EP si el nivel de sospecha es elevado. La tasa de detección de TVP por ultrasonidos en pacientes asintomáticos es muy baja y no hay estudios que recomienden su uso en estos pacientes 12.
Ecocardiograma
Su papel en el TEP no está definido. Puede ser útil para detectar la presencia de disfunción ventricular izquierda, hipertensión pulmonar, abombamiento del septo interauricular hacia la aurícula izquierda o la presencia de un trombo en las cavidades derechas. Aproximadamente un 40% de pacientes con EP tienen alteraciones en el ventrículo derecho en la ecocardiografía. También sirve para descartar otras patologías que pueden simular un EP como la disección aórtica o el taponamiento cardíaco 12.
TRATAMIENTO
El objetivo del tratamiento es evitar los embolismos recurrentes o la propagación del trombo. La recomendación de la última conferencia de consenso sobre terapia antitrombótica del American College of Chest Physicians (ACCP) 24 es administrar heparina no fraccionada (UFH) intravenosa durante 5 a 10 días. La heparina ha demostrado disminuir la mortalidad de los pacientes con TEP y las recurrencias no mortales. El fracaso en alcanzar precozmente un estado de anticoagulación (APTT > 1,5 veces el control en un día) se asocia con un aumento en el riesgo de embolismos recurrentes. La anticoagulación terapéutica puede alcanzarse más rápidamente ajustando la dosis de heparina en función del peso (80 U/kg en bolo seguidas de 18 U/kg/h sin exceder de 1.600 U/h). Los dicumarínicos pueden comenzar a administrarse al primer día de comenzar con la heparina para conseguir un INR de 2 a 3 debiendo mantenerse un mínimo de 3 meses 25. Se recomienda que se solape con la heparina durante 4-5 días por el teórico efecto procoagulante inicial de los anticoagulantes orales. La duración de la anticoagulación oral tras un primer episodio de TEP debe ser de al menos 3 meses (de 3 a 6 meses), ya que la resolución de la enfermedad tromboembólica es mayor y la tasa de recurrencia es menor en los pacientes tratados durante 3 meses que en los tratados durante 4-6 semanas. Algunos autores defienden la anticoagulación indefinida en pacientes con factores de riesgo permanentes o con múltiples episodios de tromboembolismos. Varios estudios han demostrado la eficacia y seguridad de la administración ambulatoria de la heparina de bajo peso molecular (HBPM) como alternativa a la administración de UFH durante ingreso hospitalario en el tratamiento de la TVP. Con respecto al TEP, los datos disponibles hasta ahora sugieren que la heparina de bajo peso molecular puede ser eficaz y segura en el tratamiento del TEP no masivo; sin embargo, estas conclusiones están limitadas por tratarse de estudios con muestras pequeñas e inadecuado seguimiento. Son necesarios estudios prospectivos aleatorios comparativos usando diferentes HBPM en diferentes poblaciones antes de que puedan considerarse una alternativa a la UFH en el tratamiento del TEP 26.
A pesar de numerosos ensayos, el papel de la trombólisis en el TEP agudo es aún controvertido. Varios estudios han demostrado que la trombólisis produce una mejora más rápida que la heparina sola hemodinámica, angiográfica, en la gammagrafía de V/Q, en las alteraciones ecocardiográficas y en la restauración de la microcirculación pulmonar debido a que acelera la resolución del trombo. Algunos de estos beneficios se mantienen durante el seguimiento a largo plazo. No obstante, no se ha demostrado que esto se traduzca en una reducción de la morbilidad y mortalidad ya que a las 24-72 h de iniciar la terapia no hay diferencias en el pronóstico de los pacientes tratados con trombólisis o heparina. El riesgo de hemorragia es mayor en los pacientes a los que se realiza una angiografía pulmonar para confirmar el TEP antes de la trombólisis; por este hecho y debido a que la administración intrapulmonar no ofrece ninguna ventaja sobre la intravenosa 27, se recomienda usar la trombólisis en función de los resultados de técnicas no invasivas y a través de una vía periférica 27-29. Algunos expertos recomiendan realizar trombólisis en todos los pacientes con TEP agudo 30; sin embargo, dado el alto riesgo de complicaciones hemorrágicas y el hecho de que aún no se haya demostrado que produzca un beneficio clínicamente significativo sobre la morbimortalidad, la mayoría de los investigadores limitan esta indicación a pacientes con TEP masivo, entendiendo por éste aquellos casos con inestabilidad hemodinámica, hipoxia grave, oclusión de la arteria pulmonar mayor del 40-50% u oclusión de dos o más arterias lobulares 31,32. Esta recomendación se basa en el hecho de que el TEP masivo tiene mayor tendencia a asociarse con inestabilidad hemodinámica, hipoxia y disfunción del VD y que la fibrinólisis parece mejorar agudamente dichos parámetros 33. La elección del agente trombolítico y la dosis óptima del mismo aún permanecen bajo controversia. Las dosis de los agentes trombolíticos más usados en el tratamiento del TEP aprobadas por la FDA se hallan resumidas en la tabla 10. Al finalizar la infusión del trombolítico debe determinarse el APTT cada 4 h hasta que descienda a valores por debajo de dos veces el control comenzando entonces la terapia con heparina con o sin el bolo inicial de 5.000 U seguido de una infusión continua. La dosis de heparina debe ajustarse para mantener un APTT entre 1,5 y 2,5 veces el control.
El papel exacto de la embolectomía percutánea o mediante cirugía abierta en el TEP agudo es controvertido. Tradicionalmente se había reservado para aquellos pacientes con TEP masivo que experimentaban deterioro hemodinámico a pesar de la trombólisis. Probablemente también represente un papel en aquellos pacientes en los que la trombólisis esté contraindicada. La mortalidad perioperatoria de la embolectomía en series no controladas es del 29-37%. Durante el tratamiento de estos pacientes críticos, suele requerirse noradrenalina o dobutamina para mantener la presión media de la arteria pulmonar y asegurar una adecuada perfusión de la arteria coronaria derecha 34,35.
El filtro en la vena cava inferior está indicado en aquellos pacientes con TEP o TVP en los que esté contraindicada la anticoagulación, en los que presentan TEP o TVP a pesar de estar adecuadamente anti-coagulados o en los que presentan una hemorragia activa. También se ha empleado en pacientes con TEP masivo en los que otro embolismo pulmonar podría ser fatal 36.
PREVENCIÓN
La incidencia de trombosis venosa profunda, embolismo de pulmón y muerte debida a éste puede reducirse significativamente sólo mediante la adopción de medidas profilácticas. Los pacientes que fallecen debido a TEP lo hacen en las primeras horas, por tanto, ninguna medida terapéutica puede tener un impacto comparable a la profilaxis. Es fundamental que todos los pacientes sean evaluados y estratificados de acuerdo con el riesgo de EP y que se instaure el régimen profiláctico adecuado (tablas 11 y 12). Las modalidades de que disponemos son las siguientes:
1. La primera medida a tener en cuenta es la movilización precoz del paciente encamado.
2.Compresión mecánica mediante dispositivos neumáticos o medias de compresión gradual que aumentan el flujo sanguíneo y la actividad fibrinolítica endógena al estimular el endotelio vascular.
3.Filtro de vena cava inferior. Bloquea la migración de los trombos originados en el sistema venoso profundo de los miembros inferiores, pero no evita su formación. No ha demostrado aumentar la supervivencia frente al tratamiento con heparina; además, en casos raros puede originar trombosis de la cava y edema masivo de miembros inferiores. No obstante, su uso es necesario en pacientes con contraindicación al tratamiento anticoagulante, embolismo recurrente a pesar de anticoagulación y pacientes de muy alto riesgo o en los que un segundo episodio podría ser fatal (HP grave crónica secundaria a EP, cirugía de fractura de cadera con EP reciente) 37.
4.Profilaxis farmacológica12,15.
a) Heparina no fraccionada subcutánea (UFH): se utiliza a dosis bajas fijas vía subcutánea como profilaxis. Las dosis habituales son 5.000 U cada 8-12 h. No requiere controles hematológicos, es económico y reduce significativamente la tasa de TVP y TEP incluyendo el TEP fatal. La dosis inicial se administra 2 h antes de la cirugía continuando después de ésta incluso ambulatoriamente. No aumenta la incidencia de he-morragias mayores, aunque sí la tasa de hematomas. Debe monitorizarse el plaquetócrito regularmente para detectar la rara pero importante trombocitopenia inducida por heparina.
b)Heparina de bajo peso molecular (HBPM): numerosos estudios aleatorios han demostrado que es tan eficaz o más que la heparina no fraccionada en la prevención de trombosis venosa con tasas bajas de hemorragia similares a los de la UFH. Ha reemplazado a esta última debido a su mayor biodisponibilidad y absorción y a la necesidad de un menor número de inyecciones y menor tasa de trombocitopenia inducida. Tres HBPM (enoxaparina, dalteparina y ardeparina) y un heparinoide (danaparoid) han sido aprobados por la FDA para indicaciones profilácticas específicas (tabla 12). Es habitual comenzar la profilaxis antes de la anestesia en los pacientes que van a ser sometidos a cirugía toracoabdominal. En Europa la profilaxis en la prótesis total de cadera o de rodilla se inicia la noche previa a la cirugía mientras que en los EE.UU. se inicia 12-24 h tras la cirugía. Con respecto a la duración de la profilaxis tras procedimientos de alto riesgo, diversos estudios apoyan la extensión del tratamiento hasta 28-35 días tras la cirugía por haberse comprobado la aparición de trombosis venosa en dichos días.
Bibliografía
[1]
Rubin L..
ACCP consensus statement: primary pulmonary hypertension..
Chest, (1987), 104 pp. 236-250
[2]
Executive Summary from the World Symposium on Primary Pulmonary Hypertension 1998. Evian, France, September 6-10 1998. Co-sponsored by The World Heart Organization.
[3]
Gaine SP, Rubin LJ..
Primary Pulmonary Hipertension..
Lancet, (1998), 352 pp. 719-725
[4]
Pulmonary hypertension. En: Braunwald E, editor. Heart disease (5.
[5]
Rubin LJ..
Primary pulmonary hypertension..
N Engl J Med, (1997), 336 pp. 111-117
[6]
Jeffrey D, Leah E, Berkeley M..
The registry of the International society For Heart and Lung Transplantation: Fourteenth Official Report-1997..
J Heart Lung Transplant, (1997), 16 pp. 691-712
[7]
Pulmonary embolism. En: Braunwald E, editor. Heart disease (5.
[8]
Moser KM, Auger WR, Fedullo PF..
Chronic mayor-vessel thromboembolic pulmonary hypertension..
Circulation, (1990), 81 pp. 1735-1743
[9]
The UKEP study..
Multicentre clinical trial on two local regimens of urokinase in massive pulmonary embolism. The UKEP study research group..
Eur Heart J, (1987), 8 pp. 2-10
[10]
Moser KM, Fedullo PF, Auger WR, Channick RW..
Criteria for pulmonary thromboendarterectomy..
Chest, (1995), 108 pp. 1767-1768
[11]
A multidisciplinary approach to chronic thromboembolic pulmonary hypertension. En: Braunwald E, Goldhauber SZ, editores. Atlas of heart diseases. Vol. III, Cardiopulmonary diseases and cardiac tumors. Filadelfia: Current Medicine, 1995; 71.
[12]
Goldhaber SZ..
Pulmonary embolism..
N Engl J Med, (1998), 339 pp. 93-104
[13]
PIOPED investigators..
Value of the ventilation/perfusion scan in acute pulmonary embolism: results of the Prospective Investigation of Pulmonary Embolism Diagnosis..
JAMA, (1990), 263 pp. 2753-2759
[14]
Carson JL, Kelley MA, Duff A, Weg JA, Fulkerson WJ, Palevsky HI et al..
The clinical course of pulmonary embolism..
N Engl J Med, (1992), 326 pp. 1240-1245
[15]
Baker WF Jr..
Diagnosis of deep venous thrombosis and pulmonary embolism..
Med Clin of North Am, (1998), 82 pp. 459-476
[16]
Kakkar VV, Howe CT, Flanc C, Clarke MB..
Natural history of postoperative deep vein thrombosis..
Lancet, (1969), 2 pp. 230-232
[17]
Quinn DA, Thompson BT, Terrin ML, Thrall JH, Athanasoulis CA, McKusick KA et al..
A prospective investigation of pulmonary embolism in women and men..
JAMA, (1992), 268 pp. 1689-1696
[18]
Stein PD, Terrin ML, Hales CA, Palevsky HI, Saltzman HA, Thompson BT et al..
Clinical, laboratory, roentgenographic and electrocardiographic findings in patients with acute pulmonary embolism and no pre-existing cardiac or pulmonary disease..
Chest, (1991), 100 pp. 598-603
[19]
Bounameaux H, De Moerloose P, Perrier A, Miron MJ..
D-dimer testing in suspected venous tromboembolism: an update..
QJM, (1997), 90 pp. 437-442
[20]
Bounameaux H, De Moerloose P, Perrier A, Reber G..
Plasma measurement of D-dimer as diagnostic aid in suspected venous tromboembolism: an overview..
Thromb Haemost, (1994), 71 pp. 1-6
[21]
Goldhaber SZ, Simons GR, Elliot CG, Haire WD, Toltzis R, Blacklow SC et al..
Quantitative plasma D-dimer levels among patients undergoing pulmonary angiography for suspected pulmonary embolism..
JAMA, (1993), 270 pp. 2819-2282
[22]
Stein PD, Athanasoulis C, Alavi A, Greenspan RH, Hales CA, Saltzman HA et al..
Complications and validity of pulmonary angiography in acute pulmonary embolism..
Circulation, (1992), 85 pp. 462-468
[23]
Hansell DM, Flower CD..
Imaging pulmonary embolism..
Br Med J, (1998), 316 pp. 490-491
[24]
Hyers TM, Hull RD, Weg JG..
Antithrombotic therapy for venous thromboembolic disease..
Chest, (1992), 102 pp. 408S-425S
[25]
Brandjes DP, Heijboer H, Buller HR, De Rijk M, Jagt H, Ten Cate JW..
Acenocumarol and heparin compared with acenocumarol alone in the initial treatment of proximal-vein thrombosis..
N Engl J Med, (1992), 327 pp. 1485-1489
[26]
Charland SL, Klinter DE..
Low-molecular-weight heparins in the treatment of pulmonary embolism..
Ann Pharmacother, (1998), 32 pp. 258-263
[27]
Verstraete M, Miller GA, Bounameaux H, Charbonier B, Colle JP, Lecorf G et al..
Intravenous and intrapulmonary recombinant tissue-type plasminogen activator in the treatment of acute massive pulmonary embolism..
Circulation, (1988), 77 pp. 353-359
[28]
Schwarz F, Stehr H, Zimmermann R, Manthey J, Kubler W..
Sustained improvement of pulmonary hemodynamics in patients at rest and during exercise after thrombolytic treatment of masive PE..
Circulation, (1985), 71 pp. 117-123
[29]
Kasper W, Konstantinides S, Geibel A, Olschewski M, Heinrich F, Grosser KD et al..
Management strategies and determinants of outcome in acute major pulmonary embolism: results of a multicenter registry..
J Am Coll Cardiol, (1997), 30 pp. 1165-1171
[30]
Goldhaber SZ, Haire WD, Feldstein ML, Miller M, Toltzis R, Smith JL et al..
Alteplase versus heparin in acute pulmonary embolism: randomised trial assesing right ventricular function and pulmonary perfusion..
Lancet, (1993), 341 pp. 507-511
[32]
Moser KM..
Venous thomboembolism..
Am Rev Respir Dis, (1990), 141 pp. 235-249
[33]
Daniels LB, Parker JA, Patel SR, Grodstein F, Goldhaber SZ..
Relation of duration of symptoms with response to thrombolytic therapy in pulmonary embolism..
Am J Cardiol, (1997), 80 pp. 184-188
[34]
Greenfield LJ, Proctor MC, Williams DM, Wakefield TW..
Long-term experience with transvenous catheter pulmonary embolectomy..
J Vasc Surg, (1993), 18 pp. 450-457
[35]
Gulba DC, Schmid C, Borst HG, Lichtlen P, Dietz R, Luft RC..
Medical compared with surgical treatment for massive pulmonary embolism..
Lancet, (1994), 343 pp. 576-577
[36]
Greenfield LJ, Peyton R, Crute S, Barnes R..
Greeenfield vena cava filter experience: late results in 156 patients..
Arch Surg, (1981), 1 pp. 1451-1456
[37]
Decousus H, Leizorovicz A, Parent F, Page Y, Tardy B, Girard P..
A clinical trial of vena cava filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis..
N Engl J Med, (1998), 338 pp. 409-415