Las arritmias son, sin duda, uno de los mayores problemas para el clínico a cargo de pacientes adultos con cardiopatías congénitas. Su protagonismo en el momento actual es incuestionable, pero a medida que los pacientes con cardiopatías reparadas en edad pediátrica envejezcan, es esperable que el impacto de las complicaciones arrítmicas aumente. Además, por diferentes motivos, las cardiopatías congénitas se apartan del manejo electrofisiológico habitual. En este capítulo nos disponemos a abordar de forma resumida las particularidades que las cardiopatías congénitas suponen para el especialista en arritmias, con un breve acercamiento a la terapia de resincronización cardiaca para el manejo de la insuficiencia cardiaca.
Palabras clave
Después de una infancia y una adolescencia de relativa estabilidad, la mayoría de los pacientes con cardiopatías congénitas (CC), especialmente aquellos con procesos más complejos, empiezan a desarrollar complicaciones tardías derivadas de la extensa cirugía a la que frecuentemente han sido sometidos y de las lesiones residuales subyacentes.
Las arritmias, tanto lentas como rápidas, son la principal fuente de morbilidad e ingreso hospitalario en estos pacientes1. Su papel en la muerte súbita, primera causa de mortalidad en muchas de estas cardiopatías, es indiscutible. Pero además pueden ser un factor desestabilizador de un frágil equilibrio hemodinámico de muchas otras y en ocasiones constituyen indicación de cirugía de lesiones residuales por considerar que anuncian el fin de un periodo de acomodación del corazón a éstas. Las complejas anatomías a las que frecuentemente nos enfrentamos suponen un auténtico reto tanto para el manejo farmacológico como, principalmente, para el abordaje invasivo por parte del electrofisiólogo.
Por otro lado, la insuficiencia cardiaca emerge como una entidad de impacto creciente y suele representar la recta final de un largo camino. En situaciones tan alejadas de las guías de práctica clínica como pueden ser los ventrículos derechos sistémicos o los ventrículos únicos, la utilidad del tratamiento farmacológico es limitada. Las nuevas técnicas de resincronización cardiaca son una opción esperanzadora también en este terreno.
El presente capítulo pretende ser un acercamiento al importante papel del electrofisiólogo en el manejo intervencionista de los pacientes con CC.
ABLACIÓNEl fracaso del tratamiento antiarrítmico en la prevención de recurrencias, al menos a largo plazo, así como sus potenciales efectos adversos, ha hecho que la ablación con catéter sea cada vez más utilizada para el tratamiento y el control de las arritmias en los pacientes con cardiopatías congénitas.
Todas las arritmias que observamos en la población normal pueden darse en los pacientes con CC. Algunas se asocian de forma específica a determinadas anomalías congénitas como, por ejemplo, las vías accesorias en la anomalía de Ebstein. Sin embargo, lo más frecuente es que estos pacientes presenten arritmias adquiridas, raramente presentes en la población normal, que se deben a un sustrato arritmogénico complejo en el que se engloban: a) secuelas debidas a la propia cardiopatía congénita, como dilatación, hipertrofia o áreas de fibrosis causadas por la sobrecarga hemodinámica o la cianosis, y b) secuelas derivadas de la cirugía reparadora, como cicatrices de atriotomía o ventriculotomía, parches o derivaciones anatómicas, que pueden actuar como barreras de conducción facilitando el desarrollo de arritmias, generalmente por mecanismo de reentrada.
En los pacientes con CC, se ha empleado la ablación con catéter con éxito en la mayoría de las taquicardias. Sin embargo, las características únicas de estos pacientes confieren una mayor complejidad al procedimiento. Uno de los desafíos más importantes es la distorsión anatómica que puede dificultar enormemente la comprensión de la anatomía y la manipulación de los catéteres. Por ello, antes del procedimiento, es fundamental conocer en detalle la cardiopatía de base, así como la corrección o las correcciones quirúrgicas realizadas. Aun así, en el curso del procedimiento se pueden plantear situaciones que constituyen verdaderos retos, como la dificultad en el acceso venoso, que puede estar deteriorado por el antecedente de múltiples procedimientos previos; la imposibilidad de acceso a determinadas zonas del corazón debido a la presencia de parches o a la obstrucción de derivaciones, como en pacientes con cirugía de Fontan o en la corrección mediante técnicas de Senning o Mustard en la transposición de grandes vasos; la imposibilidad de acceso al sustrato arritmogénico si éste queda englobado debajo de un parche o de material protésico; la dificultad para localizar determinadas estructuras anatómicas como, por ejemplo, el anillo tricuspídeo en pacientes con anomalía de Ebstein y vías accesorias derechas, o el propio sistema de conducción, que en determinadas cardiopatías puede estar desplazado de su posición habitual, lo que facilita la posibilidad de lesionarlo durante la ablación, y la dificultad para crear lesiones transmurales, en cavidades generalmente dilatadas y con bajo flujo, lo que limita el contacto del catéter y la aplicación de suficiente cantidad de energía.
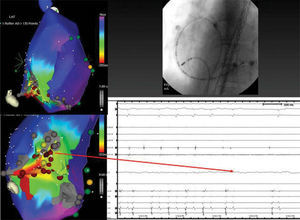
Sin embargo, los avances tecnológicos acontecidos en los últimos años han facilitado el abordaje de sustratos arritmogénicos cada vez más complejos, mejorando el éxito del procedimiento2. Entre estos avances, mención especial merece el desarrollo de los sistemas de navegación, que permiten la reconstrucción tridimensional de la cavidad de interés y la creación de mapas de voltaje, activación y propagación, y facilitan la comprensión del mecanismo electrofisiológico de la arritmia y su relación con el sustrato anatómico (fig. 1). Además, la posibilidad de integración de técnicas de imagen, como la resonancia o la tomografía, con los sistemas de navegación ha contribuido a una mejor definición de la compleja anatomía de estos pacientes, que facilita la realización del procedimiento. Otro avance importante en la electrofisiología ha sido el desarrollo de catéteres de ablación que permiten crear lesiones más profundas. No es infrecuente que la cavidad sobre la que asienta el sustrato arritmogénico sea una cámara dilatada y con bajo flujo, lo que limita la potencia durante la aplicación de radiofrecuencia. Y por otro lado, es frecuente que estos pacientes presenten cierto grado de hipertrofia o engrosamiento del tejido auricular o ventricular. Con el desarrollo de los catéteres de punta irrigada, es posible aplicar mayor potencia debido a la refrigeración de la punta del catéter y conseguir mayor profundidad de la lesión. Por otro lado, el desarrollo de nuevas fuentes de energía, como la crioablación, puede contribuir a minimizar el riesgo de lesión sobre el tejido de conducción en estos pacientes.
Mapa de activación durante una taquicardia por reentrada intraauricular (TRIA) en paciente con cardiopatía congénita tipo cor triatriatum. La secuencia de activación muestra TRIA sobre la cicatriz de atriotomía lateral. La flecha marca el punto en el que la aplicación de radiofrecuencia interrumpe el flutter. En fluoroscopia se observa la posición del catéter durante la aplicación efectiva en proyección oblicua anterior izquierda.
También conocida como flutter auricular atípico, taquicardia auricular incisional o taquicardia auricular macrorreentrante, la taquicardia por reentrada intraauricular (TRIA) ha sido descrita como una complicación a largo plazo de prácticamente cualquier tipo de cirugía cardiaca. Sin embargo, la combinación de ciertas cardiopatías congénitas y reparaciones quirúrgicas específicas se asocia a una mayor incidencia de TRIA. Éstas incluyen las cirugías que requieren una mayor manipulación de la aurícula, como la reparación de la comunicación interauricular, los procedimientos de Mustard y Senning en la transposición de grandes arterias o la cirugía de Fontan. Diversos estudios han identificado como factores de riesgo para el desarrollo de TRIA la reparación quirúrgica a una edad más avanzada y un mayor tiempo de seguimiento.
Identificar la localización del circuito es el objetivo fundamental del procedimiento de ablación. Según diversos trabajos, la localización más frecuente del circuito de reentrada se halla a nivel del istmo cavotricuspídeo3,4, seguido de la cicatriz de atriotomía en la pared lateral de la aurícula derecha5. Estas localizaciones, fácilmente accesibles en corazones normales, pueden ser imposibles de abordar cuando la anatomía está más distorsionada. Tal es el caso de pacientes con cirugía de Senning o Mustard en los que, a pesar de que el istmo cavotricuspídeo se ha dentificado como la zona de conducción lenta del circuito, en ocasiones parte de este istmo crítico puede quedar en la circulación sistémica y hay que acceder a él de forma retrógrada o a través de una punción en las neoaurículas. Los casos más complejos son los observados tras cirugía de Fontan, donde se pueden encontrar múltiples circuitos en relación con atriotomía, parches, suturas, etc.
La utilización de los sistemas de navegación y catéteres de punta irrigada ha mejorado la tasa de éxito en la ablación de la TRIA, hasta cifras cercanas al 90%2. A pesar de ello, la tasa de recurrencias es aún elevada: el 20% en 3 años. Los pacientes con cirugía de Fontan son los que presentan una tasa de recidiva más alta (40%). Ello se debe a la complejidad para entender determinados circuitos, la imposibilidad de crear lesiones adecuadas en determinados tejidos con importante fibrosis o engrosamiento y la dificultad para validar el bloqueo completo de la conducción en las líneas de ablación. No obstante y a pesar de las recurrencias, el seguimiento de estos pacientes tras la ablación ha demostrado un mejor control de los síntomas y mejora de la calidad de vida6.
Ablación de vías accesoriasLa experiencia en la ablación de vías accesorias en pacientes con CC proviene principalmente de pacientes con anomalía de Ebstein en los que, además, no es infrecuente encontrar múltiples vías7. La mayor dificultad en la ablación de estas vías accesorias radica en la correcta localización del anillo auriculoventricular y en lograr un buen contacto del catéter con el tejido. Para la localización del anillo se ha empleado la angiografía de la arteria coronaria derecha o la introducción, dentro de la arteria, de catéteres multipolares de calibre muy fino para la cortografía eléctrica. Por otro lado, en pacientes con importante dilatación de cavidades, la estabilización del catéter para la ablación de vías localizadas a nivel de la pared libre del anillo tricuspídeo suele ser muy difícil, incluso con la ayuda de introductores largos. Todo ello limita la eficacia del procedimiento a tasas de éxito de alrededor del 85% y recidivas de la conducción por la vía hasta en un 25%. Una de las complicaciones más temidas en estos procedimientos es la posibilidad de lesionar la arteria coronaria derecha como consecuencia de la aplicación de radiofrecuencia en un anillo anormalmente más delgado. Otras CC en las que se ha observado un aumento de la incidencia de vías accesorias son la comunicación interauricular, la L-transposición de grandes arterias o la heterotaxia con ventrículo único, cardiopatías complejas en las que es imprescindible una buena definición de la anatomía auricular, el anillo auriculoventricular, el seno coronario y la localización del sistema de conducción, que con frecuencia está desplazado de su posición habitual. La tasa de éxito en estos pacientes se sitúa alrededor del 80% y parte de los fracasos en la ablación son debidos a la proximidad de la localización de la vía con el tejido de conducción y el consiguiente riesgo de bloqueo auriculoventricular (BAV). Actualmente, el margen de seguridad que proporciona la crioablación en estos casos puede ayudar a mejorar el éxito del procedimiento8.
Arritmias ventricularesLa incidencia de taquicardia ventricular (TV) monomórfica en los pacientes con CC es claramente inferior a la de la TRIA; sin embargo, la TV puede ser un precursor de muerte súbita en estos pacientes. El mecanismo que interviene en la TV parece ser igualmente la reentrada sobre un sustrato arritmogénico formado por barreras anatómicas y zonas de cicatriz como consecuencia de la reparación quirúrgica. La mayoría de las publicaciones sobre la ablación de TV son casos aislados o pequeñas series de casos. Las dos únicas series publicadas hasta la actualidad han mostrado que la CC con mayor incidencia de TV es la tetralogía de Fallot seguida de la comunicación interventricular9,10. No obstante, otras cardiopatías congénitas que se asocian con TV son la estenosis aórtica, la transposición de grandes vasos, algunas formas de ventrículo único y la anomalía de Ebstein. Las técnicas descritas para la ablación de la TRIA han sido aplicadas en la ablación de la TV con tasas de éxito cercanas al 90%. Una vez más, la dificultad en la creación de la lesión sobre una zona del ventrículo engrosada, como es el caso de la tetralogía de Fallot, podría explicar el 20% de la tasa de recurrencias descrito en estas series. La cuestión aún por resolver en el manejo de estos pacientes es, puesto que la TV puede ser marcador de muerte súbita, si la ablación puede utilizarse como terapia única o como terapia adyuvante a la implantación de un desfibrilador automático11.
MARCAPASOSLos pacientes con CC presentan una anatomía compleja y cirugías de reconstrucción que pueden afectar al desarrollo, la función o la irrigación del nodo sinusal, del nodo auriculoventricular o del tejido de conducción, por lo que no es infrecuente que requieran la implantación de marcapasos. Las causas más frecuentes de implantación de marcapasos en esta población son la disfunción sinusal, el síndrome bradicardia-taquicardia y el bloqueo avanzado12 (tabla 1).
indicaciones para implantación de marcapasos en niños, adolescentes y pacientes con cardiopatías congénitas12
|
BAV: bloqueo auriculoventricular; FC: frecuencia cardiaca; MCP: marcapasos.
La disfunción sinusal es una manifestación inherente a algunas cardiopatías congénitas (heterotaxia, malformaciones de la unión vena cava-aurícula derecha) y se presenta también en pacientes sometidos a cirugías de reparación auricular (tipo Mustard, Senning, Glenn o Fontan13,14). El marcapasos, en los pacientes con síndrome de bradicardia-taquicardia, corrige las bradicardias sintomáticas, permite el uso de fármacos antiarrítmicos y puede tratar la taquicardia con algoritmos de estimulación. Además, según algunos estudios, la estimulación auricular reduce la incidencia de taquicardias auriculares1. Las alteraciones en el sistema de conducción pueden ser tanto congénitas (por alteraciones de la anatomía, la localización o la función, en que los ejemplos más frecuentes son la transposición congénitamente corregida de grandes vasos o los defectos de cojinetes endocárdicos) como por cirugías o procedimientos intervencionistas1,13,15 sobre la región del nodo auriculoventricular (defectos septales, canal auriculoventricular o valvulopatías) que evolucionan al BAV completo.
Problemas de acceso-navegación-avanceimplante del electrodoSe han descrito dificultades debidas a: a) la edad y la superficie corporal de los pacientes; b) las malformaciones venosas; c) las cirugías previas que dificultan el acceso, y d) los problemas para localizar un adecuado punto de fijación.
Como en todos los implantes, pero especialmente en los pacientes con CC, la planificación del acceso y el abordaje son fundamentales. Se debe recopilar toda la información previa disponible (notas quirúrgicas o pruebas de imagen), y realizar, en ocasiones, una inyección de contraste en la vena anterocubital homolateral al implante para valorar anomalías del sistema venoso y oclusiones (presentes en el 9 y el 25%, respectivamente1,15).
Las variaciones anatómicas y las correcciones quirúrgicas suponen un reto para avanzar los electrodos y acceder hasta la cavidad destino. Así, la implantación transvenosa habitual puede ser imposible (exclusión de cámaras como en Fontan), muy dificultosa (malformaciones venosas, neoaurículas) o asociada a un riesgo embolígeno elevado (persistencia de shunts intracardiacos). Se ha cifrado el riesgo de eventos embólicos paradójicos en pacientes con shunts en un 2% de los implantes transvenosos y en un 0,5% de los epicárdicos16. Por ello, se debe plantear el abordaje epicárdico o el cierre del shunt antes del implante. El abordaje epicárdico disminuye el riesgo embolígeno; sin embargo, requiere una instrumentación quirúrgica más compleja y presenta mayor tasa de complicaciones y de disfunción del electrodo, pero en los pacientes con riesgo elevado de disfunción o BAV sometidos a cirugía por otro motivo se pueden colocar los electrodos epicárdicos para evitar cirugías en el futuro. Por último, para el implante definitivo del electrodo se debe tener en cuenta la presencia de cicatrices, parches sintéticos, resección de localizaciones habituales y lugares donde existe captura diafragmática o elevado riesgo embólico.
Las CC se consideran un factor de riesgo para la disfunción del electrodo, pero probablemente el mayor número de implantes epicárdicos actúa como un factor de confusión en esta relación1.
Extracción de electrodosEn los últimos años, se han potenciado las técnicas de reparación, desobstrucción o extracción de electrodos en este grupo debido a la mayor incidencia de disfunción (mayor número de implantes epicárdicos), al crecimiento de los pacientes (que eran más jóvenes en el momento del implante y presentan electrodos más anticuados en el momento de la extracción) y a las particularidades de la anatomía con resultados exitosos (91%) y complicaciones (6%) similares a las de los pacientes sin cardiopatías congénitas1,13,15.
TERAPIA DE RESINCRONIZACIÓN CARDIACALa terapia de resincronización cardiaca (TRC) es una opción terapéutica empleada de forma habitual en adultos con insuficiencia cardiaca izquierda, secundaria a miocardiopatía dilatada idiopática o cardiopatía isquémica, en presencia de asincronía electromecánica. En dichos pacientes, no sólo se ha demostrado una mejora en los parámetros hemodinámicos y clase funcional, sino también, en algunos casos, un remodelado inverso del ventrículo izquierdo17. La existencia de mecanismos fisiopatológicos comunes (intolerancia al ejercicio, cambios neurohormonales, alteraciones electromecánicas) hace pensar que dicho tratamiento puede extrapolarse a la insuficiencia cardiaca en las CC. Sin embargo, la experiencia en este contexto es escasa y se limita a pequeñas series de casos, con frecuencia retrospectivas y con factores de confusión, como la cirugía concomitante. Por otro lado, la heterogeneidad de sustratos, con formas únicas de asincronía, dificulta la selección de los pacientes, las técnicas de implante y la optimización de los parámetros de estimulación.
La TRC ha demostrado una mayor efectividad, incluso se ha logrado un remodelado inverso completo, en los pacientes con estimulación cardiaca permanente del ventrículo derecho y disfunción del ventrículo izquierdo sistémico. La TRC temporal también parece un tratamiento eficaz de la insuficiencia cardiaca aguda en el postoperatorio de la cirugía cardiaca congénita18,19, ya que mejora de forma temporal los parámetros hemodinámicos hasta la recuperación espontánea de la función sistólica. Se ha aplicado fundamentalmente en pacientes con disfunción de un ventrículo derecho subpulmonar, mediante la estimulación desde uno o más puntos de la pared libre del ventrículo derecho, con el objetivo de reducir el bloqueo de rama derecha, o en pacientes con un ventrículo único con implante de tres electrodos en posiciones alejadas del miocardio ventricular. La identificación de los pacientes con asincronía ventricular y una estrecha colaboración con el cirujano, con el fin de lograr un correcto posicionamiento de los electrodos, son aspectos fundamentales para el éxito del tratamiento en este contexto.
En los demás sustratos la evidencia es menos contundente, aunque prometedora. En pacientes con disfunción de un ventrículo derecho subpulmonar, se ha observado acortamiento del intervalo QRS y mejora del índice cardiaco y la función sistólica durante la estimulación temporal desde diferentes puntos del ventrículo derecho20. Sin embargo, no hay datos concluyentes sobre la utilidad de la TRC permanente en estos casos. En la disfunción del ventrículo derecho en posición sistémica, la TRC también ha demostrado acortar la duración del QRS y mejorar la función ventricular21, aunque en menor medida que en el ventrículo estructuralmente izquierdo. Esto apunta a la influencia de factores fisiopatológicos adicionales, sobre los que no actúa la TRC, en la disfunción miocárdica de este grupo de pacientes, si bien podría ser de ayuda en combinación con otros tratamientos como la cirugía de la insuficiencia tricuspídea. Por último, en pacientes con ventrículo único, no se ha objetivado una significativa repercusión en la fracción de eyección, a pesar de acortar la duración del QRS21.
DESFIBRILADOR AUTOMÁTICO IMPLANTABLELa mayoría de los pacientes con CC que llegan a la edad adulta tienen, como grupo, menos supervivencia total que la población general de la misma edad22. La muerte súbita es una de las causas más frecuentes de atrición en las CC en general y en determinados grupos en particular. Dada su prevalencia en las unidades de CC del adulto, la tetralogía de Fallot reparada es la entidad que más se ha estudiado en este sentido. En este grupo de pacientes la tasa de mortalidad en diferentes series es aproximadamente de un 2,5% por cada década a lo largo del seguimiento23,24.
Por una parte, no hay ninguna duda de que los pacientes con tetralogía de Fallot y que han presentado un episodio de arritmia ventricular maligna o muerte súbita recuperada deben recibir un desfibrilador automático implantable (DAI) como prevención secundaria, por lo general independientemente de que se realicen otras medidas terapéuticas.
El problema en el momento actual está en la decisión de implantar un DAI a los pacientes que no han presentado eventos previos, es decir, como prevención primaria. En primer lugar, cabe decir que, a diferencia de la cardiopatía isquémica o la cardiopatía dilatada, no hay datos de estudios prospectivos y controlados que permitan dar una respuesta a esta pregunta desde la medicina basada en la evidencia. En realidad, debe destacarse que esta población tiene algunas características que la hacen diferente de los pacientes con cardiopatía isquémica o dilatada, e incluso con miocardiopatía hipertrófica o miocardiopatía arritmogénica del ventrículo derecho. La primera es que, aunque estos pacientes tienen una tasa de mortalidad mayor que la que les correspondería por la edad, y además por el hecho de tratarse de pacientes jóvenes, esta mortalidad tiene un especial impacto clínico; desde el punto de vista cuantitativo, dicha tasa es mucho más baja que la que presentan los pacientes con otros tipos de cardiopatía. Diversos autores han analizado cuáles son las variables clínicas que permitan identificar a los pacientes con mayor riesgo de muerte súbita. Parece bastante claro que, cuanto mayor es la edad en el momento de la primera cirugía reparadora, mayor es la mortalidad en el seguimiento23,25. Asimismo, los parámetros electrocardiográficos, como la anchura del QRS23, o hemodinámicos, como la severidad de la insuficiencia pulmonar y la disfunción ventricular derecha, que indican una mayor sobrecarga de ventrículo derecho se asocian también a una mayor mortalidad23,24.
En cuanto a los marcadores eléctricos, se ha propuesto que los episodios de taquicardia ventricular no sostenida en el registro Holter podrían ser marcadores de mayor mortalidad al seguimiento. Especial interés se ha tenido en analizar el papel de la estimulación ventricular programada para predecir eventos en el seguimiento. Los datos de la literatura son algo contradictorios ya que, mientras que algunos grupos hallan que la inducción de arritmias ventriculares en el estudio electrofisiológico identifica a un grupo de pacientes en mayor riesgo26, otros grupos27, incluida nuestra propia experiencia, no hallan correlación entre la inducción de taquicardia ventricular y la presencia de eventos arrítmicos en el seguimiento. Así pues, en el momento actual no tenemos marcadores fiables y contrastados que nos permitan identificar de manera inequívoca qué pacientes se podrían beneficiar de la implantación de un DAI como prevención primaria.
Por otra parte, la implantación y el seguimiento de los DAI en este tipo de pacientes son distintos en los pacientes con otras cardiopatías. En primer lugar, diversos estudios han mostrado que la tasa de terapias apropiadas es más baja que la de los pacientes con otras cardiopatías28. Otro dato que se debe tener en consideración cuando se plantea la indicación de implantar un DAI en estos pacientes es que esta población tiene una mayor tasa de complicaciones, tanto en el implante como en el seguimiento, así como una mayor incidencia de descargas inapropiadas, en comparación con otros tipos de cardiopatía28,29. Ello se debe, probablemente, a las características especiales de esta población. Por un lado, pueden tener más problema de accesos venosos, mientras que, por otra parte, dado que se trata de una población más joven y con más actividad física, tienen una mayor probabilidad de dislocación o fractura del electrodo. Asimismo, por el mismo hecho de que realizan más actividad física y, además, porque, debido a su cardiopatía, tienen una mayor probabilidad de presentar arritmias supraventriculares paroxísticas, tienen también una mayor tasa de terapias inapropiadas que los pacientes con cardiopatía isquémica o dilatada.
Todo ello ha llevado a que, en el momento actual, en las guías de recomendaciones de prevención de muerte súbita, sólo se considere como indicación establecida de clase I de DAI a los pacientes que han presentado un episodio de muerte súbita recuperada o taquicardia ventricular sostenida12,30, mientras que se considera indicación de clase II a aquellos que han presentado un episodio sincopal de causa desconocida30. En este contexto, en los pacientes sin ninguna de estas condiciones, y en espera de nuevos datos que nos permitan contestar a estas preguntas, la decisión debe ser individualizada.
CONCLUSIONESLas arritmias en los adultos con cardiopatías congénitas aparecen como un campo emergente en el mundo de la electrofisiología. La excepcionalidad y la complejidad de la anatomía subyacente, entre otras consideraciones, las convierten en un reto para el experto en arritmias, que requiere de una formación específica para su manejo. Quedan, como en toda disciplina emergente, múltiples incógnitas por resolver que la hacen, si cabe, todavía más apasionante.