Dos grandes grupos de cardiopatías congénitas se presentan al cardiólogo intervencionista: simples, que incluyen comunicación interauricular, estenosis pulmonar, ductus persistente, comunicación interventricular, estenosis aórtica, etc., y complejas, generalmente consecuencia de operaciones paliativas o correctoras en la edad pediátrica (estenosis de ramas pulmonares, obstrucciones de conductos protésicos, dehiscencias de cierres previos, neoformaciones venosas o arteriales). En ambos grupos, la cirugía es eficaz, aunque con morbimortalidad e incomodidad para el paciente, a veces operado varias veces y pendiente de más cirugías futuras. El cateterismo terapéutico en este creciente grupo de pacientes aporta soluciones que evitan un procedimiento quirúrgico. El cierre de la comunicación interauricular, ductus persistente y malformaciones venosas o arteriales evita por completo la cirugía. En otras enfermedades, como la coartación de aorta y la estenosis aórtica, retrasan la cirugía o resuelven sus complicaciones. Los stents en ramas pulmonares permiten tratar lesiones casi inaccesibles al cirujano. Múltiples dehiscencias se ocluyen con prótesis o dispositivos. La ecocardiografía, la resonancia magnética y la tomografía computarizada son herramientas imprescindibles.
Palabras clave
Hay un número creciente de cardiopatías congénitas (CC), susceptibles de tratamiento percutáneo, que pueden dividirse en dos grupos bien diferenciados (tabla 1). El cateterismo terapéutico permite tratar con éxito y escasa morbilidad muchas de estas lesiones, y evitar así los riesgos e inconvenientes de la cirugía convencional.
Cardiopatías congénitas susceptibles de tratamiento percutáneo
|
El primer grupo (nativas) es más sencillo de diagnosticar y tratar. Hay criterios definidos de indicación de intervención1–3 y material específico para ello. El segundo grupo (lesiones residuales) es mucho más amplio y obliga a tener en cuenta una serie de datos previos, no siempre aportados por el paciente, como: diagnóstico inicial, fecha y variedad de intervención quirúrgica efectuada, tipo de material protésico implantado, prótesis insertada, dispositivo intravascular empleado, etc., es decir, todas las acciones que se hayan empleado en modificar la anatomía lesional original. El apoyo en las técnicas de imagen actuales es de gran importancia para preparar la estrategia terapéutica adecuada. Detallaremos en este capítulo las indicaciones, los aspectos técnicos y los resultados en cada enfermedad.
GeneralidadesEl cateterismo terapéutico en las cardiopatías congénitas abarca un amplio y variado espectro de técnicas, sin las cuales es difícil alcanzar la eficacia terapéutica. Es muy diferente de la práctica habitual del intervencionismo en la cardiopatía isquémica y precisa de unos recursos especiales en cuanto a sala, stock de material, entrenamiento continuo e interrelación con técnicas de imagen, incluidos ecocardiogramas intravascular e intracardiaco, visualización en sala de la resonancia magnética (RM) o la tomografía computarizada (TC) multicorte, etc. En nuestra unidad médico-quirúrgica de cardiología pediátrica, con 32 años de experiencia de cateterismo en cardiopatías congénitas diversas y en pacientes de todas las edades, hemos realizado más de 2.250 intervencionismos en cardiopatías congénitas, de los cuales 240 han sido en adultos mayores de 18 años.
Se requiere entrenamiento en múltiples técnicas que se desarrollarán en este capítulo. Para efectuar este tipo de tratamientos es imprescindible un laboratorio de cateterismo terapéutico, con sala de rayos X digital, idealmente biplana con monitorización completa, que incluya medidores de coagulación —tiempo de cefalina (TCA)— y sistemas de reanimación avanzados, ubicada en un hospital terciario, con cirugía torácica, cardiaca y vascular y unidad coronaria y de cuidados intensivos. El stock de productos debe ser amplio, ágil y versátil, que incluya múltiples tamaños de dispositivos, prótesis o stent recubiertos de politetrafluoroetileno (PTFE) y gran variedad de balones y catéteres diagnósticos y terapéuticos. En la actualidad, hay programas de entrenamiento en la disciplina, que exigen el conocimiento amplio de las cardiopatías congénitas desde la infancia hasta la edad adulta.
CIERRE DE LA COMUNICACIÓN INTERAURICULARLa comunicación interauricular (CIA) es la cardiopatía más frecuentemente hallada en el adulto, dada su óptima tolerancia clínica hasta la segunda o la tercera década de la vida y la primera en requerir tratamiento. Este orificio tiene distintas localizaciones anatómicas. Únicamente las situadas en la región de la fosa oval, aproximadamente el 70% de ellas, son susceptibles de cierre percutáneo. Para valorar la indicación de cierre, se debe tener en cuenta la repercusión clínica, el tamaño del defecto y la localización anatómica.
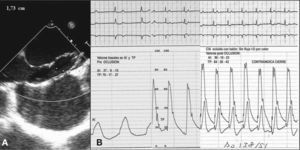
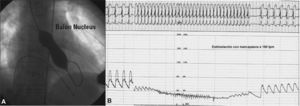
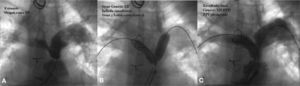
Indicamos el cierre en pacientes sintomáticos con o sin arritmias auriculares, con defectos menores de 36mm de diámetro, únicos o múltiples, con cortocircuito izquierda-derecha (I-D) significativo (sobrecarga de volumen del ventrículo derecho [VD] y movimiento paradójico del septum interauricular [SIA], indicativo de Qp/Qs > 1,5), con bordes mayores de 5-7mm, al menos en tres lugares diferentes del SIA y con longitud suficiente del septum para alojar el dispositivo elegido. También está indicado el cierre en defectos de menor tamaño, con riesgo de embolia paradójica: buceadores, escaladores, tromboflebitis frecuente, etc. Contraindican el cierre la hipertensión arterial pulmonar fija, la ausencia de bordes superior, inferior o ambos, la ausencia de borde en el seno coronario, la desproporción entre el tamaño auricular y el dispositivo a emplear y la CIA pequeña en asociación con disfunción del ventrículo izquierdo (VI) o estenosis mitral moderada. Algunas de estas entidades serán desestimadas mediante el test de oclusión con balón (fig. 1).
A: Balón que ocluye una comunicación interauricular (CIA). Las marcas indican el diámetro del defecto, ocluido por Doppler color stop flow. B: presiones en la aurícula izquierda y la arteria pulmonar, antes y durante la oclusión de la CIA. Paciente con disfunción de prótesis biológica mitral y del ventrículo izquierdo. Contraindica el cierre del defecto.
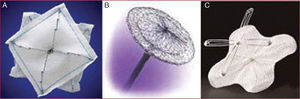
El tratamiento quirúrgico, ya sea con sutura continua o parche de dacrón, permite dejar el SIA con un espesor y una movilidad similares a los normales4. Los dispositivos de cierre percutáneo, no se anclan con puntos, son más gruesos y rígidos y a veces les exigimos que se adapten a formas de CIA muy diferentes (fig. 2). Precisan de bordes consistentes para anclarse, alrededor de la mayor parte del orificio. Estas particularidades hacen comprensible la dificultad de cierre de algunas CIA y el continuo esfuerzo investigador para conseguir mejores dispositivos. Desde el primer cierre percutáneo, se han utilizado múltiples dispositivos, pero con la incorporación del Amplatzer (Amplatzer Septal Occluder, AGA Medical Corporation®)5, se ha estandarizado la técnica de cierre percutáneo y hay numerosas series de pacientes tratados, con excelentes resultados, y cerca de 200.000 dispositivos implantados.
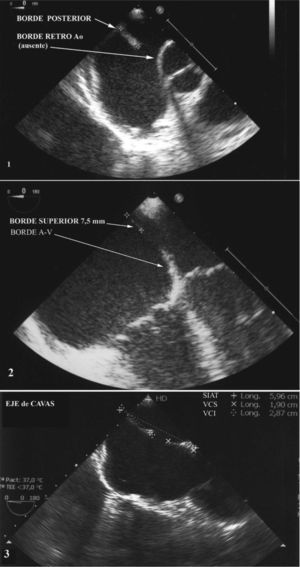
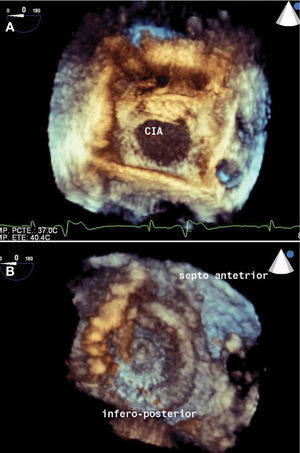
No todas pueden cerrarse por vía percutánea, sólo el 9,8% son centrales y en el 53% falta el borde anterosuperior. El 9,9% son aneurismáticas y el 7,3%, múltiples. Se denominan complejas aquellas con diámetro de oclusión > 26mm, bordes menores de 4mm en varios lugares, dobles, aneurismáticas o multiperforadas, debido a su mayor exigencia técnica en el momento del implante. Cada forma anatómica precisará de un dispositivo específico. El análisis de la anatomía del SIA por medio de eco-2D y 3D, transtorácico (TT) o transesofágico (TE), es imprescindible antes y durante el procedimiento6. Con la ecocardiografía, se demuestra la localización, el número de defectos, el tamaño del orificio y de los bordes adyacentes (fig. 3) y de las aurículas, y la longitud del SIA, valorando además las estructuras adyacentes y la repercusión hemodinámica del defecto. El ecocardiograma tridimensional (fig. 4) define mejor la forma del defecto, su variación con el ciclo cardiaco y nos reafirma en la estimación del diámetro de oclusión, medido con balón.
Estudios eco-3D. A: comunicación interauricular de 28mm de diámetro, central. B: dispositivo Amplatzer Septal Occluder de 28mm implantado en el septum interauricular, al mes del implante. (Cortesía del Dr. Abdul Karoni. Servicio de Cardiología. Hospital Infanta Cristina. Parla. Madrid.)
En la actualidad, los dispositivos de cierre percutáneo más utilizados son: ASO (AGA Medical Corporation®), Helex® (©2002-2009W.L. Gore & Associates, Inc.), Solysafe® (Swiss implant), Occlutech® (Occlutech International AB, Helsingborg, Sweden), Cardioseal-Starflex® (NMT Medical Inc., Boston, Massachusetts). El dispositivo cribiforme de Amplatzer® es especialmente útil en la CIA aneurismática y multiperforada7 (fig. 5).
La molestia que produce la sonda del ecocardiograma TE aconseja sedación o anestesia general. El cierre es generalmente indoloro y con ecocardiograma intracardiaco, la sedación es suficiente. Previa punción venosa femoral, se posiciona una guía en la vena pulmonar izquierda y, con ayuda de balón estático o dinámico y ecocardiograma transesofágico, se estima el diámetro de oclusión, con la técnica de stop-flow (desaparición del flujo I-D en eco). Se elige el tamaño del dispositivo, que en el caso del ASO debe de ser entre 0 y 2mm por encima del diámetro de oclusión. Los dispositivos no autocentrantes tienen otro criterio de elección. A través de una vaina larga en AI, se procede al cierre mediante desplegado secuencial del dispositivo. Hay diferentes técnicas de ayuda para posicionarlo en casos complejos8. Tras el anclaje del dispositivo, se comprueba la posición normal en varios planos, si hay o no shunt residual, la distancia a las válvulas A-V y el seno coronario, etc., y finalmente se desenrosca el cable de sujeción del ASO.
Después del implante, debe mantenerse antiagregación, generalmente doble, por un periodo mínimo de 6 meses (clopidogrel 75mg/día y ácido acetilsalicílico [AAS] 2-5mg/kg/día). Es indispensable el control clínico y ecográfico a las 24 horas, seguido de 1, 3, 6 y 12 meses tras el implante, descartando trombos, mala posición o derrame pericárdico. Se recomienda profilaxis antiendocarditis bacteriana durante 1 año y evitar golpes y movimientos violentos las primeras semanas.
La técnica quirúrgica es sencilla y con mínima mortalidad, aunque con morbilidad secundaria a esternotomía, dolor, síndrome pospericardiotomía (2%) o fibrilación auricular (10%) en el adulto. Los resultados del cierre percutáneo son similares y con menor índice de complicaciones locales y generales, evitando la toracotomía. En general, y con un adecuado entrenamiento, el procedimiento es seguro, sin mortalidad y con alto porcentaje de éxito inmediato. Pueden registrarse complicaciones en un 8,6%. Inmediatas: embolización del dispositivo (2,4-6,5%), mala posición (5,5%), shunt residual, arritmias cardiacas, migraña (5%), derrame pericárdico (2,8%), formación de trombos, cefaleas, palpitaciones y malestar inespecífico, en general, más acusados en los cierres con ASO grandes (> 28mm). Tardías: la erosión de estructuras adyacentes presenta una frecuencia variable en las series (0,15-1,3%)9. Diversos estudios lo han asociado a deficiencia de los bordes superior y/o retroaórtico y a la sobredimensión del dispositivo. También pueden aparecer de forma tardía arritmias auriculares (0,9-2,9%), así como el engrosamiento del SIA y fracturas del dispositivo. La muerte súbita es muy rara, pero se ha descrito tras el cierre percutáneo10,11. Diversas series muestran un seguimiento a más de 10 años, con excelente tolerancia, normalización de función y volúmenes cardiacos, así como una notable mejoría clínica, a partir de los pocos meses del implante, en pacientes previamente sintomáticos12–14.
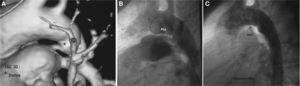
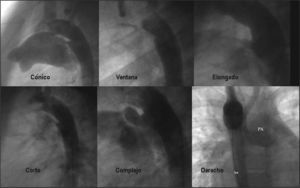
CIERRE DE DUCTUSEl ductus arterioso persistente (DAP) es una cardiopatía congénita frecuente (el 0,04% de los recién nacidos vivos), simple y fácilmente tratable por cualquier método. Rara vez llega sin tratar a la vida adulta; su cierre percutáneo es el método de elección en ese momento. Se ha descrito una clara incidencia de endocarditis bacteriana, y es obligada la profilaxis en los casos no tratados. Por encima de los 40 años, es común la aparición de calcio en la región ductal, incluso la calcificación total del conducto. En nuestro país, iniciamos el tratamiento de la lesión en 1989, con el paraguas de Rashkind15,16, seguido de los distintos tipos de coils (Gianturco, Jackson y Flipper o PFM), hasta la aparición del Amplatzer Duct Occluder®: (ADO; AGA Medical Corporation) y recientemente el ADO II, que perfeccionan aún más el tratamiento de esta lesión. A la vista de los resultados del cierre percutáneo17,18, esta modalidad terapéutica se considera de elección frente al cierre quirúrgico. El diagnóstico clínico es sencillo y el ecocardiograma confirma el nivel y la magnitud del cortocircuito. La RM o la TC (fig. 6) también pueden visualizar el DAP y mostrar su forma en casos de cardiopatías complejas. La forma anatómica determina el tipo de dispositivo a emplear (fig. 7).
Varón de 22 años con atresia pulmonar operada en la infancia. A: ductus persistente (PDA) en la tomografía computarizada. B: imagen angiográfica del ductus persistente elongado, aortograma en proyección lateral. C: ductus persistente cerrado con Amplatzer Duct Occluder (ADO) y foramen oval permeable con Helex en el mismo procedimiento.
Son más frecuentes las formas cónica y elongada. Además de los tipos mencionados, puede encontrarse un «ductus bilateral» en arco aórtico derecho y tras cierre previo, quirúrgico o con dispositivo. En manos expertas, todo ductus, sintomático o no, con o sin calcificación, derecho o izquierdo, asociado o no a otra cardiopatía o recanalizado tras cierre previo, se puede cerrar por vía percutánea en la edad adulta, excepto en casos de hipertensión pulmonar importante o fija (Eisenmenger). Los DAP pequeños (≤ 3mm) se pueden ocluir fácilmente con coils y los medianos o grandes, con Amplatzer ADO. En la forma anatómica tipo ventana o DAP muy corto, el dispositivo de cierre de CIV muscular Amplatzer muscular VSD Occluder19 representa una óptima alternativa. Generalmente, se cierra por vía transvenosa, aunque en casos medianos o pequeños, puede usarse la vía transarterial, incluso con el nuevo dispositivo ADO II. La aortografía, en proyección lateral, oblicua anterior izquierda (OAI) o variantes, demuestra la forma y el tamaño del ductus.
La aorta dilatada a veces dificulta la medición del tamaño y el análisis de la forma: el inflado de un balón en el ductus permite medir el diámetro real y elegir el dispositivo. En casos complejos, establecer un asa arteriovenosa simplifica el procedimiento y es de especial interés en los ductus severamente calcificados. Para el implante, se cruza el ductus con catéter y guía de intercambio, posicionando una vaina en la aorta descendente. Se lleva el dispositivo por ella, y se libera con angiografías de control, por el catéter arterial. Aparte de los Flipper Cook coils (©2009 Cook Medical), para ductus pequeños, hay otros dispositivos como el Amplatzer (ADO), con diámetros oclusores desde 4 a 16mm, incluso de 18mm, si usamos un dispositivo de cierre de CIV muscular. En la figura 8 se muestran los más comúnmente utilizados. El ADO II, disponible desde 2008, es más flexible y tiene doble disco de retención.
Hay numerosas series de casos tratados, con gran eficacia20,21. En nuestra serie de 450 cierres de ductus, 57 eran en adultos, con diámetro medio de 3,2mm. Hemos usado paraguas de Rashkind en 21; coils (Jackson y Flipper), en 15; ADO, en 20; ADO II, en 1, y asa A-V, en 10 casos.
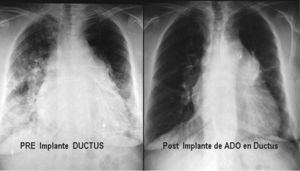
La oclusión total con el oclusor Amplatzer se consigue de forma rápida e inmediata, a los pocos minutos del implante; el 90% queda ocluido a las 24 horas, y el 100%, a los 6 meses22,23 (fig. 9).
La técnica es sencilla y, en general, carente de morbimortalidad, aunque se han descrito casos de muerte21. La embolización indeseada de coils o ADO sucede ocasionalmente (1,5%); la del ADO es la que más atención demanda, especialmente en el lado aórtico. Con experiencia y material extractor, se puede recuperar la mayoría de los dispositivos, aunque ocasionalmente se ha precisado cirugía cardiaca o vascular para extraer un tapón oclusor de Amplatzer. En nuestro seguimiento, se produjeron 2 casos de estenosis de rama pulmonar izquierda, resueltas con implante de stent. En general, el seguimiento a 20 años ha mostrado eficacia y ausencia de complicaciones tardías, incluso ausencia de endocarditis bacteriana subaguda (EBS)24,25.
ESTENOSIS PULMONARLa estenosis de la válvula pulmonar es una afección de origen casi exclusivamente congénito, que se presenta frecuentemente de forma aislada, aunque también puede aparecer en el contexto de otras cardiopatías congénitas (tetralogía de Fallot, transposición de grandes arterias, corazón univentricular, etc.). En su forma aislada, es frecuentemente asintomática, aunque en casos severos se ha descrito su asociación con arritmias malignas, infarto ventricular o muerte súbita26. En el adulto con cardiopatía congénita, puede presentarse de forma nativa o tras antecedente de cirugía o valvuloplastia previa.
Existen tres formas anatomopatológicas fundamentales: típica, por fusión intercomisural con apertura limitada y en forma de cúpula. Suele asociarse a diverso grado de dilatación postestenótica de tronco pulmonar. Displasia valvular: con velos engrosados y poco móviles; se puede asociar a cierto grado de hipodesarrollo de anillo y tronco pulmonar proximal. Este tipo de presentación es frecuente en el síndrome de Noonan. Asociada a cardiopatía compleja: es frecuente la presentación como válvula bicúspide. Puede asociarse asimismo a obstrucciones a otros niveles (infundibular, tronco o ramas pulmonares), así como a hipoplasia de anillo pulmonar.
El análisis ecocardiográfico permite medir adecuadamente la magnitud de la estenosis, su morfología y la repercusión en el ventrículo subpulmonar y descartar otras malformaciones cardiacas concomitantes. Asimismo, permite calcular el diámetro del anillo valvular. Las indicaciones de tratamiento han sido revisadas recientemente, con un consenso general de actitud expectante en casos leves27, e indicación terapéutica con gradiente transvalvular por cateterismo o medio transvalvular por ecocardiografía ≥ 40mmHg en pacientes asintomáticos o incluso 30mmHg en presencia de síntomas, disfunción del ventrículo subpulmonar o cianosis debida a cortocircuito intracardiaco de derecha a izquierda28.
El tratamiento universalmente aceptado de esta lesión es la valvuloplastia percutánea con catéterbalón. Esta técnica consiste en la dilatación estática de la válvula pulmonar con un catéter-balón situado a nivel del plano valvular. El diámetro recomendado del balón debe ser 1,2-1,25 veces el diámetro del anillo pulmonar previamente estimado por ecocardiografía y ventriculografía derecha biplana29. En el paciente adulto, se recomienda una longitud de balón de 40mm. Ocasionalmente, y debido al mayor diámetro del anillo pulmonar, es necesario inflar simultáneamente dos catéteres-balón. Para ello, se han descrito fórmulas para calcular los diámetros estimados de ambos balones30. No se han demostrado diferencias significativas en términos de eficacia entre la valvuloplastia pulmonar con simple o doble balón. En el caso de válvulas displásicas, se recomienda la utilización de catéteres balón de mayor diámetro, llegando a relaciones de 1,5 respecto al anillo valvular pulmonar. Cuando el gradiente transvalvular residual tras el procedimiento es > 30mmHg, se recomienda nueva valvuloplastia con catéter-balón 2mm mayor. Esta técnica, iniciada en 1982, ha demostrado resultados comparables con la valvulotomía quirúrgica clásica, tanto inmediatos como a largo plazo; normalmente es resolutiva en un procedimiento y comporta mínima morbimortalidad. Se ha descrito una tasa de éxito inmediato (disminución significativa del gradiente) > 80%; los peores resultados corresponden a casos de válvulas displásicas o hipodesarrollo del anillo pulmonar. El porcentaje de complicaciones de esta técnica es mínimo; destacan el daño vascular (7-19%), más frecuente en pacientes pediátricos, y la bradicardia o la hipotensión transitoria durante el inflado. Por ello se recomiendan inflados durante periodos no superiores a 5s. En el paciente con enfermedad de largo tiempo de evolución, es frecuente la persistencia transitoria de obstrucción residual tras el procedimiento, secundaria a obstrucción dinámica infundibular, que tiende a disminuir paulatinamente.
En el seguimiento, se ha descrito reestenosis en el 8%. Son predictores de reestenosis la persistencia de un gradiente transvalvular inmediato > 30mmHg y la utilización de una relación balón/anillo < 1,231. Muchos de estos casos son susceptibles de una nueva valvuloplastia percutánea con catéteresbalón de mayor diámetro. En la reestenosis de válvulas displásicas, debe recurrirse a la cirugía. Se ha descrito el desarrollo de insuficiencia pulmonar durante el seguimiento en un 40-90% en distintos estudios, aunque infrecuentemente de carácter severo. Estudios comparativos han mostrado que esta complicación es más relevante tras la cirugía32.
COARTACIÓN DE AORTALa coartación de aorta (CoAo) representa el 7% de las cardiopatías congénitas y es la cuarta cardiopatía en requerir tratamiento quirúrgico o intervencionista. Sin tratamiento, se asocia a una notable morbimortalidad, sobre todo en mayores de 35 años, debido a hipertensión arterial, enfermedad coronaria temprana, accidente cerebrovascular, insuficiencia cardiaca progresiva, rotura aórtica, endarteritis, dilatación aneurismática de la aorta ascendente, etc.33. Aunque clásicamente su tratamiento ha sido quirúrgico, en la actualidad, y de forma general, el tratamiento percutáneo de la CoAo y recoartación en la edad adulta puede considerarse electivo frente a la cirugía, con resultados altamente comparables con los quirúrgicos, con menor morbilidad y estancia hospitalaria. Indicamos el tratamiento percutáneo de CoAo en toda lesión obstructiva evidente, a nivel ístmico o en la aorta torácica con gradiente transcoartación de 30mmHg o 20mmHg con incremento al ejercicio e hipertrofia o disfunción diastólica del VI. Asimismo, se indicará tratamiento en toda CoAo asociada a hipertensión arterial, respuesta tensional anormal al ejercicio, accidente cerebrovascular, insuficiencia cardiaca o disfunción del ventrículo izquierdo, intolerancia al esfuerzo, enfermedad coronaria o insuficiencia aórtica.
El diagnóstico clínico y ecocardiográfico debe complementarse con técnicas de imagen como la RM o la TC. El análisis de la lesión permite elegir el tamaño y el tipo de stent a utilizar. El cateterismo y la angiografía quedan para los detalles finales y el tratamiento. Se debe descartar siempre la presencia de una arteria subclavia derecha aberrante. Durante el procedimiento, la ecografía intravascular puede ser de máxima utilidad para reconocer flaps de disección o evaluar la pared vascular.
Existe todavía cierta controversia acerca de la técnica a emplear; angioplastia con balón (AB) o implante de stent, simple o recubierto. Si analizamos la anatomía patológica de la zona coartada y el modo de acción de la AB, «rotura controlada de la íntima o media del vaso tratado», es comprensible que se sea muy crítico con esta modalidad de tratamiento34. La AB se ha asociado a disección, formación de aneurismas y rotura aórtica en un porcentaje no despreciable de casos. En la CoAo del adulto, con importante afección anatomopatológica de la pared arterial, la AB tiene un potencial de complicaciones que la hacen desaconsejable. Sin embargo, el implante de stent en el segmento coartado, evitando la sobredistensión de la pared y el retroceso elástico, podría reducir la formación de aneurismas. Su mayor desventaja estriba en dejar la pared tratada con alteración de su distensibilidad vascular y de la propagación de la onda de presión arterial, cuyos efectos a largo plazo son desconocidos35. La reciente aparición del stent recubierto covered CP stent (NuMED, Inc.; Hopkinton, New York, Estados Unidos) y su progresiva expansión36,37 han revolucionado el manejo de la CoAo. Permite tratar lesiones muy severas con eficacia; aumenta la seguridad del procedimiento y resuelve sus potenciales complicaciones, por lo que se afianza como tratamiento de elección frente a la cirugía en la edad adulta. El stent recubierto, ha sido empleado asimismo para el tratamiento simultáneo de la coartación y el ductus persistente. Incluso se ha descrito el acceso con éxito a vasos ocluidos por el PTFE, mediante punción y dilatación de la membrana del stent38.
La técnica ha evolucionado considerablemente y las más temidas complicaciones, migración indeseada del stent y disección o rotura aórtica, han disminuido de manera considerable con el uso de catéteres doble balón (BIB balón; NuMED, Inc. Hopkinton, New York), stents recubiertos y la sobreestimulación con marcapasos a frecuencias rápidas, lo cual permite apertura e implante más estables y evita el movimiento sistólico y la migración indeseada del stent.
Antes del implante del stent, deben valorarse los siguientes diámetros: lesional, preestenótico, dilatación postestenótica, istmo y aorta diafragmática. El diámetro final del stent se ha de elegir según el diámetro del istmo. En aortas distales sanas, el diámetro de la aorta diafragmática es otro indicador. La longitud del stent se decide de acuerdo con la de la lesión estenótica, calculando un acortamiento promedio del stent del 30%.
El implante se realiza mediante acceso retrógrado arterial y acceso venoso para implante de marcapasos en el ápex del ventrículo derecho. A través de una vaina gruesa transarterial, se lleva el complejo balón-stent al centro de la lesión, dilatándolo al diámetro elegido con sobreestimulación durante el inflado en el ventrículo derecho a frecuencias de 180 a 200 lat/min. En la recoartación, con reacción cicatricial perilesional, puede considerarse el implante de stent simple. También en las arteriopatías con pared gruesa y previsión de redilataciones, puede indicarse este tipo de stent. En las CoAo severas, localizadas, con múltiple circulación colateral, en adultos con arteriopatía y sospecha de necrosis quística de la pared aórtica, el stent recubierto es la mejor opción. Se acepta el tratamiento de la lesión en dos tiempos, dilatando inicialmente de modo subtotal, para redilatar al diámetro final unos meses o años después del implante (fig. 10).
El tratamiento percutáneo de la CoAo no está exento de complicaciones. Aunque éstas han disminuido de forma importante en las últimas series, se han descrito en el 11,7% de los casos. Las complicaciones se pueden dividir en: técnicas —migración del stent o su fractura, rotura del balón u oclusión de vasos del cuello—; aórticas —rasgado local en la íntima (1,3%), disección aórtica (1,5%) y aparición de aneurismas de diferentes tamaño y evolución—, y vasculares —accidente vascular cerebral, embolia distal o daño vascular local—. Existen casos descritos de rotura aórtica y muerte, así como un caso de paraplejía tras angioplastia con balón39,40. Los stents simples más usados en la actualidad son: CP, EV3 Max y Génesis XD. Entre los recubiertos, la mayor experiencia se ha descrito con el Covered CP®. Asimismo, se ha descrito el uso de recubiertos Génesis, así como un caso tratado con Atrium stent®. Ocasionalmente, los aneurismas con mínima estrechez aórtica o sin ella pueden ser tratados con endoprótesis aórticas, en el seno de una colaboración interdepartamental. La redilatación posterior de stents es posible y fácil41–43.
En nuestra experiencia, hemos tratado con stents a 45 enfermos de CoAo, 18 nativas y 27 con recoartación, con una eficacia cercana al 98% (duplicación del diámetro a nivel de la lesión y práctica abolición de gradiente transcoartación) y sin mortalidad. Un paciente presentó migración indeseada del stent en la experiencia inicial. Tras el uso sistemático de estimulación rápida durante el implante, no se ha vuelto a producir esta complicación.
Distintos autores han descrito el seguimiento de pacientes tras tratamiento percutáneo de coartación de aorta, y documentan una mejora en las cifras tensionales o el número de fármacos utilizados para su control. La aparición de fracturas es ocasional y generalmente sin consecuencias. El seguimiento clínico es imprescindible, incluso con técnicas de imagen, como TC multicorte, para descartar aneurismas o disecciones en el seguimiento44,45.
Podemos concluir que el tratamiento de la coartación aórtica con stent es una alternativa actual, válida y segura frente a la cirugía. Su uso en adultos proporciona resultados impactantes a corto y medio plazo, debido a su eficacia, simplicidad y bajo índice de complicaciones. Sin embargo, sólo los resultados a largo plazo, el seguimiento continuo y los progresos en el diseño de las prótesis permitirán comparar ambas técnicas con óptima perspectiva.
ESTENOSIS VALVULAR AÓRTICA CONGÉNITALa valvuloplastia aórtica con catéter-balón fue comunicada por Lababidi et al46 en 1984 para el tratamiento paliativo de la estenosis valvular aórtica congénita.
Clásicamente las indicaciones para la realización de valvuloplastia percutánea han sido28:
Sintomáticos con:
- –
Velocidad valvular aortica > 3,5m/s por ecocardiograma.
- –
Gradiente medio transvalvular > de 30mmHg por ecocardiograma.
- –
Inversión de onda T en el ECG.
- –
Gradiente pico en cateterismo > 50mmHg sobre válvula sin calcificación severa y sin insuficiencia moderada o severa.
Asintomáticos con:
- –
Velocidad valvular aórtica > 4m/s por ecocardiograma.
- –
Gradiente medio transvalvular > 40mmHg por ecocardiograma.
- –
Gradiente pico en cateterismo > 60mmHg sobre válvula sin calcificación severa y sin insuficiencia moderada o severa.
En los últimos años, e independientemente de la edad del paciente, hay una tendencia cada vez más conservadora en el abordaje terapéutico de la válvula aórtica, tanto en el campo de la cirugía como del intervencionismo, en que se otorga un papel predominante a la historia clínica en la indicación terapéutica. En el adulto, las indicaciones de abordaje percutáneo son más limitadas y controvertidas; algunos autores consideran que únicamente estaría indicada en el embarazo o la disfunción ventricular izquierda, como medida paliativa previa a la cirugía, o el implante valvular percutáneo, por sus resultados menos efectivos que en la población infantil.
Para todos los autores la insuficiencia aórtica severa o moderada es una contraindicación absoluta para la realización de valvuloplastia. En la insuficiencia aórtica leve se individualizará en cada caso.
Las válvulas monocúspides comportan un peor pronóstico en cuanto a las complicaciones y los resultados. En la población adulta más frecuentemente se trata de una válvula bicúspide. En las válvulas calcificadas, por lo general, no se considera indicada su dilatación, salvo como tratamiento de rescate, ya que el beneficio esperado es escaso y hay un riesgo alto de embolización de material calcificado47.
El ecocardiograma TE durante la valvuloplastia es de indudable utilidad, ya que permite estudiar exhaustivamente la anatomía valvular, valorar la presencia o no de insuficiencia y el resultado hemodinámico, sin necesidad de retirar la guía o el catéter del ventrículo izquierdo48. La relación balón/ anillo no debe ser > 0,9 para evitar el riesgo de causar insuficiencia aórtica tras el inflado, que será lo más corto posible.
Es frecuente la utilización de doble balón, técnica algo más tediosa que la de monobalón, pero que mejora los resultados en anillos grandes. También se han utilizado balones autocentrables (Nucleus; Numed Inc.), que permiten una mayor estabilidad. En los últimos años se han ensayado diferentes técnicas para evitar las complicaciones del procedimiento, como la estimulación ventricular derecha transitoria49,50 a frecuencias de 180-200 lat/min, así se disminuye la movilidad del balón y mejoran los resultados de la técnica (fig. 11). En nuestra experiencia, la aplicación de esta técnica ha reducido a cero la incidencia de insuficiencia aórtica inmediata.
Las principales complicaciones son el daño vascular con posibilidad de producción de disecciones y aneurismas en la aorta ascendente51 y la insuficiencia aórtica tras valvuloplastia. El desarrollo a medio y largo plazo de esta última es frecuente y evolutiva (el 10-30% de insuficiencia moderada o severa), y no totalmente relacionada con la técnica52.
La experiencia acumulada en los últimos años demuestra que la estenosis aórtica es una enfermedad de peor pronóstico que la estenosis pulmonar; un porcentaje amplio de casos necesitan reintervenciones terapéuticas a lo largo de la vida, con una incidencia de reestenosis del 50% a los 5 años y del 60% a los 10 años, sin diferencias significativas respecto a la cirugía53. En muchas ocasiones, el paciente requerirá tratamiento quirúrgico en algún momento de la evolución de la enfermedad. Esta limitación en la efectividad del tratamiento intervencionista hace que se deba individualizar la indicación en cada paciente en función de su edad, si presenta o no insuficiencia aórtica concomitante y la posibilidad de tratamiento quirúrgico definitivo sobre la válvula.
En el niño mayor y el adolescente, creemos que inicialmente la aproximación terapéutica debe ser con el cateterismo intervencionista, a no ser que se valore una intervención quirúrgica definitiva sobre la válvula, que tenga un grado de insuficiencia aórtica mayor que leve o presencia de calcio. Los resultados publicados por algunos grupos quirúrgicos respecto a la cirugía de Ross son alentadores, aunque no está exenta de riesgos y sus resultados a largo plazo, especialmente en cuanto a la necesidad de reemplazo del homoinjerto y el desarrollo de disfunción del autoinjerto, son una incógnita. En el adulto mayor habrá que ajustar mucho más la indicación, por la alta tasa de reestenosis de esta técnica sobre válvula bicúspide calcificada, que es el tipo más frecuentemente encontrado en este grupo.
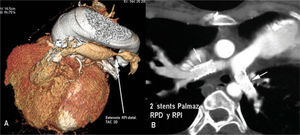
ESTENOSIS DE RAMAS PULMONARESLas estenosis de ramas pulmonares, centrales o periféricas, son poco frecuentes como entidad nativa y generalmente se asocian a síndromes o alteraciones genéticas, tipo Alaguille y otros. Sin embargo, con la supervivencia de los enfermos paliados en la infancia y las múltiples variedades de correcciones quirúrgicas (fístulas sistemicopulmonares, anastomosis cavopulmonares, ampliaciones de rama con parches diversos, interposición de conductos entre VD y ramas pulmonares, etc.) o procedimientos intervencionistas que implican el árbol pulmonar (implante de stent en ductus neonatal, algunos dispositivos de cierre de ductus y el implante previo de stents, que no han crecido al ritmo del paciente o se han reestenosado, etc.), se ha ido generando una patología, cada vez más frecuente y variada, susceptible de tratamiento percutáneo. Vemos esta patología con mayor frecuencia en las unidades de cardiopatías congénitas del adulto (UCCA). El diagnóstico se hace principalmente con la clínica y las técnicas de imagen: ecocardiograma, RM o TC multicorte con reconstrucción 3D, con las que se puede planificar el tipo de tratamiento, que generalmente se basa en el implante de stents (fig. 12).
A: tomografía computarizada helicoidal con reconstrucción 3D. Edad: 22 años. Portador de atresia pulmonar compleja operada. Estenosis nativa en la rama pulmonar distal izquierda. B: tomografía computarizada. Edad: 18 años. Portador de Fallot operado: insuficiencia pulmonar severa y stents en ambas ramas pulmonares.
En cuanto a las posibilidades terapéuticas, hay tres técnicas para dilatar las estenosis vasculares: angioplastia con balón (AB), angioplastia con cutting-balloon e implante de stent, simple o recubierto. La AB produce una rotura controlada de la íntima y la media o adventicia del vaso tratado secundaria a una cierta sobredistensión de éste, y sus resultados son variables. El balón de corte o cutting-balloon permite dilatar lesiones fibrosas y rígidas, por medio de microcortes, producidos por las cuchillas soldadas al balón54. El stent amplía definitivamente el diámetro del vaso, que lo convierte en rígido y lo «empuja o desplaza» hacia las estructuras adyacentes.
En 1988, Mullins inició el implante de stents en ramas pulmonares estenóticas utilizando el stent vascular de Palmaz55,56. En 1992, con él, iniciamos nuestra experiencia con este tratamiento.
En el niño, el factor crecimiento es fundamental y el mayor reto es implantar un stent que pueda redilatarse hasta el tamaño definitivo, con accesos vasculares pequeños. En el adulto con cardiopatía congénita, los accesos vasculares son más amplios y se puede implantar, generalmente, un stent definitivo. Según el vaso diana, podemos dividir los stents en tres tamaños: pequeño (3 a 12mm), mediano (12 a 18mm) y grande (18 a 30mm). Su fuerza radial es variable según su composición y fabricación. Otro aspecto importante es el acortamiento del stent, variable entre el 15 y el 40%, dependiendo de su estructura y el diámetro alcanzado. En la tabla 2 se muestran los stents más usados en nuestro medio (fig. 13).
El stent EV3 Max (EV3®) es especialmente útil en estenosis con colaterales emergentes cercanas a ella57. El Génesis XD (Cordis J & J Interventional Systems Co.) tiene gran fuerza radial58. El CP stent (Numed Inc.), de 6, 8 o 10 zig, es dilatable hasta 15, 24 y 30mm59. Entre los stents pequeños y premontados, hemos conseguido llevar in vitro hasta 14mm al stent Valeo (C.R. Bard, Inc.), procedente del intervencionismo vascular60. Debido al riesgo de rotura del vaso, no puede faltar en el laboratorio alguna unidad de stent recubierto (Covered CP o Atrium stent; Atrium Medical Corp.) para tratar lesiones potencialmente frágiles, conductos biológicos calcificados o aneurismas tras el tratamiento convencional mediante AB.
Se indica el tratamiento percutáneo de estenosis de ramas pulmonares en caso de hipertensión del VD (> 60 o 70% de la presión aórtica) y su disfunción o insuficiencia pulmonar severa. Lesiones que causen hipoperfusión o desequilibrio del flujo pulmonar y, en general, toda anomalía significativa que produzca síntomas o deterioro progresivo del VD o la válvula tricúspide. Los aneurismas en ramas pulmonares u otra localización pueden tratarse con stent recubierto. La estenosis residual en el tronco pulmonar, post debanding, puede ser tratada con stent, y así evitar una reintervención (figs. 14 y 15).
Tras analizar la anatomía lesional, diámetro, longitud y estructuras vecinas, cruzamos la lesión y, a través de una vaina larga, centramos el stent en el segmento estenótico, y lo abrimos con ayuda de angiografías de posicionamiento. En lesiones bilaterales, es frecuente el implante doble simultáneo o el inflado de un balón, durante el implante, en la rama contralateral (fig. 16). Los tests con balón y coronariografía simultánea previos al implante se están imponiendo en el tratamiento de lesiones cercanas a las arterias coronarias61–63. Son imprescindibles las guías extrarrígidas y vainas de distinto calibre, a veces con mallado interno, balones de alta presión y amplio stock de stents simples y recubiertos.
El implante de stent en estenosis vasculares es una técnica eficaz que amplía significativamente la luz del vaso, disminuye el gradiente y baja la presión del VD. La técnica, aunque segura en manos expertas, no carece de complicaciones. Se han descrito muerte por rotura vascular, anemia aguda y hemoptisis, así como migración del stent, rotura del balón y atrapamiento del balón en la válvula tricúspide. Otras complicaciones posibles son el tiempo de fluoroscopia prolongado, paresia braquial transitoria por hiperextensión de brazos, trombosis de rama o pérdida de una arteria segmentaria y hemotórax. La reestenosis (2%) es infrecuente y está asociada a superposición insuficiente de dos stents en tándem, angulación excesiva del stent, exceso de dilatación previa o implante sobre tejido anormal.
Nuestra serie general de stents en cardiopatías congénitas comprende 317 stents implantados en 195 pacientes (250 procedimientos). En la población adulta, implantamos 59 stents en ramas pulmonares en 40 pacientes (24 implantes simples y 18 dobles).
En este grupo de pacientes, el diámetro vascular se incrementó y el gradiente se redujo de manera muy significativa. El procedimiento fue eficaz en 39 (97%) y fallido en 1. Siete lesiones precisaron dilatación con balones de alta presión. Un caso de aneurisma de la RPD quedó excluido de la circulación con un stent recubierto. No hubo complicaciones graves ni mortalidad en este grupo de pacientes. En 5 de ellos se ha efectuado redilatación con éxito en el seguimiento y sin complicaciones.
Podemos concluir que esta técnica es eficaz. Incrementa significativamente el diámetro del vaso tratado, reduce el gradiente y descomprime la cámara de bombeo implicada. Mejora los resultados de la angioplastia convencional, evitando el retroceso elástico. En general, se observa un bajo índice de reestenosis por proliferación neointimal; la redilatación es posible y, generalmente, fácil. La aparición de fracturas en el seguimiento es un hecho64, más frecuente en zonas de gran movimiento y torsión, como angulaciones y tracto de salida del VD. La ulterior manipulación quirúrgica de la zona tratada es un reto y debe tenerse en cuenta.
TRATAMIENTO O PREVENCIÓN DE LA EMBOLIA CEREBRAL CRIPTOGENÉTICALa asociación de embolia cerebral y foramen oval permeable (FOP) ha sido demostrada en varios estudios. Probablemente hay un factor favorecedor individual procoagulante que influya en una realidad anatómica preexistente. Debe pensarse en embolia paradójica como la causa de un evento embólico en: a) ausencia de causa tromboembolica en el lado izquierdo (aurícula o ventrículo izquierdos, fibrilación auricular, enfermedad carotídea, etc.); b) posibilidad de cortocircuito de derecha a izquierda, y c) detección de trombos en el sistema venoso o la aurícula derecha.
Comparados con sujetos normales, aquellos con FOP tienen 4 veces más riesgo de tener un accidente isquémico, y éste se eleva a 33 veces cuando coexisten FOP y aneurisma del septum interauricular. Los parámetros más importantes son el diámetro del FOP, la presencia de un aneurisma de septo y el grado de cortocircuito de derecha a izquierda. La utilización de técnicas de cierre con dispositivo puede solucionar al menos la parte anatómica de este importante problema, y de hecho hay varias series que demuestran la eficacia de este procedimiento en disminuir la recurrencia de embolia cerebral. La técnica es sencilla, altamente resolutiva y cuenta con variados diseños de dispositivos de cierre que aseguran su éxito. Entre ellos, se han utilizado con éxito: Cardioseal (NMT Medical Inc.), Amplatzer PFO (AGA Medical Inc.), la tercera generación del PFO-Star, el Helex (Gore Medical) y el Premere (St. Jude Medical)64 (fig. 17), intentando minimizar la cantidad de material extraño intracardiaco y problemas secundarios.
Por estas razones, aconsejamos cerrar el FOP con dispositivo oclusor en los pacientes: a) jóvenes, con embolia cerebral criptogenética; b) FOP demostrado por ecocardiograma transesofágico, y c) asociación a trombosis venosa profunda.
En la actualidad, a pesar de que se ha relacionado la presencia de migraña con aura con el FOP, no se recomienda su cierre percutáneo sistemático por esta causa. La técnica de implante es similar a la de cierre de comunicaciones interauriculares, guiada por ecocardiografía transesofágica para constatar el cierre del FOP sin existencia de shunt residual y la ausencia de complicaciones y trombos endocavitarios, con peculiaridades técnicas dependiendo del dispositivo utilizado. Por lo general, se trata de una técnica segura con una bajísima incidencia de complicaciones, como asociación de trombos endocavitarios secundarios a la técnica, embolización del dispositivo o arritmias intraprocedimiento, que rara vez persisten más allá de las 24 horas, o problemas locales en la región de venopunción. Con respecto al manejo posterior a su cierre, se recomienda doble antiagregación durante más de 6 meses o indefinidamente, según criterio del neurólogo. Los problemas pendientes de dilucidar son la mejora de los dispositivos específicos para este tipo de defecto, la definición de las características del grupo diana de tratamiento y la comparación con el tratamiento farmacológico (anticoagulación, antiagregación). Hay estudios prospectivos65–68, algunos pendientes de publicación, para valorar la eficacia del tratamiento hemodinámico frente al tratamiento farmacológico, que orientan a una mayor efectividad en pacientes con oclusión total y más de un evento previo, que servirán para resolver las dudas planteadas.
CIERRE DE DEHISCENCIAS POSQUIRÚRGICASEste grupo comprende una amplia variedad de afecciones y acciones terapéuticas, que pretenden dar solución o paliar las lesiones adquiridas, evolutivas, residuales o complicadas tras una intervención, y evitar así una nueva cirugía, a veces imposible, en pacientes generalmente con múltiples intervenciones59–70.
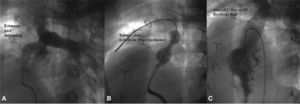
Usaremos la nomenclatura descrita por otros autores para diferenciar entre lesión residual (lesión o defecto después de una intervención y que se dejan de forma consciente buscando un beneficio o para evitar un riesgo inaceptable o innecesario) (fig. 18) y lesión complicada (lesión o defecto remanentes después de un procedimiento y no deseados o que producen un problema inaceptable) (fig. 19).
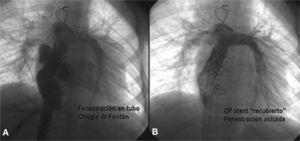
Cierre de fenestración de Fontan. A: angiografía en vena cava inferior (VCI) que muestra, de abajo arriba, las venas suprahepáticas, conducto VCI-arteria pulmonar, ambas arterias pulmonares y el relleno de la aurícula derecha a ambos lados del conducto, por la fenestración. B: angiografía en el conducto que muestra el stent recubierto (Covered CP stent), rellenando ambas ramas pulmonares y con oclusión total de la fenestración. CP: Cheatham platinum.
El estudio de la anatomía de la lesión debe ser lo más exhaustivo posible para establecer el tratamiento más oportuno. La colaboración de las unidades de ecocardiografía, radiología y RM es importante y nunca se insistirá bastante en utilizar todas las técnicas disponibles, cruentas o incruentas, lo que incidirá en una mayor eficacia y menor peligro para el enfermo.
Entre las lesiones residuales más frecuentemente encontradas en el postoperatorio de las cardiopatías congénitas, están las fenestraciones que habitualmente se dejan intencionadamente en la cirugía de Fontan, fuente potencial de desaturación y embolias, por tratarse de lesiones de flujo no pulsátil. Siempre debe realizarse un test de oclusión con balón, antes del cierre de la fenestración, para confirmar su viabilidad. Este tipo de oclusiones requiere un alto grado de inventiva y capacidad improvisadora, para elegir el dispositivo que mejor se adapte a la anatomía de la lesión: stents recubiertos, dispositivos oclusores múltiples, etc.71.
En cuanto a lesiones complicadas, se han descrito hasta en un 25% de los pacientes intervenidos mediante cirugía de Mustard o Senning, las dehiscencias interauriculares que ocasionan desaturación y que únicamente deben tratarse cuando produzcan un shunt hemodinámicamente significativo. Para su cierre, como en las fenestraciones en el Fontan, se utilizarán los dispositivos que mejor se adapten a la anatomía de la lesión72–74.
Las complicaciones del procedimiento generalmente son escasas, siendo destacable la dificultad de encontrar un acceso vascular, trombos en relación con la técnica o embolización del dispositivo. También se han descrito casos de hemolisis si la oclusión no es completa. Generalmente, el paciente requerirá antiagregación en los 6 meses siguientes al implante.
IMPLANTE DE PRÓTESIS PULMONAR PERCUTÁNEALa utilización de conductos quirúrgicos valvulados para conectar el ventrículo derecho y la circulación pulmonar ha supuesto un importante avance en el tratamiento de un gran número de cardiopatías congénitas, que cursan con obstrucción o incluso ausencia de conexión ventriculopulmonar. Los conductos valvulados biológicos (homoinjertos, xenoinjertos, heteroinjertos valvulados, etc.) son de elección en estos casos. Estas prótesis presentan, no obstante, una durabilidad limitada, con una vida media habitualmente inferior a 10 años, debido fundamentalmente a degeneración y calcificación; son frecuentes la estenosis y/o la insuficiencia valvular74. Estas lesiones, aunque en ocasiones clínicamente bien toleradas, tienen conocidos efectos deletéreos en el ventrículo subpulmonar75. Como consecuencia, un importante número de pacientes se ven necesitados de múltiples intervenciones quirúrgicas a lo largo de su vida para sucesivos recambios de conductos.
Hasta fechas recientes, el único procedimiento intervencionista que permitía prolongar la durabilidad de estos conductos era la angioplastia con o sin implante simultáneo de stent76. Este procedimiento permite eficazmente aliviar la obstrucción, disminuyendo la presión intraventricular derecha, aunque no mejora e incluso empeora la insuficiencia pulmonar.
En el año 2000, se publicó el primer implante con éxito de prótesis pulmonar percutánea en humanos77, compuesta por un segmento de vena yugular bovina con válvula venosa suturada en un stent vascular (CP stent; NuMED). Desde entonces esta técnica se ha extendido progresivamente y ha introducido modificaciones técnicas que han ayudado a mejorar los resultados.
Para una adecuada indicación del implante, es imprescindible conocer la historia del paciente (cirugías previas, tipo de conducto quirúrgico o de ampliación del tracto de salida ventricular derecho, etc.) y la definición anatómica de la lesión a tratar mediante técnicas de imagen, como RM o TC.
En la actualidad, las indicaciones para su implante tienen en cuenta criterios clínicos y de idoneidad del receptor78 (tabla 3). El peso mínimo adecuado del paciente ha de ser 20kg. La vía de acceso más frecuente es venosa femoral y, ocasionalmente, la vena yugular interna derecha. Con ayuda de guía de alto soporte, se avanza una vaina larga de 22 Fr hasta el tracto de salida ventricular derecho. El stent valvulado se monta sobre un catéter balón (BIB; NuMED Inc.) y, transportado por el interior de la vaina hasta el conducto ventriculopulmonar, se procede al implante mediante inflado secuencial del doble balón.
Indicaciones de valvulación pulmonar percutánea
|
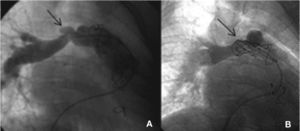
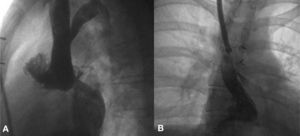
Esta técnica ha sido implementada con diversas ayudas metodológicas, a lo largo de la curva de aprendizaje, entre las que destacan el inflado previo del balón en el conducto, con coronariografía simultánea para descartar la posibilidad de compresión u obstrucción coronarias, y el implante previo de un stent en el conducto para reforzar el posterior implante de la prótesis (fig. 20).
A y B: inflado de un balón de angioplastia en el tubo de Contegra estenótico, previamente implantado, para conectar el ventrículo derecho con el árbol pulmonar, y coronariografías derecha e izquierda, durante el inflado. Se comprueba la lejanía del balón inflado de las arterias coronarias. C: stent implantado sin problemas.
Recientemente, se ha publicado la serie más importante y con mayor tiempo de seguimiento, en 155 pacientes tratados con este método79. En esta serie, tras el procedimiento, se produjo una disminución significativa de la presión intraventricular derecha y ningún paciente presentó insuficiencia pulmonar mayor a leve. No se produjo ningún fallecimiento y la tasa de complicaciones graves fue del 5% (rotura de homoinjerto, migración de la prótesis, compresión de arteria coronaria izquierda). Fue necesaria la intervención quirúrgica urgente en 7 pacientes.
Durante el seguimiento, no hubo fallecimientos secundarios a mala función de la prótesis. No se produjo aumento significativo de la insuficiencia pulmonar. Se apreció un porcentaje significativo de reestenosis y fractura de stent que, en muchos casos, se pudo tratar de forma percutánea mediante angioplastia y/o nuevo implante de prótesis percutánea en el interior de la previa.
A pesar de que inicialmente se requería implantar la válvula sobre un conducto previo, recientemente se ha publicado el implante de esta prótesis en casos seleccionados de pacientes con ampliación con parche transanular del TSVD en tetralogía de Fallot, con buen resultado79.
El implante percutáneo de prótesis pulmonar constituye, por lo tanto, uno de los mayores avances en el intervencionismo en los últimos años y así como uno de los primeros pasos en las técnicas de reemplazo valvular percutáneo. A pesar de no ser un tratamiento curativo, permite disminuir el número y el riesgo de los procedimientos quirúrgicos en pacientes candidatos a la cirugía. Es preciso mayor tiempo de seguimiento y número de pacientes para evaluar su impacto real a medio y largo plazo.
CIERRE PERCUTÁNEO DE COMUNICACIÓN INTERVENTRICULARLa CIV es la cardiopatía congénita más frecuente al nacimiento. Gran número de los defectos tienden al cierre espontáneo o se corrigen durante la infancia. En un número importante de pacientes, estos defectos persisten durante la vida adulta. Asimismo, son frecuentes las CIV residuales tras el cierre quirúrgico.
El cierre quirúrgico de este defecto es un procedimiento seguro y eficaz con mínima mortalidad y escasas complicaciones, que incluyen bloqueo auriculoventricular en el 1-5% o persistencia de cortocircuito residual significativo, con necesidad de reintervención en un 2% de los pacientes80,81.
Desde que en 1988 se realizó el primer cierre percutáneo de comunicación interventricular en humanos, se han ideado múltiples dispositivos y técnicas para este fin. Los resultados iniciales tuvieron un alto porcentaje de complicaciones y cortocircuito residual. La reciente aparición de los dispositivos de cierre percutáneo de comunicación interventricular muscular y perimembranosa de Amplatzer82 ha mejorado los resultados, lo que ha ayudado a la expansión de esta técnica. En el adulto, las indicaciones descritas para el cierre percutáneo de CIV nativa o posquirúrgica se podrían resumir en evidencia de cortocircuito izquierda-derecha significativo asociado a83:
- –
Repercusión clínica, criterios ecocardiográficos: crecimiento de la aurícula izquierda, aumento del diámetro diastólico de VI > 2 desviaciones estándar, insuficiencia aórtica adquirida progresiva, QP/QS hemodinámico ≥ 1,5 y antecedente de endocarditis bacteriana previa.
- –
Criterios anatómicos: localización del defecto en el septo membranoso o muscular y presencia de un borde no inferior a 2mm por debajo del anillo aórtico en los defectos del septo membranoso.
Para la realización de la técnica es imprescindible la monitorización constante mediante fluoroscopia y control ecocardiográfico intraesofágico. Éste analizará la posición, la anatomía y el diámetro del defecto septal, así como su relación con las estructuras adyacentes. Se requiere doble acceso vascular arterial y venoso femoral para el cierre de la CIV perimembranosa o la vena yugular interna derecha en el caso de CIV muscular. Es preciso crear un asa arteriovenosa, a través del defecto septal, que permita avanzar la vaina de transporte del dispositivo al ventrículo izquierdo desde el ventrículo derecho. El dispositivo debe ser 1-2mm mayor que el diámetro mayor del defecto.
Diversas series han publicado tasas de éxito en el momento del implante entre el 87 y el 100%. En un reciente estudio multicéntrico, se describen los resultados con esta técnica en 410 pacientes84, con implantes exitosos en el 95,3% de los casos. Hubo un fallecimiento relacionado con la técnica (0,2%). Las complicaciones inmediatas fundamentales fueron: embolización del dispositivo (0,9%), hemolisis (1,2%), bloqueo auriculoventricular (2,8%), regurgitación aórtica (3,3%) y regurgitación tricúspide (6%). Durante el seguimiento se objetivó cortocircuito residual en el 17% de los pacientes, generalmente sin trascendencia.
El bloqueo auriculoventricular (BAV) se ha descrito como una complicación importante, fundamentalmente en relación con el cierre de la CIV perimembranosa, con aparición tanto en el momento agudo como durante el seguimiento, con una incidencia de hasta el 5,7% en algunas series85. Esto hace necesario un seguimiento estrecho del ritmo cardiaco en estos pacientes tras el implante. Recientemente se han descrito los resultados de un subgrupo de pacientes adultos tratados de cierre percutáneo de CIV muscular y perimembranosa con una tasa de éxito en el procedimiento del 100%. Sólo hubo un caso de BAV transitorio con resolución espontánea. Durante el seguimiento no se produjeron complicaciones reseñables y todos los pacientes presentaron oclusión total de su defecto83.
En resumen, el cierre percutáneo de comunicación interventricular en el paciente adulto presenta claras ventajas en cuanto a morbilidad respecto a la cirugía. En el caso de CIV perimembranosa, dada su mayor proximidad a las válvulas tricúspide y aórtica y al tejido de conducción, el porcentaje de complicaciones, fundamentalmente BAV, no es despreciable, aunque se están realizando modificaciones en el dispositivo con el objetivo de mejorar los resultados. Aun así, los resultados publicados en el subgrupo de pacientes adultos resultan prometedores.
PROCEDIMIENTOS HÍBRIDOSDeterminadas lesiones presentan gran dificultad de tratamiento mediante técnicas quirúrgicas o intervencionistas por el elevado riesgo de estos procedimientos o la imposibilidad de acceso a las lesiones diana. La unión de ambas disciplinas en los últimos años ha dado lugar al nacimiento de los procedimientos híbridos86. Consisten, generalmente, en el acceso a la lesión diana a través de incisiones quirúrgicas específicas, generalmente toracotomías, realizadas por el cirujano para, a través de ellas, iniciar un procedimiento intervencionista determinado.
En la actualidad, estos procedimientos se realizan indistintamente en quirófano o sala de hemodinámica, según la conveniencia del principal operador y siempre relacionado con la técnica de imagen a emplear: ecocardiograma o fluoroscopia.
En algunos centros, se han creado salas polivalentes que aúnan las características de un quirófano y una sala de hemodinámica, además de disponer de la posibilidad de otras técnicas de imagen (ecocardiografía, resonancia magnética, etc.). Se ha descrito la utilización de este tipo de intervención en múltiples procedimientos:
CIERRE DE VASOS ANÓMALOSLas oclusiones vasculares son un importante campo dentro del intervencionismo en pacientes adultos con cardiopatía congénita. Comprende un grupo heterogéneo de procedimientos cuyo fin es el cierre de estructuras vasculares para eliminar efectos indeseables producidos por ellas.
Las estructuras vasculares que más frecuentemente necesitan oclusión podrían clasificarse en nativas (colaterales aortopulmonares, fístulas coronarias y colaterales venosas) y posquirúrgicas (fístulas aortopulmonares).
Las colaterales aortopulmonares aparecen frecuentemente en contexto de cardiopatías congénitas que cursan con hipoaflujo pulmonar, como la atresia pulmonar con comunicación interventricular, o incluso en el curso de cardiopatías univentriculares o cardiopatías en situación de Eisenmenger, que cursan con hipoxemia de larga evolución. Estas colaterales emergen desde las arterias sistémicas y conectan con el árbol vascular pulmonar; pueden cursar con hiperaflujo y sobrecarga de cavidades izquierdas e incluso daño vascular pulmonar. Asimismo, pueden presentar conexiones con el árbol bronquial y, en ocasiones, causan hemoptisis de diferente gravedad.
Presentan gran dificultad o incluso imposibilidad para el abordaje quirúrgico. Sin embargo, hay múltiples publicaciones que documentan el cierre percutáneo de estas colaterales con distintos dispositivos; los más frecuentemente utilizados son los coils o espirales de liberación controlada89 y, más recientemente, los tapones vasculares de Amplatzer® específicamente diseñados para estos procedimientos90, con buenos resultados. Antes de realizarse la oclusión, es preciso asegurar que el flujo pulmonar abastecido por la colateral es dual, para no producir un infarto de la región distal.
En el contexto de hemoptisis secundarias a circulación colateral aortopulmonar con conexión al árbol bronquial, frecuentemente hay múltiples colaterales finas muy ramificadas. Este tipo de colateralidad difusa suele ser susceptible de cierre con micropartículas de distinto tamaño, o incluso coils según la magnitud del vaso a embolizar91.
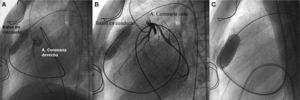
Las fístulas coronarias pueden producirse desde cualquier arteria coronaria principal y normalmente conectan con cavidades cardiacas derechas, frecuentemente aurícula derecha, ventrículo derecho o tronco pulmonar. Producen sintomatología por sobrecirculación pulmonar o por isquemia cardiaca secundaria a robo coronario. Se han empleado distintos dispositivos para su cierre: coils, tapones vasculares de Amplatzer, incluso dispositivos Amplatzer de cierre ductal y stents recubiertos92, con tasas de cierre total en torno al 85% y cortocircuitos residuales mínimos en los demás pacientes, con mínimas complicaciones.
Las colaterales venosas aparecen frecuentemente como complicación en la evolución de los pacientes con corrección tipo Fontan, de cardiopatías con fisiología univentricular, fundamentalmente en casos de aumento de resistencia al flujo pulmonar pasivo. Estas colaterales presentan, en múltiples ocasiones, conexiones con el territorio vascular sistémico, que resultan en cianosis e hipoxemia. El cierre de estas colaterales es relativamente sencillo mediante cateterismo intervencionista y ha sido descrito con múltiples dispositivos93, mínima morbilidad y alto porcentaje de eficacia.
Las fístulas sistemicopulmonares quirúrgicas se utilizan frecuentemente en la edad pediátrica como técnica paliativa en cardiopatías congénitas, con el fin de incrementar el flujo pulmonar. Tras la realización de la cirugía correctora definitiva, estas fístulas pueden producir complicaciones similares a las colaterales aortopulmonares y son susceptibles de cierre percutáneo con distintos dispositivos y técnicas, con elevado porcentaje de eficacia y mínimas complicaciones94.
EXTRACCIÓN DE CUERPOS EXTRAÑOSPara finalizar, cabe recordar la necesidad de tener siempre a mano los distintos materiales que se precisan para extraer del cuerpo algún material extraño y así evitar una cirugía al paciente. Ejemplos de material extraíble son: restos de vías centrales y silásticos, guías, electrodos de marcapasos, coils, dispositivos o stents embolizados durante o después de un procedimiento. Se requieren para la extracción vainas, pinzas fórceps de cocodrilo, catéteres lazo y otro material adecuado95,96.
CONCLUSIONESEl tratamiento percutáneo de numerosas cardiopatías congénitas del adulto es posible y altamente eficaz. Esto es aplicable además a las lesiones más frecuentes, con ello se evita la morbilidad de una cirugía cardiaca abierta o cerrada. El ductus persistente, ciertas comunicaciones interauriculares, la estenosis pulmonar valvular y determinados vasos anómalos pueden curarse por vía percutánea, y un amplio seguimiento internacional avala este hecho. El cierre de la comunicación interventricular es posible, pero con un porcentaje no despreciable de bloqueo auriculoventricular, temprano o tardío. Los stents en el síndrome de la coartación aórtica, nativa, postoperatoria o complicada representan una alternativa a la actuación quirúrgica y, en el caso de las estenosis de ramas pulmonares, puede considerarse de primera elección frente a la cirugía.
La estimulación simultánea a alta frecuencia con marcapasos en VD durante el implante de stents en aorta o la valvuloplastia aórtica disminuye los riesgos de migración del stent o avulsión valvular aórtica.
La embolia cerebral criptogenética puede prevenirse mediante el cierre del foramen oval permeable, y la secundaria puede evitarse cerrando las dehiscencias de parches o fenestraciones mediante dispositivos o stents recubiertos.
El implante de válvula pulmonar, todavía en casos seleccionados, reemplaza temporalmente la valvulación quirúrgica. Los dispositivos mal posicionados o migrados generalmente se pueden rescatar y extraer con catéteres y pinzas especiales.
Finalmente, la unión de habilidades médicas y quirúrgicas, procedimientos híbridos, en salas especialmente diseñadas, permite disminuir el riesgo de ciertos tratamientos, imposibles o de riesgo excesivo con una sola técnica terapéutica.