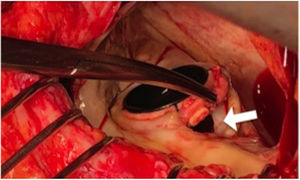
Las fugas paravalvulares (FPV) se definen como las comunicaciones anormales que se producen entre el anillo de sutura de la prótesis valvular y el tejido cardiaco circundante (figura 1). Aunque la mayor parte de las FPV no son clínicamente relevantes, se estima que entre el 2 y el 5% causan insuficiencia cardiaca congestiva, anemia hemolítica o ambas1.
Tradicionalmente, la cirugía ha sido la única terapia correctora de las FPV, y actualmente aún se la considera la técnica de referencia por haberse demostrado una mejora en la supervivencia y una reducción de los síntomas de pacientes con FPV significativas, en comparación con el tratamiento médico conservador2. Las opciones quirúrgicas incluyen la reparación de la FPV o una nueva sustitución protésica. El tipo de cirugía depende del tamaño o la extensión de la FPV, el estado del anillo valvular nativo y los antecedentes quirúrgicos del paciente. Sin embargo, independientemente de la técnica utilizada, la reoperación por FPV supone un mayor riesgo de mortalidad y morbilidad que la primera cirugía, especialmente en intervenciones sobre la válvula mitral. Además, tras repetidas cirugías, hay un riesgo considerable de recurrencia de FPV debido a la persistencia de calcificación o friabilidad tisular subyacente3.
Desde que Hourihan describió el procedimiento en 1992, es cada vez mayor el interés en las técnicas transcatéter para el tratamiento de las FPV4. Inicialmente, se reservaron como alternativa al tratamiento médico para pacientes inoperables o con alto riesgo quirúrgico, pero en los últimos años muchos centros con experiencia han convertido las técnicas transcatéter en la terapia de primera línea para pacientes con FPV5.
Hasta hace unos años, la evidencia científica global con estas técnicas se limitaba a estudios monocéntricos sin seguimiento clínico a largo plazo pero, más recientemente, se han publicado los registros nacionales de España6 y de Reino Unido e Irlanda7, así como varios estudios que comparan los resultados del tratamiento quirúrgico y las técnicas transcatéter, que se resumen a continuación.
Millán et al. realizaron un metanálisis bayesiano en el que se incluyeron 12 estudios y un total de 362 pacientes con FPV tratados mediante técnicas transcatéter8. La mayor parte de los procedimientos (70%) se realizaron sobre FPV en posición mitral. Se observó éxito del procedimiento, definido como la liberación de un dispositivo de cierre sin interferencia protésica y con reducción de al menos 1 grado en la gravedad de la insuficiencia, en el 76,5% de los pacientes, con una tasa de éxito ligeramente inferior con los procedimientos mitrales que en los aórticos (el 73,3 frente al 84,1%).
En comparación con los procedimientos fallidos, el tratamiento transcatéter de las FPV exitoso se tradujo en una menor mortalidad cardiaca (odds ratio [OR]=0,08; intervalo de credibilidad del 95% [ICr95%], 0,01-0,90), una superior mejoría en la clase funcional de la New York Heart Association (NYHA) o hemólisis (OR=9,95; ICr95%, 2,1-66,7) y una menor necesidad de reoperaciones (OR=0,08; ICr95%, 0,01-0,40).
CIRUGÍA FRENTE A TÉCNICAS TRANSCATÉTERNo existen estudios aleatorizados que comparen la cirugía y las técnicas transcatéter en el tratamiento de las FPV y la evidencia se limita a los estudios retrospectivos que se recogen en la tabla 1. Taramasso et al.9 fueron los primeros en comparar ambas estrategias terapéuticas en FPV mitrales y observaron que el tratamiento transcatéter conlleva menos mortalidad a 30 días que la cirugía convencional (0 frente al 9,3%), manteniendo una elevada tasa de éxito del procedimiento (94%). Sin embargo, hay que destacar que en este estudio los procedimientos menos invasivos no fueron exclusivamente transcatéter al realizarse todos ellos mediante un abordaje transapical, tras una minitoracotomía anterolateral.
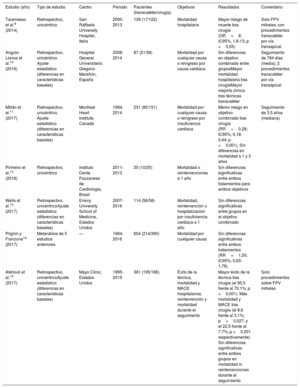
Estudios que comparan los tratamientos quirúrgico y transcatéter de las FPV
| Estudio (año) | Tipo de estudio | Centro | Periodo | Pacientes (transcatéter/cirugía) | Objetivos | Resultados | Comentario |
|---|---|---|---|---|---|---|---|
| Taramasso et al.9 (2014) | Retrospectivo, unicéntrico | San Raffaele University Hospital, Italia | 2000-2013 | 139 (17/122) | Mortalidad hospitalaria | Mayor riesgo de muerte tras cirugía (OR=8; IC95%, 1,8-13; p <0,05) | Solo FPV mitrales, con procedimientos transcatéter por vía transapical |
| Angulo-Llanos et al.10 (2016) | Retrospectivo, unicéntrico. Ajuste estadístico (diferencias en características basales) | Hospital General Universitario Gregorio Marañón, España | 2008-2014 | 87 (51/36) | Mortalidad por cualquier causa o reingreso por causa cardiaca | Sin diferencias en objetivo combinado entre gruposMayor mortalidad hospitalaria tras cirugíaMayor mejoría clínica tras técnicas transcatéter | Seguimiento de 784 días (media); 2 procedimientos transcatéter por vía transapical |
| Millán et al.11 (2017) | Retrospectivo, unicéntrico. Ajuste estadístico (diferencias en características basales) | Montreal Heart Institute, Canadá | 1994-2014 | 231 (80/151) | Mortalidad por cualquier causa o reingreso por insuficiencia cardiaca | Menor riesgo en objetivo combinado tras cirugía (RR=0,28; IC95%, 0,18-0,44; p <0,001). Sin diferencias en mortalidad a 1 y 3 años | Seguimiento de 3,5 años (mediana) |
| Pinheiro et al.12 (2016) | Retrospectivo, unicéntrico | Instituto Dante Pazzanese de Cardiología, Brasil | 2011-2013 | 35 (10/25) | Mortalidad o reintervenciones a 1 año | Sin diferencias significativas entre ambos tratamientos para ambos objetivos | |
| Wells et al.13 (2017) | Retrospectivo, unicéntricoAjuste estadístico (diferencias en características basales) | Emory University School of Medicine, Estados Unidos | 2007-2016 | 114 (56/58) | Mortalidad, reintervención u hospitalización por insuficiencia cardiaca a 1 año | Sin diferencias significativas entre grupos en el objetivo combinado | |
| Pilgrim y Franzone14 (2017) | Metanálisis de 5 estudios anteriores | — | 1994-2016 | 604 (214/390) | Mortalidad por cualquier causa | Sin diferencias significativas entre ambos tratamientos (RR=1,05; IC95%, 0,63-1,76) | |
| Alkhouli et al.15 (2017) | Retrospectivo, unicéntricoAjuste estadístico (diferencias en características basales) | Mayo Clinic, Estados Unidos | 1995-2015 | 381 (195/186) | Éxito de la técnica, mortalidad y MACE hospitalarios, reintervención y mortalidad durante el seguimiento | Mayor éxito de la técnica tras cirugía (el 95,5 frente al 70,1%; p <0,001). Más mortalidad y MACE tras cirugía (el 8,6 frente al 3,1%; p=0,027; y el 22,5 frente al 7,7%; p <0,001 respectivamente). Sin diferencias significativas entre ambos grupos en mortalidad ni reintervenciones durante el seguimiento | Solo procedimientos sobre FPV mitrales |
FPV: fuga paravalvular; IC95%: intervalo de confianza del 95%; MACE: eventos adversos cardiovasculares mayores; OR: odds ratio; Ref: referencia; RR: riesgo relativo.
Adaptada con permiso de Giblett et al.16.
En el estudio de Angulo-Llanos et al.10 sí que se compararon los resultados tras el tratamiento íntegramente percutáneo de 51 pacientes con los de 36 pacientes intervenidos quirúrgicamente. Concluyeron que en el grupo transcatéter la mortalidad hospitalaria fue menor (el 9,8 frente al 30,6%; p=0,002) y la mejoría clínica tras 2 años de seguimiento fue superior que en el grupo quirúrgico (el 71,4 frente al 36,4%; p=0,002). No hubo diferencias entre grupos en el objetivo combinado de muerte u hospitalización por insuficiencia cardiaca.
En el estudio de Millán et al.11 se compararon los resultados de 151 pacientes sometidos a cirugía con 80 intervenidos por vía percutánea. A pesar de no alcanzar diferencias estadísticamente significativas, el grupo transcatéter presentó una menor mortalidad perioperatoria (el 2,5 frente al 6,6%) y ausencia de complicaciones graves (0 frente al 2,3% en infartos de miocardio y 0 frente al 4,6% en accidentes cerebrovasculares). A largo plazo, con una mediana de seguimiento de 3,5 años, el tratamiento quirúrgico se asoció con una reducción del 72% en el objetivo combinado de muerte u hospitalización por insuficiencia cardiaca (intervalo de confianza del 95% [IC95%], 0,18-0,44; p <0,001). Sin embargo, en lo que concierne a la mortalidad por cualquier causa, sin considerar las hospitalizaciones por insuficiencia cardiaca, no se documentaron diferencias entre ambas estrategias terapéuticas ni a 1 año ni a los 3 años de seguimiento.
De forma similar, en una pequeña serie de 35 pacientes, Pinheiro et al.12 no observaron diferencias significativas en cuanto a mortalidad ni rehospitalizaciones al año de seguimiento. Los autores atribuyen la tendencia observada hacia una mayor mortalidad tras el tratamiento transcatéter (el 20% frente a 0; p=0,08) a la mayor comorbilidad de este grupo de pacientes.
Más recientemente, Wells et al.13 estudiaron a 114 pacientes con FPV (56 tratados percutáneamente y 58 quirúrgicamente). El objetivo primario fue un combinado de mortalidad, reintervención y hospitalización por insuficiencia cardiaca. Tras ajuste estadístico por las diferencias basales existentes entre grupos (mayor comorbilidad en el grupo percutáneo), concluyeron que el tratamiento transcatéter tenía resultados clínicos equivalentes al tratamiento quirúrgico al año de seguimiento, pero con una menor morbilidad perioperatoria.
Asimismo, se dispone de los resultados de un metanálisis de los 5 estudios comentados anteriormente que compararon las estrategias quirúrgica y transcatéter para el tratamiento de las FPV14. Con un total de 604 pacientes incluidos, no se observaron diferencias significativas en cuanto a mortalidad por cualquier causa entre las 2 terapias (riesgo relativo=1,05; IC95%, 0,63-1,76). Los autores admiten que la evidencia acumulada sigue siendo inconcluyente y que sus resultados apuntan a ventajas e inconvenientes de ambas estrategias. Debido a la heterogeneidad en los estudios incluidos en lo que refiere a la localización de las FPV (mitrales en un 61-80% de los casos) o las técnicas transcatéter utilizadas (puramente percutáneas o mediante abordaje transapical), la interpretación de los resultados es compleja.
Por último, el grupo de la Mayo Clinic15 comunicó sus resultados tras comparar ambas estrategias terapéuticas sobre FPV mitrales entre 1995 y 2015, y es la mayor serie publicada hasta la fecha, con un total de 381 pacientes intervenidos (195 percutáneamente y 186 quirúrgicamente). Como en otros estudios presentados, se observó que el tratamiento quirúrgico obtuvo mejores tasas de éxito técnico que los procedimientos transcatéter (resolución total o casi total de la FPV: el 95,5 frente al 70,1%; p <0,001), pero se asoció con más morbilidad y mortalidad perioperatorias (el 8,6 frente al 3,1%; p=0,027). Tras ajustar por las comorbilidades previas, no se encontraron diferencias significativas entre ambas modalidades terapéuticas en la mortalidad o la necesidad de reintervenciones durante el seguimiento.
La tendencia actual de muchos centros de considerar las técnicas transcatéter como la terapia de primera línea para pacientes con FPV se basa en las consideraciones que se exponen a continuación. En primer lugar, la baja tasa de complicaciones durante estas intervenciones menos invasivas, incluso en casos de procedimientos sin éxito o con reducción incompleta de la FPV. En efecto, en el registro español HOLE Registry (en el que se incluyeron 514 procedimientos en 469 pacientes procedentes de 19 centros), el 80,2% de los pacientes no sufrieron ninguna complicación y la que se produjo con mayor frecuencia fue el sangrado menor en relación con el acceso vascular (8,6%), generalmente sin repercusión clínica6. La incidencia de complicaciones mayores (muerte, ictus o necesidad de cirugía emergente) a los 30 días fue del 5,6%. Similares resultados pueden extraerse del registro de Reino Unido e Irlanda (259 pacientes de 20 centros distintos), en el que la mortalidad hospitalaria fue del 2,9% en procedimientos electivos7. En segundo lugar, el rápido desarrollo de las técnicas transcatéter debido a la creciente experiencia de los operadores. Al haberse demostrado la existencia de una curva de aprendizaje, los estudios comentados previamente coinciden en resaltar la importancia de la experiencia de los operadores para conseguir resultados favorables tras el tratamiento transcatéter de las FPV17. El registro español puso de manifiesto una mayor tasa de éxito en procedimientos mitrales en los centros con mayor experiencia6. La aparición de nuevos dispositivos específicos para el tratamiento de FPV (además del Occlutech Paravalvular Leak Device, el ampliamente utilizado Amplatzer Vascular Plug III también ha obtenido la marca CE para su uso en FPV) y la posibilidad de fusionar distintas modalidades de imagen (tomografía computarizada o ecocardiografía transesofágica intraprocedimiento) con la fluoroscopia hacen que el tratamiento transcatéter de FPV sea un procedimiento cada vez más eficaz y seguro18. Y por último, el hecho de que los procedimientos transcatéter no impidan ni limiten futuras intervenciones quirúrgicas debería hacer que se consideraran estas técnicas como terapia inicial para pacientes con FPV sintomáticas.
Sin embargo, hay que señalar que en alguno de los estudios presentados el tratamiento quirúrgico de las FPV obtuvo mayores beneficios clínicos a largo plazo que las técnicas transcatéter. Estos resultados pueden explicarse por distintas razones: por una parte, el papel determinante del resultado de la intervención. En este aspecto, las tasas de éxito de la cirugía (> 95%) superan a las de las técnicas transcatéter (entre el 70 y el 90%). Además, la mayor parte de los procedimientos transcatéter exitosos no consiguen una resolución completa de la FPV, lo que condiciona un mayor riesgo de hospitalizaciones por insuficiencia cardiaca y una peor clase funcional durante el seguimiento, pero no se traduce necesariamente en una mayor mortalidad. De hecho, el tratamiento exitoso de FPV mediante técnicas transcatéter equipara el riesgo de muerte a los 3 años de seguimiento al de los pacientes intervenidos quirúrgicamente11.
Por otra parte, las ventajas observadas tras la cirugía respecto al tratamiento transcatéter FPV deben interpretarse con cautela debido a las diferencias existentes entre ambos grupos de pacientes. A pesar de las variadas estrategias de ajuste estadístico utilizadas en los diferentes estudios, los pacientes sometidos a terapia transcatéter eran significativamente mayores y tenían más comorbilidades que los pacientes sometidos a cirugía, lo que probablemente influya en su peor evolución.
En resumen, a falta de estudios aleatorizados, la evidencia acumulada muestra que las técnicas transcatéter son una opción eficaz y segura para pacientes con alto riesgo, como los portadores de prótesis valvulares con FPV sintomáticas, y se comparan positivamente con el tratamiento quirúrgico, por lo que consideramos que no deberían limitarse a los pacientes críticos rechazados para cirugía, sino que deberían plantearse como primera opción terapéutica en centros con experiencia.
CONFLICTO DE INTERESESD. Arzamendi declara haber recibido honorarios de Abbott Laboratories, sin relación con el trabajo actual. Los demás autores no declaran conflictos de intereses.