La desregulación del metabolismo de los ácidos grasos en la mitocondria es un mecanismo involucrado en el desarrollo de insuficiencia cardiaca (IC) y fibrilación auricular (FA). Se evaluó la asociación entre la concentración plasmática de acilcarnitinas y la incidencia de IC o FA y si la dieta mediterránea (DietMed) puede atenuar la asociación entre las acilcarnitinas y el riesgo de IC o FA.
MétodosDos estudios de casos y controles anidados en el ensayo Prevención con dieta mediterránea (PREDIMED). Se incluyó a participantes con elevado riesgo cardiovascular en España: 326 casos incidentes de IC y 509 de FA se emparejaron individualmente con 1 a 3 controles. Las acilcarnitinas en plasma se midieron con espectrometría de masas en tándem con cromatografía líquida de alta resolución. Se ajustaron modelos de regresión logística condicional para estimar las OR multivariables y los IC95%. Se evaluaron interacciones multiplicativas y aditivas por el grupo de intervención, obesidad (índice de masa corporal ≥ 30) y diabetes mellitus tipo 2.
ResultadosLas altas concentraciones de acilcarnitinas de cadena mediana y larga se asociaron con un mayor riesgo de IC (respectivamente, ORporDE ajustada=1,28; IC95%, 1,09-1,51, y ORporDE ajustada=1,21; IC95%, 1,04-1,42). Se observó una asociación significativa entre las acilcarnitinas de cadena larga y el riesgo de FA: 1,20 (1,06-1,36). Se encontró una interacción aditiva entre las acilcarnitinas de cadena larga y la FA con la DietMed suplementada con aceite de oliva virgen extra (p de interacción=0,036) y con la obesidad (p=0,022) de forma inversa y directa respectivamente.
ConclusionesEn las personas con alto riesgo cardiovascular, las altas concentraciones de acilcarnitinas de cadena larga se asocian con mayor riesgo de IC y FA incidentes. Una intervención con DietMed+aceite de oliva virgen extra puede reducir el riesgo asociado con las acilcarnitinas de cadena larga.
Estudio registrado en controlled-trials.com (Identificador: ISRCTN35739639).
Palabras clave
La insuficiencia cardiaca (IC) y la fibrilación auricular (FA) son enfermedades cardiovasculares (CV) emergentes que contribuyen a la carga creciente de las enfermedades crónicas y el gasto en salud pública1. Tanto la IC como la FA se deben a la exposición acumulada a factores de riesgo CV compartidos que favorecen vías biológicas comunes y simultáneas tales como la liberación de mediadores de la inflamación que intervienen en la remodelación electrofisiológica estructural y cardiaca2.
Al estudiar la IC y la FA al mismo tiempo, se puede comprender mejor los mecanismos que causan dichas enfermedades, así como las diferencias fisiopatológicas clave que existen entre ellas3. Se ha propuesto la desregulación metabólica de los ácidos grasos en la mitocondria como mecanismo habitual involucrado en la aparición de la IC y la FA. Además, la acumulación de acilcarnitinas de cadena larga (ACCL) en el plasma y los tejidos desempeña un papel activo en la inflamación y la resistencia a la insulina4.
En el estudio Prevención con dieta mediterránea (PREDIMED), la intervención de la dieta mediterránea (DietMed) atenuó la asociación entre la alta concentración de acilcarnitinas (AC) y el riesgo de sufrir eventos CV mayores (es decir, infarto de miocardio, ictus o muerte CV) frente al grupo de control5. No obstante, en el momento actual no hay pruebas similares con respecto a la FA y la IC. Se diseñaron 2 estudios de casos y controles insertados en el ensayo PREDIMED para evaluar la relación entre las AC y la incidencia de IC o FA, y si la DietMed puede atenuar los efectos perjudiciales relacionados con la mayor concentración inicial de AC. Como objetivo secundario, puesto que ambas enfermedades CV comparten factores de riesgo habituales6, se evaluó la relación entre las AC y un resultado compuesto que incluía a participantes con IC o con FA.
MÉTODOSPoblación y diseñoSe diseñaron 2 estudios de casos y controles anidados en el ensayo PREDIMED7. Se seleccionaron los 326 casos nuevos de IC y los 509 casos nuevos de FA tras excluir los casos ya diagnosticados y los casos nuevos sin muestras disponibles. Como método de selección de los controles, se utilizó el muestreo por densidad de incidencia con sustitución8. Así, se seleccionó a los controles aleatoriamente a partir de todos los participantes con riesgo en el momento en que aparecieron los casos nuevos, y los controles seleccionados podían volver a seleccionarse como un control de otro caso, y posteriormente podían convertirse en un caso. Según los resultados de un estudio de simulación, el muestreo por densidad de incidencia con sustitución es el método más eficiente y menos sesgado para realizar el muestreo en los estudios de casos y controles anidados9. Los controles se emparejaron por centro de reclutamiento, año de nacimiento (± 5 años) y sexo. Se seleccionaron de 1 a 3 controles emparejados por caso. En la se muestra el diagrama de flujo del proceso de selección de participantes.
El protocolo fue aprobado por el comité de ética de investigaciones de todos los sitios donde se llevó a cabo el estudio, y todos los participantes dieron su consentimiento informado por escrito.
ResultadosLa IC y la FA se definieron a priori como variables de resultado secundarias en el protocolo del ensayo PREDIMED. En este análisis, se incluyeron todos los casos nuevos de IC y FA diagnosticados entre 2003 y diciembre de 2017. En un centro se suspendió el seguimiento en diciembre de 2014 y a todos los participantes de aquel centro se les aplicó censura estadística en aquella fecha para seleccionarlos como controles.
La información sobre estos resultados se obtuvo del contacto continuo entre los participantes y los médicos de atención primaria, las visitas de seguimiento anuales, la revisión anual de las historias clínicas según se necesitara y la consulta anual del Índice Nacional de Defunciones. Esta información la obtuvieron médicos que desconocían cuáles eran los grupos de intervención y las mediciones metabolómicas. Si se hallaba un diagnóstico clínico de IC o FA, se obtenía toda la documentación pertinente, incluidos los registros clínicos del alta hospitalaria, los centros ambulatorios y los registros de los médicos de familia. Las historias clínicas se enviaban anonimizadas al Comité de valoración de eventos clínicos. Dos cardiólogos evaluaban por separado esta documentación, y si no estaban de acuerdo en la clasificación del episodio, intervenía un tercer cardiólogo (el jefe del comité). En algunos casos, se requería más información para completar la adjudicación. El Comité de valoración de eventos adjudicó los episodios según los criterios preespecificados en el «Manual de operaciones» .
Obtención de la muestra y análisis metabolómicoDurante la visita basal, es decir, varios años antes de la aparición de la IC o la FA, los participantes proporcionaron una muestra de sangre tras al menos 8 h de ayuno. Todas las muestras se procesaron en cada uno de los centros de preselección antes de que pasaran 2 h de su obtención y se almacenaron a –80°C hasta su análisis. Las muestras se enviaron y analizaron en la misma serie analítica conservando el emparejamiento de casos y controles y siguiendo un orden aleatorio para reducir el sesgo y la variabilidad entre análisis. En el se explica el análisis metabolómico. La información sobre la relación entre la masa y la carga y el tiempo de retención se muestra en la .
CovariablesSe utilizaron cuestionarios al inicio del ensayo para obtener variables sociodemográficas sobre el estilo de vida, los antecedentes familiares, el predominio de enfermedades y el consumo de medicamentos. Se determinó la actividad física en el tiempo libre con la versión validada en español del cuestionario Minnesota de actividad física en el tiempo libre10. El nuevo diagnóstico de enfermedad coronaria (cualquier diagnóstico de angina de pecho o infarto de miocardio o intervención de revascularización coronaria) y de ictus (cualquier diagnóstico de ictus isquémico o hemorrágico o accidente isquémico transitorio) se obtuvo sin conocer la información metabolómica, según los criterios diagnósticos aplicados por el Comité clínico de criterios de valoración.
Análisis estadísticoLos valores individuales de los metabolitos se normalizaron y escalaron a múltiples de 1 desviación estándar (DE) con la transformación normal inversa basada en rangos. Se utilizó la media ± DE para describir los rasgos cuantitativos y el número absoluto y el porcentaje para describir las variables categóricas.
Se calculó el coeficiente de correlación de Pearson para la carnitina libre, las AC y los aminoácidos de cadena ramificada. También se organizaron modelos de regresión lineal con los valores de las AC como variables dependientes y los factores de riesgo CV como variables independientes y ajustadas a la edad y el sexo.
Se aplicaron modelos de regresión logística multivariable y condicional para tener en cuenta el emparejamiento entre los casos y los controles. Se calcularon las odds ratio (OR) emparejadas y sus intervalos de confianza del 95% (IC95%) para la IC o la FA al comparar los cuartiles superiores de las AC con el cuartil inferior, y para cada DE de las AC utilizándolas como variables continuas. Se calcularon los valores límite para cada cuartil según la distribución de las AC en los controles (es decir, los participantes sin IC o FA). Se ajustó el modelo multivariable al grupo de intervención (DietMed+aceite de oliva virgen extra [AOVE], DietMed+frutos secos o control), tabaquismo (nunca/actual/previo), índice de masa corporal (IMC), actividad física en el tiempo libre (equivalentes metabólicos [EM]/min/día), enfermedades crónicas predominantes (hipertensión, diabetes mellitus tipo 2 [DM2] y dislipemia) y consumo de medicamentos como inhibidores de la enzima de conversión de la angiotensina, diuréticos, otros tratamientos con antihipertensores, las estatinas y otras sustancias hipolipemiantes, insulina, sustancias hipoglucémicas orales y antiagregantes plaquetarios. Como análisis complementario, también se ajustaron por la enfermedad coronaria (angina de pecho, infarto de miocardio, revascularización coronaria) y el ictus de nuevo diagnóstico (isquémico o hemorrágico, incluidos los accidentes isquémicos transitorios) diagnosticados durante el seguimiento pero antes del diagnóstico de IC o FA. El ajuste por múltiples comparaciones se basó en el procedimiento de tasa de falsos descubrimientos propuesto por Simes11. En se describen los análisis estadísticos.
Los análisis estadísticos se realizaron con la versión 15.1 de Stata/SE (Stata Corp).
RESULTADOSSe analizaron los datos de 2 estudios de casos y controles anidados en el ensayo PREDIMED. Los casos de IC de nuevo diagnóstico fueron 326 y los nuevos casos de FA, 509. En total, hubo 727 casos porque 108 participantes sufrieron tanto IC como FA durante el seguimiento (). En la tabla 1 se muestran las características de los participantes de ambos estudios de casos y controles anidados en el ensayo PREDIMED.
Características basales de los pacientes de los grupos de casos de IC y FA y de control
| Serie de casos y controles para IC | Serie de casos y controles para FA | |||
|---|---|---|---|---|
| Controlesa | Casos con IC | Controlesa | Casos con FA | |
| Pacientes, n | 426 | 326 | 617 | 509 |
| Edad (años) | 70,4±5,9 | 70,3±5,8 | 68,5±6,1 | 68,3±6,1 |
| Mujeres, % | 54,2 | 58,3 | 49,3 | 49,7 |
| Grupo de intervención, % | ||||
| DietMed+AOVE | 37,6 | 30,1 | 36,5 | 31,4 |
| DietMed+frutos secos | 26,5 | 32,5 | 28,5 | 31,4 |
| Control | 35,9 | 36,4 | 35,0 | 37,1 |
| Tabaquismo, % | ||||
| Nunca | 61,3 | 59,8 | 58,0 | 58,7 |
| Previo | 27,5 | 25,8 | 28,7 | 726,9 |
| Actual | 11,2 | 14,4 | 13,3 | 14,4 |
| Actividad física (MET/min/día) | 217±220 | 216±204 | 229±220 | 228±216 |
| Estudios, % | ||||
| Elementales o inferiores | 81,7 | 85,0 | 78,8 | 76,0 |
| Secundaria o superior | 18,3 | 15,0 | 20,2 | 24,0 |
| Ingesta calórica total (kcal/día) | 2.279±637 | 2.217±632 | 2.342±603 | 2.285±600 |
| Adherencia a la DietMedb | 8,6±2,0 | 8,5±2,0 | 8,8±1,9 | 8,7±2,0 |
| Consumo de alcohol (g/día) | 8,4±13 | 8,1±15 | 9,9±15 | 8,9±13 |
| Perímetro abdominal (cm) | ||||
| Mujeres | 98,1±10,2 | 101,89±10. | 98,0±10,3 | 100,7±10,2 |
| Varones | 101,2±8,8 | 106,4±9,4 | 102,9±8,9 | 106,0±8,8 |
| Perímetro abdominal > 88cm (mujeres) o > 102cm (varones), % | 64,1 | 80,7 | 68,6 | 76,8 |
| Índice de masa corporal | 29,4±3,6 | 31,1±3,8 | 29,8±3,8 | 30,7±3,8 |
| Antecedentes familiares de EC prematura, % | 19,3 | 19,3 | 20,1 | 19,1 |
| Hipertensión, % | 82,2 | 87,4 | 82,8 | 88,4 |
| Dislipemia, % | 69,0 | 64,1 | 68,4 | 52,2 |
| Diabetes mellitus tipo 2, % | 52,1 | 59,5 | 49,9 | 47,9 |
| FA, % | 0 | 4,3 | - | - |
| IC, % | - | - | 0,2 | 0,4 |
AOVE: aceite de oliva virgen extra; EC: enfermedad coronaria; FA: fibrilación auricular; IC: insuficiencia cardiaca; MET: equivalentes metabólicos.
Salvo otra indicación, los valores expresan media ± desviación estándar.
Se observó una gran correlación entre las AC de cadenas corta, mediana y larga (). En la , se muestran los coeficientes beta de los valores de las AC según los diversos factores de riesgo CV. La glucosa se asoció con las AC de cadena corta y los triglicéridos, con las AC de cadena mediana.
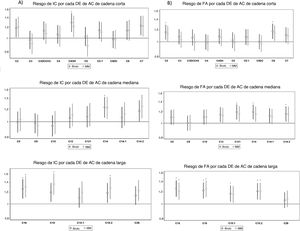
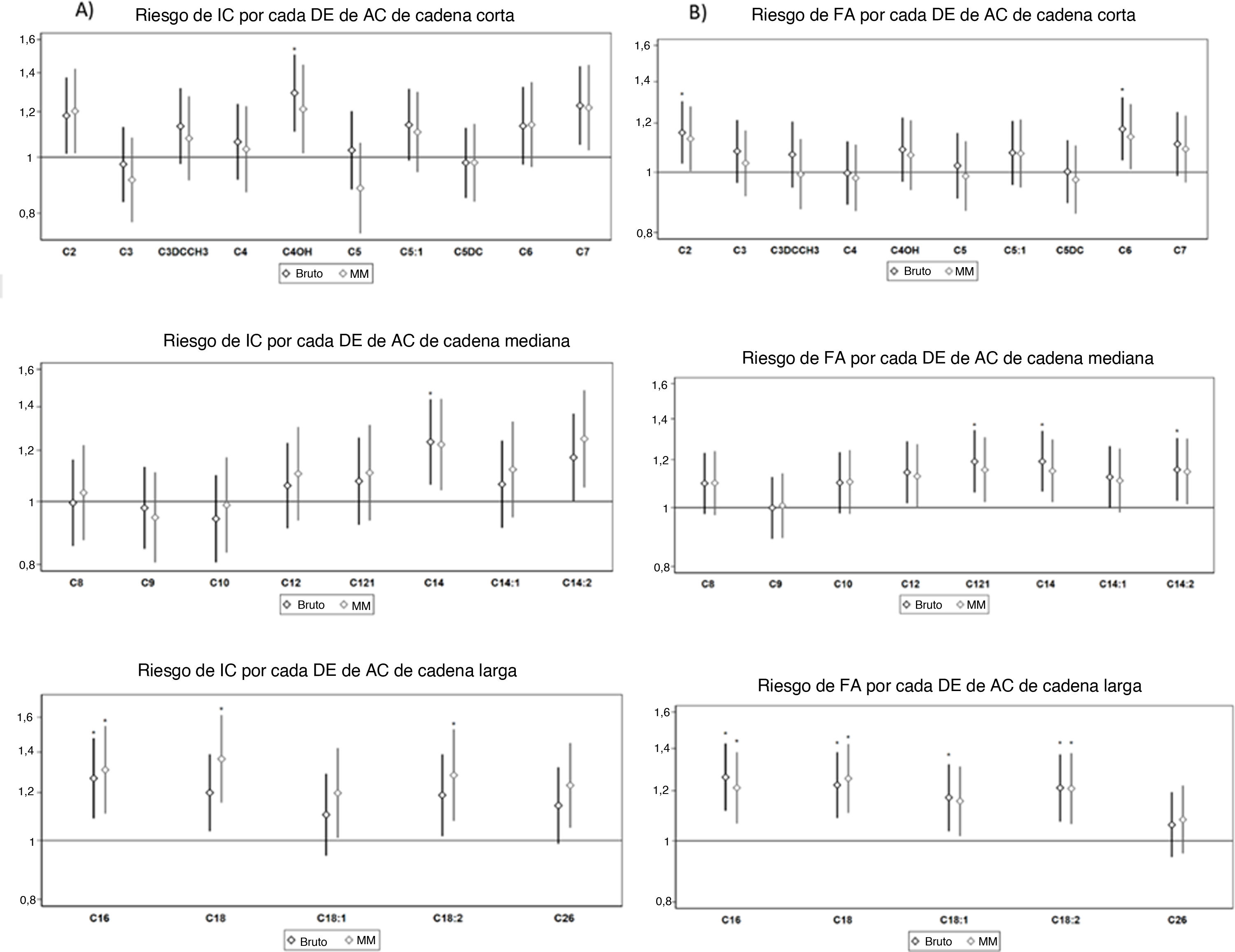
Acilcarnitinas y riesgo de insuficiencia cardiacaEn el modelo multivariable, la C14, la C16, la C18 y la C18:2 se asociaron con un mayor riesgo de IC tras la corrección para comparaciones múltiples (figura 1A, ). Los resultados significativos siguieron siendo los mismos para la C16, la C18 y la C18:2 al ajustar también por los aminoácidos de cadena ramificada ().
Odds ratio (intervalo de confianza del 95%) entre la concentración basal de AC y la incidencia de IC o FA en estudios de casos y controles anidados (emparejados por sexo, edad y centro de preselección). AC: acilcarnitina; DE: desviación estándar; FA: fibrilación auricular; IC: insuficiencia cardiaca; MM: modelo multivariable ajustado por grupo de intervención, índice de masa corporal, tabaquismo, actividad física en el tiempo libre, enfermedades crónicas predominantes y consumo de medicamentos.
Durante el seguimiento, 50 pacientes con IC sufrieron enfermedad coronaria o cerebrovascular antes del diagnóstico de IC y otros 54 controles también sufrieron por lo menos 1 de estos eventos CV mayores. No se observaron cambios en la asociación entre cada una de las AC y la IC al ajustar por una enfermedad coronaria incidente previa o enfermedad cerebrovascular (no se muestran datos).
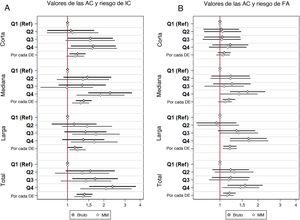
La puntuación total con todas las AC se relacionó con un mayor riesgo de IC (). Se observó mayor riesgo con los valores de las AC de cadena mediana y larga en la comparación entre los cuartiles extremos (figura 2A). Los valores de las AC de cadena mediana y larga se asociaron de manera significativa con la IC como variables continuas (figura 2A y ). No se observaron diferencias significativas en las pruebas de interacción al analizar la modificación del posible efecto por sexo o grupo de edad (≤ 70 frente a > 70 años) en la asociación entre los valores de las AC y el riesgo de IC ().
Relación entre las puntuaciones basales combinadas (suma ponderada de los valores normalizados de cada metabolito, con el método de validación cruzada dejando uno fuera para evitar el sobreajuste) de las acilcarnitinas en plasma y la incidencia de IC o FA en los estudios de casos y controles (casos y controles emparejados por sexo, edad y centro de preselección) anidados en el ensayo PREDIMED. AC: acilcarnitina; DE: desviación estándar; FA: fibrilación auricular; IC: insuficiencia cardiaca; MM: modelo multivariable ajustado por grupo de intervención, índice de masa corporal, tabaquismo, actividad física en el tiempo libre, enfermedades crónicas predominantes y consumo de medicamentos.
Con respecto al riesgo de FA, las AC C16, C18 y C18:2 se asociaron con mayor riesgo de FA tras la corrección por múltiples comparaciones (figura 1B, ). Estas asociaciones no cambiaron tras ajustar también por los aminoácidos de cadena ramificada (). Un total de 62 sujetos con FA y 73 controles sufrieron enfermedad coronaria o cerebrovascular antes del diagnóstico de FA. No se observaron cambios tras ajustar también por estas enfermedades CV de nuevo diagnóstico previas (no se muestran datos).
Se observó que solo las ACCL se relacionan de manera significativa con el riesgo de FA, con OR = 1,20 (IC95%, 1,06-1,36; p de tendencia = 0,005) por cada DE (). No se observó ninguna modificación del efecto por sexo o grupo de edad (≤ 70 frente a > 70 años) ().
Acilcarnitinas y resultado compuesto de la insuficiencia cardiaca/fibrilación auricularEn el resultado compuesto de los casos de IC o FA, se observó una asociación significativa de los valores de AC de cadena mediana y ACCL (). Tras un ajuste recíproco por todos los valores de AC, la IC incidente se asoció de manera significativa solo con las AC de cadena mediana y la FA incidente, solo con las ACCL ().
En los modelos polinomiales de regresión logística (tabla 2), la probabilidad de sufrir solamente IC, frente a los participantes sin IC o FA incidentes, fue un 27% (IC95%, 8-49%) mayor por cada DE del valor de la AC de cadena mediana, que no fue significativo para los participantes que solo sufrieron FA, un 40% (IC95%, 9-78%) mayor para los que sufrieron IC y FA por cada DE del valor de AC de cadena mediana. Se observó similar mayor riesgo solo para la IC o la FA por cada aumento de la DE del valor de las ACCL y se halló una asociación significativa entre la AC de cadena corta y el riesgo de sufrir solo IC frente a los participantes sin IC o FA.
Odds ratio e intervalos de confianza del 95% de los modelos polinomiales de regresión logística en los que se observa la asociación entre los valores plasmáticos basales de acilcarnitinas y un resultado compuesto
| OR (IC95%) multivariablea ajustada | ||
|---|---|---|
| por cada incremento de 1 DEb | p | |
| Sin IC ni FA (n=726) | ||
| AC de cadena corta | 1,00 (ref.) | - |
| AC de cadena mediana | 1,00 (ref.) | - |
| AC de cadena larga | 1,00 (ref.) | - |
| AC totales | 1,00 (ref.) | - |
| Solo IC (n=218) | ||
| AC de cadena corta | 1,23 (1,02-1,48) | 0,035 |
| AC de cadena mediana | 1,27 (1,08-1,49) | 0,004 |
| AC de cadena larga | 1,22 (1,09-1,38) | 0,001 |
| AC totales | 1,38 (1,14-1,66) | 0,001 |
| Solo FA (n=401) | ||
| AC de cadena corta | 1,08 (0,97-1,19) | 0,158 |
| AC de cadena mediana | 1,07 (0,97-1,18) | 0,154 |
| AC de cadena larga | 1,25 (1,09-1,43) | 0,001 |
| AC totales | 1,17 (1,05-1,30) | 0,004 |
| IC y FA (n=108) | ||
| AC de cadena corta | 0,99 (0,81-1,21) | 0,909 |
| AC de cadena mediana | 1,40 (1,09-1,78) | 0,007 |
| AC de cadena larga | 1,29 (0,98-1,69) | 0,072 |
| AC totales | 1,31 (0,94-1,84) | 0,111 |
AC: acilcarnitina; AOVE: aceite de oliva virgen extra; DE: desviación estándar; DietMed: dieta mediterránea; FA: fibrilación auricular; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; OR: odds ratio; ref.: referencia.
Ajuste por edad, sexo, centro de preselección, grupo de intervención (DietMed + AOVE, DietMed + frutos secos), índice de masa corporal, tabaquismo (nunca, actual, previo), actividad física en el tiempo libre (equivalentes metabólicos en min/día), enfermedades crónicas predominantes (dislipemia, hipertensión y diabetes mellitus) y consumo de medicamentos (inhibidores de la enzima de conversión de la angiotensina, diuréticos, otros tratamientos antihipertensivos, estatinas y otros hipolipemiantes, insulina, hipoglucemiantes orales y tratamiento antiagregante plaquetario).
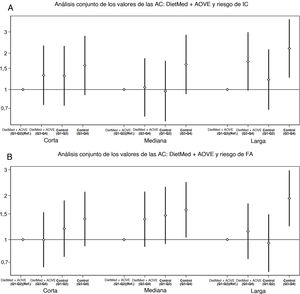
En la figura 3 se muestra el análisis conjunto por cuartiles de los valores de las AC (Q1-Q2 frente a Q3-Q4) y la intervención con dieta (DietMed + AOVE frente al grupo de control) y la relación con el riesgo de IC o de FA. En el grupo asignado a DietMed + AOVE, se modificó el efecto de las altas concentraciones de AC de cadena larga (Q3-Q4) en el riesgo de FA comparado con el grupo de control (p de interacción aditiva = 0,036). No se observaron otras interacciones aditivas o multiplicativas según los grupos de intervención.
Odds ratioa (IC95%) del análisis conjunto de los valores de las ACb/DietMed + AOVE y el riesgo de IC o FA en estudios de casos y controles anidados en el ensayo PREDIMED. A: ERRI: AC de cadena corta, −0,05 (IC95%, −1,15 a 1,04; p=0,924); AC de cadena mediana, 0,53 (IC95%, −0,29 a 1,35, p=0,209); AC de cadena larga, 0,23 (IC95%, −0,41 a 0,87; p=0,478). B: ERRI: AC de cadena corta, 0,17 (IC95%, −0,37 a 0,71; p=0,534); AC de cadena mediana, −0,21 (IC95%, −0,94 a 0,51, p=0,562); AC de cadena larga, 0,77 (IC95%, 0,05-1,48; p=0,036). En el análisis no se incluyó el grupo con DietMed + frutos secos. AC: acilcarnitina; AOVE: aceite de oliva virgen extra; DietMed: dieta mediterránea; ERRI: exceso de riesgo relativo debido a la interacción; FA: fibrilación auricular; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%. aAjustadas por grupo de intervención, índice de masa corporal, tabaquismo, actividad física en el tiempo libre, enfermedades crónicas predominantes y consumo de medicamentos. bSuma ponderada de los valores normalizados de cada metabolito.
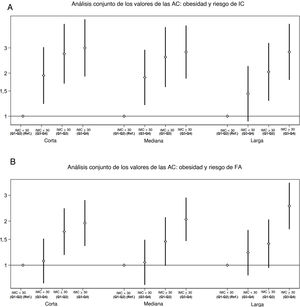
Se observó un mayor riesgo de FA asociado con las altas concentraciones de ACCL (Q3-Q4) en los participantes obesos comparados con los no obesos (p de interacción aditiva = 0,022) (figura 4). No se observaron interacciones significativas excepto por la relación entre las AC de cadena corta y la IC en el análisis estratificado por DM2.
Odds ratioa (IC95%) del análisis conjunto de los valores de las ACb/obesidad y riesgo de IC o FA en estudios de casos y controles anidados en el ensayo PREDIMED. A: RERI: AC de cadena corta, −0,65 (IC95%, −2,15 a 0,84; p=0,392); AC de cadena mediana, −0,65 (−2,08 a 0,79; p=0,377); AC de cadena larga, 0,34 (IC95%, −0,83 a 1,51; p=0,568). B: RERI: AC de cadena corta, 0,18 (IC95%, −0,55 a 0,91; p=0,634); AC de cadena mediana, 0,56 (IC95%, −0,13 a 1,25, p=0,112); AC de cadena larga, 0,92 (IC95%, 0,14-1,70; p=0,022). AC: acilcarnitina; FA: fibrilación auricular; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; RERI: exceso de riesgo relativo debido a la interacción. aAjustada por grupo de intervención, índice de masa corporal, tabaquismo, actividad física en el tiempo libre, enfermedades crónicas predominantes y consumo de medicamentos. bSuma ponderada de los valores normalizados de cada metabolito.
En 2 estudios de casos y controles emparejados y anidados en el ensayo PREDIMED, el riesgo de IC y FA de nuevo diagnóstico fue mayor entre los sujetos con una concentración basal de ACCL elevada, mientras que algunas AC de cadena corta o mediana tuvieron una asociación más claramente positiva con la IC. Los resultados también indican una posible modificación del efecto de la concentración elevada de las ACCL en el riesgo de FA por obesidad definido como un IMC ≥ 30 (que aumenta el riesgo) y por una intervención de la DietMed suplementada con AOVE (que reduce el riesgo).
Los resultados coinciden con algunos resultados de estudios de casos y controles sobre IC previos. En un estudio se identificaron concentraciones altas de linoleilcarnitina e hidroxibutirilcarnitina en los pacientes con IC en etapa C frente a los controles12. En el estudio CATHGENE, se observó mayor concentración de 6 ACCL en pacientes con IC y fracción de eyección reducida (IC-FEr) que en aquellos con IC y fracción de eyección conservada (IC-FEc), y en ambos tipos de IC las concentraciones fueron mayores que en los controles13. En un estudio de casos y controles de menor tamaño, la concentración de ACCL fue mayor en los pacientes con IC que en los controles14. Por último, según los resultados del estudio Mälmo, hay asociación entre las AC de cadena mediana y las ACCL15. En el presente estudio se halló una asociación más convincente entre las AC de cadena mediana y la IC, pero no con las ACCL. Esta discrepancia se explicaría porque se analizó la asociación entre las AC basales y la IC incidente en lugar de determinar la concentración de las AC de los pacientes que ya tenían diagnóstico de IC.
En el estudio de cohortes MURDOCK, las AC de cadena mediana, las AC dicarboxil de cadena corta y las ACCL se relacionaron con FA incidente en los pacientes remitidos a angiografía coronaria16. Se observó la mayor asociación entre las ACCL y la FA, mientras que la asociación con las AC de cadena corta o mediana perdió significación después de ajustar por distintos factores de confusión. No se proporcionó información detallada sobre las AC concretas asociadas a la IC, pero los autores clasificaron la palmitoil-L-carnitina como AC de cadena mediana y no como una ACCL, tal como se hizo en el presente estudio. Otra diferencia es que en el estudio MURDOCK se incluyó a pacientes que habían sufrido FA tras la cirugía de revascularización coronaria16, mientras que en el ensayo PREDIMED se excluyeron los casos de FA incidente posoperatoria17. La función de las ACCL está respaldada por su conocido efecto de aumentar el calcio intracelular e inducir las alteraciones electrofisiológicas en los sistemas experimentales donde la expulsión de calcio aumenta en función de la concentración de palmitoil-L-carnitina y estearoil-L-carnitina, pero no por los ésteres de cadena corta18.
El análisis y la interpretación de la concentración plasmática de las AC son complejos porque la concentración aumentada se relaciona con varias enfermedades crónicas. Los participantes en el estudio corrían un riesgo CV alto, con una edad promedio de 70 años y un IMC medio de 30 y más del 50% de ellos sufrían DM2. Todos estos factores se relacionan con una mayor concentración plasmática de AC. No se observaron diferencias significativas en la asociación entre las AC y el riesgo de IC o FA al estratificar por sexo o grupo de edad (≤ 70 frente a > 70 años). Estos resultados coinciden con un estudio en el que se observaron similares concentraciones totales de las AC en varones y mujeres19. No obstante, en otro estudio se observaron efectos específicos en función del sexo del tabaquismo y el IMC en el metabolismo de las AC20, por lo que están justificados más estudios sobre los posibles efectos (o modificación del efecto) del IMC y el tabaquismo. Se observaron asociaciones entre concentración de AC y algunos factores de riesgo CV. En un estudio previo dentro del ensayo PREDIMED, se observó que las AC de cadena corta y las ACCL aumentaban el riesgo de DM221, mientras que la concentración plasmática de las AC de cadena corta y mediana se relacionó con enfermedad CV5 (infarto de miocardio, ictus y muerte CV). En otros estudios se ha observado que las mayores concentraciones de hidroxibutirilcarnitina, AC de cadena mediana y oleoilcarnitina se asociaban con una situación prediabética, DM2 y factores de riesgo cardiometabólico22. En un estudio de menor tamaño se observaron correlaciones positivas significativas entre las AC, las medidas de sobrepeso/obesidad (IMC y perímetro abdominal) y la presión arterial diastólica y una correlación negativa con el colesterol unido a lipoproteínas de alta densidad (cHDL)23. Se requieren más estudios con muestras de mayor tamaño para evaluar estas relaciones e identificar los posibles biomarcadores asociados con riesgo de IC y FA y el posible efecto modulador de factores de riesgo CV como una glucemia elevada y la obesidad24,25.
La propionilcarnitina y la isovalerilcarnitina son subproductos del metabolismo de los aminoácidos de cadena ramificada, y se observan mayores concentraciones plasmáticas de aminoácidos de cadena ramificada y AC C3/C5 en las personas con sobrepeso y síndrome metabólico26. Se observó relación entre la glucemia en ayunas y las AC de cadena corta, y una relación mayor entre las AC de cadena corta y mediana y la IC o la FA en los participantes obsesos, aunque la interacción no fue significativa. Además, ya se ha mencionado la relación entre los aminoácidos de cadena ramificada y la enfermedad CV27 y la DM228.
Las AC de cadena mediana y las ACCL son subproductos de la producción mitocondrial de energía a través del catabolismo oxidativo de los ácidos grasos. Las ACCL intervienen principalmente en el metabolismo muscular y cardiaco y se ha indicado que el corazón puede ser el mayor contribuyente a las ACCL del plasma29. La acumulación de las ACCL en el miocardio diabético refleja alteraciones en los ácidos grasos como sustrato energético30. Durante la aparición de la IC, se altera la capacidad del corazón para utilizar los ácidos grasos como principal fuente energética y se utilizan los cuerpos cetónicos como fuente alternativa31. La propuesta de esta disfunción mitocondrial como mecanismo molecular habitual entre la IC y la FA se basa en modelos animales32.
La asociación entre las ACCL y la IC o la FA fue mayor entre los participantes obsesos y los asignados al grupo de control. Esta relación puede explicarse por la inflamación sistémica crónica relacionada con la obesidad y el efecto antiinflamatorio de la DietMed y el AOVE. La acumulación de las ACCL interviene en la activación de vías de señalización proinflamatorias y la inflamación sistémica es un proceso mecanístico habitual de la IC y la FA33. Este proceso inflamatorio está conectado a la expansión del tejido adiposo epicárdico que interviene en la patogénesis de la FA34 y es notable en pacientes con IC-FEc y FA3. No obstante, se requieren más investigaciones para comprender mejor si el posible efecto protector de la DietMed + AOVE tiene lugar a través de una modulación del efecto de la oxidación de los ácidos grasos en la FA o mediante la atenuación del efecto inflamatorio de las ACCL. Además, en un ensayo realizado en España se halló relación entre la intervención con DietMed y cambios en los metabolitos circulantes, como las AC, y estos cambios se asociaron con una disminución de la glucosa, la insulina y el valor de HOMA-IR35. Por otro lado, en este estudio se indicó una interacción entre la dieta, los metabolitos circulantes y la microbiota intestinal. Un punto fuerte importante del presente estudio es el diseño prospectivo de 2 estudios de casos y controles emparejados anidados en el ensayo PREDIMED, que permitió conservar la secuencia temporal adecuada porque se determinaron las AC plasmáticas años antes de la aparición de la IC y la FA incidentes. Otro punto fuerte es la capacidad de controlar por un gran número de posibles factores de confusión. Además, gracias al diseño aleatorizado, se pudo estudiar si la intervención con DietMed modifica las asociaciones observadas.
LimitacionesEste estudio también tiene varias limitaciones. En primer lugar, no se pudo determinar en la mayoría de los casos de IC si se trataba de pacientes con IC-FEr o IC-FEc. En otros estudios se han observado diferencias en la relación entre la concentración de las AC y la IC-FEr o la IC-FEc13. Así pues, se requieren más estudios para aclarar si la superposición entre la IC y la FA depende del tipo de IC, así como la asociación con la DietMed enriquecida con AOVE. Segundo, el número de casos fue relativamente bajo, sobre todo en lo que respecta a los sujetos con IC y la superposición entre los sujetos con IC y los sujetos con FA. Asimismo, el estudio de las posibles interacciones en las que intervienen la obesidad o la dieta requeriría estudios con una muestra de mayor tamaño. No obstante, este estudio tiene un diseño único para analizar la modificación del efecto de la DietMed y se analizaron las interacciones en escalas aditivas y multiplicativas. Tercero, se identificó un pequeño número de AC y se requieren más estudios para examinar si otras AC se relacionan con la IC y la FA. No obstante, los resultados han confirmado asociaciones previas entre algunas de las AC determinadas y los riesgos de FA e IC. Cuarto, no se cuantificó la concentración absoluta de las AC, y las implicaciones clínicas prácticas probablemente requieran más evaluaciones en el contexto clínico. Sin embargo, los resultados de este estudio aportan nuevos conocimientos sobre las asociaciones habituales y diferenciales entre las AC y la IC o la FA y los posibles mecanismos asociados con la DietMed. Por último, estos resultados no pueden extrapolarse a otras poblaciones de edad distinta o predominio distinto de factores de riesgo CV.
CONCLUSIONESEn una población de sujetos con alto riesgo de enfermedad CV, las ACCL basales se relacionaron de manera significativa con un mayor riesgo de IC o FA incidente, y en algunas AC de cadena corta o mediana se constató una mayor asociación positiva con la IC. Se observó que el mayor riesgo asociado con las concentraciones de AC aumentadas es el de aparición simultánea de IC y FA. Una intervención con DietMed + AOVE podría atenuar el efecto perjudicial de las ACCL en el riesgo de FA.
FINANCIACIÓNEste trabajo fue financiado por la subvención de investigación R01HL118264 de los National Institutes of Health estadounidenses. El ensayo PREvención con DIeta MEDiterránea fue financiado por fondos de la Agencia oficial para investigaciones biomédicas del Gobierno de España, el Instituto de Salud Carlos III (ISCIII), a través de ayudas proporcionadas a redes de investigación creadas específicamente para el ensayo (RTIC G03/140, a Ramón Estruch de 2003-2005; RTIC RD 06/0045, a Miguel A. Martínez-González de 2006-2013 y a través del Centro de Investigación Biomédica en Red de Fisiopatología de la Obesidad y Nutrición [CIBEROBN]), y por subvenciones del Centro Nacional de Investigaciones Cardiovasculares (CNIC 06/2007), el Fondo de Investigación Sanitaria-Fondo Europeo de Desarrollo Regional (PI04–2239, PI 05/2584, CP06/00100, PI07/0240, PI07/1138, PI07/0954, PI 07/0473, PI10/01407, PI10/02658, PI11/01647, P11/02505, PI13/00462 y JR17/00022), el Ministerio de Ciencia e Innovación (AGL-2009–13906-C02, AGL2010–22319-C03 y SAF2016–80532-R), la Fundación Mapfre 2010, la Consejería de Salud de la Junta de Andalucía (PI0105/2007), el Servicio de Salud Pública del Departamento de Salud de la Generalitat de Cataluña, la Generalitat Valenciana (ACOMP06109, GVA-COMP2010–181, GVACOMP2011–151, CS2010-AP-111, PROMETEO 17/2017 y CS2011-AP-042), la Fundació La Marató-TV3 (subvenciones 294/C/2015 y 538/U/2016) y el Gobierno Foral de Navarra (P27/2011). La Marta Guasch-Ferré recibió financiación de la American Diabetes Association (#1-18-PMF-029). Jordi Salas-Salvadó recibió financiación parcial de ICREA bajo el programa ICREA Academia.
CONTRIBUCIÓN DE LOS AUTORESM. Ruiz-Canela llevó a cabo los análisis estadísticos, redactó el artículo y es responsable del contenido general como garante. M. Guasch-Ferré, F.B. Hu, E. Toledo, C. Razquin, P. Hernández, C.B. Clish, L. Liang, C. Wittenbecher, J. Salas-Salvadó y M.Á. Martínez-González contribuyeron de manera sustancial a idear y diseñar este estudio. Todos los autores contribuyeron de manera sustancial en la obtención de los datos, su análisis o interpretación. Todos los autores hicieron una revisión crítica del importante contenido intelectual del artículo y aprobaron la versión final.
CONFLICTO DE INTERESESJ. Salas-Salvadó declara ser un miembro no remunerado de la Nut and Dried Fruit Foundation y el Instituto Internacional Danone, es miembro del Instituto Danone (España) y recibe financiación parcial de ICREA bajo el programa ICREA Academia. Los demás autores declaran no tener conflictos de intereses. Función de los patrocinadores: ninguna de estas fuentes de financiación desempeñó papel alguno en el diseño, la recogida, el análisis o la interpretación de los datos o en la decisión de presentar el artículo para su publicación.
- –
La desregulación metabólica de los ácidos grasos en la mitocondria es un mecanismo habitual involucrado en la aparición de insuficiencia cardiaca y fibrilación auricular, y el aumento de las acilcarnitinas se relaciona con un mayor riesgo de sufrir ambas enfermedades.
- –
Las AC de cadena larga (ACCL) aumentadas en el plasma de los pacientes con alto riesgo cardiovascular se relaciona con un mayor riesgo de IC o FA incidentes. Se observaron interacciones aditivas entre las ACCL y el riesgo de FA con la DietMed enriquecida con aceite de oliva virgen extra (p de interacción aditiva = 0,036) y con la obesidad (p=0,022), directa e inversa respectivamente.