Evaluar en pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) sometidos a angioplastia primaria con qué ritmo se ha introducido en la práctica clínica (2010-2017) los tratamientos con stents farmacoactivos, ticagrelor, prasugrel y antiagregante plaquetario doble (TAPD) prolongado y su potencial impacto en el resultado a 2 años.
MétodosAnálisis retrospectivo de un registro prospectivo exhaustivo de 14.841 pacientes con IAMCEST sometidos a angioplastia primaria entre 2010 y 2017. Los eventos índice se obtuvieron del Registro de Código IAM de Cataluña y los eventos en el seguimiento, del conjunto mínimo de datos de altas hospitalarias. Se definió el TAPD a partir de la dispensación farmacéutica. Se evaluó el resultado a 24 meses. Las tendencias temporales de los factores de exposición y los resultados se analizaron mediante modelos de regresión.
ResultadosLa edad> 65 años, la diabetes, la insuficiencia renal, la insuficiencia cardiaca previa y la necesidad de anticoagulación al alta fueron más frecuentes en periodos más tardíos (p <0,001). Entre 2010 y 2017 el implante de stents farmacoactivos aumentó del 31,1 al 69,8%; la prescripción de ticagrelor, del 0,1 al 28,6% y la de prasugrel, del 1,5 al 23,8%, y la media de meses consecutivos con TAPD, de 2 a 10 (p <0,001 en todos los casos). El análisis ajustado mostró una tendencia temporal a disminución del riesgo de la variable de resultado principal: el evento compuesto de muerte, infarto agudo de miocardio, ictus y nueva revascularización (reducción absoluta de la probabilidad, el 0,005% por trimestre; OR=0,995; IC95%, 0,99-0,999; p=0,028). Todos los componentes individuales excepto el ictus mostraron una reducción de la probabilidad, solo significativa para la aparición de nueva revascularización.
ConclusionesA pesar de un importante aumento de la prescripción y la duración del TAPD, ticagrelor y prasugrel y el implante de stents farmacoactivos entre 2010 y 2017, no se observó una reducción importante en los resultados cardiovasculares principales.
Palabras clave
Si bien la disminución de las tasas de mortalidad de pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) se ha atribuido fundamentalmente a los beneficios de la reperfusión temprana1,2, otros tratamientos concomitantes del IAMCEST también han alcanzado el mayor nivel de recomendación en las guías de práctica clínica durante la última década. Así, la utilización de stents farmacoactivos (SFA) en la intervención coronaria percutánea (ICP) primaria, los inhibidores del receptor P2Y12 ticagrelor y prasugrel y el mantenimiento del tratamiento antiagregante plaquetario doble (TAPD) al menos los primeros 12 meses si no hay contraindicaciones se han convertido con el paso del tiempo en el tratamiento habitual3-5.
Aunque estas recomendaciones de las guías de práctica clínica con un elevado nivel de evidencia se basan en grandes ensayos clínicos aleatorizados6–10, pocos estudios han analizado con qué ritmo se han introducido en la práctica clínica y su impacto general en los resultados a medio plazo de pacientes con IAMCEST revascularizado11. En la actualidad, dado que la adhesión a las guías de práctica clínica no es inmediata, se esperaría un retraso en su potencial beneficio cuando estas recomendaciones se introduzcan en la práctica clínica11,12.
El registro Codi IAM recopila, de forma prospectiva desde 2010, datos de una cohorte exhaustiva de pacientes con IAMCEST en la Comunidad Autónoma de Cataluña (España)13–16. Se calcula que el registro incluye más del 90% de todos los casos de IAMCEST de Cataluña que se notifican al sistema sanitario13. La recopilación y el tratamiento de datos del Codi IAM se han mantenido prácticamente sin cambios a lo largo del tiempo, lo que puede evitar algunos sesgos. Además, vincular los datos sobre episodios de hospitalización, registros de mortalidad y renovación de recetas con el Conjunto Mínimo Básico de Datos (CMBD) permite evaluar los resultados a lo largo del tiempo y su relación con la introducción de tratamientos específicos en la práctica clínica. En este estudio, se evaluó en pacientes con IAMCEST tratados con ICP primaria y dados de alta vivos con qué ritmo se introdujeron en la práctica clínica 4 intervenciones de interés (implante de SFA, ticagrelor, prasugrel y TAPD prolongado) desde 2010 y la relación potencial entre el cambio a lo largo del tiempo y los resultados a 2 años en función de cuánto se utilizaron las intervenciones especificadas.
MÉTODOSDiseño del estudio y fuentes de informaciónSe trata de un análisis retrospectivo de datos de pacientes incluidos prospectivamente en un registro clínico específico de IAM, vinculado con datos administrativos de prescripción farmacéutica, CMBD y registros de mortalidad.
Los datos se obtuvieron a través del programa de Análisis de datos públicos para la investigación y la innovación en salud (PADRIS). El programa facilita el acceso a diferentes fuentes de información sobre utilización de los servicios públicos de salud de la población de Cataluña vinculadas a nivel de paciente, cumpliendo con los principios éticos y la Ley española de protección de datos 3/2018. El protocolo del estudio fue aprobado por el comité ético del Hospital Vall d’Hebron y no requirió el consentimiento informado de los pacientes.
Los criterios de admisión y la información clínica basal se obtuvieron del registro de la red Codi IAM. Este registro se puso en marcha en 2010 para evaluar el rendimiento de la red de reperfusión de emergencia Codi IAM, que consiste en la activación de un conjunto de acciones coordinadas dirigidas a tratar a los pacientes con IAMCEST con la mejor alternativa terapéutica en el momento oportuno13,16. La base de datos que integra el registro pertenece al Departamento de Salud de Cataluña y contiene datos demográficos, clínicos y terapéuticos. Cumple los requisitos éticos y legales para fines de investigación. Todos los métodos del estudio se ajustan a las normas éticas descritas en la Declaración de Helsinki. Periódicamente se comprueba la calidad de los datos del registro mediante una auditoría externa. Si bien el registro se puso en marcha en 2010, en años posteriores se han ido incorporando diversas variables. Para el presente análisis, solo se tuvieron en cuenta las variables que se registraron desde el inicio en 2010.
Los eventos durante el seguimiento se obtuvieron del CMBD (), mientras que la muerte se obtuvo del Registro de Mortalidad. El tratamiento farmacológico durante el seguimiento se obtuvo de la base de datos de dispensación farmacéutica, que registra todos los productos de farmacia y el número de envases dispensados a cada individuo cada mes.
Criterios de inclusiónSe incluyó a todos los pacientes registrados en la base de datos de la red Codi IAM que sobrevivieron al episodio inicial (dados de alta con vida o que estaban vivos 2 semanas después del IAMCEST) y se sometieron a una ICP primaria, con datos disponibles de un mínimo de 2 años de seguimiento. Se excluyó a los pacientes sin información completa sobre el tratamiento durante el seguimiento.
Definición de exposiciónSe cuantificó en qué grado se introdujeron en la práctica clínica 4 intervenciones de interés (implante de SFA durante el procedimiento inicial, prescripción de ticagrelor al alta, prescripción de prasugrel al alta y meses consecutivos de TAPD) desde 2010.
El uso de SFA se obtuvo del registro Codi IAM o del CMBD (código diagnóstico 36.07 para los SFA y 36.06 para los stents metálicos), mientras que el consumo de ticagrelor y prasugrel y el tiempo de TAPD se obtuvieron de la dispensación farmacéutica. El TAPD se definió como el tratamiento concomitante con ácido acetilsalicílico y un inhibidor del receptor P2Y12 todos los meses después del episodio inicial. El consumo de medicación se definió como la dispensación de 1 envase de cada fármaco por cada mes después del alta hospitalaria. Si se dispensaba más de 1 envase en 1 mes, los envases sobrantes se trasladaban a los meses siguientes para rellenar los espacios entre dispensaciones y hasta la última dispensación. Una vez trasladados los envases sobrantes, se consideró que finalizaba el tiempo de TAPD cuando había más de 2 meses consecutivos sin dispensación de los 2 fármacos.
Definición de resultadosLa variable de resultado principal es la compuesta definida como muerte por cualquier causa, infarto agudo de miocardio (IAM), ictus isquémico o revascularización después del episodio inicial y durante los primeros 2 años después del alta. El IAM y el ictus isquémico durante el seguimiento se definieron como un episodio de hospitalización posterior al alta del episodio índice con diagnóstico principal de IAM o ictus isquémico respectivamente. Las hemorragias mayores se definieron como un diagnóstico de ictus hemorrágico o hemorragia intraocular o un diagnóstico de hemorragia gastrointestinal u otros tipos de hemorragia que necesitaron tratamiento invasivo o transfusión de hemoderivados. Consulte la para conocer la definición de eventos a partir de los códigos de la Clasificación Internacional de Enfermedades 9 y 10. El seguimiento se interrumpió a los 24 meses del episodio inicial para garantizar una exposición por tiempo homogénea.
Análisis estadísticosLas variables cualitativas se describen mediante frecuencias absolutas y relativas. Las variables cuantitativas se describen como media ± desviación estándar o mediana [intervalo intercuartílico]. La distribución de todas las variables se comparó entre periodos de 2 años (2010-2011, 2012-2013, 2014-2015 y 2016-2017). Las tendencias temporales en variables cualitativas y continuas se evaluaron mediante una prueba no paramétrica de tendencia entre grupos ordenados (una extensión de la prueba de Kruskal-Wallis).
El análisis de eventos de resultado se realizó por paciente (es decir, el número de pacientes con al menos 1 evento durante el seguimiento de 2 años) y por el número total de eventos (es decir, el número total de eventos cada 1.000 pacientes-años de seguimiento). Se analizaron los siguientes eventos: muerte por cualquier causa, infarto de miocardio, ictus, revascularización, hemorragia mayor y la combinación de muerte, IAM, ictus y revascularización.
La tendencia temporal de las exposiciones de interés y los resultados se evaluó mediante modelos de regresión. Se utilizaron modelos lineales, logísticos y de Poisson con variables continuas y discretas respectivamente. La tendencia temporal se evaluó utilizando diferentes periodos de tiempo de referencia, como semanas, meses, trimestres y años. Se probaron tendencias lineales, cuadráticas y spline. Se ajustaron 3 modelos secuenciales multivariantes para calcular las tendencias temporales ajustando por los cambios en las características de los pacientes a lo largo del tiempo. El modelo «vacío» (M0) incluyó solo el tiempo (semanas, meses, trimestres o años) para probar la tendencia lineal temporal. En el modelo 1 (M1), se añadieron la edad (continua) y el sexo. En el modelo 2 (M2) se añadieron todos los factores de riesgo y comorbilidades que estaban disponibles en el registro durante todo el periodo de análisis: insuficiencia renal, IAM previo, diabetes, Killip III-IV y localización anterior del infarto de miocardio. Por último, como análisis de sensibilidad, se revaluaron todos los modelos excluyendo a los pacientes con tratamiento anticoagulante al alta.
Se utilizó la versión 4.0.4 de R para todos los análisis estadísticos. Se consideró significativo un valor de p < 0,05.
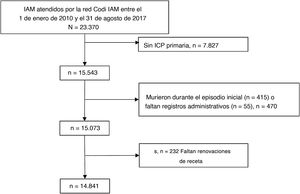
RESULTADOSEn la red Codi IAM se trató a 23.370 pacientes con sospecha de IAMCEST entre el 1 de enero de 2010 y el 31 de agosto de 2017. Tras la exclusión de los pacientes no sometidos a ICP primaria (n = 7.827; aproximadamente la mitad por activaciones poco apropiadas y el resto por diagnósticos finales distintos del IAM, ausencia de lesiones causales importantes u otros motivos), los que fallecieron durante el episodio inicial (n=415) y aquellos con faltantes en información administrativa (n=55) o dispensación farmacéutica (n=232), se obtuvieron datos válidos para los análisis de 14.841 pacientes (figura 1).
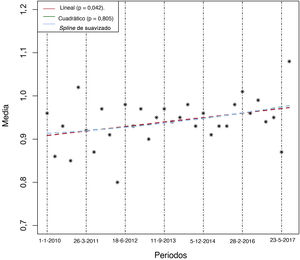
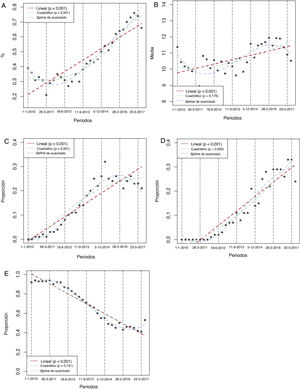
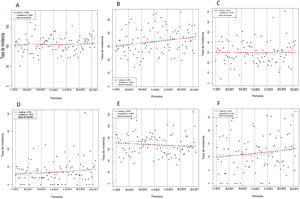
La tabla 1 compara las características basales y las intervenciones de interés entre periodos de 2 años. La media de edad aumentó considerablemente con el tiempo (p = 0,004), al igual que las prevalencias de diabetes (p=0,042) e insuficiencia renal (p <0,001) y la necesidad de anticoagulación al alta. En cambio, los antecedentes de IAM previo disminuyeron con el tiempo. No hubo diferencias importantes en otras variables de riesgo basales, aunque hubo una tendencia a mayor proporción de clase Killip III/IV (p=0,076) y mayor prevalencia de IAM anterior (p=0,072) en los periodos más tardíos. El análisis de regresión confirmó un claro aumento lineal en el tiempo del número medio de los siguientes factores de riesgo: edad > 65 años, diabetes, insuficiencia renal, insuficiencia cardiaca previa, IAM previo y necesidad de anticoagulación al alta (figura 2) (p de tendencia lineal = 0,0042), lo que indica que hubo una población en mayor riesgo en los periodos más recientes. El implante de SFA durante la ICP primaria y la prescripción al alta de ticagrelor, prasugrel y clopidogrel fueron notablemente diferentes entre los periodos bianuales (tabla 1). Los análisis gráficos de tendencias temporales confirmaron un fuerte aumento del implante de SFA junto con un aumento de la duración media del TAPD y un aumento del consumo de prasugrel y ticagrelor en lugar de clopidogrel (figura 3 y ).
Diferencias poblacionales y de intervención entre bienios
| 2010-2011(n=3.362) | 2012-2013(n=3.755) | 2014-2015(n=4.060) | 2016-2017(n=3.664) | p* | Todos(n=14.841) | |
|---|---|---|---|---|---|---|
| Edad (años) | ||||||
| Media±desviación estándar | 62,21±13,17 | 62,62±12,86 | 62,74±13,01 | 63,3±12,96 | 0,004 | 62,73±13 |
| Mediana [intervalo intercuartílico] | 52 [62-73] | 53 [62-73] | 53 [61-73] | 53 [62-73] | 62 [53-73] | |
| Intervalo | 24-93 | 24-98 | 29-96 | 27-98 | 24-98 | |
| Mujeres | 683 (20,3) | 795 (21,2) | 848 (20,9) | 795 (21,7) | 0,216 | 3.121 (21) |
| IAM previo | 289 (8,6) | 313 (8,3) | 295 (7,3) | 240 (6,6) | <0,001 | 1.137 (7,7) |
| Diabetes | 665 (19,8) | 739 (19,7) | 744 (18,3) | 816 (22,3) | 0,042 | 2.964 (20) |
| ICP previa | 203 (6) | 242 (6,4) | 263 (6,5) | 229 (6,2) | 0,728 | 937 (6,3) |
| Cirugía de revascularización coronaria previa | 28 (0,8) | 37 (1) | 50 (1,2) | 34 (0,9) | 0,478 | 149 (1) |
| Insuficiencia renal | 208 (6,2) | 231 (6,2) | 333 (8,2) | 315 (8,6) | <0,001 | 1.087 (7,3) |
| Enfermedad pulmonar obstructiva crónica | 343 (10,2) | 401 (10,7) | 457 (11,3) | 386 (10,5) | 0,500 | 1.587 (10,7) |
| Antecedentes de insuficiencia cardiaca | 584 (17,4) | 697 (18,6) | 768 (18,9) | 643 (17,5) | 0,782 | 2.692 (18,1) |
| Arteriopatía periférica | 102 (3) | 127 (3,4) | 147 (3,6) | 125 (3,4) | 0,317 | 501 (3,4) |
| Killip III-IV | 175 (5,2) | 223 (5,9) | 233 (5,7) | 232 (6,3) | 0,076 | 863 (5,8) |
| IAM anterior | 1.308 (38,9) | 1.458 (38,8) | 1.658 (40,8) | 1.480 (40,4) | 0,072 | 5.904 (39,8) |
| Anticoagulación al alta | 156 (4,6) | 211 (5,6) | 244 (6) | 249 (6,8) | 0,014 | 860 (5,8) |
| Intervenciones | ||||||
| Stent farmacoactivo | 1.046 (31,1) | 1.231 (32,8) | 1.991 (49) | 2.556 (69,8) | <0,001 | 6.824 (46) |
| Clopidogrel prescrito al alta | 3.115 (92,7) | 3.043 (81,0) | 2.216 (54,6) | 1.640 (44,8) | <0,001 | 10.014 (67,5) |
| Prasugrel prescrito al alta | 51 (1,5) | 374 (10) | 992 (24,4) | 871 (23,8) | <0,001 | 2.288 (15,4) |
| Ticagrelor prescrito al alta | 3 (0,1) | 184 (4,9) | 713 (17,6) | 1047 (28,6) | <0,001 | 1.947 (13,1) |
| Meses en TAPD | 2 [11-15] | 3 [11-14] | 7 [11-13] | 10 [12-14] | <0,001 | 11 [5-14] |
IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; TAPD: tratamiento antiagregante plaquetario doble.
Salvo otra indicación, los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Tendencias temporales de las intervenciones de interés. A: tasa de implante de stents farmacoactivos en la ICP primaria. B: número medio de meses consecutivos con TAPD. C: proporción de pacientes con prescripción de prasugrel al alta. D: proporción de pacientes con prescripción de ticagrelor al alta. E: proporción de pacientes con prescripción de clopidogrel al alta. Las tendencias temporales se probaron en modelos spline lineales, cuadráticos y de suavizado. La referencia de la unidad de tiempo es el trimestre. Se realizaron otras referencias de unidades de tiempo. Véase la . ICP: intervención coronaria percutánea; TAPD: tratamiento antiagregante plaquetario doble.
*Valores observados.
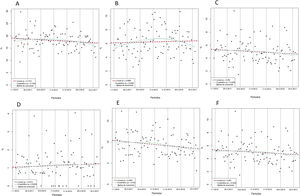
La tabla 2 compara las tasas de resultados entre bienios. Hubo diferencias considerables solo en el número total de pacientes con al menos 1 revascularización (p=0,024). Sin embargo, la tasa de incidencia de revascularización, que expresa el número total de revascularizaciones, también fue semejante entre bienios (tabla 2). Los análisis gráficos de tendencias temporales no mostraron un cambio estadísticamente significativo en los resultados, a excepción del número de pacientes con al menos 1 revascularización, que disminuyó con el tiempo (p=0,043) (figura 4). Con todo, la tasa de incidencia de revascularización no mostró cambios con el tiempo (p=0,278) (figura 5).
Diferencias entre periodos en los resultados a 2 años
| 2010- 2011(n=3.362) | 2012-2013(n=3.755) | 2014-2015(n=4.060) | 2016-2017(n=3.664) | p | |
|---|---|---|---|---|---|
| Número de pacientes con al menos 1 resultado | |||||
| Objetivo combinado de muerte, IAM, ictus y revascularización | 620 (18,4) | 717 (19,1) | 702 (17,3) | 638 (17,4) | 0,076 |
| Muerte por cualquier causa | 200 (5,9) | 243 (6,5) | 260 (6,4) | 226 (6,2) | 0,781 |
| IAM | 168 (5) | 205 (5,5) | 191 (4,7) | 170 (4,6) | 0,23 |
| Ictus | 38 (1,1) | 38 (1) | 52 (1,3) | 41 (1,1) | 0,738 |
| Revascularización | 368 (10,9) | 427 (11,4) | 399 (9,8) | 359 (9,8) | 0,024 |
| Hemorragia mayor | 62 (1,8) | 65 (1,7) | 76 (1,9) | 76 (2,1) | 0,395 |
| Tasa de incidencia de resultados (cada 1.000 pacientes-años) | |||||
| Objetivo combinado de muerte, IAM, ictus, revascularización | 130 (121-139) | 139 (131-148) | 126 (118-134) | 138 (129-148) | 0,656 |
| Tasa de muerte por cualquier causa | 31,1 (27,1-35,6) | 34,0 (30,0-38,4) | 33,9 (30,0-38,1) | 36,2 (31,8-41,1) | 0,15 |
| Tasa de IAM | 28,5 (24,6-32,7) | 30,9 (27,1-35,2) | 27,3 (23,9-31,2) | 29,9 (26,0-34,4) | 0,983 |
| Tasa de ictus | 6,7 (5,0-8,8) | 5,6 (4,1-7,5) | 7,4 (5,7-9,5) | 8,8 (6,8-11,3) | 0,080 |
| Tasa de revascularización | 63,6 (57,8-69,9) | 68,3 (62,5-74,5) | 57 (51,9-62,5) | 63,2 (57,3-69,6) | 0,310 |
| Tasa de hemorragia mayor | 11,2 (8,8-14,1) | 10,2 (8,0-12,9) | 11,3 (9,1-14,0) | 13,0 (10,3-16,1) | 0,283 |
IAM: infarto agudo de miocardio.
Los valores expresan n (%) y tasas con sus intervalos de confianza del 95%.
La tabla 3 muestra la tendencia temporal de los resultados a 2 años en los análisis ajustados y no ajustados. Ajustando por edad y sexo (M1), hubo una clara tendencia temporal a menor riesgo del combinado de muerte por cualquier causa, IAM, ictus y revascularización (reducción absoluta de las probabilidades del 0,005% por trimestre; odds ratio [OR] = 0,995; intervalo de confianza del 95% [IC95%], 0,99-1) que se mantuvo después de ajustar por insuficiencia renal, IAM previo, diabetes, clase Killip III/IV y localización anterior del IAMCEST (p=0,028) (M2). Aunque no significativa, se encontró una tendencia semejante en el mismo sentido de los componentes individuales del resultado compuesto: muerte, IAM y, especialmente, revascularización. Por último, el riesgo de hemorragia mayor no cambió con el tiempo. Los modelos de tendencia temporal ajustados y no ajustados, excluidos los pacientes con anticoagulación prescrita al alta (n=860), mostraron resultados semejantes ().
Tendencia temporal de los resultados en los análisis ajustados y no ajustados en toda la población
| OR (IC95%) | p | |
|---|---|---|
| Muerte o IAM o ictus o revascularización | ||
| M0 | 0,996 (0,992-1,001) | 0,121 |
| M1 | 0,995 (0,99-1) | 0,045 |
| M2 | 0,995 (0,99-0,999) | 0,028 |
| Muerte | ||
| M0 | 1,002 (0,995-1,01) | 0,544 |
| M1 | 0,998 (0,991-1,006) | 0,706 |
| M2 | 0,996 (0,988-1,004) | 0,335 |
| IAM | ||
| M0 | 0,995 (0,986-1,003) | 0,22 |
| M1 | 0,994 (0,986-1,003) | 0,198 |
| M2 | 0,995 (0,986-1,003) | 0,215 |
| Ictus | ||
| M0 | 1,003 (0,986-1,02) | 0,755 |
| M1 | 1 (0,983-1,018) | 0,967 |
| M2 | 1 (0,983-1,018) | 0,971 |
| Revascularización | ||
| M0 | 0,993 (0,987-1) | 0,038 |
| M1 | 0,994 (0,988-1) | 0,058 |
| M2 | 0,995 (0,988-1,001) | 0,089 |
| Hemorragia | ||
| M0 | 1,007 (0,994-1,021) | 0,282 |
| M1 | 1,006 (0,992-1,019) | 0,416 |
| M2 | 1,004 (0,991-1,018) | 0,528 |
IAM: infarto agudo de miocardio; IC95%: intervalo de confianza del 95%; OR: odds ratio.
M0: tendencia lineal de la unidad de tiempo (trimestre). M1: M0 + edad + sexo. M2: M1 + insuficiencia renal + IAM previo + diabetes + Killip III/IV + IAM anterior. La unidad de tiempo es el trimestre. Los modelos expresan la disminución o el aumento del riesgo cada trimestre.
El principal hallazgo de este análisis de resultados de tendencias temporales en una cohorte grande de pacientes con un IAMCEST revascularizado es que, a pesar del gran incremento entre 2010 y 2017 de los implantes de SFA durante la ICP primaria, el consumo de ticagrelor y prasugrel en lugar de clopidogrel y la mediana de duración del TAPD después del alta, el cambio de los principales resultados cardiovasculares a los 2 años de seguimiento fue pequeño. Se observa una considerable disminución paulatina del resultado combinado de muerte, IAM, ictus o revascularización; sin embargo, a pesar de que se produjo una similar disminución de todos los componentes individuales excepto el ictus, solo fue estadísticamente significativa en el caso de la revascularización.
No se pudo demostrar una tendencia temporal clara en los resultados individuales relevantes, a pesar del aumento sustancial del implante de SFA, el consumo de prasugrel y ticagrelor y la duración del TAPD.
Otros estudios que han analizado las tendencias temporales del tratamiento y los resultados del IAM han demostrado un aumento de la prevalencia del tratamiento basado en la evidencia que se asoció con una disminución persistente de los principales resultados durante el seguimiento. Sin embargo, la mayoría de estos estudios probablemente recogieron los efectos de la generalización de la reperfusión temprana en el IAMCEST11, que no era el objetivo principal de nuestro estudio. El análisis del registro SWEDHEART de Szummer et al.17 muestra que la reducción de los tiempos de isquemia gracias al aumento progresivo de la ICP primaria desencadenó los más importantes cambios en los resultados clínicos del IAM en la década de 2000 a 2010. Los tratamientos de prevención secundaria aportaron mejoras adicionales, pero menos claras, mientras que el tratamiento concomitante con la ICP (tratamientos cardioprotectores que tienen como objetivo reducir la lesión por reperfusión) en general no ha rendido ningún beneficio18.
Podrían ser varios los motivos de la ausencia de cambios sustanciales en los principales resultados de estos pacientes a pesar de la mejora relevante en la adopción de los tratamientos recomendados por las guías de práctica clínica.
En primer lugar, el efecto real de estos tratamientos en la práctica podría ser menor de lo esperado a partir de los resultados en los ensayos clínicos pivotales6–10,19, al menos en pacientes con IAMCEST revascularizados con ICP primaria. Además, no se puede descartar que con un mayor consumo de prasugrel y ticagrelor, en lugar de clopidogrel, se observaran mayores reducciones de eventos isquémicos. Respecto a los SFA, los ensayos clínicos sistemáticamente han encontrado una reducción de las tasas de nueva revascularización coronaria, pero con diferencias en los efectos de los SFA en las variables de resultado principales6,7,19. Respecto a los antiagregantes plaquetarios, ni prasugrel ni ticagrelor redujeron de manera importante el resultado combinado de muerte cardiovascular, reinfarto o ictus respecto a clopidogrel en el análisis del subconjunto de pacientes con IAMCEST tratados con ICP primaria incluidos en los respectivos estudios pivotales20,21. En cuanto a la duración óptima del TAPD, continúa siendo un tema de debate, especialmente en relación con pacientes con IAMCEST revascularizado, cuyo máximo riesgo de recurrencia de eventos isquémicos se concentra en los primeros meses tras el infarto5,22.
En segundo lugar, la ventana de tiempo de nuestro estudio podría ser demasiado corta para observar un beneficio tras la adopción gradual de estos tratamientos; podría ser necesaria una mayor tasa de utilización para trasladar a la vida real el beneficio observado en los ensayos clínicos. En este sentido, el único resultado que disminuyó con el tiempo fue el número de pacientes con nuevas revascularizaciones, que probablemente sea el efecto más relevante asociado con el implante de SFA6,7,19, que en nuestra cohorte es la exposición con mayor incremento en el tiempo.
En tercer lugar, un seguimiento de 2 años podría ser insuficiente para observar el beneficio potencial de estos tratamientos en los principales resultados. En este sentido, en el estudio EXAMINATION solo se observó beneficio de los SFA en la mortalidad por cualquier causa a los 5 años de seguimiento7. En los análisis ajustados de nuestro estudio, tanto la muerte por cualquier causa como el IAM mostraron una tendencia no significativa a menos riesgo con el paso del tiempo (OR = 0,996; IC95%, 0,988-1,004; y OR = 0,995; IC95%, 0,986-1,003), lo que indica que el estudio no tendría suficiente potencia estadística. Aparte esta consideración, la ausencia de significación estadística en la reducción del riesgo de estos resultados en el análisis de más de 14.000 pacientes seguidos durante 2 años apunta a que no hubo cambios importantes en el pronóstico del IAMCEST revascularizado de 2010 a 2017. Cabe destacar que el análisis de sensibilidad excluyendo a los pacientes con anticoagulación oral, que representan una población especial por su mayor riesgo de eventos y su tratamiento, obtuvo resultados semejantes a los observados en la cohorte general.
En nuestra cohorte, se observó que los pacientes con IAMCEST tendían con el tiempo a ser mayores y con más comorbilidades como diabetes e insuficiencia renal. Este hallazgo contrasta con los de otros estudios11,23. Aunque no se puede descartar la influencia de la estructura demográfica de la población española, ya que España es uno de los países occidentales con mayor incremento de la media de edad de la población, conviene evitar las comparaciones con otras poblaciones de IAMCEST24,25 porque se seleccionó a pacientes tratados con ICP primaria y que habían sobrevivido al episodio inicial. En este sentido, la mejora del pronóstico a corto plazo del IAMCEST secundario a ICP primaria está plenamente documentada en registros de la vida real11, mientras que faltan estudios que evalúen los resultados de la tendencia temporal a medio y largo plazo en pacientes revascularizados, que hoy es la situación más frecuente en los países occidentales.
Uno de los hallazgos del presente estudio es que estos tratamientos con nivel de evidencia alto se han incorporado gradualmente a la práctica clínica. Esto también se ha observado con anterioridad11 y probablemente refleja variaciones en el proceso de atención, lo que resalta la necesidad de programas continuos para homogeneizar y estandarizar la atención de salud. Son fundamentales para la mejora de la calidad rigurosos mediciones, reportes y evaluaciones comparativas de los indicadores de procesos y resultados, como los actualizados recientemente por la Sociedad Europea de Cardiología26. En el caso concreto de los SFA, el prasugrel y el ticagrelor, no se puede descartar como causa de la lenta introducción en la práctica clínica de tratamientos nuevos y más caros la influencia de las restricciones presupuestarias para fármacos por la crisis económica, especialmente virulenta en España.
Aunque la introducción en la práctica clínica de nuestro contexto del ticagrelor, el prasugrel y el TAPD prolongado ha sido paulatina, entre 2010 y 2017 el número de pacientes con ticagrelor y prasugrel se ha multiplicado por 10 y la media de meses consecutivos en TAPD por paciente ha aumentado más del 20%. A pesar de ello, el número de pacientes que han sufrido un episodio de hemorragia mayor y la tasa de hemorragias mayores se han mantenido prácticamente sin cambios desde 2010, incluso si se tiene en cuenta que algunos factores de riesgo hemorrágico se han vuelto más prevalentes (p. ej., edad > 65 años, diabetes, enfermedades renales). Ello puede indicar que tanto el ticagrelor como el prasugrel no aumentan considerablemente el riesgo de hemorragia grave respecto al clopidogrel, especialmente si se utilizan en pacientes con menor riesgo hemorrágico, como suele ocurrir en la práctica clínica habitual. Sin embargo, este hallazgo debe interpretarse teniendo en cuenta que nuestra cohorte incluía a pacientes con IAMCEST reperfundidos mediante ICP primaria que sobrevivieron al evento inicial, por lo que no es extrapolable a otros contextos.
LimitacionesDado que se empleó una base de datos clínico-administrativa para conocer los resultados clínicos durante el seguimiento, la validez de nuestros hallazgos depende de la capacidad de los registros oficiales del sistema sanitario para detectar todos los eventos. Sin embargo, las variables de resultado que se han tenido en cuenta son variables «duras» y la cobertura de los registros oficiales incluye a la mayor parte de la población, por lo que es poco probable una subestimación relevante de la tasa de eventos. Esto se ha evaluado recientemente en la población general española en el caso del síndrome coronario agudo27. Además, dado que las fuentes de información y las definiciones han sido las mismas desde el inicio del registro Codi IAM, la posible codificación errónea o el posible registro insuficiente también deberían ser semejantes a lo largo del tiempo, por lo que la estimación del cambio en las exposiciones y los resultados no afectarse demasiado. También debe tenerse en cuenta que, aunque la muestra es lo bastante grande para demostrar cambios importantes en las tasas de tratamiento, es posible que no tenga suficiente potencia para detectar cambios leves en los eventos isquémicos y hemorrágicos, que se espera sean mucho menores. Se estudió una cohorte de pacientes con IAMCEST sometidos a ICP primaria que sobrevivieron al evento inicial para una mejor evaluación de la eficacia de otros tratamientos del IAMCEST distintos de la ICP primaria. Por lo tanto, nuestros hallazgos no deben extrapolarse a otros contextos. Por último, el ritmo de incorporación a la práctica clínica de estos tratamientos con grado de recomendación alto tampoco es extrapolable. Sin embargo, esta falta de generalización no debería afectar al objetivo principal de este trabajo, que es la evaluación de la relación entre el cambio en la práctica clínica a lo largo del tiempo y el cambio en el pronóstico del IAMCEST.
CONCLUSIONESEste análisis de resultados de tendencias temporales en una cohorte grande de pacientes con un IAMCEST revascularizado ha mostrado un aumento considerable entre 2010 y 2017 de los tratamientos recomendados con un nivel de evidencia alto en el contexto clínico, como el implante de SFA durante la ICP primaria, la prescripción de ticagrelor y prasugrel al alta y la duración del TAPD después del alta. A este cambio siguió una pequeña variación en las tasas del combinado de muerte por cualquier causa, IAM o ictus a los 2 años de seguimiento.
FINANCIACIÓNEste estudio se financió por una subvención del Instituto de Salud Carlos III del Ministerio de Sanidad español (número de subvención: PI13/00399) y Marató de TV3 (número de subvención: 430/U/2015).
CONTRIBUCIÓN DE LOS AUTORESA. Ribera, M.T. Faixedas, A. Rosas e I. Ferreira-González participaron en la concepción y diseño del estudio. I. Ferreira-González, José A. Barrabés y Aida Ribera redactaron el artículo. M.T. Faixedas, H. Tizón-Marcos, S. Rojas, C. Labata, M. Cárdenas, S. Homs, C. Tomás-Querol, J. García-Picart, Gerard Roura y Monica Masotti participaron en la adquisición de datos. En el análisis de los datos participaron J.R. Marsal, A. Ribera, J.I. Pijoan, J.A. Barrabés e I. Ferreira-González. Todos los autores participaron en la interpretación de los resultados, revisaron críticamente el borrador y aprobaron la versión final.
CONFLICTO DE INTERESESNinguno.
- –
En las últimas décadas, la reperfusión temprana ha sido el principal impulsor de mejoras importantes en las tasas de mortalidad de los pacientes con infarto agudo de miocardio con elevación del segmento ST. Al mismo tiempo, otros tratamientos concomitantes, como el implante de stents farmacoactivos, el consumo de los inhibidores del receptor P2Y12 ticagrelor y prasugrel y la duración del tratamiento antiagregante plaquetario doble ≥ 12 meses, se han convertido en una práctica habitual, tras haberse demostrado su eficacia en varios ensayos clínicos importantes.
- –
Entre 2010 y 2017 aumentó considerablemente el riesgo de los pacientes con infarto agudo de miocardio con elevación del segmento ST tratados mediante angioplastia primaria, al igual que el implante de stents farmacoactivos, la prescripción y la duración del tratamiento antiagregante plaquetario doble y el consumo de ticagrelor y prasugrel en lugar de clopidogrel. El análisis ajustado mostró una tendencia temporal a menos riesgo del objetivo combinado de muerte, IAM, ictus y nueva revascularización, pero no de cada resultado individual salvo la revascularización.
Este estudio se ha realizado utilizando los datos enlazados anonimizados que ha facilitado la Agencia de Calidad y Evaluación Sanitarias (AQuAS) de Cataluña, en el marco del Programa PADRIS.