
Las secuelas cardiacas tras la infección por SARS-CoV-2 todavía están poco documentadas. Se realizó un estudio transversal en trabajadores sanitarios para estudiar la prevalencia de afección pericárdica y miocárdica tras la infección por SARS-CoV-2.
MétodosSe estudió a 139 trabajadores sanitarios con infección previa confirmada por SARS-CoV-2. Los participantes se sometieron a evaluación clínica, electrocardiograma, laboratorio, incluido el perfil de células inmunitarias, y resonancia magnética cardiaca (RMC). El diagnóstico clínico de pericarditis se realizó ante la presencia de los criterios clásicos y el diagnóstico clínico de miocarditis ante la presencia de al menos 2 criterios de RMC.
ResultadosLa mediana de edad fue de 52 (41–57) años, el 71,9% eran mujeres, y el 16,5% había sido hospitalizado previamente por neumonía por COVID-19. En la evaluación (10,4 [9,3–11,0] semanas después de los síntomas de infección), todos los participantes presentaban estabilidad hemodinámica. El 41,7% presentaba dolor torácico, disnea o palpitaciones; el 49,6%, alteraciones electrocardiográficas; el 7,9%, elevación de NT-proBNP; el 0,7%, elevación de troponina; y el 60,4%, alteraciones en la RMC. Un total de 30,9% de participantes cumplieron los criterios clínicos establecidos de pericarditis o miocarditis: pericarditis aislada en el 5,8%, miopericarditis en el 7,9% y miocarditis aislada en el 17,3%. La mayoría de los participantes (73,2%) mostraron recuentos de células inmunitarias alterados en sangre; en particular diminución de eosinófilos (27,3%; p <0,001) y aumento del número de células T citotóxicas (17,3%; p <0,001). La sospecha clínica de pericarditis se asoció (p <0,005) particularmente con un elevado número de células T citotóxicas y recuento de eosinófilos disminuidos; mientras que los participantes con sospecha clínica de miopericarditis o miocarditis tenían recuentos de neutrófilos, células natural killer y células plasmáticas más bajos (p <0,05).
ConclusionesLa afección pericárdica y miocárdica con estabilidad hemodinámica es frecuente después de la infección por SARS-CoV-2 y se asocia con perfiles de células inmunitarias específicas.
Palabras clave
El nuevo coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) está causando una persistente pandemia de COVID-19 y conlleva un riesgo de secuelas cardiacas a largo plazo en la población infectada1. El temor a que el SARS-CoV-2 cause un daño miocárdico superior al producido por otros virus convencionales se basa en su mecanismo de infección de las células humanas al unirse a la enzima de conversión de la angiotensina 2 transmembranaria (que se expresa principalmente en las células de los alveolos y el tejido miocárdico), el aumento de las concentraciones de troponina observado en los pacientes con COVID-19 hospitalizados con neumonía y su asociación con un aumento de la mortalidad, y la probable reducción de las defensas antivirales innatas contra un nuevo virus2.
Tanto la pericarditis como la miocarditis que se producen después de las infecciones víricas convencionales derivan de una respuesta inmunitaria inadecuada o excesiva, producida por mecanismos en los que intervienen los linfocitos T y B3,4. Si se produce una respuesta inadecuada, la persistencia de la multiplicación del virus en el perimiocardio prolonga la inflamación al atraer linfocitos T natural killer («asesinos naturales»), así como la producción concomitante de quimiocinas y citocinas. En cambio, el mimetismo molecular puede dar lugar a la producción de autoanticuerpos dirigidos contra proteínas cardiacas, que dan lugar a una respuesta autoinmunitaria específica del corazón, que causa inflamación sostenida, derrame o remodelado cardiaco. Sin embargo, no se conocen todavía los perfiles inmunitarios específicos que se producen tras una infección por SARS-CoV-2, en especial en los pacientes que presentan secuelas cardiacas5.
El presente estudio se diseñó para buscar signos de afección del pericardio y el miocardio después de una infección por SARS-CoV-2 mediante un estudio exhaustivo con evaluación clínica, análisis de laboratorio, electrocardiografía y resonancia magnética cardiaca (RMC). Además, se realizó una caracterización detallada de los compartimentos de células inmunitarias en la sangre y de la respuesta inmunitaria humoral específica al virus en los participantes. Dado que los trabajadores sanitarios son el grupo más afectado por el SARS-CoV-2 en España, pero también con más exámenes realizados que el resto de la población, se decidió llevar a cabo el estudio en esta cohorte singular.
MÉTODOSDiseño del estudio y trabajadores sanitarios participantesPara este estudio transversal se reclutó de forma consecutiva a 142 trabajadores sanitarios con una infección por SARS-CoV-2 con confirmación analítica en el Hospital Universitario de Salamanca, que participaron en el estudio voluntariamente. De ellos, 106 presentaron un resultado positivo de la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) de una muestra obtenida con escobillón nasofaríngeo entre el 13 de marzo y el 25 de abril de 2020 y 36 fueron diagnosticados tras un resultado positivo para anticuerpos de inmunoglobulina G (IgG) anti-SARS-CoV-2 mediante ELISA entre el 10 de abril y el 22 de mayo de 2020, en el marco de una importante campaña hospitalaria. El objetivo de este segundo grupo fue disponer también de datos de participantes con una infección por SARS-CoV-2 anterior, que tienen una mayor probabilidad de haber sufrido síntomas leves de infección viral, y también porque hay estudios poblacionales de seroprevalencia del SARS-CoV-2 cada vez mejor establecidos6,7. La inclusión en el estudio se inició el 25 de mayo y finalizó el 12 de junio de 2020.
Se obtuvo del Comité de Ética de Investigación del Hospital Universitario de Salamanca la aprobación del centro (2020/05/490) para el estudio, y todos los participantes dieron su consentimiento informado por escrito. El estudio está registrado en ClinicalTrials.gov NCT04413071. La responsabilidad del diseño del estudio, la obtención de los datos y la interpretación de estos corresponde exclusivamente a los investigadores del estudio. Un comité de supervisión y validación interno examinó todos los resultados de exploraciones cardiacas y validó («adjudicó») los resultados correspondientes a los criterios de valoración. Los autores tuvieron pleno acceso a todos los datos y elaboraron todos los materiales para presentarlos para publicación.
Proceso y procedimientos de la investigaciónSe realizó a todos los participantes una evaluación clínica y exámenes de electrocardiografía, análisis de laboratorio y exploraciones mediante RMC en la misma visita. Tras la obtención del consentimiento informado por escrito, entrevistadores específicamente formados aplicaron un cuestionario estructurado para obtener los datos basales mediante entrevistas personales presenciales. En otra sala, en la que se realizó un electrocardiograma y se obtuvieron muestras de sangre inmediatamente después de la RMC, un cardiólogo se encargó de obtener los antecedentes completos, realizó la exploración física y verificó que el cuestionario estuviera completo. Los electrocardiogramas fueron interpretados mediante consenso por 2 evaluadores experimentados, a los que se ocultó la identificación, la historia clínica, los síntomas, la exploración física y otras características de los participantes.
La RMC se realizó con un escáner de resonancia magnética corporal total de 1,5 T en el laboratorio de diagnóstico por la imagen cardiaco del Hospital Universitario de Salamanca8. El protocolo de obtención de las imágenes se describe detalladamente en el apartado «Métodos» del . Se analizaron con un programa informático dedicado las imágenes de RMC generales y regionales, mediante el consenso de 2 evaluadores experimentados cegados a los datos de los participantes de modo similar que en el protocolo del electrocardiograma. Se analizaron marcadores en T2 y T1 de la inflamación miocárdica en cada uno de los 16 segmentos del modelo de 17 segmentos de la American Heart Association (se excluyó el vértice cardiaco real), en el que solo se tuvieron en cuenta las concordancias de segmentos positivas de marcadores en T2 y T1 diferentes. Dado que la miocarditis se diagnosticó mediante estos marcadores de la RMC en T2 y T1 y es fundamental una elección adecuada de los valores de referencia normales, se utilizaron imágenes de RMC de control poblacionales procedentes de 50 individuos igualados en cuanto a edad y sexo que no presentaban afecciones cardiacas9. La prevalencia de los factores de riesgo cardiovascular (hipertensión, diabetes mellitus, dislipemia, tabaquismo actual) en la cohorte de control fue similar a la existente en la población del estudio.
Se realizó un análisis inmunofenotípico de poblaciones de células inmunitarias en muestras de sangre periférica (> 250) obtenidas en ácido K3-etilendiaminotetraacético (EDTA), 10ml/muestra, y tinción con el tubo de criba linfocitaria EuroFlow y los tubos de monitorización inmunitaria de linfocitos T del cluster de diferenciación 4 (TCD4), linfocitos natural killer (NK)/TCD8, hidrolizados de betalactoglobulina (BIgH) y células dendríticas derivadas de monocitos (MoDC) mediante citometría de flujo (FACSCANTO II y LSR-Fortessa, respectivamente; Becton/Dickinson Biosciences, Estados Unidos), utilizando un análisis de plataforma dual que se ha descrito detalladamente con anterioridad10. Los valores de referencia para cada uno de los subgrupos de células inmunitarias estudiados en sangre mediante citometría de flujo se definieron con un grupo poblacional de control formado por 463 adultos emparejados por edad (mediana de edad, 52 [intervalo intercuartílico, 47-61] años) estudiados antes de la pandemia de SARS-CoV-2. Se determinaron en paralelo las concentraciones de anticuerpos anti-SARS-CoV-2 IgM (AnshLabs, Estados Unidos), IgG e IgA (Mikrogen Diagnostik, Alemania) en el plasma de las mismas muestras de sangre mediante kits de ELISA (semicuantitativo) aprobados como producto sanitario comercializado para diagnóstico in vitro, siguiendo estrictamente las instrucciones de uso de los fabricantes.
Variables de valoración del estudio y definicionesLos criterios de valoración del estudio fueron la prevalencia de la pericarditis y la miocarditis clínicas con caracterización de los grupos de células inmunitarias en sangre y la respuesta inmunitaria humoral específica para el virus. La sospecha clínica de pericarditis se estableció si se daban como mínimo 2 de los siguientes criterios, siguiendo lo establecido en las guías vigentes3: dolor torácico pericardítico, roce pericárdico a la auscultación, elevación amplia del segmento ST o depresión del segmento PR en el electrocardiograma y signos de derrame pericárdico en la RMC. La elevación de los marcadores inflamatorios, como la proteína C reactiva, y los signos de inflamación pericárdica en la RMC se utilizaron como datos de apoyo adicionales. El diagnóstico de la sospecha clínica de miocarditis se basó en los criterios de RMC11; se consideraron como criterios principales de RMC los marcadores en T2 sensibles al edema positivos (imágenes con ponderación T2 o mapeo T2) o los marcadores de caracterización tisular en T1 positivos (anomalías en el tiempo de relajación T1 o volumen extracelular o realce tardío de gadolinio), y como criterios de RMC de apoyo, el derrame pericárdico o los signos de inflamación pericárdica en la RMC o las anomalías del movimiento de la pared del ventrículo izquierdo en la sístole. Teniendo en cuenta que se examinó a los participantes tras la fase aguda de la infección por SARS-CoV-2, en este estudio la sospecha clínica de miocarditis se definió como la presencia de una combinación de al menos 2 criterios principales de RMC en T2 o T1 o una combinación de solo 1 criterio principal en T2 o T1 junto con 1 criterio de apoyo de RMC adicional.
Sabiendo que la pericarditis y la miocarditis se dan juntas en la práctica clínica, se definió como sospecha clínica de miopericarditis los casos de pericarditis con una miocarditis asociada en la RMC, pero sin anomalías del movimiento de la pared del ventrículo izquierdo, y como sospecha clínica de perimiocarditis los casos en los que sí había anomalías del movimiento de la pared del ventrículo izquierdo12.
Análisis estadísticoSe utilizó estadística descriptiva para resumir los datos. Los resultados se presentan en forma de proporción (%) de casos válidos para las variables discretas y en forma de mediana [intervalo intercuartílico] para las variables continuas. Las diferencias entre los grupos se analizaron con la prueba exacta de Fisher para las variables discretas y con las pruebas de Kruskal-Wallis y de Mann-Whitney no paramétricas para los datos continuos. Las comparaciones entre recuentos de células inmunitarias en la sangre de los pacientes y los sujetos de control se ajustaron por edad y sexo (covariables) mediante ANCOVA (análisis de covarianza) de 1 vía y una prueba de modelización lineal general univariante (programa informático estadístico SPSS v25.0, IBM, Estados Unidos). Se compararon las características de los participantes y los resultados de las exploraciones, en todas las tablas, según el diagnóstico clínico final (manifestaciones no pericárdicas y miocárdicas frente a pericarditis frente a miopericarditis frente a miocarditis). Para la visualización bidimensional de los datos de citometría de flujo, se utilizó un análisis canónico multivariante con reducción multidimensional de los datos a través de un análisis discriminante lineal y las herramientas de visualización de algoritmo de aprendizaje automático con inclusión de valores vecinos estocástica con la distribución de t (Infinicyt software, Cytognos, Universidad de Salamanca)13.
RESULTADOSPoblación del estudioEn la figura 1 se muestra el diagrama de flujo de los trabajadores sanitarios incluidos. De los 142 trabajadores sanitarios reclutados que firmaron el consentimiento informado, no se completó 1 RMC a causa de claustrofobia. Se excluyó a otros 2 participantes debido a antecedentes de miocardiopatía hipertrófica grave en un caso y déficit inmunitario hereditario en el otro. Así pues, se completaron la evaluación clínica, el electrocardiograma, los análisis de laboratorio y la RMC de un total de 139 participantes. De ellos, 103 (74,1%) habían sido diagnosticados mediante RT-PCR y 36 (25,9%) mediante serología. Ninguno de los participantes tenía diagnóstico clínico de una afección cardiaca tras COVID-19 en el momento del diagnóstico de infección, tampoco los hospitalizados previamente.
En la tabla 1 se presentan las características de todos los participantes. Por categorías profesionales, hubo 49 (35,3%) enfermeras, 35 (25,2%) médicos y 55 (39,6%) de diferentes perfiles, como auxiliares de enfermería y otro personal del hospital. Un total de 67 (48,2%) trabajadores sanitarios se infectaron durante la atención directa prestada en salas de hospitalización de COVID-19.
Características basales de la cohorte de estudio
| Todos los participantes | Manifestaciones pericárdicas y miocárdicas | p | ||||
|---|---|---|---|---|---|---|
| (n=139) | No (n=96) | Pericarditis (n=8) | Miopericarditis (n=11) | Miocarditis (n=24) | ||
| Edad (años) | 52 [41-57] | 52 [39-58] | 50 [34-56] | 50 [44-61] | 53 [49-58] | 0,704 |
| Mujeres | 100 (71,9) | 64 (66,7) | 7 (87,5) | 8 (72,7) | 21 (87,5) | 0,164 |
| Trastornos coexistentes | ||||||
| Obesidada | 17 (12,2) | 14 (14,6) | 1 (12,5) | 0 | 2 (8,3) | 0,620 |
| Hipertensión | 17 (12,2) | 12 (12,5) | 1 (12,5) | 1 (9,1) | 3 (12,5) | 1,000 |
| Diabetes | 2 (1,4) | 2 (2,1) | 0 | 0 | 0 | 1,000 |
| Dislipemia | 27 (19,4) | 20 (20,8) | 1 (12,5) | 2 (18,2) | 4 (16,7) | 0,977 |
| Tabaquismo actual | 6 (4,3) | 5 (5,2) | 0 | 1 (9,1) | 0 | 0,534 |
| Tabaquismo previo | 70 (50,4) | 52 (54,2) | 2 (25,0) | 4 (36,4) | 12 (50,0) | 0,337 |
| Consumo de alcoholb | 23 (16,5) | 12 (12,5) | 2 (25,0) | 2 (18,2) | 7 (29,2) | 0,140 |
| Enfermedad cardiovascular | 8 (5,8) | 5 (5,2) | 0 | 2 (18,2) | 1 (4,2) | 0,297 |
| Enfermedad pulmonarc | 8 (5,8) | 6 (6,3) | 0 | 0 | 2 (8,3) | 0,898 |
| Síndrome de apneas-hipopneas | 8 (5,8) | 6 (6,3) | 1 (12,5) | 1 (9,1) | 0 | 0,326 |
| Enfermedad renal crónica | 5 (3,6) | 2 (2,1) | 0 | 0 | 3 (12,5) | 0,118 |
| Cáncer | 4 (2,9) | 3 (3,1) | 0 | 0 | 1 (4,2) | 1,000 |
| Al menos 1 de los anteriores | 106 (76,3) | 75 (78,1) | 5 (62,5) | 7 (63,6) | 19 (79,2) | 0,493 |
| Diagnóstico de infección por SARS-CoV-2 | 0,395 | |||||
| RT-PCR | 103 (74,1) | 67 (69,8) | 7 (87,5) | 10 (90,9) | 19 (79,2) | |
| Anticuerpos IgG anti-SARS-CoV-2 | 36 (25,9) | 29 (30,2) | 1 (12,5) | 1 (9,1) | 5 (20,8) | |
| Síntomas durante la infección por SARS-CoV-2 | ||||||
| General | ||||||
| Fatiga | 117 (84,2) | 79 (82,3) | 6 (75,0) | 11 (100) | 21 (87,5) | 0,404 |
| Fiebre | 94 (67,6) | 65 (67,7) | 7 (87,5) | 9 (81,8) | 13 (54,2) | 0,260 |
| Tos | 91 (65,5) | 64 (66,7) | 6 (75,0) | 7 (63,6) | 14 (58,3) | 0,849 |
| Cefalea | 90 (64,7) | 60 (62,5) | 4 (50,0) | 9 (81,8) | 17 (70,8) | 0,449 |
| Mialgia | 83 (59,7) | 55 (57,3) | 6 (75,0) | 7 (63,6) | 15 (62,5) | 0,810 |
| Anosmia | 73 (52,5) | 48 (50,0) | 6 (75,0) | 6 (54,5) | 13 (54,2) | 0,617 |
| Ageusia | 66 (47,5) | 40 (41,7) | 5 (62,5) | 5 (45,5) | 16 (66,7) | 0,133 |
| Dolor abdominal o diarrea | 64 (46,0) | 44 (45,8) | 1 (12,5) | 7 (63,6) | 12 (50,0) | 0,161 |
| Escalofríos | 60 (43,2) | 40 (41,7) | 3 (37,5) | 6 (54,5) | 11 (45,8) | 0,846 |
| Faringitis | 55 (39,6) | 37 (38,5) | 3 (37,5) | 4 (36,4) | 11 (45,8) | 0,940 |
| Náuseas o vómitos | 30 (21,6) | 17 (17,7) | 2 (25,0) | 5 (45,5) | 6 (25,0) | 0,154 |
| Torpeza | 20 (14,4) | 15 (15,6) | 1 (12,5) | 2 (18,2) | 2 (8,3) | 0,856 |
| Pérdida de memoria | 19 (13,7) | 13 (13,5) | 0 | 2 (18,2) | 4 (16,7) | 0,733 |
| Lesiones cutáneas | 5 (3,6) | 4 (4,2) | 0 | 0 | 1 (4,2) | 1,000 |
| Cardiacos | ||||||
| Dificultad respiratoria | 68 (48,9) | 42 (43,8) | 5 (62,5) | 9 (81,8) | 12 (50,0) | 0,090 |
| Palpitaciones | 44 (31,7) | 25 (26,0) | 5 (62,5) | 7 (63,6) | 7 (29,2) | 0,017 |
| Dolor torácico | 40 (28,8) | 24 (25,0) | 3 (37,5) | 4 (36,4) | 9 (37,5) | 0,455 |
| Mareo | 4 (2,9) | 0 | 1 (12,5) | 2 (18,2) | 1 (4,2) | 0,003 |
| Al menos 1 síntoma cardiaco | 86 (61,9) | 54 (56,3) | 6 (75,0) | 10 (90,9) | 16 (66,7) | 0,114 |
IgG: inmunoglobulina G; RT-PCR: reacción en cadena de la polimerasa con transcriptasa inversa.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Entre la población estudiada, 106 participantes (76,3%) tenían como mínimo 1 comorbilidad y 8 (5,8%), antecedentes de ECV: 1 con cardiopatía isquémica crónica tratada mediante revascularización con stent, 3 con fibrilación auricular paroxística, 2 con taquicardias supraventriculares intranodulares tratadas con ablación y 2 con un episodio de pericarditis aguda años antes.
La mayoría de los trabajadores sanitarios (137 [98,6%]) presentaron un pródromo vírico durante la infección por SARS-CoV-2 y 86 (61,9%) refirieron síntomas cardiacos de dificultad respiratoria, dolor torácico, palpitaciones o mareo. A 27 trabajadores sanitarios (19,4%) se les había diagnosticado una neumonía por COVID-19 y 23 (16,5%) requirieron hospitalización (a ninguno de ellos se le diagnosticó una pericarditis o miocarditis durante esa hospitalización índice).
El tratamiento farmacológico crónico y el tratamiento durante la infección por SARS-CoV-2 se muestran en la . En términos generales, el tratamiento farmacológico destinado a mitigar la enfermedad fue heterogéneo: se administró hidroxicloroquina a 33 (23,7%), lopinavir-ritonavir a 17 (12,2%), glucocorticoides orales a 9 (6,5%), un bolo intravenoso de dosis altas de metilprednisolona a 15 (10,8%) e inhibidores de interleucinas a 18 (12,9%).
Perfil sintomático, electrocardiográfico, bioquímico y de resonancia magnética cardiacaLas pruebas del estudio (tabla 2) se realizaron 10,4 (9,3-11,0) semanas después del inicio de los síntomas de infección. Todos los participantes mostraron estabilidad hemodinámica en las constantes vitales y la exploración física. Un total de 91 trabajadores sanitarios (65,5%) presentaban síntomas persistentes, que eran de tipo cardiaco en 58 (41,7%).
Parámetros clínicos, electrocardiográficos y analíticos en el examen
| Todos los participantes | Manifestaciones pericárdicas y miocárdicas | p | ||||
|---|---|---|---|---|---|---|
| (n=139) | No (n=96) | Pericarditis (n=8) | Miopericarditis (n=11) | Miocarditis (n=24) | ||
| Tiempo desde el inicio de los síntomas hasta el examen (semanas) | 10,4 [9,3-11,0]a | 10,4 [9,0-11,1] | 10,5 [8,5-10,9] | 10,1 [9,7-10,6] | 10,2 [9,3-10,7] | 0,603 |
| Tiempo desde el análisis de SARS-CoV-2 hasta el examen (semanas) | ||||||
| RT-PCR | 9,4 [8,1-10,0] | 9,4 [7,9-10,0] | 9,1 [7,0-10,4] | 9,6 [9,0-10,1] | 9,7 [8,9-10,1] | 0,780 |
| Anticuerpos IgG anti-SARS-CoV-2b | 4,4 [3,6-5,0] | 4,6 [3,5-5,0] | 4,3 | 2,3 | 4,7 [3,7-4,8] | 0,522 |
| Constantes vitales en el examen | ||||||
| Presión arterial (mmHg) | ||||||
| Sistólica | 124 [113-139] | 125 [114-141] | 127 [111-142] | 121 [114-139] | 114 [104-135] | 0,157 |
| Diastólica | 76 [70-83] | 76 [70-85] | 78 [73-83] | 77 [69-82] | 72 [63-77] | 0,097 |
| Frecuencia cardiaca (lpm) | 70 [63-80] | 71 [63-82] | 69 [59-76] | 70 [66-72] | 71 [61-77] | 0,723 |
| Saturación de oxígeno <95% | 10 (7,2) | 9 (9,4) | 1 (12,5) | 0 | 0 | 0,294 |
| Exploración física | ||||||
| Roce pericárdico | 0 | 0 | 0 | 0 | 0 | 1,000 |
| Soplo cardiaco | 3 (2,2) | 3 (3,1) | 0 | 0 | 0 | 1,000 |
| Tercer y cuarto ruidos cardiacos | 0 | 0 | 0 | 0 | 0 | 1,000 |
| Crepitantes respiratorios | 5 (3,6) | 4 (4,2) | 0 | 1 (9,1) | 0 | 0,458 |
| Síntomas en el examen | ||||||
| Ausencia de síntomas | 48 (34,5) | 39 (40,6) | 2 (25,0) | 1 (9,1) | 6 (25,0) | 0,118 |
| Generales | ||||||
| Fatiga | 37 (26,6) | 25 (26,0) | 2 (25,0) | 3 (27,3) | 7 (29,2) | 0,982 |
| Anosmia | 12 (8,6) | 5 (6,3) | 1 (12,5) | 1 (9,1) | 4 (16,7) | 0,241 |
| Ageusia | 7 (5,0) | 4 (4,2) | 1 (12,5) | 0 | 2 (8,3) | 0,375 |
| Cefalea | 7 (5,0) | 4 (4,2) | 1 (12,5) | 1 (9,1) | 1 (4,2) | 0,332 |
| Faringitis | 7 (5,0) | 3 (3,1) | 0 | 1 (9,1) | 3 (12,5) | 0,154 |
| Dolor abdominal | 6 (4,3) | 3 (3,1) | 0 | 1 (9,1) | 2 (8,3) | 0,333 |
| Pérdida de memoria | 4 (2,9) | 2 (2,1) | 0 | 0 | 2 (8,3) | 0,441 |
| Dolor articular | 3 (2,2) | 1 (1,0) | 2 (25,0) | 0 | 0 | 0,027 |
| Piloerección | 2 (1,4) | 1 (1,0) | 1 (12,5) | 0 | 0 | 0,174 |
| Cardiacos | ||||||
| Disnea o dificultad respiratoria | 36 (25,9) | 21 (21,9) | 3 (37,5) | 6 (54,5) | 6 (25,0) | 0,100 |
| Dolor torácico | 27 (19,4) | 9 (9,4) | 5 (62,5) | 9 (81,8) | 4 (16,7) | <0,001 |
| De tipo pericarditis | 18 (12,9) | 4 (4,2) | 5 (62,5) | 9 (81,8) | 0 | <0,001 |
| Palpitaciones | 20 (14,4) | 12 (12,5) | 2 (25,0) | 3 (27,3) | 3 (12,5) | 0,345 |
| Mareo | 8 (5,8) | 3 (3,1) | 1 (12,5) | 2 (18,2) | 2 (8,3) | 0,066 |
| Al menos 1 síntoma cardiaco | 58 (41,7) | 32 (33,3) | 8 (100) | 9 (81,8) | 11 (45,8) | 0,003 |
| Alteraciones electrocardiográficas similares a la pericarditis | ||||||
| Elevación amplia del segmento ST | 13 (9,4) | 8 (8,3) | 2 (25,0) | 3 (27,3) | 0 | 0,018 |
| Depresión del segmento PR | 33 (23,7) | 19 (19,8) | 5 (62,5) | 5 (45,5) | 4 (16,7) | 0,014 |
| Parámetros analíticos | ||||||
| Filtrado glomerular <60 ml/min/1,73 m2 | 2 (1,4) | 1 (1,0) | 1 (12,5) | 0 | 0 | 0,174 |
| Troponina T de alta sensibilidad > 14 pg/mlc | 1 (0,7) | 0 | 0 | 0 | 1 (4,2) | 0,309 |
| NT-proBNP ≥ 125 pg/ml | 11 (7,9) | 6 (6,3) | 0 | 2 (18,2) | 3 (12,5) | 0,289 |
| Proteína C reactiva > 3 mg/dl | 10 (7,2) | 6 (6,3) | 1 (12,5) | 0 | 3 (12,5) | 0,439 |
IgG: inmunoglobulina G; RT-PCR: reacción en cadena de la polimerasa con transcriptasa inversa.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
De los 139 electrocardiogramas evaluados, en 69 (49,6%) se observaron anomalías electrocardiográficas (). Un total de 33 (23,7%) electrocardiogramas presentaron criterios de pericarditis (). Dado que el Servicio de Salud Laboral del hospital realiza a los trabajadores sanitarios una evaluación médica previa a su incorporación laboral, se pudo recuperar y examinar 53 electrocardiogramas previos (76,8%) de los 69 pacientes que presentaron alteraciones electrocardiográficas en el estudio. En estas 53 comparaciones electrocardiográficas, el 67,9% de las alteraciones del electrocardiograma observadas en el estudio no estaban presentes anteriormente y consistieron sobre todo en alteraciones de tipo pericárdico y depresión del segmento ST o inversión de la onda T ().
Los biomarcardores cardiacos e inflamatorios estuvieron dentro del intervalo de referencia en la mayoría de los participantes (tabla 2). Se observaron anomalías en la RMC de 84 (60,4%) participantes (tabla 3, figura 2 y ); 2 participantes (1,4%) mostraron un aumento del tiempo de relajación en T2 miocárdico; 5 (3,6%), edema en las imágenes con ponderación en T2; 40 (28,8%), un aumento del tiempo de relajación del miocardio nativo en T1; 27 (19,4%), un aumento del volumen extracelular en T1; 10 (7,2%), un realce tardío de gadolinio en T1; 42 (30,2%), derrame pericárdico; 1 (0,7%), un grosor del pericardio de 3mm y 7 (5,0%), anomalías globales o regionales de la contractilidad del ventrículo izquierdo.
Parámetros de resonancia magnética cardiaca
| Controles poblacionales(n=50) | Todos los participantes(n = 139) | p | Manifestaciones pericárdicas y miocárdicas | p | ||||
|---|---|---|---|---|---|---|---|---|
| No (n=96) | Pericarditis (n=8) | Miopericarditis (n=11) | Miocarditis (n=24) | |||||
| Edad (años) | 51 [42-56] | 53 [42-58] | 0,335 | 52 [39-58] | 51 [34-56] | 50 [44-61] | 53 [49-58] | 0,704 |
| Mujeres | 35 (70,0) | 100 (71,9) | 0,856 | 64 (66,7) | 7 (87,5) | 8 (72,7) | 21 (87,5) | 0,164 |
| Estatura (cm) | 166 [160-172] | 165 [160-173] | 0,844 | 166 [161-174] | 164 [162-169] | 167 [162-169] | 162 [158-170] | 0,300 |
| Peso (kg) | 65 [59-75] | 69 [58-80] | 0,506 | 72 [60-83] | 58 [54-75] | 60 [56-71] | 59 [53-74] | 0,003 |
| Área de superficie corporal (m2) | 1,7 [1,6-1,9] | 1,8 [1,6-1,9] | 0,555 | 1,8 [1,7-2,0] | 1,6 [1,6-1,9] | 1,6 [1,6-1,8] | 1,6 [1,6-1,9] | 0,004 |
| Hematocrito (%) | 42 [40-43] | 39 [37-41] | <0,001 | 40 [38-42] | 39 [36-41] | 41 [36-41] | 37 [35-39] | 0,002 |
| Ventrículo izquierdo | ||||||||
| Volumen telediastólico indexado (ml/m2) | 74 [58-82] | 72 [67-83] | 0,483 | 72 [65-84] | 73 [60-89] | 77 [71-96] | 72 [69-79] | 0,322 |
| Volumen telesistólico indexado (ml/m2) | 23 [20-31] | 26 [23-31] | 0,079 | 27 [22-31] | 27 [20-34] | 26 [25-40] | 26 [23-30] | 0,802 |
| Masa del ventrículo izquierdo indexada (g/m2) | 48 [43-60] | 51 [46-60] | 0,071 | 53 [46-62] | 49 [41-58] | 50 [43-59] | 50 [47-55] | 0,488 |
| Fracción de eyección del ventrículo izquierdo (%) | 66 [61-70] | 64 [60-67] | 0,019 | 63 [59-67] | 64 [60-67] | 65 [61-66] | 65 [61-67] | 0,782 |
| Anomalías regionales del movimiento de la pared | 0 | 7 [5,0] | 0,193 | 4 [4,2] | 0 | 0 | 3 [12,5] | 0,291 |
| Tiempo de relajación T2 miocárdico global (ms) | 52 [48-54] | 50 [48-51] | <0,001 | 50 [48-51] | 49 [45-51] | 50 [48-53] | 50 [50-52] | 0,086 |
| Tiempo de relajación T1 miocárdico nativo global (ms) | 1.024 [991-1.040] | 1.021 [1.005-1.040] | 0,615 | 1.020 [1.002-1.039] | 1.028 [997-1.046] | 1.027 [1.024-1.045] | 1.030 [1.008-1.052] | 0,411 |
| Volumen extracelular T1 global (%) | 25 [22-30] | 26 [24-28] | 0,355 | 25 [23-27] | 27 [26-27] | 28 [25-30] | 28 [26-30] | <0,001 |
| Strain longitudinal global del ventrículo izquierdo | –23 [–26 a –21] | –22 [–24 a –20] | 0,004 | –21 [–24 a –20] | –24 [–25 a –18] | –22 [–24 a –21] | –22 [–25 a –20] | 0,880 |
| Strain circunferencial global del ventrículo izquierdo | –33 [–36 a –28] | –28 [–32 a –26] | <0,001 | –28 [–32 a –25] | –29 [–31 a –24] | –31 [–32 a –25] | –29 [–32 a –26] | 0,952 |
| Strain radial global del ventrículo izquierdo | 73 [60-88] | 59 [45-70] | <0,001 | 58 [44-68] | 60 [43-70] | 60 [51-71] | 60 [49-76] | 0,676 |
| Ventrículo derecho | ||||||||
| Volumen telediastólico indexado (ml/m2) | 71 [61-80] | 74 [67-85] | 0,094 | 74 [66-86] | 78 [62-92] | 78 [69-90] | 76 [69-80] | 0,449 |
| Volumen telesistólico indexado (ml/m2) | 26 [18-30] | 27 [22-34] | 0,032 | 27 [22-33] | 30 [18-40] | 27 [23-36] | 29 [22-34] | 0,909 |
| Fracción de eyección del ventrículo derecho (%) | 66 [60-69] | 63 [59-68] | 0,095 | 63 [58-67] | 61 [56-72] | 66 [60-69] | 63 [60-66] | 0,839 |
| Strain longitudinal global de la pared libre del ventrículo derecho | –28 [–32 a –24] | –25 [–27 a –21] | <0,001 | –25 [–27 a –21] | –20 [–25 a –19] | –25 [–26 a –20] | –26 [–28 a –22] | 0,214 |
| Aurícula | ||||||||
| Área indexada de la aurícula izquierda (cm/m2) | 11 [10-13] | 11 [10-13] | 0,947 | 11 [10-12] | 13 [11-13] | 13 [12-14] | 12 [10-14] | 0,067 |
| Fracción de eyección de la aurícula izquierda (%) | 58 [53-66] | 60 [54-66] | 0,540 | 61 [56-66] | 60 [37-68] | 58 [52-69] | 60 [54-66] | 0,859 |
| Strain longitudinal global de la aurícula izquierda | 41 [34-50] | 41 [35-52] | 0,522 | 41 [35-53] | 43 [28-55] | 40 [33-56] | 43 [34-51] | 0,983 |
| Área indexada de la aurícula derecha (cm/m2) | 10 [10-12] | 10 [9-12] | 0,497 | 10 [9-11] | 11 [9-14] | 11 [10-13] | 10 [9-12] | 0,087 |
| Criterios principales de RMC de Lake-Louise para la miocarditis | ||||||||
| Aumento del tiempo de relajación T2 miocárdico | 0 | 2 (1,4) | 0,540 | 0 | 0 | 0 | 2 (8,3) | 0,094 |
| Hiperintensidad con ponderación T2 | 0 | 5 (3,6) | 0,211 | 0 | 0 | 1 (9,1) | 4 (16,7) | 0,002 |
| Aumento del tiempo de relajación T1 miocárdico nativo | 0 | 40 (28,8) | <0,001 | 19 (19,8) | 0 | 5 (45,5) | 16 (66,7) | <0,001 |
| Aumento del volumen extracelular en T1 | 0 | 27 (19,4) | <0,001 | 8 (8,3) | 0 | 6 (54,5) | 13 (54,2) | <0,001 |
| Realce tardío de gadolinio en T1a | 0 | 10 (7,2) | 0,042 | 2 (2,1) | 0 | 4 (36,4) | 4 (16,7) | <0,001 |
| Al menos 1 criterio principal | 0 | 63 (45,3) | <0,001 | 28 (29,2) | 0 | 11 (100) | 24 (100) | <0,001 |
| Criterios complementarios de RMC de Lake-Louise para la miocarditis | ||||||||
| Derrame pericárdicob | 0 | 42 (30,2) | <0,001 | 11 (11,5) | 7 (87,5) | 11 (100) | 13 (54,2) | <0,001 |
| Engrosamiento del pericardioc | 0 | 1 (0,7) | 0,735 | 0 | 0 | 1 (9,1) | 0 | 0,137 |
| Anomalías de la contractilidad del ventrículo izquierdod | 0 | 7 (5,0) | 0,112 | 4 (4,2) | 0 | 0 | 3 (12,5) | 0,291 |
| Al menos 1 criterio complementario | 0 | 48 (34,5) | <0,001 | 14 (14,6) | 7 (87,5) | 11 (100) | 16 (66,7) | <0,001 |
RMC: resonancia magnética cardiaca.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
El patrón de realce tardío de gadolinio en T1 fue de carácter no transmural y no isquémico en los 10 pacientes identificados, y se identificó en la pared ventricular izquierda inferolateral (7 pacientes), la pared ventricular izquierda inferior (1 paciente), la pared ventricular izquierda inferoseptal (1 paciente) y las paredes ventricular derecha inferior y ventricular izquierda inferoseptal (1 paciente).
Las anomalías de la contractilidad del ventrículo izquierdo consistieron en hipocinesia global (4 pacientes) y regional (3 participantes, 2 casos apicolaterales y 1 medioinferoseptal). A la izquierda, valor de p para las comparaciones entre los controles poblacionales y el conjunto de participantes. A la derecha, valor de p para la comparación entre los 4 grupos participantes.
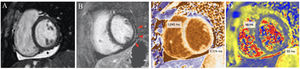
Composición de las imágenes de resonancia magnética cardiaca de un participante con afección pericárdica y miocárdica. Las principales observaciones consisten en un derrame pericárdico en la pared inferior (*), un sutil realce tardío de gadolinio subepicárdico (flechas rojas) y un aumento del tiempo de relajación nativo en T1 en el segmento inferolateral, con un aumento no significativo del tiempo de relajación T2 en ese segmento. Todas las imágenes corresponden a proyecciones de eje corto a nivel de los músculos papilares. Imagen A: imagen de cine telediastólica (Steady State Free Precession [SSFP]). Imagen B: realce tardío de gadolinio con inversión-recuperación sensible a la fase. Imagen C: mapeo nativo en T1 (Modified Look-Locker Imaging [MOLLI]). Imagen D: mapeo en T2 (Gradient and Spin-Echo [GraSE]).
En total, 43 participantes (30,9%) cumplían los criterios de sospecha clínica de pericarditis o miocarditis. Se realizó el diagnóstico de sospecha clínica de pericarditis aislada en 8 (5,8%); miocarditis aislada en 24 (17,3%) y miopericarditis en 11 (7,9%). No hubo ningún caso de perimiocarditis. En la figura 3 se presenta la descripción de las combinaciones de criterios y en la tabla 1 y tabla 2 se detallan las características basales y de las exploraciones en cada grupo diagnóstico.
Descripción de los criterios clínicos de pericarditis y las combinaciones de criterios de resonancia magnética cardiaca en los participantes a los que se diagnosticó pericarditis, miopericarditis o miocarditis. Derrame: derrame pericárdico determinado en la RMC; ECG: electrocardiograma; engrosamiento: grosor del pericardio ≥ 3 mm; Mapa T1: aumento del tiempo de relajación del miocardio nativo en T1; Mapa T2: aumento del tiempo de relajación del miocardio en T2; PCR: proteína C reactiva; Ponderación T2: aumento de la hiperintensidad de señal en T2; RTG: realce tardío de gadolinio en T1; VEC: aumento del volumen extracelular en T1; VI: anomalías del movimiento de la pared del ventrículo izquierdo.
Hubo mayor proporción de participantes con sospecha clínica de pericarditis, miopericarditis o miocarditis que presentaron síntomas cardiacos durante la infección por SARS-CoV-2 (32 [74,4%] frente a 54 [56,3%]; p=0,058) y en las pruebas del estudio (26 [60,5%] frente a 32 [33,3%]; p=0,005) en comparación con lo observado en los participantes sin esas manifestaciones. El tratamiento farmacológico crónico con estatinas fue más frecuente en los participantes sin manifestaciones pericárdicas o miocárdicas que en aquellos con sospecha clínica de pericarditis, miopericarditis o miocarditis (16 [16,7%] frente a 1 [2,3%]; p=0,022).
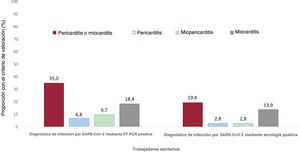
Participantes con infección confirmada mediante detección de IgG anti-SARS-CoV-2De los 36 participantes a los que se diagnosticó una infección previa mediante la detección de IgG anti-SARS-CoV-2 (la comparación de los datos de este grupo y de los participantes diagnosticados mediante RT-PCR se muestran en la ), 34 (94,4%) presentaron al menos 1 de los 18 síntomas de COVID-19 evaluados (es decir, fiebre, tos persistente o anosmia, cuya presencia, según las guías actuales, requeriría aislamiento y análisis de 27 [75,0%] de estos 36 participantes); 28 (77,8%) habían presentado anteriormente un resultado negativo de la RT-PCR tras mostrar síntomas de SARS-CoV-2 y en 8 (22,2%) no se realizó ninguna RT-PCR.
Hubo un porcentaje menor de participantes diagnosticados mediante una serología positiva con síntomas persistentes al realizar el examen, en comparación con lo observado en los participantes con RT-PCR (18 [50,0%] frente a 73 [70,9%]; p=0,027); no obstante, la prevalencia de la sospecha clínica de pericarditis, miopericarditis o miocarditis fue alta en ambos grupos (figura 4).
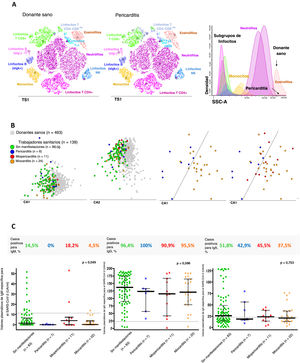
Alteración de los perfiles de inmunidad humoral y de células inmunitarias en la sangreEn la mayor parte de los participantes en el estudio (101 [73,2%]) se observó una alteración del hemograma en al menos 1 población mayor de células inmunitarias, tal como se observa en la tabla 4 y la figura 5 y se describe con más detalle en las . Las alteraciones más frecuentes consistieron en eosinopenia (38 [27,3%]; p <0,001) y aumento de los linfocitos T (en especial los CD4-CD8-/lo citotóxicos) (24 [17,3%]; p <0,001) y, en menor grado, también el recuento de linfocitos B (16 casos [11,5%]; p <0,001). Además, en comparación con los donantes sanos emparejados por edad y sexo, los participantes presentaron una mediana del recuento de basófilos en sangre superior (38 frente a 47 células/μl respectivamente; p=0,007) y monocitos (317 frente a 405 células/μl; p <0,001); en cambio, los participantes presentaron una disminución de la mediana del número de neutrófilos en sangre circulante (3.723 frente a 3.430 células/μl; p=0,010), eosinófilos (157 frente a 74 células/μl; p <0,001) y células plasmáticas (1,7 frente a 0,8 células/μl; p <0,001).
Distribución de los subgrupos de células inmunitarias mieloides y linfoides en la sangre
| Donantes sanos(n=463) | Todos los participantes(N=139) | p | Manifestaciones pericárdicas y miocárdicas | p | ||||
|---|---|---|---|---|---|---|---|---|
| No(n=96) | Pericarditis(n=8) | Miopericarditis(n=11) | Miocarditis(n=24) | |||||
| Neutrófilos | 3.723 [2.969-4.613] | 3.430 [2.633-4.225] | 0,010 | 3.468 [2.647-4.223] | 3.013 [2.385-3.699] | 3.966 [3.157-4.255] | 3.023 [1.966-4.208] | 0,491 |
| Casos < p5/> p95 | - | 18 (12,9)/5 (3,6) | <0,001/0,001 | 10 (10,4)/4 (4,2) | 1 (12,5)/0 | 0/0 | 7 (29,2)/1 (4,2) | 0,051/0,844 |
| Eosinófilos | 157 [101-249] | 74 [47-149] | <0,001 | 82 [50-130] | 48 [31-189] | 59 [46-69] | 102 [39-191] | 0,463 |
| Casos < p5/> p95 | - | 38 (27,3)/1 (0,7) | <0,001/0,231 | 24 (25,0)/1 (1,0) | 4 (50,0)/0 | 3 (27,3)/0 | 7 (29,2)/0 | 0,499/0,929 |
| Basófilos | 38 [21-52] | 47 [35-62] | 0,007 | 49 [37-62] | 34 [23-55] | 36 [29-56] | 51 [38-65] | 0,293 |
| Casos < p5/> p95 | - | 4 (2,9)/5 (3,6) | <0,001/<0,001 | 2 (2,1)/3 (3,2) | 1 (12,5)/1 (25) | 1 (9,1)/1 (9,1) | 0/1 (4,2) | 0,169/0,719 |
| Monocitos | 317 [245-433] | 405 [328-523] | <0,001 | 418 [345-533] | 369 [307-424] | 404 [347-476] | 358 [282-574] | 0,724 |
| Casos < p5/> p95 | - | 3 (2,2)/8 (5,8) | 0,012/<0,001 | 3 (3,1)/5 (5,2) | 0/1 (12,5) | 0/0 | 0/2 (8,3) | 0,712/0,639 |
| Células dendríticas | 29 [20-35] | 28 [20-35] | 0,561 | 28 [20-35] | 28 [20-33] | 29 [18-42] | 23 [19-35] | 0,920 |
| Casos < p5/> p95 | - | 14 (10,2)/5 (3,6) | <0,001/<0,001 | 11 (11,7)/5 (5,3) | 0/0 | 1 (9,1)/0 | 2 (8,3)/0 | 0,755/0,508 |
| Linfocitos | 1.675 [1.332-2.223] | 2.221[1.717-2.563] | <0,001 | 2.294 [1.854-2.760] | 1.990 [1.555-2.422] | 1.660 [1.379-2.089] | 1.998 [1.619-2.439] | 0,055 |
| Casos < p5/> p95 | - | 3 (2)/8 (6) | 0,012/<0,001 | 1 (1,0)/6 (6,3) | 1 (12,5)/1 (12,5) | 1 (9,1)/0 | 0/1 (4,2) | 0,054/0,683 |
| Linfocitos T | 1.246 [943-1.642] | 1.652 [1.348-1.985] | <0,001 | 1.747 [1.417-2.003] | 1.417 [1.194-1.938] | 1.350 [1.186-1.621] | 1.635 [1.309-2.018] | 0,102 |
| Casos < p5/> p95 | - | 1 (1)/10 (7) | 0,231/<0,001 | 0/8 (8,3) | 0/1 (12,5) | 1 (9,1)/0 | 0/1 (4,2) | 0,304/0,636 |
| Linfocitos NK | 260 [162-372] | 213 [137-321] | 0,427 | 237 [143-337] | 233 [142-281] | 120 [76-321] | 156 [137-248] | 0,230 |
| Casos < p5/> p95 | - | 9 (6,5)/6 (4,3) | <0,001/0,001 | 5 (5,2)/5 (5,2) | 0/0 | 3 (27,3)/0 | 1 (4,2)/1 (4,2) | 0,003/0,791 |
| Linfocitos B | 154 [108-228] | 208 [158-297] | <0,001 | 234 [175-327] | 233 [119-443] | 174 [153-188] | 181 [136-230] | 0,020 |
| Casos < p5/> p95 | - | 2 (1,4)/16 (11,5) | 0,053/<0,001 | 1 (1,0)/10 (12,5) | 1 (12,5)/2 (25,0) | 0/0 | 0/2 (8,3) | 0,525/0,362 |
| Células plasmáticas | 2 [0,8-3] | 0,8 [0,3-2] | <0,001 | 0,9 [0,5-2] | 1 [0,2-1] | 0,4 [0,3-0,8] | 1 [0,3-2] | 0,362 |
| Casos < p5/> p95 | - | 11 (7,9)/1 (0,7) | <0,001/0,231 | 7 (7,3)/1 (1,0) | 0/0 | 2 (18,2)/0 | 2 (8,3)/0 | 0,506/0,929 |
NK: natural killer.
Los valores expresan mediana [intervalo intercuartílico] del número de células/μl en sangre o n (%) de casos inferiores al quinto percentil (< p5) y superiores 95 (> p95) para cada subgrupo celular en los donantes sanos emparejados por edad. Izquierda: valor de p para las comparaciones entre los donantes sanos y el conjunto de participantes. Derecha: valor de p para la comparación entre los 4 grupos participantes. En las comparaciones de los donantes sanos con el conjunto de todos los participantes, se aplica un ajuste por edad y sexo.
Perfiles alterados de células inmunitarias y concentración sérica de anticuerpos en trabajadores sanitarios según la presencia o ausencia de pericarditis, miopericarditis o miocarditis. A: representación gráfica en t-SNE de la distribución de las principales poblaciones de células inmunitarias en la sangre de un donante sano (izquierda) y un participante con diagnóstico de pericarditis (gráfico central) que muestra tanto el aumento de linfocitos Tab + CD4-CD8-/lo como la disminución del recuento de eosinófilos en sangre. B: representación gráfica bidimensional de los gráficos del análisis canónico (discriminante lineal) multivariante, en la que se observan perfiles globales de células inmunitarias diferentes en la sangre de los participantes con infección por SARS-CoV-2 previa (n=139; círculos de color) en comparación con los donantes sanos de la misma edad (n=463; cuadrados grises) (2 gráficos de la izquierda); se observaron también perfiles de células inmunitarias claramente diferenciados en los participantes con diagnóstico de pericarditis (círculos azules) o miocarditis (círculos naranja); la mayoría de los casos de miopericarditis (círculos rojos) tenían en común una alteración del perfil de células inmunitarias en la sangre similar al observado en la miocarditis. C: frecuencia y cantidad de anticuerpos anti-SARS-CoV-2 determinados en el plasma de 123/139 participantes. CA: análisis canónico (correlación); IgG: inmunoglobulina G; NK: natural killer; t-SNE: algoritmo de inclusión de valores vecinos estocástica con la distribución de t (abreviado en las representaciones gráficas como TS1); SCC: dispersión de luz hacia los lados (es decir, granularidad celular).
En comparación con los donantes sanos, los participantes con sospecha clínica de pericarditis fueron los que mostraron un valor más alto en el recuento de linfocitos T CD4-CD8-/lo (citotóxicos) en sangre (46 frente a 104 células/μl; p=0,003) y presentaron especialmente una disminución del número de eosinófilos (157 frente a 48 células/μl; p=0,049) y (de manera similar a lo observado en los participantes con sospecha clínica de miopericarditis y aquellos con miocarditis) del recuento de células plasmáticas en sangre circulante (1,7 frente a 0,8, 0,4 y 0,7 células/μl; p=0,075, p=0,018 y p=0,004 respectivamente). A su vez, los pacientes con sospecha clínica de miocarditis presentaron con mayor frecuencia una disminución del recuento de neutrófilos en sangre (7 [29,2%]; p=0,011), junto con una disminución del número de linfocitos NK (260 frente a 156 células/μl; p=0,021). Por último, los participantes con sospecha clínica de miopericarditis mostraron perfiles inmunitarios diversos, que fueron más coincidentes con los de miocarditis (7 de los 11 casos; 63,6%) que con los de pericarditis (4 de los 11 casos; 36,4%) (figura 5B).
En términos generales, no se observaron diferencias importantes entre los participantes con o sin afección pericárdica y miocárdica en cuanto a la frecuencia y las concentraciones de anticuerpos anti-SARS-CoV-2 IgM, IgG e IgA en plasma (figura 5C). Es importante señalar que se detectó un solapamiento de los perfiles inmunitarios entre los participantes diagnosticados mediante RT-PCR y los diagnosticados mediante serología.
DISCUSIÓNEn este estudio se examinó la prevalencia de la sospecha clínica de pericarditis y miocarditis en una cohorte de trabajadores sanitarios positivos para SARS-CoV-2. En una de las cohortes de participantes con evaluaciones mediante RMC disponibles más amplias presentadas hasta ahora, se demuestra que la afección pericárdica y miocárdica tiene gran prevalencia después de la infección por SARS-CoV-2, en relación con una alteración de la respuesta inmunitaria.
Se decidió llevar a cabo el estudio en trabajadores sanitarios porque este sector ha sufrido infecciones de un modo desproporcionadamente alto en España, y ello brindaba la oportunidad de estudiar la prevalencia de la sospecha clínica de pericarditis y miocarditis en casos de infección por SARS-CoV-2 con un resultado confirmado de RT-PCR positiva o serología positiva. Además, dado que la proporción de mujeres entre los trabajadores sanitarios es elevada en España, en nuestro estudio no están infrarrepresentadas, pues constituyeron más de 2 tercios de los participantes incluidos. A diferencia de otros estudios observacionales que han indicado que la miocarditis puede tener una prevalencia ligeramente superior en los varones que en las mujeres14, en nuestro estudio los varones presentaron una prevalencia de afección pericárdica y miocárdica inferior a la de las mujeres (7 [17,9%] frente a 36 [36,0%]; p=0,043). Algunos resultados recientes apuntan que el espectro inmunitario existente en la COVID-19 difiere considerablemente entre sexos15, de tal manera que las mujeres presentan una activación de los linfocitos T más robusta que la de los varones. Teniendo en cuenta que tanto la pericarditis como la miocarditis se producen a través de mecanismos mediados por linfocitos T y B, nuestras observaciones tienen interés y aportan nueva evidencia que indica la existencia de unas diferencias entre los sexos por lo que respecta a los resultados clínicos de la COVID-19 que será necesario corroborar en futuros estudios.
En estudios previos se ha descrito la prevalencia de la lesión miocárdica después de la COVID-1916–18. Un estudio observacional retrospectivo inicial realizado en 26 pacientes con neumonía por COVID-19 que presentaron síntomas cardiacos durante la hospitalización reveló edema miocárdico en un 54% de los pacientes y realce tardío con gadolinio en un 31%16. Observaciones similares en un estudio prospectivo de 100 pacientes que se recuperaron de neumonías por COVID-19 indicaron que había edema miocárdico en un 60% de los casos y realce tardío de gadolinio en un 32%17. Nuestras observaciones, principalmente en participantes no hospitalizados (83,5%) entre los que también había diagnosticados mediante serología (25,9%), mostraron unos porcentajes de lesión miocárdica en la RMC (en especial edema miocárdico) inferiores a las de los estudios antes mencionados, que concuerdan más con las tasas de lesión miocárdica observadas en la gripe (en la que se ha descrito aumento de las enzimas cardiacas y aparición de signos electrocardiográficos, ecocardiográficos e histológicos en aproximadamente una tercera parte de los casos19). En 2 recientes estudios anatomopatológicos post mortem de pacientes con neumonías por COVID-19, se ha observado miocarditis linfocítica en el 14,3 y el 26,7% de los casos, lo cual concuerda más con nuestras observaciones (el 17,3% con miocarditis aislada y el 25,2% con cualquier grado de afección del miocardio en la RMC)20,21. Además, la lesión del pericardio después de la COVID-19 tiene alta prevalencia; en un reciente estudio de 54 estudiantes deportistas consecutivos con un resultado positivo para el SARS-CoV-2 en la RT-PCR o en la serología, se ha observado inflamación del pericardio, con un derrame pericárdico asociado en el 39,5% de los casos, lo cual es similar al 30,2% de casos de derrame pericárdico observado en nuestro estudio. Es de destacar que los deportistas presentaron valores aumentados del tiempo de relajación en T1 nativo en el 19,0% de los casos, pero los resultados de T2 nativo fueron normales en todos los participantes22.
Es importante señalar que la evaluación clínica de nuestros participantes con sospecha de pericarditis y miocarditis mostró estabilidad clínica, y ningún participante sufrió un derrame pericárdico grave, insuficiencia cardiaca o disfunción ventricular izquierda (solo 3 participantes con miocarditis mostraron anomalías de la contractilidad segmentaria). Sin embargo, serán necesarios estudios de seguimiento para determinar la evolución de las secuelas cardiacas observadas incluso en los participantes asintomáticos y paucisintomáticos después de la infección por SARS-CoV-2. Los participantes a los que se diagnosticó una infección previa mediante serología, que era más probable que estuvieran asintomáticos o presentaran síntomas leves y podrían ser más representativos de los casos detectados en los estudios de seroprevalencia en toda la población6,7, mostraron también una elevada prevalencia de manifestaciones pericárdicas y miocárdicas, si bien fue inferior a la observada en los participantes con una RT-PCR positiva (7 [19,4%] frente a 36 [35,0%]; p=0,097).
Actualmente hay gran interés por las secuelas a largo plazo de la COVID-19. Resulta intrigante que hubiera una sospecha clínica de manifestaciones pericárdicas y miocárdicas mucho tiempo después de la infección por SARS-CoV-2 (más de 10 semanas después del pródromo vírico inicial de la infección), así como en algunos pacientes actualmente asintomáticos (9 casos; 1 de cada 5 casos finales de sospecha clínica de un diagnóstico de pericarditis, miopericarditis o miocarditis). Es posible que estas manifestaciones a largo plazo se deban a una respuesta inmunitaria innata y adaptativa inadecuada; los datos relativos a las consecuencias inmunitarias a más largo plazo de una infección por SARS-CoV-2 previa son muy escasos5, y ningún estudio se ha centrado específicamente en el contexto de la pericarditis y la sospecha clínica de miocarditis. En este estudio, una investigación detallada de la distribución de las poblaciones principales y secundarias de células inmunitarias en la sangre puso de manifiesto una alta frecuencia de perfiles inmunitarios con alteración generalizada.
Varias de las alteraciones de las células inmunitarias identificadas son parecidas a las anomalías descritas durante la infección activa en la población general con COVID-19, como la disminución del recuento de eosinófilos y linfocitos NK23. El patrón general que surge en este estudio es un perfil inmunitario singular asociado al SARS-CoV-2. Por ejemplo, aunque la disminución del recuento de eosinófilos en sangre se ha descrito en los participantes infectados por la gripe24, no se ha descrito todavía ninguna asociación con un aumento del recuento de linfocitos T citotóxicos (CD4-CD8-/lo) y plasmablastos en sangre, como la que se ha identificado en participantes con infección por el VIH sin eosinopenia25. Un análisis más detallado de los perfiles inmunitarios alterados en los diferentes grupos de participantes puso de relieve que, en los casos de sospecha clínica de miopericarditis o miocarditis, hubo un recuento de linfocitos más próximo al normal, pero con una reducción del número de eosinófilos y linfocitos NK en sangre circulante. Un perfil singular de este tipo se parece al que se ha descrito recientemente durante la fase aguda de la infección por SARS-CoV-2, y ello apunta a una respuesta citotóxica continua, con aumento de la migración tisular o la muerte por apoptosis de subgrupos específicos de células citotóxicas. Estos resultados indican que puede producirse una respuesta humoral menos pronunciada (que podría ser insuficiente) o tardía en estos participantes, y ello puede conducir a una reducción local de la neutralización, opsonización o eliminación del virus en el perimiocardio; la persistencia local del virus podría favorecer un aumento del alojamiento (homing) tisular (o una muerte temprana) de los eosinófilos y los monocitos inmunomoduladores e intermedios, además de las células citotóxicas (efectoras). Así pues, de manera similar a lo que ocurre con la gripe26, aunque la neumonía por SARS-CoV-2 es la complicación más ampliamente identificada, el coronavirus podría desencadenar también una pericarditis o una miocarditis como parte de la respuesta inmunitaria del huésped, más que por una miocarditis causada por el virus en sí. En este sentido, están empezando a describirse casos de afección cardiaca después de la segunda dosis de la vacuna contra la COVID-1927.
LimitacionesLa principal limitación de este estudio es que la sospecha clínica de miocarditis no se confirmó mediante una biopsia endomiocárdica. Los parámetros de T1 y T2 de la RMC, aun siendo significativos, mostraron diferencias pequeñas entre los participantes con infección por SARS-CoV-2 y el grupo de control. El análisis del estudio se limitó a trabajadores sanitarios y, por consiguiente, tiene una posibilidad limitada de generalización externa a otros contextos distintos de la asistencia sanitaria. Sin embargo, el punto fuerte de este estudio es la adición de participantes no hospitalizados, así como la inclusión de participantes no diagnosticados por serología de una infección anterior por SARS-CoV-2, que mostraron también gran prevalencia de afección pericárdica y miocárdica.
CONCLUSIONESEn este estudio se pone de manifiesto que la sospecha clínica de pericarditis y miocarditis es frecuente entre los trabajadores sanitarios después de una infección por SARS-CoV-2, así como en algunas personas actualmente asintomáticas. Además, se presenta evidencia que indica una alteración de la distribución de células inmunitarias en la sangre que afecta tanto a las células que participan en la respuesta inmunitaria innata (p. ej., eosinófilos, monocitos y linfocitos NK) como a las que intervienen en las respuestas de inmunidad adaptativa celular (como los linfocitos T citotóxicos) y humoral (como los linfocitos B y las células plasmáticas). Así pues, la afección pericárdica y miocárdica tras la infección por SARS-CoV-2 podría ser consecuencia indirecta de esta respuesta inmunitaria del huésped. Estas observaciones podrían indicar la aparición tardía de secuelas cardiacas después de una infección por SARS-CoV-2.
FINANCIACIÓNEste estudio contó con el apoyo de CIBERCV (CB16/11/00374) y CIBERONC (CB16/12/00400) y la subvención COV20/00386 del Instituto de Salud Carlos III y FEDER, Ministerio de Ciencia e Innovación, Madrid, España, y por GRS COVID 26/A/20 de la Gerencia Regional de Salud, Junta de Castilla y León, España.
CONTRIBUCIÓN DE LOS AUTORESR. Eiros y M. Barreiro-Pérez contribuyeron por igual a este trabajo y comparten la primera autoría.
A. Orfao y P.L. Sánchez contribuyeron por igual a este trabajo y comparten la última autoría.
R. Eiros, M. Barreiro-Pérez, J. Almeida, J.L. Bravo-Grande, A. Orfao y P.L. Sánchez concibieron y diseñaron el estudio. R. Eiros, M. Barreiro-Pérez, A. Orfao, P.L. Sánchez participaron en la búsqueda bibliográfica; R. Eiros, S. Merchán, I. Toranzo participaron en la evaluación clínica de los participantes; S. Merchán, C. Sánchez-Pablo, I. Toranzo, E. Díaz-Peláez, L. Macías-Álvarez participaron en la obtención de los datos clínicos; M. Barreiro-Pérez, A. Martín-García participaron en el análisis de los datos (RMC); E. Villacorta, D. González-Calle participaron en el análisis de los datos (ECG); A. Pérez-Pons, A. Torres-Valle, O. Pérez-Escurza, B. Fuentes-Herrero realizaron los experimentos inmunofenotípicos y de serología y obtuvieron los datos; J. Almeida, B. Fuentes-Herrero, G. Oliva-Ariza, Q. Lecrevisse, R. Fluxa y A. Orfao participaron en el análisis y la interpretación de los datos (determinación de inmunofenotipo y serología); R. Eiros, M. Barreiro-Pérez, A. Martín-García, E. Villacorta, A. Orfao y P.L. Sánchez participaron en el análisis y la interpretación de los datos; M. Barreiro-Pérez, J. Almeida, J.L. Bravo-Grande, A. Orfao y P.L. Sánchez participaron en la redacción del artículo.
CONFLICTO DE INTERESESA. Orfao y J. Almeida declaran ser dos de los inventores de la patente europea 119646NL00 propiedad de EuroFlow, registrada en noviembre de 2019 (Means and methods for multiparameter flow cytometry based leukocyte subsetting) y A. Orfao y J. Almeida son también autores de la patente WO 2010/140885A1 de PCT (Methods, reagents and kits for flow cytometric immunophenotyping). El programa informático Infinicyt se basa en la propiedad intelectual de la Universidad de Salamanca de España. Todos los derechos de propiedad intelectual y patentes relacionadas se han licenciado a Cytognos (Salamanca) y Becton/Dickinson Biosciences (San José, Estados Unidos), y estas empresas pagan derechos de autor al EuroFlow Consortium. Estos derechos de autor se usan exclusivamente para continuar la colaboración EuroFlow y la sostenibilidad del EuroFlow Consortium. No hay otros conflictos de intereses relacionados con este estudio.
- -
Cada vez es mayor la evidencia de secuelas cardiacas después de la infección por SARS-CoV-2.
- -
Aunque la pericarditis y la miocarditis son 2 de las manifestaciones cardiacas más frecuentes tras una infección vírica, la bibliografía con revisión externa publicada se limita a presentaciones de casos aislados de pericarditis y pequeños estudios de observación de miocarditis, principalmente en pacientes hospitalizados con una RT-PCR positiva y neumonía por COVID-19, y ello es insuficiente para generalizar las conclusiones acerca de la prevalencia real de la afección pericárdica y miocárdica después de una infección por SARS-CoV-2.
- -
No hay ningún estudio en el que se hayan investigado las consecuencias inmunitarias de la infección por SARS-CoV-2 en el contexto de la pericarditis y la miocarditis.
- -
La prevalencia de pericarditis y miocarditis con estabilidad clínica después de una infección por SARS-CoV-2 es elevada y se da en hasta un 31% de los casos y también en algunos de los participantes actualmente asintomáticos (1 de cada 5 casos diagnosticados), en relación con una notable alteración de los perfiles de células inmunitarias en la sangre.
- -
Las mujeres mostraron una mayor probabilidad de sufrir pericarditis o miocarditis.
- -
La pericarditis y la miocarditis clínicas se asocian con unos perfiles específicos de células inmunitarias, y ello abre el camino a un mejor conocimiento de los mecanismos inmunitarios involucrados. A este respecto, está empezando a describirse afección pericárdica y miocárdica después de la vacunación contra la COVID-19.




![Composición de las imágenes de resonancia magnética cardiaca de un participante con afección pericárdica y miocárdica. Las principales observaciones consisten en un derrame pericárdico en la pared inferior (*), un sutil realce tardío de gadolinio subepicárdico (flechas rojas) y un aumento del tiempo de relajación nativo en T1 en el segmento inferolateral, con un aumento no significativo del tiempo de relajación T2 en ese segmento. Todas las imágenes corresponden a proyecciones de eje corto a nivel de los músculos papilares. Imagen A: imagen de cine telediastólica (Steady State Free Precession [SSFP]). Imagen B: realce tardío de gadolinio con inversión-recuperación sensible a la fase. Imagen C: mapeo nativo en T1 (Modified Look-Locker Imaging [MOLLI]). Imagen D: mapeo en T2 (Gradient and Spin-Echo [GraSE]). Composición de las imágenes de resonancia magnética cardiaca de un participante con afección pericárdica y miocárdica. Las principales observaciones consisten en un derrame pericárdico en la pared inferior (*), un sutil realce tardío de gadolinio subepicárdico (flechas rojas) y un aumento del tiempo de relajación nativo en T1 en el segmento inferolateral, con un aumento no significativo del tiempo de relajación T2 en ese segmento. Todas las imágenes corresponden a proyecciones de eje corto a nivel de los músculos papilares. Imagen A: imagen de cine telediastólica (Steady State Free Precession [SSFP]). Imagen B: realce tardío de gadolinio con inversión-recuperación sensible a la fase. Imagen C: mapeo nativo en T1 (Modified Look-Locker Imaging [MOLLI]). Imagen D: mapeo en T2 (Gradient and Spin-Echo [GraSE]).](https://static.elsevier.es/multimedia/03008932/0000007500000009/v2_202302010736/S0300893221004681/v2_202302010736/es/main.assets/thumbnail/gr2.jpeg?xkr=eyJpdiI6IldXdGhWcWc2WXhyTWgwM0xyMnRnYnc9PSIsInZhbHVlIjoiODNpZFJZZVJ4K3JUY0Npck9VTnRlLzRkZ0tTVlVVV0VWdFBVanp5clM1cz0iLCJtYWMiOiIyNWI1OTZhZTRlMWIzNGJjMjNiOTlhYWIxYzYxYmM5NzI5N2JjMDVjYzQzMzBiYTZmODYyZDg5OGRjOGQ0MGZhIiwidGFnIjoiIn0=)


