Palabras clave
INTRODUCCIÓN
El tratamiento definitivo de los pacientes con fibrilación auricular (FA) incluye el aislamiento de los potenciales focos arritmogénicos disparadores localizados predominantemente en las venas pulmonares (VVPP)1, así como la abolición de focos no pulmonares2,3, empleando la radiofrecuencia (RF) como fuente de energía. Aquellos con fibrilación auricular paroxística (FAP), constituyen el subgrupo mejor, en términos de eficacia, en comparación con las formas crónicas4.
Las complicaciones típicamente descritas con RF incluyen estenosis de las VVPP5, fístula auriculoesofágica6, tromboembolismo7 y arritmias auriculares postablación8.
La lesión producida por frío, a diferencia de la obtenida mediante RF, preserva la arquitectura tisular y disminuye la formación de trombos9.
La crioablación con catéter o catéter-balón se ha mostrado segura en animales y humanos, ya que permite el aislamiento circunferencial completo de la unión aurícula-vena, en el antro de las VVPP9,10.
Presentamos en este trabajo nuestra experiencia inicial de crioablación mediante catéter-balón, enfocada al aislamiento circunferencial completo y agudo de las VVPP en pacientes con FAP; en la medida de nuestros conocimientos, ésta es la primera observación en España con esta técnica.
MÉTODOS
Dispositivo
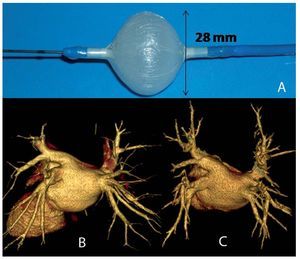
Utilizamos el catéter-balón Artic Front de 28 mm, 10,5 Fr (Cryo-Cath Technologies, Montreal, Quebec, Canadá) (fig. 1) de doble cámara que permite la circulación de óxido nitroso a temperaturas de -30 a -75 °C, y el vapor refrigerante absorbe el calor del tejido que lo rodea, con lo que produce su congelación. Tras cada aplicación, el gas es evacuado al exterior del sistema.
Fig. 1. A: catéter-balón inflado. B: tomografía computarizada (TC) (64 cortes) de las venas pulmonares, caso 5. C: TC (64 cortes) de las venas pulmonares, 3 meses postablación, caso 5.
La fuente de frío es liberada a través de una consola con monitor ajustado que proporciona datos de temperatura alcanzada y tiempo de aplicación.
Pacientes
Se incluyeron 5 pacientes (4 varones y 1 mujer), con edad media de 58,6 (intervalo, 53-72) años, sin cardiopatía estructural y con historia de FAP documentada recurrente y refractaria a tratamiento antiarrítmico, de más de 2-6 años de evolución. La fracción de eyección del ventrículo izquierdo (FEVI) en todos los casos fue del 58% o más (tabla 1).
Estudios previos al procedimiento
En todos los pacientes, se realizó ecocardiograma transtorácico y transesofágico al menos 48 h antes del procedimiento y angio-TC de 64 cortes (fig. 1), para obtener la anatomía de la aurícula izquierda y de las VVPP (tabla 2).
Procedimiento
Los procedimientos se realizaron con anestesia general; en la intubación se utilizó cisatracurio como relajante neuromuscular.
Se introdujeron un electrocatéter decapolar de 6 Fr hasta el seno coronario, y un cuadripolar de 6 Fr hasta la unión AV, para registro bipolar proximal del potencial del haz de His.
Tras la punción transeptal, se mantuvo la anticoagulación con tiempo de coagulación activado (TCA) ≥ 300 ms. Una vez introducida la vaina SL0 o SL1 en la aurícula izquierda, se pasó la guía de 260 cm, 0,32, con punta en jota, St. Jude 404878, selectivamente a cada una de las VVPP, y se realizó flebografía con inyección de contraste al 50%. Tras la angiografía, se pasó a través de la guía el catéter guía Flex-Cath 15 Fr, con su dilatador (Cryo-Cath Technologies), posicionándolo en su porción distal en la cavidad auricular, en OAI 40° y, a través de éste, el catéter circular dodecapolar 7 Fr con diámetro ajustable (St. Jude Reflexion Spiral); se cartografiaron todas y cada una de las VVPP, empezando sistemáticamente por la superior izquierda, seguida de la inferior izquierda y posteriormente la superior derecha y la inferior derecha.
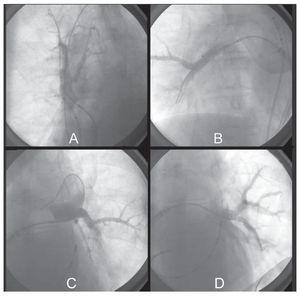
Tras la cartografía, selectivamente se cateterizó cada una de las venas con el catéter-balón de 28 mm de diámetro, que se ajustó al antro hasta conseguir una buena oclusión objetivada, con retención de contraste al 50% en el interior de la vena, y ausencia de drenaje a la cavidad auricular (fig. 2). Comprobado esto, se lavó el interior del catéter con 3-5 ml de suero salino heparinizado, al objeto de evitar cristalización del contraste con el frío, y se inició la congelación manteniendo la presión del balón sobre la vena hasta alcanzar los 90 s; pasado este tiempo, el balón se encontraba completamente adherido al antro de la vena pulmonar, continuándose la congelación por un tiempo total de 300 s.
Fig. 2. Ablación. Oclusión catéter-balón, que muestra retención del contraste con ausencia de drenaje auricular por oclusión completa, caso 5. A: ablación. Oclusión catéter-balón de la vena pulmonar superior derecha. Nótese el catéter cuadripolar en la vena cava superior para estimulación frénica. B: ablación. Oclusión catéter-balón de la vena pulmonar inferior derecha. C: ablación. Oclusión catéter-balón de la vena pulmonar superior izquierda. D: ablación. Oclusión catéter-balón de la vena pulmonar inferior izquierda.
Se realizaron entre 2 y 3 aplicaciones de frío en cada vena (media, 2,75), individualmente, pasando el catéter cuatripolar de His hasta la vena cava superior para estimulación frénica continua a frecuencias bajas (3.000 ms de LC), al objeto de monitorizar su integridad durante la crioablación de las VVPP derechas, especialmente las superiores.
Finalizado el procedimiento, y tras retirar las vainas del transeptal, se revirtió la anticoagulación con protamina, pasando a HBPM, y a las 4 h se inició dosis de carga de dicumarol oral y 300 mg de ácido acetilsalicílico (AAS).
RESULTADOS
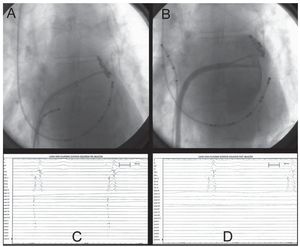
Treinta minutos después de terminar las aplicaciones de frío, nuevamente se cartografiaron las VVPP con el catéter circular, y se demostró su aislamiento completo (100%) (fig. 3C y D), cartografiando el antro previo al ostium y dentro de la propia vena pulmonar (fig. 3A y B), demostrándose, con estimulación, bloqueo de entrada y salida.
Fig. 3. Caso 5. A: catéter-cartografía en el antro de la vena pulmonar superior izquierda antes de la ablación. B: catéter-cartografía de la vena pulmonar superior izquierda con inyección de contraste postablación. C: registro intracavitario antes de la ablación obtenido en la figura 3A con el catéter circular en la porción externa del ostium de la vena pulmonar con potenciales arritmogénicos de las venas pulmonares (PAVP). D: registro obtenido en la misma posición de 3A postablación con ausencia de PAVP que muestra su aislamiento circunferencial completo.
La temperatura media alcanzada en todas las aplicaciones fue mayor de -40 °C (intervalo -32 a -70 °C).
La media de duración total del procedimiento fue de 5,4 h (329 min), con un tiempo medio de fluoroscopia de 81,6 min.
Evolución
Los pacientes pasaron 24 h tras el procedimiento en la unidad de cuidados intensivos, y se les dio el alta hospitalaria en 48-72 h, sin complicaciones, con flecainida 300 mg, AAS y anticoagulación oral, para los primeros 3 meses postablación.
En ningún caso se documentó estenosis de las VVPP a los 3 meses postablación ni recurrencia clínica de la arritmia, con seguimiento programado con Holter a los 7, 15, 30 y 90 días y TC multicorte a los 30 y 90 días.
DISCUSIÓN
La ablación por RF en torno a la desembocadura de las VVPP es el método más ampliamente utilizado para el tratamiento definitivo de la FA.
Este método, en todas sus variantes técnicas, requiere habilidad técnica y experiencia, ya que exige procedimientos prolongados con tiempos de escopia considerables.
Además, aplicaciones de RF en el ostium pueden causar estenosis de alguna vena pulmonar5, y por íntima relación anatómica11, complicaciones más letales como la fístula auriculoesofágica6.
Las primeras experiencias publicadas en humanos, mediante aplicación de frío a través de un catéter puntual, sugieren que la crioablación puede ser más segura que la ablación con RF, ya que puede disminuir el riesgo de estenosis venosa pulmonar y otras complicaciones, como la fístula auriculoesofágica, y consigue un aislamiento agudo inmediato del 97% de las VVPP12.
La disponibilidad del nuevo catéter-balón Artic Front ha demostrado10 ausencia de estenosis de las VVPP y de fístula auriculoesofágica.
En resumen, presentamos aquí el resultado agudo inmediato de los primeros casos realizados en España con el criocatéter-balón como método más rápido y seguro de aislamiento circunferencial completo agudo del foco arritmogénico de las VVPP en pacientes con FAP.
Un mayor número de pacientes, con seguimiento a medio y largo plazo, y estudios comparativos con otras metodologías permitirán dilucidar finalmente cuál es el papel de la crioablación en el tratamiento curativo de la FAP.
AGRADECIMIENTOS
Al Dr. Juan J. Fernández-Ramos, gerente de nuestro hospital, por su apoyo continuo en la asistencia y la investigación. A Gema Mariscal por la preparación del manuscrito.
Full English text available from: www.revespcardiol.org
Declaración de conflicto de intereses: el Dr. Robert H. Hoyt es investigador USA del sistema Crio-Cath.
Correspondencia: Dr. J.M. Paylos.
Laboratorio de Electrofisiología. Unidad de Arritmias. Clínica Moncloa. Avda. de Valladolid, 83. 28008 Madrid. España.
Correo electrónico: jpaylos@ircus.com
Recibido el 14 de enero de 2009.
Aceptado para su publicación el 17 de abril de 2009.