Palabras clave
INTRODUCCIÓN
La aldosterona, principal mineralocorticoide sintetizado por la glándula adrenal, desempeña una función fundamental en la homeostasis de sodio y agua, así como en la excreción urinaria de potasio. Sin embargo, en los últimos años se está poniendo de manifiesto que esta hormona tiene un importante papel patogénico en el aumento de las cifras de presión arterial y en el desarrollo del remodelado vascular, la hipertrofia ventricular izquierda y la nefropatía en forma de proteinuria y glomerulosclerosis en el paciente hipertenso1. Un claro ejemplo de esta asociación es el hiperaldosteronismo primario, una causa secundaria de hipertensión arterial (HTA), en el que el incremento de la concentración plasmática de aldosterona produce un significativo efecto deletéreo cardiaco y vascular, así como un mayor riesgo de sufrir eventos cardiovasculares2.
Por otro lado, en fases avanzadas de insuficiencia renal, los valores de aldosterona se encuentran aumentados de forma significativa a medida que se reduce el filtrado glomerular, debido a la activación del sistema renina-angiotensina-aldosterona secundario al cambio hemodinámico glomerular, lo que contribuye a un mayor daño orgánico, tanto renal como cardiaco3,4. Sin embargo, en pacientes hipertensos con función renal conservada, no hay publicaciones que hayan estudiado específicamente la asociación entre aldosterona y filtrado renal. El objetivo de nuestro trabajo es analizar la relación entre las concentraciones plasmáticas de aldosterona y el filtrado glomerular (FG) en pacientes hipertensos con función renal conservada, tras descartar hiperaldosteronismo.
MÉTODOS
Se ha analizado de manera prospectiva a todos los pacientes hipertensos, mayores de 18 años, remitidos a nuestra unidad de hipertensión arterial, integrada en un servicio de cardiología, durante los años 2005-2008. Se realizó a todos los pacientes anamnesis y examen físico completos, junto con pruebas de laboratorio específicas para descartar una causa secundaria de HTA. Las pruebas de laboratorio se realizaron tras ayuno de 12 h e incluían hemograma y bioquímica estándares, hormonas tiroideas, aldosterona con cociente aldosterona plasmática/actividad de renina plasmática (ALD/ARP), catecolaminas y cortisol en orina y microalbuminuria en orina de 24 h. La función renal se estimó mediante el cálculo del FG con la fórmula MDRD (Modification of Diet in Renal Disease); se definió como disfunción renal un FG < 60 ml/min. Se determinó la masa ventricular izquierda por estudio ecocardiográfico mediante la fórmula de Penn.
Se excluyó a los pacientes con diagnóstico de hiperaldosteronismo primario por un cociente ALD/ ARP > 30, junto con aldosterona plasmática elevada (> 20 ng/dl) y falta de supresión de la aldosterona plasmática tras sobrecarga hídrica durante 4 h. También se excluyó a los pacientes con función renal disminuida (FG < 60 ml/min). Se dividió a los pacientes en dos grupos en función del FG (60-89 ml/min y > 90 ml/min), según la clasificación de los estadios de la enfermedad renal crónica de la National Kidney Foundation (estadios 1 y 2).
Análisis estadístico
Las variables continuas se expresan como media ± desviación estándar, mientras que las variables cualitativas aparecen como número y porcentaje. Para el análisis de la correlación entre dichas variables cuantitativas (ALD y FG) se utilizó el test de correlación de Spearman ya que no seguía una distribución normal. Posteriormente, se realizó un análisis de regresión lineal múltiple ajustado por edad, sexo, diabetes mellitus, tabaco, dislipemia, cardiopatía isquémica previa, tiempo de evolución de la HTA, cifras de presión arterial sistólica y diastólica, la masa ventricular izquierda ajustada por superficie corporal determinada por ecocardiografía y las concentraciones plasmáticas de aldosterona. Dado que los valores de aldosterona no seguían una distribución normal, se hizo una transformación logarítmica de la variable. El análisis estadístico se realizó con el programa SPSS 13 y se consideró significativas diferencias con un valor de p < 0,05.
RESULTADOS
Tras descartar a los pacientes con hiperaldosteronismo y/o FG < 60 ml/min, se incluyó a 186 pacientes hipertensos (el 58,1%, varones), con una media de edad de 55 ± 13,4 años. En la tabla 1 se recogen las principales características clínicas de la población.
Del total de pacientes reclutados, 77 presentaron un FG > 90 ml/min, mientras que 109 tenían un FG de 60-89 ml/min. Los pacientes con un FG de 60-89 ml/min presentaban unos valores de aldosterona significativamente más elevados que el grupo con FG > 90 ml/min (20,02 frente a 15,3 ng/dl; p < 0,05). Además, este grupo presentaba más antecedentes de cardiopatía isquémica, hipertrofia ventricular izquierda en el estudio ecocardiográfico y concentraciones plasmáticas más elevadas de NT-proBNP (tabla 1). No hubo diferencias en el tratamiento farmacológico entre ambos grupos, a excepción de un mayor empleo de estatinas en los pacientes con FG de 60-90 ml/min, próximo a la significación (el 32,1 frente al 19,5%; p = 0,06).
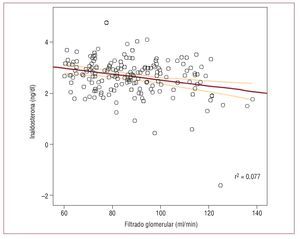
Se obtuvo una correlación negativa modesta entre las concentraciones plasmáticas de aldosterona y el FG (r = -0,196; p < 0,01), de tal manera que cifras más elevadas de aldosterona plasmática se asociaban con un menor filtrado glomerular (fig. 1). En el análisis multivariable, tras ajustar por diversas variables, se confirmó esa asociación independiente entre las concentraciones séricas de aldosterona y el FG en nuestros pacientes hipertensos (B = -7,36; p < 0,001). Otras variables asociadas fueron la edad (B = -0,58; p < 0,001) y las cifras de presión arterial sistólica (B = -0,13; p < 0,05).
Fig. 1. Correlación mediante rho de Spearman de las concentraciones plasmáticas de aldosterona y el filtrado glomerular.
DISCUSIÓN
Nuestro estudio pone de manifiesto un resultado interesante, no analizado anteriormente en profundidad, como es la asociación independiente entre las concentraciones plasmáticas de aldosterona y el filtrado renal en pacientes hipertensos con función renal «normal», de tal manera que cifras menores de filtrado renal se asocian con una concentración plasmática de aldosterona mayor. Si bien es cierto que la correlación es modesta, es el primer trabajo que pone de manifiesto tal asociación en fases incipientes de daño renal hipertensivo.
En los últimos años se está centrando la atención en el protagonismo que tiene la aldosterona en la fisiopatología de la HTA y la enfermedad cardiovascular. En diferentes estudios se ha demostrado que las cifras elevadas de aldosterona en pacientes con hiperaldosteronismo primario se asocian con una mayor tasa de albuminuria y un empeoramiento de la función renal en comparación con los pacientes con HTA esencial5, así como con un mayor número de eventos cardiovasculares, hipertrofia ventricular izquierda y un mayor grado de remodelado vascular6. Por otro lado, diferentes ensayos clínicos apoyan la hipótesis de que la aldosterona produce, de manera independiente, daño renal y cardiaco en pacientes sin hiperaldosteronismo7. Sabemos que en fases avanzadas de insuficiencia renal, los valores de aldosterona suelen aumentar de forma secundaria a la activación del sistema renina-angiotensina-aldosterona, y ello puede contribuir a un mayor daño orgánico y crear un círculo vicioso3,4. Por el contrario, en pacientes hipertensos con función renal conservada, no hay publicaciones clínicas específicas en las que se haya estudiado la posible relación entre aldosterona y función renal.
Fundamentalmente, ha sido en estudios experimentales con animales donde se ha analizado el daño originado por la aldosterona en diferentes niveles de la nefrona, bien sea en el mesangio, la membrana basal o en el túbulo renal, esto indica un importante papel patogénico de dicha hormona en el deterioro de la función renal8-10. Parece claro que la aldosterona es un importante mediador en el recambio de colágeno, que estimula la expresión de diversas moléculas profibróticas e inhibe otras antifibróticas, por lo que tiene un papel decisivo en el desarrollo de fibrosis, tanto renal como cardiaca11. En este último aspecto nuestro estudio también pone de manifiesto el posible efecto deletéreo de la aldosterona a nivel cardiaco, traducido en una mayor prevalencia de cardiopatía isquémica en los pacientes con mayores concentraciones de aldosterona, tal y como ha sido descrito previamente en pacientes con hiperaldosteronismo6, y una correlación significativa con la masa ventricular izquierda ajustada por superficie corporal (r = 0,167; p < 0,05).
Nuestros hallazgos refuerzan el interés de la asociación entre las concentraciones plasmáticas de aldosterona y el deterioro del filtrado renal en fases iniciales de pacientes hipertensos. Se precisan estudios en este campo que analicen si un bloqueo más efectivo e intenso de la secreción de aldosterona puede ser eficaz en la prevención del deterioro de la función renal de estos pacientes.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. P. Morillas Blasco.
Servicio de Cardiología. Hospital Universitario San Juan. 03550 San Juan de Alicante. Alicante. España.
Correo electrónico: pedromorillas@teleline.es
Recibido el 20 de diciembre de 2008.
Aceptado para su publicación el 12 de mayo de 2009.