La amiloidosis cardiaca por transtirretina (ACTTR) se asocia con fibrilación auricular y un riesgo trombótico y hemorrágico aumentados. Nuestro objetivo fue evaluar los resultados del cierre percutáneo de orejuela izquierda (COI) comparado con pacientes sin diagnóstico conocido de ACTTR.
MétodosComparación de la evolución a largo plazo de pacientes con diagnóstico de ACTTR frente a pacientes sin ese diagnóstico sometidos a COI entre 2009 y 2021.
ResultadosSe incluyó a 1.159 pacientes de los que 40 (3,5%) fueron diagnosticados de ACTTR; fueron más ancianos, con más comorbilidades, mayores puntuaciones HAS-BLED y CHA2DS2-VASc y menor función ventricular izquierda. Se consiguió el COI exitoso en 1.137 pacientes (98,1%) sin diferencias entre los grupos. No hubo diferencias intrahospitalarias ni al seguimiento en ictus isquémico (5 frente a 2,5%, p=0,283), ictus hemorrágico (2,5 frente a 0,8%, p=0,284), ni sangrado mayor o menor. La mortalidad a 2 años no presentaba diferencias entre los pacientes con ACTTR y los que no presentaban este diagnóstico (20 frente a 13,6%, 0,248); sin embargo, a los 5 años los pacientes ACTTR presentaron mayor mortalidad (40 frente a 19,2%, p <0,001) pero no relacionada con complicaciones hemorrágicas o ictus isquémico.
ConclusionesEl COI podría reducir complicaciones hemorrágicas y accidentes cerebrovasculares sin incrementar las complicaciones precoces en pacientes con ACTTR. Aunque la supervivencia a largo plazo en pacientes con ACTTR es muy reducida, a dos años fue comparable a la del grupo sin diagnóstico de ACTTR lo que sugiere que el COI no es fútil en pacientes con ACTTR.
Palabras clave
La amiloidosis cardiaca (AC) es una miocardiopatía causada por depósitos extracelulares de proteínas estructuradas e inestables en el miocardio que originan una fisiología restrictiva en el corazón1. En aproximadamente el 98% de los casos se debe a depósitos de fibrillas compuestas por cadenas ligeras de immunoglobulina monoclonal (AL) o amiloidosis por transtirretina (ATTR), pero existen 9 proteínas amiloidógenas que pueden afectar al miocardio2. El diagnóstico de AC empieza con una fase de sospecha (identificación de alarmas) y termina con la confirmación del diagnóstico según criterios invasivos o no invasivos1,2. No obstante, solo la amiloidosis cardiaca por transtirretina (ACTTR) puede diagnosticarse sin criterios invasivos (biopsia) cuando haya datos radiológicos cardiacos que la confirmen: en la gammagrafía, absorción miocárdica del marcador radioactivo de grado 2 o 3 según la Escala de Peruggini y ausencia de otras discrasias clonales2,3. Tras confirmar la AC, el pronóstico es variable y depende de la fase de la enfermedad y el tipo de AC (AL-AC, forma nativa o hereditaria de la ACTTR); la supervivencia a 5 años varía entre el 14 y el 68%4,5. Cabe destacar que la prevalencia y la incidencia de ACTTR han aumentado de manera constante desde el año 2000 y actualmente es el tipo diagnosticado con mayor frecuencia; afecta en particular a varones ancianos en el caso de la forma nativa de la ACTTR y a pacientes con polineuropatía y miocardiopatía en el caso de las formas hereditarias4–6.
En el curso de la enfermedad, pueden ocurrir varias manifestaciones arrítmicas, como trastornos inespecíficos de la conducción, bradiarritmias, fibrilación auricular (FA) y parada cardiaca repentina7. La prevalencia de FA en la ACTTR es de aproximadamente el 70% en la forma nativa y el 54% en la hereditaria, por lo que es la arritmia más frecuente asociada con esta enfermedad8,9. Incluso cuando no parece que la FA aumente la mortalidad en este contexto, pueden aumentar los episodios de insuficiencia cardiaca, y su tratamiento, basado en fármacos antiarrítmicos y anticoagulantes, no siempre es bien tolerado por los pacientes con AC7,10. Además, los riesgos hemorrágico y trombótico son superiores a los estimados por la mayoría de las escalas11. Algunas estrategias, como el control del ritmo o la ablación, son controvertidas como opción terapéutica para tratar la FA de estos pacientes, pero el riesgo trombótico se mantiene alto incluso cuando se recurre a la anticoagulación y probablemente a pesar del control del ritmo12,13. Además, aunque se ha demostrado que el cierre de la orejuela izquierda (COI) tiene buenos resultados en pacientes con FA y riesgo hemorrágico alto14, esta intervención no se ha estudiado en la población con AC, cuya esperanza de vida es inferior; así pues, su indicación en este contexto sigue sin estar clara, ya que los riesgos quirúrgicos podrían aumentar y su eficacia para prevenir la formación de trombos está poco clara.
El objetivo de este estudio es evaluar si el COI en pacientes con FA y ACTTR producía resultados parecidos que en los pacientes sin un diagnóstico conocido de AC.
MÉTODOSPoblación del estudioEstudio retrospectivo con pacientes consecutivos con FA sometidos a COI por tener contraindicados los anticoagulantes, entre diciembre de 2009 y diciembre de 2020 en 11 hospitales españoles. Se revisó retrospectivamente a los pacientes con diagnóstico de ACTTR y siempre que fue posible se verificaron los criterios diagnósticos del Grupo de trabajo sobre enfermedades del miocardio y el pericardio de la Sociedad Europea de Cardiología2; se comparó a los pacientes con aquellos sin diagnóstico de ACTTR (grupo de control). La decisión de excluir otros tipos de AC se tomó antes de recoger datos, pero al final no se halló ningún caso en la población del estudio. Cabe destacar que la AC no se investigó sistemáticamente en el grupo de control. Todos los datos clínicos y los resultados hospitalarios y del seguimiento se preespecificaron en la base de datos en línea utilizada por los centros, que cumplieron los requisitos de la Ley sobre protección de datos y solo estaban accesibles para los cardiólogos participantes y los coordinadores del registro. El seguimiento fue retrospectivo mediante la revisión de las historias clínicas y el contacto directo por teléfono cuando las historias estaban incompletas o ausentes. Este estudio fue aprobado por los comités de ética locales.
Objetivos del estudioEl objetivo primario fue comparar los resultados hospitalarios y de seguimiento entre los pacientes con ACTTR y del grupo de control sometidos a COI. Los secundarios fueron comparar la mortalidad durante el seguimiento entre los 2 grupos para describir las características clínicas de la población con ACTTR y definir los factores predictivos de la mortalidad. Se definió inutilidad como la supervivencia < 1 año tras la intervención.
Análisis estadísticoLas variables categóricas expresan frecuencias y las comparaciones entre grupos se hicieron con la prueba de la χ2 o la prueba exacta de Fisher en su caso. Las variables continuas expresan media ± desviación estándar o mediana [intervalo intercuartílico]. Se comprobó la distribución normal de las variables continuas con la prueba de Kolmogorov-Smirnov y mediante gráficas Q-Q. Las comparaciones entre grupos se realizaron con la prueba de la t de Student o la prueba de la U de Mann-Whitney según la distribución de las variables.
Se hizo un análisis de regresión multivariable de Cox para identificar los factores pronósticos no dependientes de la mortalidad a 2 años. El modelo multivariable se construyó por selección retrospectiva gradual (cociente de verosimilitud). Se incluyeron en el modelo las variables asociadas con la mortalidad en el análisis univariante. Se verificó la hipótesis de los riesgos proporcionales. Las variables incluidas fueron la edad, la superficie corporal, la fracción de eyección del ventrículo izquierdo, la presencia de diabetes, enfermedad coronaria previa, ictus isquémico previo, ictus hemorrágico previo, enfermedad renal crónica, enfermedad hepática y ACTTR y la puntuación en la escala CHA2DS2-VASc. Además, se registraron las incidencias de complicaciones isquémicas y hemorrágicas en el hospital y a largo plazo y se analizaron por separado y como objetivo combinado que incluía eventos cerebrovasculares tanto isquémicos como hemorrágicos.
Se analizó la mortalidad a 2 y 5 años mediante curvas de supervivencia de Kaplan-Meier sin eventos, y para compararlas se utilizó la prueba de rangos logarítmicos. Se hizo un análisis del riesgo competitivo para la mortalidad a los 2 años de seguimiento15. Todas las pruebas fueron bilaterales con un umbral de significación de 0,05. Todos los análisis se hicieron con el software R, versión 3.6.1 (R Project for Statistical Computing, Austria).
RESULTADOSEn este estudio se incluyó a un total de 1.159 pacientes sometidos a COI. De estos, se diagnosticó ACTTR a 40 pacientes (3,5%) (a 2 pacientes se les diagnosticó inmediatamente después de la intervención y a 38, antes de esta) y en 1.119 (96,5%) no se hallaron indicios de la enfermedad.
Características basales de la poblaciónEn la tabla 1 se resumen las principales características basales. Los pacientes del grupo con ACTTR eran con mayor frecuencia varones (34 [85%] frente a 707 [63,2%]; p=0,005), significativamente mayores (83,1±4,9 frente a 75,9±8,2 años; p <0,001) y con un índice de masa corporal inferior (25,9±3,1 frente a 27,2±4,5; p=0,017). También presentaban más comorbilidad, en particular diabetes mellitus (20 [50%] frente a 374 pacientes [33,4%]; p=0,030), enfermedad renal crónica (28 [70%] frente a 456 [40,8%]; p <0,001) y arteriopatía periférica (11 [27,5%] frente a 153 [14,3%]; p=0,020).
Principales características clínicas y ecocardiográficas basales de la población total y los grupos
| Población totalN=1.159 (100%) | Grupo de controln=1.119; (96,5%) | ACTTRn=40 (3,5%) | p | |
|---|---|---|---|---|
| Características clínicas | ||||
| Mujeres | 418 (36,1) | 412 (36,8) | 6 (15) | 0,005* |
| Edad (años) | 76,1±8,1 | 75,9±8,2 | 83,1±4,9 | <0,001* |
| IMC | 27,2±4,4 | 27,2±4,5 | 25,9±3,1 | 0,017* |
| SC | 1,83±0,21 | 1,83±0,2 | 1,85±0,16 | 0,512 |
| Hipertensión | 963 (83,1) | 931 (83,2) | 32 (80) | 0,596 |
| Diabetes mellitus | 394 (34) | 374 (33,4) | 20 (50) | 0,030* |
| Fumadores | 298 (25,7) | 295 (26,4) | 3 (7,5) | 0,007* |
| Consumo de alcohol | 73 (6,3) | 70 (6,3) | 3 (7,5) | 0,736 |
| Enfermedad coronaria previa | 263 (22,7) | 258 (24,1) | 5 (12,5) | 0,089 |
| ICP previa | 154 (13,3) | 151 (15,4) | 3 (7,5) | 0,170 |
| CABG previa | 58 (5) | 56 (5,7) | 2 (5) | 0,999 |
| Cirugía valvular previa | 53 (4,6) | 51 (6,1) | 2 (5) | 0,999 |
| Arteriopatía periférica | 164 (14,2) | 153 (14,3) | 11 (27,5) | 0,020* |
| Ictus isquémico previo | 320 (27,6) | 306 (29) | 14 (35) | 0,415 |
| Ictus hemorrágico previo | 252 (21,7) | 50 (23,4) | 13 (32,5) | 0,185 |
| AIT previo | 85 (7,3) | 69 (6,8) | 16 (40) | <0,001* |
| Embolización periférica previa | 31 (2,7) | 29 (3) | 2 (5) | 0,347 |
| ERC | 484 (41,8) | 456 (40,8) | 28 (70) | <0,001* |
| Enfermedad hepática | 89 (7,7) | 87 (8,1) | 2 (5) | 0,765 |
| Hemorragia previa | 839 (72,5) | 804 (71,9) | 35 (87,5) | 0,030* |
| HAS-BLED | 4 [3-4] | 3,5 [3-4] | 4 [4-4] | 0,001* |
| CHA2DS2-VASc | 4 [3-5] | 4,3 [3-5] | 5,2 [5-6] | <0,001* |
| Tipo de FA | ||||
| Paroxística | 398 (34,3) | 393 (35,3) | 5 (12,5) | 0,003* |
| Persistente-permanente | 754 (65,1) | 719 (64,7) | 35 (87,5) | |
| Aleteo auricular | 50 (6,5) | 50 (6,9) | 0 | 0,102 |
| Datos ecocardiográficos | ||||
| Insuficiencia mitral III-IV | 34 (2,9) | 29 (2,6) | 5 (12,5) | 0,005* |
| FEVI (%) | 58,1±10,7 | 58,5±10,5 | 46,8±8,7 | <0,001* |
AIT: accidente isquémico transitorio; CABG: cirugía de revascularización coronaria; ERC: enfermedad renal crónica (definida como tasa de filtrado glomerular <60ml/min/1,73 m2); FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; SC: superficie corporal.
No se observaron diferencias en la incidencia previa de ictus, tanto isquémica como hemorrágica, pero los pacientes con ACTTR habían sufrido más a menudo crisis isquémicas transitorias previas (16 [40%] frente a 69 pacientes [6,8%]; p <0,001) y eventos hemorrágicos en general (35 [87,5%] frente a 804 [71,9%]; p=0,030). Los pacientes del grupo con amiloidosis también presentaron puntuaciones más altas en la escala HAS-BLED (4 [4-4] frente a 3,5 [3-4]; p=0,001) y CHA2DS2-VASc (5,2 [5-6] frente a 4,3 [3-5]; p <0,001). Por último, en el grupo con amiloidosis la fracción de eyección del ventrículo izquierdo fue inferior (un 46,8±8,7% frente a un 58,5±10,5%; p <0,001) y la tasa de insuficiencia mitral (IM) fue mayor (IM III-IV, el 12,5% de los pacientes con ACTTR-AC frente al 2,6%; p=0,005).
En la tabla 2 se resumen las características específicas de los pacientes con ACTTR. En el 65% de estos pacientes se diagnosticó la forma nativa de ACTTR (n=26); en el 12,5%, la forma hereditaria (n=5) y en el 22,5% de los pacientes (n=9) no se analizó la forma. Los principales síntomas asociados con la enfermedad fueron disnea en el 97,5%, síncope en el 17,5% y síndrome del túnel carpiano en el 12,5%, pero no hubo casos de rotura del tendón bíceps ni ortostatismo; se observó estenosis lumbar del conducto vertebral en el 5% de los pacientes. Tras una revisión electrocardiográfica minuciosa, se hallaron alteraciones de la conducción en el 77,5% de los pacientes (el 12,5% presentaba bloqueo auriculoventricular de primer grado; el 52,5%, bloqueo de la rama izquierda del haz de His; el 20%, bloqueo de la rama derecha del haz de His y el 30%, otras alteraciones de la conducción).
Características clínicas y ecocardiográficas específicas de la cohorte con amiloidosis cardiaca
| Subtipo de ATTR (n=40) | |
| ATTRv | 5 (12,5) |
| ATTwt | 26 (65) |
| ATTR de subtipo desconocido | 9 (22,5) |
| Síntomas observados en las historias clínicas (n=40) | |
| Disnea | 39 (97,5) |
| NYHA III-IV | 27 (67,5) |
| Angina de pecho | 2 (5) |
| Síncope | 7 (17,5) |
| Ortostatismo | 0 |
| Rotura del tendón bíceps | 0 |
| Síndrome del túnel carpiano | 5 (12,5) |
| Estenosis lumbar del conducto vertebral | 2 (5) |
| Insuficiencia cardiaca | 33 (82,5) |
| Resultados electrocardiográficos (n=40) | |
| Alteraciones de la conducción | 31 (77,5) |
| BAV de primer grado | 5 (12,5) |
| BRIHH | 21 (52,5) |
| BRDHH | 8 (20) |
| Alteración intraventricular inespecífica | 12 (30) |
| Patrón de seudoinfarto de miocardio | 4 (10) |
| Bajo voltaje | 5 (12,5) |
| Hipertrofia del VI | 7 (17,5) |
| Parámetros bioquímicos (n=38) | |
| NT-pro-BNP (pg/dl) | 3.615 ± 1.276 |
| TFG (ml/min) | 51 ± 21 |
| Resultados ecocardiográficos (n=36) | |
| Amplitud máxima del tabique (mm) | 20 ± 6 |
| Diámetro de la aurícula izquierda, proyección paraesternal de eje largo (mm) | 51 ± 17 |
| Método diagnóstico (n=40) | |
| Invasivo | 9 (22,5) |
| No invasivo (gammagrafía DPD) | 32 (80) |
| Clasificación delNational Amyloidosis Center(n=40) | |
| Fase I | 22 (55) |
| Fase II | 14 (35) |
| Fase III | 4 (10) |
ACTTR: amiloidosis cardiaca por transtirretina; ACTTRv: forma hereditaria de la amiloidosis cardiaca por transtirretina; ACTTwt: forma nativa de la amiloidosis cardiaca por transtirretina; BAV: bloqueo auriculoventricular; BRDHH: bloqueo de la rama derecha del haz de His; BRIHH: bloqueo de la rama izquierda del haz de His; NYHA: clase funcional de la New York Heart Association; VI: ventrículo izquierdo.
Los valores expresan n (%) o media ± desviación estándar.
En la tabla 3 se resumen los principales resultados quirúrgicos y de seguimiento. La principal indicación del COI en la población general fue la hemorragia previa en tratamiento con anticoagulantes orales (67,1%), seguida de un alto riesgo de hemorragia (17,7%) e ictus pese a la anticoagulación (12,9%), sin diferencias independientemente de la presencia de ACTTR. Otras indicaciones fueron un índice internacional normalizado inestable o alto riesgo de caídas en el 2,2%. El dispositivo utilizado con mayor frecuencia fue el Amulet (46,2%), seguido del WATCHMAN (37,4%). No se observaron diferencias significativas en los resultados entre los distintos grupos cuando se compararon la indicación de cierre y el dispositivo utilizado (). La proporción de pacientes con ACTTR tratados con COI fue mayor después de 2015 (el 82,5% frente al 70,5% en el grupo de control), pero esta diferencia no fue estadísticamente significativa (p=0,102).
Principales resultados quirúrgicos y de seguimiento de la población total y según la presencia de amiloidosis cardiaca
| Población totalN=1.159 (100%) | Grupo de controln=1.119; (96,5%) | ACTTRn=40 (3,5%) | p | |
|---|---|---|---|---|
| Motivo del COI | ||||
| Hemorragia sistémica previa | 778 (67,1) | 747 (66,8) | 31 (77,5) | 0,394 |
| Ictus/embolia con ACO | 150 (12,9) | 145 (13) | 5 (12,5) | |
| Alto riesgo hemorrágico sin hemorragia previa | 205 (17,7) | 201 (18) | 4 (10) | |
| Otros (INR inestable, alto riesgo de caídas u otros) | 26 (2,2) | 26 (2,3) | 0 | |
| Dispositivo | ||||
| WATCHMAN | 434 (37,5) | 423 (37,9) | 11 (27,5) | 0,450 |
| Amulet | 536 (46,2) | 515 (46) | 21 (52,5) | |
| ACP | 115 (9,9) | 109 (9,7) | 6 (15) | |
| Otro | 74 (6,4) | 72 (6,4) | 2 (5) | |
| Éxito de la intervención | 1.137 (98,1) | 1.097 (98) | 40 (100) | 0,999 |
| Complicaciones quirúrgicas | 48 (4,1) | 48 (4,3) | 0 | 0,406 |
| Taponamiento cardiaco | 21 (1,8) | 21 (1,9) | 0 | 0,999 |
| Ictus | 5 (0,4) | 5 (0,4) | 0 | 0,999 |
| Embolización del dispositivo | 5 (0,4) | 5 (0,4) | 0 | 0,999 |
| Complicación vascular | 9 (0,8) | 8 (0,7) | 1 (2,5) | 0,272 |
| Hemorragia mayor | 8 (0,7) | 8 (0,7) | 0 | 0,999 |
| Muerte quirúrgica | 1 (0,1) | 1 (0,1) | 0 | 0,999 |
| Complicaciones hospitalarias | 39 (3,3) | 37 (3,5) | 2 (5) | 0,641 |
| Ictus isquémico hospitalario | 5 (0,4) | 5 (0,5) | 0 | 0,999 |
| Ictus hemorrágico hospitalario | 0 (0) | 0 (0) | 0 | 0,999 |
| Ictus isquémico + hemorrágico hospitalarios | 5 (0,4) | 5 (0,5) | 0 | 0,999 |
| AIT hospitalario | 3 (0,3) | 3 (0,3) | 0 | 0,999 |
| Embolia periférica hospitalaria | 0 | 0 | 0 | 0,999 |
| Hemorragia mayor hospitalaria | 19 (1,6) | 19 (1,7) | 0 | 0,999 |
| Hemorragia menor hospitalaria | 14 (1,2) | 12 (1,1) | 2 (5) | 0,081 |
| Muerte hospitalaria | 6 (0,5) | 6 (0,5) | 0 | 0,999 |
| Seguimiento | ||||
| Seguimiento medio (días) | 1.311 ± 215 | 1.339 ± 221 | 1.301 ± 202 | 0,999 |
| Ictus isquémico en seguimiento | 29 (2,5) | 27 (2,5) | 2 (5) | 0,283 |
| Ictus hemorrágico en seguimiento | 9 (0,8) | 8 (0,8) | 1 (2,5) | 0,284 |
| Ictus isquémico y hemorrágico en seguimiento | 38 (3,3) | 35 (3,1) | 3 (7,5) | 0,127 |
| AIT en seguimiento | 8 (0,7) | 8 (0,8) | 0 | 0,999 |
| Embolia periférica en seguimiento | 9 (8) | 9 (0,8) | 0 | 0,999 |
| Hemorragia mayor en seguimiento | 84 (7,2) | 81 (7,2) | 3 (7,5) | 0,999 |
| Hemorragia menor en seguimiento | 77 (6,6) | 76 (6,9) | 1 (2,5) | 0,514 |
| Tipo de tratamiento antitrombótico | ||||
| Sin antitrombóticos | 96 (8,3) | 74 (6,6) | 12 (30) | <0,001* |
| Tratamiento antiagregante plaquetario en seguimiento | 851 (73,4) | 839 (75) | 22 (55) | |
| Tratamiento antiagregante plaquetario doble en seguimiento | 69 (5,9) | 69 (6,2) | 0 | |
| Anticoagulación en seguimiento | 143 (12,3) | 137 (12,2) | 6 (15) | |
| Muerte a los 2 años de seguimiento | 160 (13,8) | 152 (13,6) | 8 (20) | 0,248 |
| Muerte a los 5 años de seguimiento | 231 (19,9) | 215 (19,2) | 16 (40) | 0,001 |
ACO: anticoagulación oral; AIT: accidente isquémico transitorio; COI: cierre percutáneo de la orejuela izquierda.
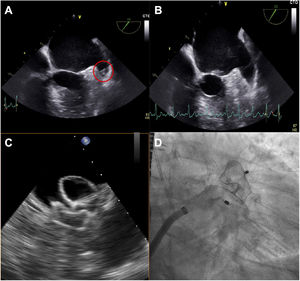
Durante la intervención, se detectaron trombos en la orejuela izquierda mediante ecocardiografía transesofágica en el 7,5% de los pacientes con ACTTR (frente al 2,9% de los pacientes sin amiloidosis; p=0,241) (figura 1), lo que llevó a un retraso en la intervención en el 93,3% de los casos y a la utilización de dispositivos de protección cerebral en el 2,7% del conjunto de la cohorte; durante el seguimiento, en el grupo de control se detectó un caso de trombosis relacionada con el dispositivo según los criterios antes descritos16.
Caso ejemplo de ACTTR que presenta un trombo durante el primer intento de cierre de la orejuela izquierda (A); tras 1 mes de heparina de bajo peso molecular subcutánea, el trombo desapareció (B) y la intervención se pudo llevar a cabo satisfactoriamente. C: guía ecocardiográfica de uso. D: resultado angiográfico.
El COI fue satisfactorio en el 98,1% del conjunto de la población, con una tasa de éxito parecida en ambos grupos (el 100% en el grupo con amiloidosis frente al 98% en el grupo de control; p=0,999). En general, la incidencia de complicaciones graves durante la intervención (taponamiento, ictus, embolización del dispositivo, complicaciones vasculares y cualquier hemorragia) fue del 4,1%, sin diferencias significativas entre los grupos. Durante la estancia hospitalaria, todos los resultados fueron comparables, excepto por una tendencia a más episodios hemorrágicos leves relacionados con el sitio de acceso en el grupo con ACTTR (el 5 frente al 1,1%; p=0,081). La mortalidad hospitalaria fue del 0,5% de la población total, pero no se observaron diferencias entre los grupos (el 0,5% en el grupo de control frente al 0% en el grupo con amiloidosis; p=0,999).
Resultados del seguimientoEn el seguimiento se constató una mayor incidencia no significativa de eventos cerebrovasculares isquémicos y hemorrágicos en los pacientes con ACTTR; el objetivo combinado de ictus por cualquier causa se mantuvo más alto en los pacientes con ACTTR.
En el seguimiento a corto plazo (mediana, 3 [2-3] meses después de la intervención), la mayoría de los pacientes de ambos grupos recibieron tratamiento antiagregante plaquetario simple (el 55% de los pacientes con ACTTR frente al 75% del grupo de control), pero ninguno de los pacientes con AC recibió tratamiento antiagregante plaquetario doble (frente al 6,2%) y el 30% no recibió ningún tratamiento antiagregante plaquetario en el momento del alta (frente al 6,6% de los pacientes sin AC; todos, p <0,001).
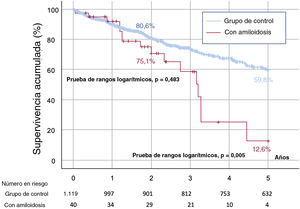
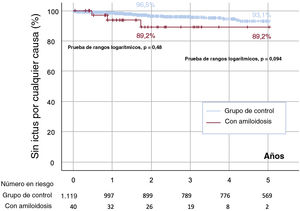
Tal como se refleja en la , la inutilidad, definida como la mortalidad durante el primer año tras la intervención, fue comparable entre los grupos con ACTTR y de control (< 10%). Tras 2 años de seguimiento, la mortalidad fue mayor en el grupo con amiloidosis (el 20 frente al 13,6% del grupo de control), aunque esta diferencia no fue estadísticamente significativa (p=0,248) (figura 2). No obstante, a los 5 años de seguimiento, la mortalidad fue mayor entre los pacientes con AC (el 40 frente al 19,2%; p=0,001) (figura 2). Según el momento del diagnóstico de AC, los resultados de los pacientes del primer tercil (n=11; mortalidad a 5 años, 45,4%) fueron parecidos a los del segundo (n=14; mortalidad, 42,8%) y el tercer tercil (n=15; mortalidad, 33,3%) (p=0,310, no significativa). No hubo diferencias en las incidencias de ictus hemorrágico (cociente de riesgos de subdistribución [HRs] = 3,483; 0,450-26,956; p=0,232), hemorragia mayor (HRs = 0,646; 0,161-2,599; p=0,539), ictus isquémico (HRs = 2,035; 0,468-8,840; p=0,343) o embolia periférica (HRs = 2,459; 0,814-5,622; p=0,354) o la combinación de estos 4 eventos a los 5 años de seguimiento (HRs = 2,379; 0,723-7,827; p=0,154). En la figura 3 se muestran las curvas de supervivencia a 5 años de seguimiento con eventos cerebrovasculares por cualquier causa, que indica una mayor incidencia del ictus por cualquier causa en el grupo con AC a los 2 años de seguimiento. La principal causa última de la mortalidad en el grupo con AC se describe con detalle en la . La AC no fue un factor pronóstico independiente de la mortalidad a los 2 años de seguimiento () y este resultado no varió por el análisis de riesgos competitivos ().
Este es el primer estudio que examina de manera sistemática los resultados inmediatos y a largo plazo de los pacientes con ACTTR que requieren el COI. Los principales resultados, resumidos en la figura 4, son los siguientes: a) incluso entre los pacientes con múltiple comorbilidad remitidos a COI, se observaron características notablemente peores en los diagnosticados con ACTTR, en particular en cuanto a riesgos hemorrágico y trombótico; b) a pesar de la fragilidad de los pacientes con ACTTR, los resultados de la intervención y la hospitalización fueron buenos, con una incidencia solo relativamente alta de eventos hemorrágicos leves tras la intervención, relacionados con el sitio de acceso y que no tuvieron impacto en la mortalidad a medio plazo; c) los resultados a los 2 años de seguimiento no difirieron mucho, aunque las diferencias sustanciales en los porcentajes podrían indicar que el estudio carecía de la potencia suficiente para hacer afirmaciones rotundas sobre las diferencias en la mortalidad; no obstante, respaldan la conclusión de que la indicación de COI puede establecerse como similar a la de los pacientes sin esta enfermedad, ya que es igualmente segura y probablemente no vana. La alta mortalidad de los pacientes con AC a los 5 años de seguimiento coincide con series previas de ACTTR, pero en la mayoría de los pacientes no se relacionó con eventos hemorrágicos o embólicos probablemente debidos a una intervención de COI previa y satisfactoria.
Figura central. Resumen de las características basales y los resultados de los pacientes con ACTTR sometidos a cierre percutáneo de la orejuela izquierda comparados con aquellos sin amiloidosis cardiaca. ACTTR: amiloidosis cardiaca por transtirretina; COI: cierre percutáneo de la orejuela izquierda; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
La seguridad del COI es más importante que en otras intervenciones, dada su naturaleza preventiva y la fragilidad de los pacientes que se someten a esta técnica. Esto podría ser especialmente relevante en caso de presencia de AC, puesto que la mayor parte de las características basales de estos pacientes (edad, menor índice de masa corporal, enfermedad renal crónica) se relacionan con una mayor incidencia de varias complicaciones como la hemorragia quirúrgica.
Además, es posible que las escalas CHA2DS2-VASc y HAS-BLED no sean tan precisas como en la población general. De hecho, en investigaciones anteriores, las autopsias revelaron que en el 33% de los corazones con amiloidosis había trombos intracardiacos pese a la presencia de factores de riesgo tradicionales como la edad, la hipertensión, la diabetes o la insuficiencia cardiaca11. Por esta razón, a los pacientes con AC y FA se les indica anticoagulación crónica independientemente de su puntuación en las escalas. Por la misma razón, y dada la seguridad de la intervención comunicada en este estudio, en esta población se podría considerar el COI para los pacientes con eventos embólicos a pesar de los anticoagulantes o con eventos hemorrágicos frecuentes mientras reciben anticoagulación oral, cualquiera sea la puntuación. El hecho de que la mayoría de los pacientes se hallaran al diagnóstico en fase I según el National Amyloidosis Center implica una mayor esperanza de vida, lo que se traduce en decisiones más complejas sobre los riesgos trombótico y hemorrágico, en las que el COI podría ser una intervención clave.
En cuanto al riesgo hemorrágico, en varios estudios se indica que los episodios hemorrágicos tienen lugar con mayor frecuencia en la AL que en las estimaciones proporcionadas por las escalas tradicionales; en los pacientes con ACTTR, no hay estudios que lleven a la misma conclusión, pero los pacientes con esta enfermedad suelen ser mayores y tener varios factores de riesgo cardiovascular que según los expertos podrían actuar en sinergia con la ACTTR y conllevar que las escalas hemorrágicas tradicionales infravaloren el riesgo hemorrágico real17,18.
Los resultados quirúrgicos óptimos comunicados en esta investigación, con tan solo un 2,5% de complicaciones quirúrgicas, coinciden con informes parecidos en candidatos estándar a COI (p. ej., una incidencia de complicaciones quirúrgicas del 2,1% en el ensayo PRAGUE-17)19. Estos resultados, junto con la adecuada supervivencia a los 2 años de seguimiento, indican que probablemente el COI no sea inútil en los pacientes con AC. De hecho, podría ser una intervención particularmente útil para el tratamiento de las complicaciones relacionadas con su enfermedad. Las alteraciones en la movilidad, como la estenosis lumbar del conducto vertebral (12,5%) y un riesgo aumentado de síncope (17,5%) debido a alteraciones de la conducción (77,5%) indican un alto riesgo de caídas que, junto con una proporción muy alta de pacientes con FA que por ello requieren anticoagulación oral, representa una combinación de alto riesgo en la que el COI podría ser una alternativa válida. Si se tiene en cuenta que la muestra del estudio es pequeña, es posible que se hayan subestimado las complicaciones hemorrágicas menores, pese a ser considerablemente mayores en el grupo con ACTTR.
Resultados a largo plazo en pacientes con ACTTRLa esperanza de vida de los pacientes con AC es reducida. En el momento del diagnóstico, se ha indicado que era de aproximadamente 20 meses para la forma nativa de la ACTTR si se detectaba en una fase avanzada, pero la supervivencia media global comunicada actualmente es de 3,5 años para la forma nativa, de 2,6 años para la hereditaria5,20 y de 6 a 12 meses para la amiloidosis primaria (AL) en fase avanzada21,22. Al contrario, la incidencia creciente del diagnóstico precoz de esta enfermedad, debido a los mejores medios diagnósticos pero también por el creciente envejecimiento de la población, indica que el análisis especializado de los resultados de las distintas intervenciones en las cohortes contemporáneas es crucial23. Durante muchos años, en el ámbito de la AC, a las enfermedades cardiacas estructurales se les negó el tratamiento invasivo, pero recientemente se ha demostrado que algunas técnicas farmacológicas y percutáneas tienen ventajas pronósticas en estos pacientes; los ejemplos paradigmáticos son el tafamidis y el implante percutáneo de la válvula aórtica24. No obstante, no puede darse por sentado que otras intervenciones con menor ganancia pronóstica, como el COI, sean igual de útiles y, por este motivo, los resultados ayudan a aclarar cuál es el mejor tratamiento para estos pacientes. Demostrar que el COI tiene efectos beneficiosos hasta a los 2 años de seguimiento, aunque el episodio combinado de ictus por cualquier causa siga siendo frecuente en los pacientes con ACTTR, ayuda a los médicos tratantes en el proceso de toma de decisiones. No obstante, los pacientes deberían comprender primero el pronóstico sombrío a los 5 años de seguimiento y considerar el tratamiento conservador según les parezca mejor, y destaca que la mortalidad en la AC se relaciona principalmente con la insuficiencia cardiaca, la muerte súbita cardiaca y el infarto de miocardio. Cabe destacar que el análisis del evento combinado de mortalidad, ictus por cualquier causa y hemorragias a los 2 años de seguimiento () confirma que la amiloidosis no es un factor pronóstico del evento combinado en sí mismo; sin embargo, la presencia de enfermedad renal crónica previa (probablemente como consecuencia de la misma enfermedad) tiene un efecto independiente en la incidencia del evento combinado y podría ser un marcador de inutilidad de la técnica.
LimitacionesLa principal limitación de este estudio es que la presencia de AC no se estudió de manera sistemática en todos los pacientes incluidos, de modo que se desconoce cuántos sujetos del grupo de control es posible que hayan sufrido AC. Además, se trata de una cohorte relativamente reducida de pacientes con ACTTR, pero sigue siendo la serie más grande de pacientes con esta enfermedad tratados con dispositivos de COI y con un grupo de control sin un diagnóstico conocido de AC al que se intervino en las mismas instituciones. Aunque los criterios diagnósticos podrían haber variado durante el estudio, se siguió la definición estándar, tal como se explica en «Métodos». Por último, puesto que se trata de un subgrupo muy específico de pacientes sometidos a COI, los resultados ecocardiográficos, clínicos y electrocardiográficos no pueden extrapolarse a todos los pacientes con AC.
CONCLUSIONESEl COI es una alternativa razonable para reducir las complicaciones hemorrágicas y los eventos cerebrovasculares isquémicos sin una tasa aumentada de complicaciones precoces o a medio plazo. Aunque la supervivencia a largo plazo se vio alterada en los pacientes con ACTTR, no hubo diferencias significativas respecto al grupo de control hasta los 2 años de seguimiento, lo que indica que el COI para pacientes sin ATTR podría no ser en vano.
FINANCIACIÓNNinguna.
CONTRIBUCIÓN DE LOS AUTORESJ.R. Delgado-Arana, I. Cruz-Gonzalez, H. Gutiérrez, I. García-Bolao, X. Millán, G. Tirado-Conte, J.M. Ruiz-Nodar, M. Mohandes, J. Palazuelos, F. Torres Saura, R. Del Valle, E. Valero Picher e I.J. Amat-Santos contribuyeron a planificar las investigaciones.
J.R. Delgado-Arana, J.C. Nuñez García, I. Gómez, R. Albarrán Rincón, D. Arzamendi, L. Nombela-Franco, L. Korniiko, A. Barrero, S. Santos-Martínez, A. Serrador e I.J. Amat-Santos llevaron a cabo las investigaciones.
J.R. Delgado-Arana e I.J. Amat-Santos redactaron la versión preliminar, escribieron el artículo final y son responsables de todo su contenido.
CONFLICTO DE INTERESESI. Cruz-Gonzalez es proctor de Abbott Vascular, Boston Scientific y Lifetech, J.M. Ruiz-Nodar e I.J. Amat-Santos son proctors de Boston Scientific. L. Nombela-Franco y D. Arzamendi son proctors de Abbott Vascular.
- –
La prevalencia y las tasas de incidencia de la amiloidosis cardiaca por transtirretina (ACTTR) muestran que se ha convertido en el tipo de AC diagnosticada con mayor frecuencia. A pesar de la alta tasa de FA (un 54-70%), que requiere un umbral bajo para empezar la toma de anticoagulantes orales, y el alto riesgo de complicaciones hemorrágicas e ictus, aún no se ha investigado sobre el análisis de riesgos/beneficios del COI.
- –
Los resultados indican que el COI tiene riesgos parecidos en los pacientes con diagnóstico de ACTTR y aquellos sin un diagnóstico conocido de la enfermedad, y podría no ser inútil, dada la similar supervivencia a los 2 años. Aunque en los pacientes con diagnóstico de ACTTR la mortalidad a los 5 años de seguimiento es mucho mayor, no se relacionó con complicaciones hemorrágicas o ictus, lo que indica la eficacia del COI. Se requieren más investigaciones para otros subtipos de amiloidosis que afecten al corazón. Además, una búsqueda sistemática de ACTTR en los candidatos al COI podría servir para dilucidar el impacto pronóstico de la enfermedad y los resultados particulares del COI en este contexto.