Análisis coste-efectividad de dabigatrán para la prevención de ictus y embolia sistémica por fibrilación auricular no valvular en España, según la perspectiva del Sistema Nacional de Salud.
MétodosAdaptación de un modelo de Markov secuencial que simula la historia natural de la enfermedad para una cohorte de 10.000 pacientes con fibrilación auricular no valvular a lo largo de su vida. Los comparadores son warfarina en un primer escenario y el patrón de prescripción habitual (el 60% con antagonistas de la vitamina K, el 30% con ácido acetilsalicílico y el 10% no tratados) en el segundo. Se realizaron análisis de sensibilidad determinístico y probabilístico.
ResultadosEn ambos escenarios dabigatrán disminuyó los eventos sufridos y consiguió ganancias en cantidad y calidad de vida. La razón coste-efectividad incremental de dabigatrán comparado con warfarina fue de 17.581 euros/año de vida ajustado por calidad ganado y de 14.118 euros/año de vida ajustado por calidad ganado respecto al patrón de prescripción habitual. Se demostró eficiencia en subgrupos. Incorporando los costes sociales al análisis, dabigatrán es una estrategia dominante (más efectiva y de menor coste). El modelo demostró ser robusto.
ConclusionesDesde la perspectiva del Sistema Nacional de Salud, dabigatrán resulta una estrategia eficiente para la prevención de ictus en pacientes con fibrilación auricular no valvular en comparación con warfarina y con el patrón de prescripción habitual; en ambas comparaciones realizadas, los valores de la razón coste-efectividad incremental estuvieron por debajo del umbral de 30.000 euros/año de vida ajustado por calidad. Desde la perspectiva de la sociedad, dabigatrán sería además una estrategia dominante que aporta más efectividad y menores costes que las dos alternativas.
Palabras clave
La fibrilación auricular (FA), la arritmia cardiaca más frecuente, origina un elevado porcentaje de los ictus isquémicos, y su importancia como factor etiológico de estos aumenta con la edad1.
En España, la prevalencia total de FA se cifra en el 4,8% de la población general2 y el 8,5% de los mayores de 60 años, y llega al 16,5% entre los mayores de 85 años3.
El coste hospitalario del ictus en España durante 2004 fue de 1.526 millones de euros4. Si junto con este coste se consideran los costes indirectos y otros costes directos no sanitarios, obtendríamos estimaciones de coste total del ictus similares al 5% del gasto sanitario público español5.
Los ictus en pacientes con FA muestran un diferente perfil que los ictus en pacientes con ritmo sinusal6. Desde el punto de vista clínico, estos suelen ser más extensos y cursan con mayor déficit neurológico inicial. Además, las secuelas son más importantes. Así, la probabilidad de quedar discapacitado tras un ictus con FA es 2,23 veces la de los pacientes con ritmo sinusal7.
Esta mayor gravedad implica mayor duración de la hospitalización y menor probabilidad de alta a domicilio8.
Asimismo, la presencia de FA es un factor independiente de riesgo de muerte hospitalaria para los pacientes con ictus isquémico, especialmente mujeres y población de edad avanzada9, y este riesgo es mayor para la mortalidad tanto hospitalaria como ambulatoria10.
Todos estos datos conllevan que la repercusión económica y social de los ictus con FA sea mayor que sin FA.
Teniendo en cuenta la mala evolución de este tipo de ictus, el manejo de los pacientes con FA debe incluir tanto el tratamiento de la arritmia como la prevención de embolias. Las guías clínicas11 basadas en la evidencia disponible recomiendan anticoagular a los pacientes con FA con riesgo embólico asociado.
Los anticoagulantes orales disponibles durante los últimos 50 años han sido los antagonistas de la vitamina K (AVK), entre los que se encuentran la warfarina y el acenocumarol. Estos fármacos han mostrado su eficacia en la prevención12, 13, si bien su farmacocinética y su farmacodinamia no predecibles y su variabilidad individual e interindividual, sumados a su estrecha ventana terapéutica, obligan a controles del grado de anticoagulación y ajustes de dosis periódicos14 para reducir el riesgo de ictus o hemorragia cuando los pacientes no están en el rango terapéutico (cociente internacional normalizado [INR]=2-3). Además, los AVK presentan frecuentes interacciones con alimentos y medicamentos.
Con una media anual de 13 controles por paciente, la monitorización del INR supone una elevada carga para el paciente y el sistema sanitario. Además, no siempre alcanza su objetivo, ya que se ha estimado que los pacientes tratados con AVK permanecen casi la mitad del tiempo fuera del rango terapéutico del INR15.
Estos inconvenientes de los AVK hacen que muchos pacientes no puedan recibir tromboprofilaxis, o que la que reciban no sea la adecuada16, 17, 18, lo que supone una necesidad no cubierta en la prevención del ictus por FA.
Dabigatrán etexilato es un inhibidor directo de la trombina, recientemente autorizado por la Agencia Europea del Medicamento19 para la prevención de ictus y embolia sistémica en pacientes adultos con FA no valvular con uno o más de los siguientes factores de riesgo: ictus, accidente isquémico transitorio o embolia sistémica previos, fracción de eyección ventricular izquierda <40%, insuficiencia cardiaca sintomática ≥ clase 2 de la escala de la New York Heart Association, edad ≥ 75 años y edad ≥ 65 años asociada a diabetes mellitus, enfermedad coronaria o hipertensión. Dabigatrán presenta una farmacocinética y una farmacodinamia predecibles y con amplio margen terapéutico, por lo que, en contraste con los AVK, no requiere monitorización de la coagulación. El ensayo clínico RE-LY (Randomized Evaluation of Long-term anticoagulation therapy) de diseño prospectivo y aleatorizado, incluyó a 18.113 pacientes y comparó dos dosis enmascaradas de dabigatrán etexilato (150 o 110 mg, ambas con dos tomas diarias) con warfarina en términos de eficacia y seguridad para la prevención del ictus en pacientes con FA no valvular20, 21.
Tras un seguimiento de 2 años como mediana, dabigatrán 150 mg administrado dos veces diarias demostró una eficacia superior a la de warfarina en la variable principal de eficacia estudiada, prevención del ictus y embolia sistémica (reducción relativa de riesgo [RRR], 35%). Redujo también significativamente el riesgo de ictus isquémico (RRR, 24%), ictus hemorrágico (RRR, 74%), muerte vascular (RRR, 15%) y hemorragias de tipo intracraneal (RRR, 59%), potencialmente mortal (RRR, 20%) y total (RRR, 9%). Las hemorragias gastrointestinales fueron mayores (incremento relativo del riesgo, 48%). La dosis de 110 mg dos veces diarias fue no inferior a warfarina respecto a la variable principal de eficacia y superior en la variable principal de seguridad, la hemorragia mayor (RRR, 20%), y redujo significativamente el ictus hemorrágico (RRR, 69%) y las hemorragias de tipo intracraneal (RRR, 70%), potencialmente mortal (RRR, 33%), mayor (RRR, 20%) y total (RRR, 22%). Asimismo, la dosis de 150 mg mostró superioridad (RRR, 10%) y la de 110 mg, no inferioridad respecto al parámetro de valoración de beneficio clínico neto.
Una vez demostradas la eficacia y la seguridad de una alternativa, es necesario evaluar su eficiencia en cuanto a costes y beneficios, para poder optimizar el uso de los recursos sanitarios y el acceso de los pacientes a las terapias más eficientes.
El objetivo del presente estudio es evaluar la relación coste-efectividad de la utilización de dabigatrán para la prevención del ictus y la embolia sistémica en pacientes adultos con FA no valvular con uno o más factores de riesgo tromboembólico, según la perspectiva de las autoridades sanitarias en España.
MétodosDiseñoModelo de Markov que simula el curso natural de los pacientes con FA no valvular a lo largo de toda su vida. El modelo conceptual se había desarrollado y publicado previamente22 y se ha utilizado en otras evaluaciones económicas de dabigatrán23, ya analizadas por agencias de evaluación de tecnologías sanitarias de varios países, como el National Institute for Health and Clinical Excellence en Reino Unido24.
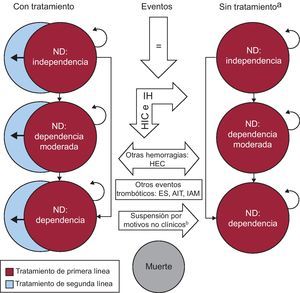
El modelo utilizado en este estudio incluye 23 estados de salud (15 permanentes y 8 temporales) basados en el nivel de discapacidad del paciente, la existencia de ictus previo y la línea de tratamiento. La Figura 1 es su representación esquemática. Se permiten tres niveles de discapacidad: discapacidad nula (puntuación en la escala Rankin ≤ 225), moderada (Rankin 3-4) y total (Rankin=5). Asimismo, se permiten tres líneas de tratamiento; la inicial, en la que se trata a los pacientes con las terapias en análisis, una segunda con ácido acetilsalicílico, y una última en la que los pacientes no reciben tratamiento.
Figura 1. Diagrama de Markov. AIT: accidente isquémico transitorio; ES: embolia sistémica; HEC: hemorragia extracraneal; HIC: hemorragia intracraneal; IAM: infarto agudo de miocardio; IH: ictus hemorrágico; ND: nivel de discapacidad. aLos antecedentes de ictus se rastrean en el modelo pero no se muestran en el diagrama. bSuspensiones debidas a eventos de hemorragia no mayor.
Una vez iniciada la simulación, cada paciente puede sufrir o no alguno de los eventos clínicos considerados (ictus isquémico primario y recurrente, ictus hemorrágico, accidente isquémico transitorio, embolia sistémica, infarto agudo de miocardio, hemorragia intracraneal, hemorragia extracraneal) y/o morir.
En el esquema, las flechas indican las transiciones permitidas entre los distintos estados de salud. Dichas transiciones se producen como consecuencia de variaciones del nivel de dependencia del paciente o por interrupciones o cambios en la línea de tratamiento y según los supuestos del modelo presentados en la Tabla 1. Los ciclos de Markov tienen una duración de 3 meses. Se aplicó la corrección de medio ciclo.
Tabla 1. Supuestos del modelo
| Eficacia clínica (probabilidades de sufrir eventos) |
| Dabigatrán y warfarina: análisis post-hoc de RE-LY estratificado por edad |
| Ácido acetilsalicílico y no tratados: metaanálisis de comparaciones indirectas |
| Tasas de interrupción: del modelo original22 |
| Dabigatrán y warfarina: según RE-LY |
| Ácido acetilsalicílico: según ensayo clínico BAFTA |
| Tasas de mortalidad, discapacidad y utilidades |
| Mortalidad general: población española por edad y sexo |
| Mortalidad adicional y discapacidad por eventos: del modelo original 22 |
| Utilidades: del modelo original22 |
| Obtenidas de puntuaciones EQ-5D e incorporadas según nivel de dependencia del paciente |
| Se asociaron disutilidades a la aparición de alguno de los eventos clínicos |
| Otras premisas del modelo. En el caso base se asume que: |
| Los pacientes no reciben ninguna medicación anticoagulante concomitante a la medicación incluida en la modelización |
| Dabigatrán no interactúa con ninguna otra medicación |
| La transición de un paciente a un nivel de mayor discapacidad sólo se asocia a la aparición de eventos cerebrales (ictus o hemorragia intracraneal) |
| Los pacientes no pueden evolucionar a niveles de menor discapacidad |
| La probabilidad de que tras un evento el paciente evolucione a un nivel de peor discapacidad no presenta relación con la existencia de ictus previos |
| Los pacientes permanecen en tratamiento con la medicación de inicio por el resto de su vida, excepto en los casos de interrupciones de tratamiento permitidas |
| Los pacientes que sufren una hemorragia intracraneal o un ictus hemorrágico abandonan el tratamiento de manera permanente durante el resto de la simulación |
| Tras la aparición de una hemorragia extracraneal, el paciente puede interrumpir temporalmente el tratamiento (el 50% de los casos durante un ciclo de 3 meses) o abandonarlo de manera permanente (el 50% restante) |
| Las interrupciones temporales del tratamiento tras la aparición de una hemorragia extracraneal no se asocian con modificaciones del riesgo de padecer alguno de los eventos |
| En las interrupciones del tratamiento permanentes por razones distintas de la aparición de un ictus isquémico o una hemorragia intracraneal, el 70% de los pacientes realizan un cambio a segunda línea de tratamiento |
| Únicamente se permite un máximo de dos líneas de tratamiento por paciente durante toda la simulación |
| En el escenario del patrón de prescripción, los pacientes inicialmente tratados con ácido acetilsalicílico que interrumpían este tratamiento no recibían ninguna otra terapia como segunda línea |
| Sólo se permite que el paciente sufra uno de los eventos clínicos descritos (a excepción de la hemorragia menor) o muerte por cada ciclo de 3 meses. Las hemorragias menores pueden suceder en cualquier momento del ciclo, asociados o no a la presencia de alguno de los otros eventos, aunque una hemorragia menor no aumenta el riesgo de sufrir otro de los eventos de mayor importancia en ese ciclo |
| No se establece dependencia entre mortalidad por ictus, hemorragia intracraneal o hemorragia extracraneal y la existencia de antecedentes de ictus |
| La eficacia de los tratamientos se asumió como constante en el tiempo |
| Las interrupciones temporales de tratamientos durante periodos cortos (1-2 semanas), que pueden darse tras la aparición de un ictus o durante los periodos periquirúrgicos, no se asociaron con impactos significativos en la eficacia ni en el coste de los tratamientos |
| La monitorización del INR de los pacientes en tratamiento con antagonistas de la vitamina K (warfarina o acenocumarol) no se asocia con disutilidades adicionales a las derivadas del nivel de discapacidad del paciente o de la aparición de los eventos clínicos considerados |
BAFTA: Birmingham Atrial Fibrillation Treatment of the Aged; INR: cociente internacional normalizado; RE-LY: Randomized Evaluation of Long-term anticoagulation therapy.
Fuente: elaboración propia con base en Sorensen et al 22,23 .
La adaptación del modelo al entorno español contó con un panel de expertos multidisciplinario, firmante de este manuscrito. Mediante cuestionarios estructurados, se recogieron datos del consumo de recursos y la práctica clínica habitual en España, consensuados en una reunión presencial y contrastados con la literatura científica disponible.
EscenariosEl primer escenario considerado comparó las alternativas evaluadas en el ensayo clínico RE-LY21: dabigatrán y warfarina. El segundo comparó dabigatrán con el patrón de prescripción para la práctica clínica en España; de acuerdo con la evidencia disponible26, se asumió que el 60% de la población recibe tratamiento con AVK; el 30%, con ácido acetilsalicílico, y el 10% no recibe tratamiento alguno.
En el caso de dabigatrán el modelo desarrollado tiene carácter secuencial; simulando las condiciones de la ficha técnica, los pacientes inician la simulación con una dosis de 150 mg de dabigatrán dos veces al día, y al cumplir 80 años, cambian a 110 mg dos veces al día, estando sujetos en cada etapa a las respectivas probabilidades de sufrir un evento observadas en el ensayo clínico RE-LY con cada dosis19.
PoblaciónEs una cohorte hipotética de 10.000 pacientes con FA no valvular que simula el perfil de los pacientes incluidos en el estudio RE-LY. Al inicio de la simulación, la media de edad de los pacientes es 69,1 años; cada paciente comienza sin ninguna discapacidad y permanece en el modelo hasta transitar al estado «muerte». La distribución de la cohorte según riesgo de ictus y tiempo en intervalo de INR controlado para los pacientes a warfarina es la del RE-LY.
Mortalidad, eficacia clínica, discapacidad y utilidadesEl riesgo de mortalidad general es el de la población española por edad y sexo27.
La eficacia clínica (probabilidad de tener un evento en la simulación), las tasas de mortalidad adicional, discapacidad por eventos e interrupción y las utilidades se han tomado del modelo original22.
Perspectiva, horizonte temporal y tasa de descuentoLa perspectiva del análisis es la del Sistema Nacional de Salud español, el horizonte temporal considera toda la vida del paciente (esperanza máxima de vida supuesta, 100 años). Se descontaron costes y beneficios a una tasa del 3% anual.
Consumo de recursos y costesEn el caso base del modelo, sólo se consideraron costes directos sanitarios asociados a las terapias evaluadas. Todos los costes están en euros del año 2010. Las actualizaciones de costes necesarias se realizaron según el Índice de Precios de Consumo anual correspondiente28.
Los costes farmacológicos se calcularon por precio de venta al público29 considerando el 7,5% de descuento en los medicamentos afectados por el Real Decreto 8/201030.
Los costes de los eventos clínicos se obtuvieron de grupos de diagnóstico relacionados31, o de la literatura32. En los eventos con costes de seguimiento asociados (ictus e ictus hemorrágico), se ha sumado al coste del evento el coste asociado al nivel de dependencia del paciente.
La monitorización del INR supone un coste adicional en el tratamiento con AVK, y se ha agregado al coste de la medicación. Para estimarlo, se consideraron las diferentes modalidades asistenciales utilizadas en España teniendo en cuenta el tipo de punción y el entorno en que se realizan los tests de monitorización, y se aplicaron los costes publicados por de Solà-Morales et al33. Asimismo, para este cálculo se asumió que un 30% de los pacientes están habitualmente mal controlados34. La Tabla 2 presenta el cálculo del coste anual total de monitorización del INR (suma ponderada según entorno). La Tabla 3 muestra el detalle de costes incluidos en el modelo.
Tabla 2. Obtención del coste anual por monitorización del cociente internacional normalizado (euros de 2010)
| Entorno de monitorización y tipo de punción (venosa o capilar) | Pacientes por entorno (%) | Coste anual según nivel de control habitual del paciente | |
| Buen control (70% de los pacientes, 13 controles anuales) | Mal control (30% de los pacientes, 19,5 controles anuales) | ||
| Hospital (10% venosa) | 3 | 173,63 | 260,44 |
| Hospital (90% capilar) | 27 | 378,00 | 462,31 |
| Atención Primaria (100% capilar) | 67 | 378,00 | 462,31 |
| Domicilio (100% capilar) | 2 | 673,31 | 905,28 |
| Autocontrol (100% capilar) | 1 | 883,90 | 1.221,16 |
| Total | 100 | 382,83 | 472,70 |
Se asumió que un 30% de los pacientes habitualmente se encuentran fuera del intervalo terapéutico (mal control) y reciben un 50% más controles que la media, por lo que se duplicaron las partidas de gastos corrientes relacionadas con la realización de los tests de monitorización.
Fuente: panel de expertos español y de Solà-Morales Serra et al 33 .
Tabla 3. Costes utilizados en el caso base del modelo (euros de 2010)
| Alternativa terapéutica | Coste diario (PVP-IVA) a | Fuente |
| Dabigatrán 150mg (2 veces día) | 3,03 | MSPSI 29 |
| Dabigatrán 110mg (2 veces día) | 3,03 | MSPSI 29 |
| Warfarina 2,1 mg | 0,05 | MSPSI 29 |
| Ácido acetilsalicílico, media ponderada de 100 mg (70%) y 300 mg (30%) | 0,10 | MSPSI 29 |
| Evento clínico | Coste | Fuente |
| Ictus isquémico mortal | 4.237,76 | MSPSI 31 |
| Ictus isquémico, independiente | 4.407,58 | MSPSI 31 , Lopez-Bastida et al b |
| Ictus isquémico, moderadamente dependiente | 4.827,18 | MSPSI 31 , Lopez-Bastida et al b |
| Ictus isquémico, totalmente dependiente | 5.483,06 | MSPSI 31 , Lopez-Bastida et al b |
| Embolia sistémica mortal | 1.834,94 | MSPSI 31 |
| Embolia sistémica no mortal | 1.834,94 | MSPSI 31 |
| Accidente isquémico transitorio | 2.453,36 | MSPSI 31 |
| Hemorragia intracraneal mortal | 5.830,96 | MSPSI 31 |
| Hemorragia intracraneal, independiente | 6.000,78 | MSPSI 31 , Lopez-Bastida et al b |
| Hemorragia intracraneal, moderadamente dependiente | 6.250,56 | MSPSI 31 , Lopez-Bastida et al b |
| Hemorragia intracraneal, totalmente dependiente | 6.486,84 | MSPSI 31 , Lopez-Bastida et al b |
| Ictus hemorrágico, mortal | 5.830,96 | MSPSI 31 |
| Ictus hemorrágico, independiente | 6.000,78 | MSPSI 31 , Lopez-Bastida et al b |
| Ictus hemorrágico, moderadamente dependiente | 6.250,56 | MSPSI 31 , Lopez-Bastida et al b |
| Ictus hemorrágico, totalmente dependiente | 6.486,84 | MSPSI 31 , Lopez-Bastida et al b |
| Hemorragia extracraneal, mortal | 3.724,68 | MSPSI 31 |
| Hemorragia extracraneal, no gastrointestinal, no mortal | 2.581,82 | MSPSI 31 |
| Hemorragia extracraneal, gastrointestinal, no mortal | 2.581,82 | MSPSI 31 |
| Hemorragia menor | 188,96 | Oblikue Consulting 32 |
| Infarto agudo de miocardio mortal | 4.072,94 c | MSPSI 31 |
| Infarto agudo de miocardio no mortal | 4.072,94 c | MSPSI 31 |
| Grado de discapacidad asociado | Coste por cada 3 meses de seguimiento | Fuente |
| Tras ictus, independiente | 169,82 | Lopez-Bastida et al b |
| Tras ictus, moderadamente dependiente | 419,60 | Lopez-Bastida et al b |
| Tras ictus, totalmente dependiente | 655,88 | Lopez-Bastida et al b |
| Monitorización del cociente internacional normalizado | Coste anual | |
| Pacientes habitualmente con buen control | 382,83 | Tabla 2 |
| Pacientes habitualmente con mal control | 472,70 | Tabla 2 |
IVA: impuesto sobre el valor añadido; MSPSI: Ministerio de Sanidad, Política Social e Igualdad; PVP: precio de venta al público.
a Con reducción del 7,5% del Real Decreto 8/2010 30 .
b Fuente: López-Bastida J, Oliva Moreno J, Worbes Cerezo M, Perestelo Perez L, Serrano-Aguilar P, et al. The Social Economic Costs and Health-Related Quality of Life of Stroke Survivors in the Canary Islands, Spain. Working paper. (J. López-Bastida, comunicación personal, 15 de noviembre de 2011).
c Se considera que un 11% es silente.
Se realizaron análisis de sensibilidad determinístico y probabilístico para confirmar la robustez del modelo e identificar los parámetros con mayor influencia en los resultados.
En el análisis determinístico se modificaron los parámetros con mayor incertidumbre: horizonte temporal, tasa de descuento, subpoblación de pacientes de 80 o más años (tratados sólo con dabigatrán 110 mg) y porcentaje de tiempo en rango terapéutico en el control del INR (el 57,1 y el 72,6%), con los mismos valores de corte utilizados en un subanálisis post-hoc de los datos de RE-LY35.
Asimismo, se ha realizado análisis de sensibilidad determinístico para observar la eficiencia en cuatro subgrupos: pacientes con mal o buen control de su INR (definido como tiempo en rango terapéutico <57,1 o 72,6%), pacientes en ácido acetilsalicílico o no tratados, y para considerar la perspectiva de la sociedad. Esta ha incluido costes directos no sanitarios36 y la valoración de los cuidados informales recibidos por supervivientes a un ictus con algún grado de dependencia37, 38, y se ha deducido del precio de los fármacos el impuesto sobre el valor añadido (Tabla 4).
Tabla 4. Costes incrementales atribuidos para el análisis de sensibilidad determinístico desde la perspectiva social, según discapacidad (euros de 2010)
| Independiente e historia de ictus | Dependiente moderado | Totalmente dependiente | Fuente | |
| Al precio de fármacos | Deducción del IVA y descuentos (se consideran en PVP) | MSPSI 29 | ||
| Al evento discapacitante ictus isquémico o hemorrágico y hemorragia intracraneal | ||||
| Inversión (p. ej., obras) | 0 | 31,1 | 31,1 | Hervas-Angulo et al 36,a |
| Ayuda institucionalizada pública | 0 | 125,8 | 125,8 | Hervas-Angulo et al 36,a |
| Al seguimiento de pacientes tras el ictus cada 3 meses | ||||
| Ayuda institucionalizada privada | 0 | 76,9 | 76,9 | Hervas-Angulo et al 36,a |
| Residencias y/o centros de día | 0 | 426,6 | 426,6 | Hervas-Angulo et al 36,a |
| Cuidados informales (coste de hora, 10,6 euros) a | 5.970,1 | 9.596,6 | 11.958,9 | Hidalgo et al 37 , Jiménez-Martín et al 38 y Oliva-Moreno et al b |
IVA: impuesto sobre el valor añadido; MSPSI: Ministerio de Sanidad, Política Social e Igualdad.
Estimación de horas de cuidados informales y no profesionales provistos a supervivientes a un ictus con algún grado de dependencia, por parte de familiares o amigos y a consecuencia exclusiva de su vínculo. Basado en datos primarios de la Encuesta sobre Discapacidades, Autonomía personal y situaciones de Dependencia 2008 (Instituto Nacional de Estadística), mediante metodología de coste de sustitución, censurando en 16 h diarias el máximo de cuidados informales y sólo considerando al principal cuidador (no cuidadores adicionales u ocasionales). Del trabajo citado, se calculó el promedio del coste unitario de hora de cuidado de sus escenarios de valoración (7,67 y 12,71 euros), y se han asimilado sus categorías de dependencia a las nuestras del siguiente modo: no dependiente a independiente con historia de ictus, dependiente moderado, y el promedio de dependiente severo y gran dependencia a totalmente dependiente.
a Se toma el promedio de los años 2 y 3 del trabajo citado.
b Oliva-Moreno J, Aranda-Reneo I, Vilaplana C, González-Domínguez A, Hidalgo-Vega A. Informal care of cerebrovascular accident survivors with activities of daily living limitations (mimeo). (J. Oliva-Moreno, comunicación personal, 15 de noviembre de 2011).
El análisis de sensibilidad probabilístico realizado (10.000 simulaciones Monte Carlo) modificó los valores de los parámetros de manera simultánea según las funciones de distribución beta sobre riesgos basales y utilidades, log normal sobre riesgos relativos y gamma sobre costes.
ResultadosEn el modelo, dabigatrán reduce el número de ictus isquémicos, embolias sistémicas, accidentes isquémicos transitorios, hemorragias intracraneales e ictus hemorrágicos comparado tanto con warfarina (escenario 1) como con el patrón de prescripción (escenario 2), pero aumenta el número de hemorragias extracraneales (debido a hemorragias gastrointestinales no mortales) y de infartos agudos de miocardio (Tabla 5).
Tabla 5. Eventos clínicos por alternativa observados para toda la cohorte de 10.000 pacientes
| Eventos clínicos | Dabigatrán | Warfarina | PP | Δ dabigatrán frente a warfarina | Δ dabigatrán frente a PP |
| Ictus isquémico | 4.244 | 4.407 | 5.170 | –162 | –926 |
| Mortal | 1.606 | 1.596 | 1.870 | 9 | –264 |
| Independiente | 1.435 | 1.598 | 1.841 | –164 | –406 |
| Moderadamente dependiente | 734 | 688 | 807 | 46 | –72 |
| Totalmente dependiente | 470 | 524 | 653 | –54 | –183 |
| Embolia sistémica | 508 | 563 | 680 | –56 | –173 |
| Mortal | 2 | 2 | 2 | 0 | –1 |
| No mortal | 506 | 561 | 678 | –55 | –172 |
| Ataque isquémico transitorio | 1.301 | 1.535 | 1.674 | –234 | –372 |
| Hemorragia intracraneal e ictus hemorrágico | 480 | 1.078 | 909 | –598 | –429 |
| Mortal | 200 | 512 | 377 | –312 | –177 |
| Independiente | 48 | 93 | 93 | –44 | –44 |
| Moderadamente dependiente | 55 | 106 | 105 | –51 | –50 |
| Totalmente dependiente | 176 | 367 | 334 | –191 | –158 |
| Hemorragia extracraneal | 4.336 | 3.884 | 3.790 | 452 | 546 |
| Mortal | 52 | 47 | 46 | 5 | 7 |
| No mortal, no gastrointestinal | 3.360 | 3.147 | 3.073 | 213 | 287 |
| No mortal, gastrointestinal | 924 | 690 | 672 | 234 | 251 |
| Infarto agudo de miocardio | 1.419 | 1.161 | 1.267 | 257 | 152 |
| Mortal | 16 | 13 | 14 | 3 | 2 |
| No mortal | 1.403 | 1.148 | 1.253 | 255 | 150 |
| Total dependencia total (Rankin=5) | 646 | 891 | 987 | –245 | –341 |
| Total mortales | 1.875 | 2.170 | 2.309 | –295 | –434 |
| Total de eventos | 12.288 | 12.628 | 13.490 | –340 | –1.203 |
PP: patrón de prescripción.
Dabigatrán, en ambos escenarios, reduce 295 y 434 eventos mortales y 250 y 463 eventos que generan algún tipo de discapacidad; de estos eventos discapacitantes evitados, el 98 y el 73% causaron dependencia total (Rankin=5) en los escenarios 1 y 2 respectivamente.
Respecto a los años de vida ganados y los años de vida ajustados por calidad (AVAC) ganados, dabigatrán logra un aumento de 2.514 años de vida y 2.759 AVAC a lo largo de la vida en el primer escenario y 3.625 años de vida y 4.085 AVAC en el segundo.
En el análisis coste-efectividad realizado, se obtuvo un valor de 17.581 euros/AVAC ganado para la comparación de dabigatrán frente a warfarina, y un valor de 14.118 euros/AVAC ganado frente al patrón de prescripción (Tabla 6).
Tabla 6. Resultados del análisis coste-efectividad en euros por año de vida ajustado por calidad ganado por paciente
| Por paciente, para todo el horizonte temporal | Coste medicación y monitorización * | Coste eventos * | Coste seguimiento * | Total coste * | AVG | AVAC | Coste incremental | AVAC incrementales | RCEI (€/AVAC) |
| Escenario 1 (dabigatrán frente a warfarina, RE-LY) | |||||||||
| Warfarina | 3.475 | 3.678 | 3.190 | 10.343 | 11,13 | 8,45 | 4.851 | 0,28 | 17.581 |
| Dabigatrán | 8.857 | 3.409 | 2.927 | 15.193 | 11,39 | 8,73 | |||
| Escenario 2 (dabigatrán frente a patrón de prescripción) | |||||||||
| Patrón de prescripción | 2.178 | 3.889 | 3.358 | 9.426 | 11,02 | 8,32 | 5.769 | 0,341 | 14.118 |
| Dabigatrán | 8.857 | 3.409 | 2.927 | 15.193 | 11,39 | 8,73 | |||
AVAC: años de vida ajustados por calidad; AVG: años de vida ganados; RCEI: razón de coste-efectividad incremental; RE-LY: Randomized Evaluation of Long-term anticoagulation therapy.
* En euros de 2010.
Desde la perspectiva del Sistema Nacional de Salud, la variación de la razón coste-efectividad incremental observada en el análisis determinístico univariable en el primer escenario osciló de 14.651 a 57.719 euros/AVAC. En el escenario 2, la tasa coste-efectividad osciló de 11.519 a 52.160 euros/AVAC.
En el análisis desde la perspectiva de la sociedad, dabigatrán resultó ser una estrategia dominante por mostrar mayor efectividad y menor coste en la comparación de dabigatrán frente a warfarina y frente al patrón de prescripción, con una reducción de 6.957.025 y 41.237.148 euros respectivamente (Tabla 7).
Tabla 7. Resultados del análisis de sensibilidad determinístico
| Parámetro | Valor CB | Valor AS | Dabigatrán frente a warfarina, RE-LY | Dabigatrán frente a PP | ||
| RCEI (€/AVAC) | Variación respecto a CB | RCEI (€/AVAC) | Variación respecto a CB | |||
| Resultados CB | 17.581 | 14.118 | ||||
| Tasa de descuento | 3% | 0 | 15.127 | –14% | 11.971 | –15% |
| 5% | 19.348 | 10% | 15.684 | +11% | ||
| Horizonte temporal | Vida del paciente | 5 años | 57.719 | 228% | 52.160 | +269% |
| 10 años | 32.001 | 82% | 27.829 | +97% | ||
| Riesgo relativo de ictus isquémico de dabigatrán frente a warfarina | <80 años: 0,77; >80 años: 0,82 | <80 años: 0,58; >80 años: 0,51 | 13.217 | –25% | 11.519 | –18% |
| <80 años: 1,03; >80 años: 1,33 | 32.175 | +83% | 20.520 | +45% | ||
| Pacientes con discapacidad total por ictus isquémico | RE-LY (150 mg: 4,1%; 110 mg: 0,1%) | 150 mg: 13,3%, 110 mg: 14,6% | 21.475 | +22% | 16.137 | +14% |
| %TRT de INR * | 64,5% | 72,6% | 21.095 | 20% | 15.072 | +7% |
| 57,1% | 13.952 | –21% | 12.776 | –10% | ||
| Edad de inicio de los pacientes, media | 69,1 | +80 (82,9) | 24.034 | 37% | 17.501 | +24% |
| Coste de monitorizar INR ( tabla 3 ) | 382,8€ | +30% | 14.014 | –20% | 12.672 | –10% |
| 472,7€ | –30% | 21.149 | +20% | 15.564 | +10% | |
| Total costes sanitarios | Fármacos, eventos y seguimiento del CB ( tabla 3 ) | +20% | 21.097 | 20% | 16.666 | +18% |
| –20% | 14.651 | –17% | 11.765 | –17% | ||
| Dabigatrán frente a pacientes con AAS | 30% | 100% | No aplicable | 13.317 | –5% | |
| Dabigatrán frente a pacientes no tratados | 10% | 100% | No aplicable | 7.104 | –50% | |
| Perspectiva de sociedad, incorpora costes sociales | Perspectiva del Sistema Nacional de Salud | Costes según detalle de tabla 6 | Dominante | Dominante | ||
%TRT: porcentaje de tiempo en rango terapéutico; AAS: ácido acetilsalicílico; AS: análisis de sensibilidad; AVAC: años de vida ajustados por calidad; CB: caso base; INR: cociente internacional normalizado; PP: patrón de prescripción; RCEI: razón coste-efectividad incremental; RE-LY: Randomized Evaluation of Long-term anticoagulation therapy.
* Los porcentajes de tiempo por encima y por debajo de rango terapéutico de INR mantuvieron la relación original del caso base (INR <2=15,2% cuando TRT=72,6 e INR <2=23,9 cuando TRT=57,1).
Los parámetros clave que afectan en mayor medida a la razón coste-efectividad incremental son el horizonte temporal, la perspectiva del análisis, el grado de control del INR que se logre en los pacientes tratados con warfarina, la reducción del riesgo de ictus y la de la discapacidad a largo plazo que logra dabigatrán respecto a ambos comparadores, así como el coste asociado a la monitorización del INR en los pacientes en tratamiento con warfarina (Tabla 3).
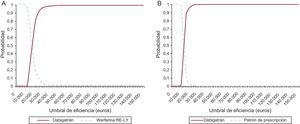
En el análisis de sensibilidad probabilístico, considerando un umbral de eficiencia de 30.000 euros/AVAC ganado39, dabigatrán sería una estrategia coste-efectiva en el 96,4% de las simulaciones frente a warfarina y en el 99,9% de las simulaciones frente al patrón de prescripción (Figura 2). En las comparaciones por subgrupos, dabigatrán resulta una estrategia coste-efectiva en el 99,4 y el 99,3% de las simulaciones para el caso de pacientes con mal y buen control de INR y en el 99,5 y el 99,9% para el caso de los pacientes con ácido acetilsalicílico y los no tratados respectivamente.
Figura 2. Curvas de aceptabilidad según escenario de comparación. A: dabigatrán frente a warfarina en el ensayo Randomized Evaluation of Long-term anticoagulation therapy. B: dabigatrán frente a patrón de prescripción. RE-LY: Randomized Evaluation of Long-term anticoagulation therapy.
DiscusiónDabigatrán, en este modelo secuencial, disminuyó el número de eventos comparado tanto con warfarina como con el patrón de prescripción en la práctica clínica habitual, aportando ganancias en cantidad y calidad de vida de los pacientes.
La importante reducción de los casos de ictus hemorrágico y de hemorragia intracraneal mortal es el principal factor que contribuye a la ganancia en años de vida observada en la rama de dabigatrán. Asimismo, en esta simulación, dabigatrán consiguió una reducción del total de ictus isquémicos, hemorragias intracraneales e ictus hemorrágicos que causan discapacidad (Rankin ≥ 3) del 15% respecto a warfarina y del 24% respecto al patrón de prescripción en España, lo que se asocia a una reducción de los costes de tratamiento y de asistencia a largo plazo.
En todas las comparaciones del análisis de sensibilidad determinístico, los valores de la razón coste-efectividad incremental estuvieron por debajo del umbral de referencia de 30.000 euros/AVAC ganado39, excepto para el horizonte temporal de 5 y 10 años en el escenario 1 y para el de 5 años en el escenario 2. Este último resultado se explica por la cronicidad de la FA y la obtención de beneficios durante toda la vida de los pacientes. Las consecuencias del ictus en discapacidad a medio y largo plazo hacen necesario evaluar los beneficios de los tratamientos considerados en el horizonte temporal de toda la vida del paciente, y este es el análisis idóneo.
Con un umbral de eficiencia de 30.000 euros/AVAC ganado, la probabilidad de dabigatrán de resultar una estrategia eficiente es del 96,4% en comparación con warfarina y del 99,9% en la comparación frente al patrón de prescripción, lo que avala la robustez de los resultados obtenidos.
Limitaciones y fortalezasCabe mencionar la existencia de varias limitaciones y posibles sesgos de la presente evaluación económica. Así, los datos procedentes de ensayos clínicos tienen limitaciones que pueden condicionar la validez externa del modelo. Sin embargo, el escenario de dabigatrán frente a la prescripción habitual en España puede suponer una mayor aproximación a la práctica clínica real.
Identificamos limitaciones propias de la adaptación del modelo al contexto español. Primero, las dispares fuentes de información de costes sanitarios nos obligaron a realizar una cuidadosa selección de dichos valores, desagregando la información por niveles de discapacidad y optando por las alternativas más conservadoras. Segundo, los datos de utilidades empleados en el modelo se refieren a población de Reino Unido, debido a las escasas referencias sobre utilidades para población española y la imposibilidad de adaptarlas a los niveles de discapacidad tras ictus que exigía el diseño. A pesar de ello, el análisis de sensibilidad probabilístico se realizó variando los datos de costes y utilidades, y no se observó que afectara a la robustez de los resultados.
Finalmente, a pesar de que en España la terapia anticoagulante utilizada es acenocumarol y no warfarina, se consideró que estos son sustitutos perfectos tanto en eficacia y seguridad como en el uso de recursos que implican.
Una fortaleza de esta evaluación económica es el seguimiento de la discapacidad causada por ictus isquémico o hemorragia intracraneal, de vital importancia dado el elevado coste de la asistencia a largo plazo, y que no suele evaluarse en otros estudios económicos40.
Una segunda fortaleza del presente trabajo son las presunciones conservadoras adoptadas respecto al control del INR. Se asumió para ambos escenarios un tiempo en rango terapéutico del 64,4%, valor observado en el ensayo clínico RE-LY, cuando en la práctica clínica real puede ser inferior. El modelo tampoco asocia decrementos de la utilidad a la monitorización del INR.
Es también de destacar que el modelo se diseñó antes de obtener resultados del estudio RE-LY y que el análisis económico se especificó paralelamente al desarrollo clínico. Asimismo, su desarrollo permitió incluir en la simulación los resultados del estudio RE-LY paciente por paciente, y no de forma agregada40, y derivar resultados de ictus por niveles de discapacidad.
Se han publicado siete evaluaciones económicas de dabigatrán hasta la fecha23, 40, 41, 42, 43, 44, 45, 46. En las adaptaciones de este mismo modelo a los contextos canadiense23, británico42 y danés46, dabigatrán resultó una estrategia coste-efectiva tanto en su comparación frente a warfarina como frente al patrón de prescripción local. Kamel et al45, en Estados Unidos, utilizando perspectiva social y un coste tratamiento día de dabigatrán de 6,75 dólares, concluyen que es una alternativa coste-efectiva para pacientes que ya han sufrido un ictus o un accidente isquémico transitorio previo.
Las otras tres publicaciones40, 41, 43, 44 concluyen que dabigatrán 150 mg administrado dos veces al día es coste-efectivo sólo en determinados subgrupos analizados. Sin embargo, cabe mencionar que estos tres trabajos incorporan algunas hipótesis que favorecen a warfarina frente a dabigatrán y aumentan la razón de coste-efectividad incremental observada: utilizar un precio de dabigatrán superior al precio de lista (coste del tratamiento ≥ 8 dólares/día)40, 43, 44, considerar el riesgo de ictus isquémico y de hemorragia intracraneal como independientes de la edad43 o utilizar valores menores de discapacidad y costes de la hemorragia intracraneal cuando dabigatrán reduce notablemente el riesgo de hemorragia intracraneal41. Pink et al41 asignan a la hemorragia intracraneal, un evento que puede resultar en mayor discapacidad que el ictus, una discapacidad permanente de sólo 0,0524, frente a 0,233 para el ictus, y asigna un coste bajo a la hemorragia intracraneal, similar al de la hemorragia extracraneal. Por otra parte, Freeman et al40, 44 y Shah et al43 evalúan las dosis de 150 o 110 mg de dabigatrán por separado. La evaluación de la dosis de 110 mg dos veces al día en el contexto social de Estados Unidos no es aplicable, pues no está autorizada por la Food and Drug Administration. Consideramos que los resultados de la evaluación aquí presentada, al ser obtenidos con el modelo secuencial, se ajustan mejor a la ficha técnica del fármaco y las condiciones reales de prescripción.
Por su parte, diversas agencias de evaluación de tecnologías sanitarias (Reino Unido, Escocia, Dinamarca, Suecia, Australia y Canadá) han evaluado dabigatrán en esta indicación y lo han considerado coste-efectivo para toda la población.
Los AVK son una opción terapéutica que lleva 50 años en el mercado, de bajo coste pero con menos eficacia y/o seguridad y serias limitaciones respecto a dabigatrán. Primero, la reducción del riesgo de ictus isquémico y hemorrágico que aporta dabigatrán otorga más cantidad y calidad de vida y además no requiere la monitorización del INR. Todo ello supone una reducción de los costes asociados. Por ello, esta evaluación no puede reducirse a un enfoque de presupuestos estancos con una mera comparación del coste farmacéutico.
El análisis desde la perspectiva de la sociedad incluyó los costes directos no sanitarios (residencias, adaptaciones al hogar, cuidadores, etc.) que, no estando financiados por el Sistema Nacional de Salud, sí pueden estar siendo asumidos en parte por los presupuestos de la Seguridad Social. Por dificultad metodológica y escasez de evidencia, no se incluyeron algunos costes como en el que incurre el paciente a causa del control del INR, el coste de oportunidad del tiempo productivo de los supervivientes con dependencia o el valor de la vida perdida.
Según un trabajo reciente, el impacto económico en horas de cuidados informales a supervivientes de un ictus en España iría desde 6.183,57 a 10.246,83 millones de euros (año 2008)37, 38. Incorporando estos datos y otros costes directos no sanitarios35 a nuestro análisis, se observó que dabigatrán supone mayor efectividad y menores costes respecto a ambas alternativas, con lo que aporta un ahorro a la sociedad. Por lo tanto, dabigatrán es una estrategia dominante en ambos escenarios47.
A pesar de las limitaciones comentadas, las premisas adoptadas en el presente modelo parecen razonables y conservadoras y los resultados de los análisis de sensibilidad confirman la robustez del modelo y de los resultados obtenidos.
Los contundentes resultados de eficacia y seguridad demostrados en el ensayo clínico RE-LY y sus subanálisis posteriores avalan la indicación de dabigatrán como un tratamiento de primera línea en la terapia anticoagulante oral para la prevención de ictus en pacientes con FA no valvular11, 48.
Los resultados de la presente evaluación económica constatan que, considerando un umbral de disposición a pagar de 30.000 euros/AVAC adicional39, dabigatrán etexilato es una terapia coste-efectiva en esta indicación en España.
ConclusionesDesde la perspectiva del Sistema Nacional de Salud español, dabigatrán es una estrategia eficiente en la indicación de prevención de ictus en pacientes con FA no valvular en comparación con warfarina y con el patrón de prescripción de la práctica clínica habitual. Desde la perspectiva de la sociedad, dabigatrán sería además una estrategia dominante por aportar a la sociedad mayor efectividad y menores costes respecto a ambas alternativas.
Conflicto de interesesTodos los autores han contribuido de forma sustancial al diseño y el desarrollo del estudio, según las recomendaciones internacionales al respecto. Dos de los autores (NGR y VB) son empleados de Boehringer Ingelheim. Otro autor (IO) es miembro de PORIB (Pharmacoeconomics & Outcomes Research Iberia), una consultora especializada en evaluación económica que ha realizado labores de asesoría para Boehringer Ingelheim en relación con este estudio. Sin embargo, esta situación en ningún caso ha influido en los resultados presentados.
Agradecimientos
A Anuraag Kansal y Sonja Sorensen de United BioSource Corporation, Maryland, Estados Unidos.
Recibido 16 Febrero 2012
Aceptado 6 Junio 2012
Autor para correspondencia: Prat de la Riba s/n, Sector Turó Can Matas, 08173 Sant Cugat del Vallès, Barcelona, España. virginia.becerra@boehringer-ingelheim.com