Palabras clave
ANEURISMAS DE LA AORTA ABDOMINAL
El aneurisma de la aorta abdominal (AAA) se define como el aumento del diámetro de la aorta en más del 50% de su tamaño original. Afecta de manera característica a varones a partir de la séptima década de la vida. Su prevalencia aumenta en nuestro medio paralelamente al incremento de la esperanza de vida y la disminución de la mortalidad cardiovascular. Su rotura es la mayor consecuencia clínica. La rotura aneurismática tiene una mortalidad global cercana 90%1.
Con la práctica precoz de técnicas quirúrgicas de resección y sustitución protésica se evita la rotura. Sin embargo, la mortalidad del tratamiento electivo se sitúa en torno al 5%2. Más recientemente, la incorporación del tratamiento endovascular permite el tratamiento electivo y urgente, con resultados iniciales más esperanzadores debido a la menor agresividad de la técnica3.
La enfermedad aneurismática afecta principalmente a varones de edad avanzada y fumadores de raza blanca. En estudios poblacionales, la prevalencia de aneurismas de 2,9-4,9 cm varía de un 1,3% en varones de 45-54 años a un 12,5% en los de 75-84 años4, con una relación varón:mujer de 4:1. La rotura es una causa frecuente de mortalidad en la población general, con 15.000 muertes/año en Estados Unidos, y constituye la decimoquinta causa de muerte y la décima en varones mayores de 55 años5.
El rastreo de la enfermedad aneurismática tiene como objetivo reducir la mortalidad y los costes sanitarios que comporta el tratamiento del AAA roto. La exploración ecográfica tiene una elevada sensibilidad y especificidad, no es agresiva y su coste es bajo. Scott et al6, a través de un estudio de rastreo con 16.000 pacientes, describieron una prevalencia del 4,0% de AAA > 3,0 cm (el 7,6% en varones, el 1,3% en mujeres) y una reducción de la incidencia de rotura del 55%. Sin embargo, debido a la baja prevalencia de pacientes con indicación quirúrgica según el diámetro, representado por el 3,5% de AAA < 4,5 cm y el 0,83% de 4,5-5,9 cm en una serie de 1.700 individuos de 65-74 años7,8, algunos autores consideran que el rastreo en la población no seleccionada no tiene una buena relación coste-efectividad.
El tabaquismo9 y la arteriopatía periférica10 se han relacionado con una mayor prevalencia de AAA, así como la presencia de familiares de primer grado con AAA. En estas circunstancias, la prevalencia oscila entre el 15 y el 30%11. De este modo, el estudio de rastreo sería razonable en varones mayores de 60 años12 fumadores o con otros factores asociados, como aneurismas periféricos y antecedentes familiares de primer grado de AAA13.
La localización infrarrenal es la más frecuente, con afectación suprarrenal en un 5% de los casos. La presentación simultánea en otros territorios es habitual, con afectación torácica (12%), iliaca (25%) y periférica (3,5%). La afectación aneurismática femoropoplítea puede acompañarse de un AAA en un 70%13,14.
Etiología
La etiopatogenia de la enfermedad aneurismática adquirida es compleja y todavía no está bien aclarada. Histológicamente, hay una degeneración de los elementos estructurales y un remodelado de la media de origen multifactorial, con evidencia de inflamación crónica, destrucción de la lámina elástica y depleción de músculo liso. Se proponen factores hereditarios, ateroscleróticos, infecciosos, inflamatorios y/o alteraciones en la actividad proteolítica en la pared aórtica. La influencia de factores biomecánicos también ha sido relacionada con la formación, el crecimiento y la rotura aneurismática.
En varios trabajos se ha descrito la presencia de una predisposición genética, al identificar una degeneración aneurismática en varones relacionada con el parentesco de primer grado en hasta un 28% de los casos4. La agregación familiar no parece influir en la velocidad de expansión, aunque sí parece estar relacionada con una edad de aparición más precoz15. La poliquistosis renal, trastorno autosómico dominante, se ha asociado con AAA16, aunque la hipertensión arterial (HTA) y los trastornos del tejido conectivo podrían ser causa de la asociación de AAA y enfermedad renal. Prockop et al17 identificaron una alteración estructural del colágeno de tipo III en miembros de una familia fallecidos por rotura de AAA.
Aunque algunos autores hayan intentado explicar que ateroma y degeneración aneurismática son procesos independientes, la mayor prevalencia de tabaquismo, HTA, cardiopatía isquémica y arteriopatía periférica, así como las concentraciones de lipoproteínas18, indican una participación de la aterosclerosis en el proceso. Marcadores de extensión de aterosclerosis, como la presencia de placas de ateroma en la aorta torácica, se han asociado con una mayor prevalencia de AAA (el 14 frente al 1,4%)19.
Fisiopatología
Los factores desencadenantes que inician una respuesta en forma de proceso inflamatorio crónico no están todavía bien definidos. La presencia de infiltrados inflamatorios linfomonocitarios y de macrófagos con un aumento de citocinas y otros mediadores provoca un aumento anómalo de la actividad proteolítica en la matriz extracelular19,20, con la destrucción de elastina y colágeno, y una respuesta inmunitaria a sus productos de degradación. Se ha propuesto la participación de agentes infecciosos, al identificar herpesvirus, Chlamydia pneumoniae en el 30-50% de los casos de AAA, así como anticuerpos frente a Chlamydia21,22 Por otro lado, la depleción de la musculatura lisa atribuida a la inducción de apoptosis celular23, junto con el aumento en la actividad de las metaloproteasas24 de la matriz extracelular, producen un remodelado anómalo incapaz de impedir el adelgazamiento y la expansión aneurismática.
La biomecánica de la aorta presenta modificaciones en relación con los cambios estructurales y de la geometría arterial. Aunque la ley de Laplace se ha utilizado para explicar la relación entre presión tangencial, radio y presión arterial, este modelo es sólo aplicable para estructuras cilíndricas, mientras que en los AAA, el crecimiento hace adoptar una conformación esférica. Este cambio de morfología reduce la tensión en la pared respecto a la obtenible a partir de dicha ley25. El diámetro máximo y el riesgo de rotura, por otro lado, no pueden considerarse como sinónimos en todos los casos, pues la composición de la pared y la morfología del aneurisma no son uniformes, y los puntos de mayor tensión no coinciden con el de mayor diámetro localizado en puntos de inflexión y transición. De la misma manera, el efecto protector del trombo mural es otro concepto equívoco, al observar que su grosor se relaciona con fenómenos locales de isquemia en la pared subyacente26.
Diagnóstico
El hallazgo incidental de un AAA asintomático durante el estudio abdominal de otras enfermedades no es infrecuente: una masa pulsátil en la palpación abdominal, los bordes calcificados en una radiografía simple de abdomen o la identificación de un aneurisma durante el estudio ecográfico de un paciente en estudio prostático o estudio por resonancia magnética de enfermedad de columna son los métodos diagnósticos más habituales de un AAA asintomático.
Sin embargo, hay algunas manifestaciones clínicas inespecíficas y sutiles que acompañan a una minoría de AAA. Así, la compresión de la vena cava inferior (VCI) puede manifestarse con edema de los miembros inferiores. Cuando las vías urinarias están afectadas puede haber dolor lumbar, con síntomas urológicos. En los aneurismas inflamatorios (5-10%), la fibrosis de estructuras vecinas (duodeno, VCI, vena renal derecha, uréter o sigma) se puede acompañar de dolores abdominales o lumbares, con pérdida de peso, velocidad de sedimentación elevada y la presencia de un halo inflamatorio perianeurismático en el estudio tomográfico. La embolización arterial periférica conducirá a episodios isquémicos agudos o crónicos por embolización iterativa. En caso de ateroembolia, puede manifestarse en forma de síndrome de los dedos azules. Finalmente, la infección arterial hematógena o por vecindad, con síndrome febril y hemocultivos positivos en el contexto de un compromiso de la integridad de la pared aórtica, son las características clinicopatológicas de los aneurismas micóticos.
La rotura aneurismática es la forma de presentación más grave y supone un compromiso vital si no se trata quirúrgicamente. Ocurre con frecuencia en pacientes con AAA no conocido, por lo que la sospecha clínica es la clave para evitar el retraso en la asistencia, uno de los factores relacionados con su alta mortalidad operatoria27. La rotura puede manifestarse clínicamente como contenida en un 2-3% de los casos, con dolor lumbar, estabilidad hemodinámica y sin hemorragia perivascular. Sin embargo, la forma más frecuente de presentación de la rotura es una hemorragia retroperitoneal (90%) con colapso circulatorio, que puede ser transitorio, y un aumento de perímetro abdominal. En ocasiones se manifiesta con sangrado hacia un órgano contiguo, como hacia el intestino (1%), en el que puede haber sangrado digestivo autolimitado con episodios febriles por bacteriemia, hacia el territorio de la vena iliocava (1%), con hipertensión venosa, insuficiencia cardiaca, embolismo pulmonar, edema de miembros inferiores o síndrome nefrótico, o como rotura intraperitoneal (5%), de consecuencias fatales si no se realiza un tratamiento inmediato.
El diagnóstico clínico del AAA es poco sensible para diámetros < 5 cm en pacientes con anatomía poco favorable para la palpación abdominal. La radiología simple de abdomen puede mostrar una calcificación arterial indicativa.
La ecografía es un método accesible y no invasivo, con una sensibilidad de 92-99% y una especificidad del 100%28-30, válido para la medición de los diámetros y el trombo mural. En la rotura se pueden identificar signos como la presencia de colecciones. Pese a las limitaciones del estudio yuxtarrenal y suprarrenal e iliaco en pacientes no seleccionados, es la exploración de elección para el seguimiento.
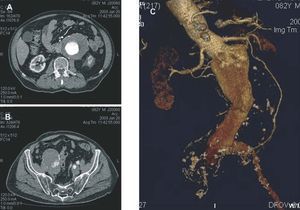
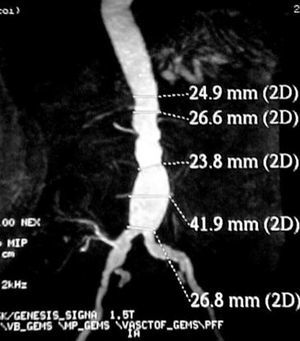
La tomografía computarizada con contraste (angio-TC) ofrece imágenes de alta resolución y posibilidad de reconstrucción tridimensional. Es la exploración de elección en el diagnóstico y el estudio preoperatorio. La evaluación de la anatomía aortoiliaca, las características de la pared (inflamación, calcificación, signos de rotura, trombo), los vasos viscerales y las variaciones anatómicas (riñón en herradura, vena renal izquierda o VCI izquierda) se obtienen de forma detallada (fig. 1). Sus inconvenientes son la irradiación y el empleo de contraste. La resonancia magnética (RM) con contraste presenta las mismas propiedades que la angio-TC, pero elimina el riesgo de nefrotoxicidad y radiaciones ionizantes (fig. 2). Puede sobreestimar el grado de estenosis en vasos viscerales, no detecta las calcificaciones y presenta artefactos en portadores de dispositivos de acero. Sin embargo, en el seguimiento de endoprotesis de Nitinol®, la angio-RM ha presentado buenos resultados en la detección de fugas31-33.
Fig. 1. Imágenes de cortes axiales de aneurisma de aorta abdominal y de ambas iliacas (A y B). Reconstrucción detallada de la anatomía en 3D (C).
Fig. 2. Imagen de un aneurisma de aorta abdominal obtenida con angiorresonancia magnética en un paciente trasplantado renal (iliaca derecha). (Imagen cedida por el Dr. I. García del Hospital Valdecilla de Santander.)
La arteriografía convencional puede realizarse en la evaluación preoperatoria de pacientes con sospecha de lesiones ateroscleróticas viscerales y periféricas, cuando sea necesario valorar los vasos renales, o la arcada de Riolano en pacientes con clínica de isquemia intestinal o cirugía digestiva previa. Debido a que sólo se obtiene información de la opacificación de la luz de los vasos, no es una técnica valida para la toma de mediciones.
Pronóstico
En la historia natural de los AAA, el crecimiento determina la evolución hacia la rotura. Esta complicación es común en aneurismas abdominales de localización aortoiliaca y visceral, a diferencia de los que afectan al territorio periférico, en los que predomina la clínica isquémica secundaria a trombosis y/o embolización.
El ritmo de crecimiento difiere según el diámetro inicial en el momento de diagnóstico. Así, el crecimiento anual en AAA < 4,0 cm oscila entre 1 y 4 mm. En AAA de 4,0-6,0 cm, el crecimiento anual se sitúa entre 4 y 5 mm y, en AAA mayores, el crecimiento alcanza hasta 8 mm/año34. Se acepta que el diámetro es el principal factor predictivo de rotura35, con un riesgo anual prácticamente nulo para aneurismas < 4 cm. El riesgo anual de rotura aumenta a 0,5-5% en AAA de 4-5 cm o a 3-15% en AAA de 5-6 cm, o al 20-40% en AAA de 7-8 cm y alcanza un 50% de rotura anual en los AAA > 8 cm.
La capacidad del tratamiento quirúrgico de interferir en la historia natural de los aneurismas de pequeño tamaño (entre 4 y 5,4 cm) ha sido estudiada en 2 estudios prospectivos y aleatorizados (Veterans Affaire Aneurysm Detection And Management Trial [ADAM] y UK Small Aneurysm Trial)34,35. No se determinó el beneficio en el tratamiento precoz de la enfermedad aneurismática debido a la baja incidencia de rotura, del 0,6 y el 3,2%, respectivamente. Sin embargo, en el 17% de mujeres del UK Small Aneurysm Trial se observó un mayor riesgo de rotura, con un 14% de mortalidad global respecto a un 4,6% en los varones. Al estudiar el comportamiento según el tamaño, un 81% de los pacientes del estudio ADAM en los que se indicó tratamiento quirúrgico por crecimiento del AAA presentaba un diámetro inicial de 5,0-5,4 cm. No se conoce el beneficio del tratamiento endovascular de los AAA pequeños. Por ello, se encuentran en curso 2 estudios prospectivos y aleatorizados en este sentido: el CAESAR en Europa y su equivalente en Estados Unidos el estudio PIVOTAL36,37.
Otros factores relacionados con la rotura son la HTA38, la enfermedad pulmonar obstructiva crónica (EPOC), el tabaquismo y la historia familiar. Se ha descrito la influencia de la presión barométrica ambiental en la incidencia de rotura39.
Tratamiento
Consideraciones farmacológicas en el tratamiento de los aneuris mas de aorta abdominal
Actualmente no hay pruebas científicas de la influencia del tratamiento farmacológico en el control del crecimiento aneurismático. El progresivo conocimiento de la etiopatogenia del proceso abre nuevas perspectivas terapéuticas que deberán evaluarse en estudios futuros.
El control de los factores de riesgo ateroscleróticos debe ser parte del tratamiento básico de estos pacientes más allá de su potencial efecto en la historia natural del AAA, debido a la reducción de la morbimortalidad cardiovascular. Se ha descrito la asociación entre EPOC y tabaquismo con el crecimiento y la rotura en aneurismas de pequeño tamaño. La hiperlipemia y el mal control de la HTA, relacionado con AAA, son también factores modificables. Algunos autores han indicado que el empleo de estatinas es potencialmente beneficioso por su interferencia en los fenómenos moleculares antes mencionados.
Además, se ha descrito la interferencia en el proceso inflamatorio con el empleo de antiinflamatorios no esteroideos (AINE) (indometacina)40 y tetraciclinas (doxiciclina)41 en pacientes con aneurismas de pequeño tamaño, observándose una reducción en el crecimiento respecto a los controles, mediada probablemente por la disminución de las metaloproteasas (MMP-9).
Indicaciones del tratamiento quirúrgico
En la práctica, debido a la presentación generalmente asintomática de los AAA, el diámetro aórtico suele ser el principal criterio clínico para la indicación de tratamiento. Tras seguimiento anual en AAA < 4,0 cm y semestral en los de 4,0-4,9 cm, el tratamiento quirúrgico se recomienda para los AAA a partir de 5-5,5 cm en varones y de 4,5-5,0 cm en mujeres. Otros autores consideran el diámetro de la aorta del 200% respecto al de la aorta previa sana. Otras indicaciones absolutas de tratamiento son la presencia de un episodio embólico, la obliteración iliaca invalidante, la coexistencia de un aneurisma iliaco, el dolor lumbar o abdominal atribuible al AAA y el crecimiento > 5 mm/año. Cuando el diámetro es menor, la morfología sacular y la enfermedad obliterante no invalidante asociada son indicaciones relativas2,4.
Tratamiento convencional
Desde su introducción por Dubost en 1951, el tratamiento de elección del AAA es la sustitución del segmento aneurismático por un injerto protésico aortoaórtico o bifurcado, en función de la afectación del territorio iliaco por enfermedad aterosclerótica aneurismática u obliterante. Las vías de abordaje clásicas son la laparotomía media o el abordaje retroperitoneal por el flanco izquierdo. Aunque algunos autores defienden un mejor acceso por la vía retroperitoneal a la aorta suprarrenal y menor incidencia de complicaciones respiratorias42, la lateralización derecha del paciente dificulta el acceso a estructuras derechas, tales como la iliaca o la arteria renal derechas. Además, la incidencia de hernia incisional es mayor en los abordajes retroperitoneales.
La mortalidad del tratamiento electivo del AAA se sitúa alrededor del 5%. En un metaanálisis realizado por Steyerberg et al43 se identificaron como factores de riesgo una creatinina plasmática > 1,8 mg/dl, insuficiencia cardiaca congestiva, isquemia electrocardiográfica, enfermedad pulmonar, edad y sexo femenino. La morbimortalidad de ese procedimiento está ligada al pinzamiento aórtico y a la isquemia de los territorios viscerales. En el primer caso, el estatus cardiológico debe evaluarse preoperatoriamente44; en el segundo, la revascularización renal e intestinal deben considerarse en caso de compromiso de las arterias renales, mesentérica superior y/o hipogástricas.
Las principales complicaciones del tratamiento convencional en los AAA son cardiológicas (15%), como el infarto de miocardio (2-8%); respiratorias (8-12%), como la neumonía (5%), la insuficiencia renal (5-12%) con hemodiálisis (1-6%), la trombosis venosa (8%), la infección de la herida (< 5%), el sangrado (2-5%), la isquemia de las extremidades (1-4%) y, con menos frecuencia, el accidente cerebrovascular (ACV), la lesión de la vía urinaria, la isquemia cólica, la isquemia medular, la trombosis y las infecciones protésicas43,45. En este último caso, la profilaxis antibiótica sistemática y la cobertura del material protésico con el saco aórtico son la principal protección contra la aparición tardía de fístulas aortodigestivas, cuya mortalidad es comparable a la de la rotura.
La supervivencia a largo plazo a los 5 y 10 años se sitúa en el 70 y el 40%, respectivamente. Cuando se analiza la influencia de cardiopatía e HTA observamos que, en su ausencia, la supervivencia mejora significativamente. En el tratamiento de los casos de rotura, la supervivencia a largo plazo es menor, debido a las comorbilidades asociadas.
Tratamiento endovascular
El tratamiento endovascular ha presentado una aplicación creciente desde las primeras experiencias clínicas de Parodi en 199146. La exclusión aneurismática se consigue mediante el implante de endoprótesis. Con la consolidación del tratamiento endovascular, el grado de complejidad de los aneurismas tratados aumenta, gracias a la versatilidad de las endoprótesis, que permiten abordajes aortouniiliacos, bifurcados, con fijación suprarrenal y fenestrados, así como a la práctica de técnicas híbridas en las que se combina la exclusión aneurismática con la revascularización visceral quirúrgica. Tras las indicaciones iniciales, restringidas a pacientes de alto riesgo para cirugía convencional, son muchos los grupos que abogan por un tratamiento endovascular del AAA (EVAR) como primera opción. Cuando la anatomía es favorable, las ventajas son significativas: alto éxito técnico (96-100%), menor tiempo operatorio, abolición de laparotomía, manipulación intestinal y pinzamiento aórtico, menor incidencia de íleo postoperatorio y de requerimiento transfusional, mejor control del dolor postoperatorio y menor estancia en cuidados intensivos y hospitalaria total47. Y lo más relevante, menor mortalidad periopertoria. Así se ha demostrado en los recientes estudios prospectivos y aleatorizados con pacientes de bajo riesgo quirúrgico48-50.
Esta menor invasividad ha permitido su aplicación en la rotura aneurismática, con unos resultados prometedores51.
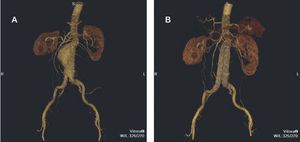
El EVAR tiene como objetivo la trombosis del saco excluido, la reducción del diámetro aneurismático y, finalmente, la eliminación del riesgo de rotura (fig. 3). Sin embargo, las complicaciones específicas (fugas, migración, fatiga de materiales, oclusión protésica, infección) (tabla 1) obligan a realizar un seguimiento indefinido del paciente y son una causa frecuente de reintervenciones. Son precisamente las reintervenciones, la mayoría de índole endovascular con baja mortalidad, las que limitan la aplicación extensa del EVAR. Sin embargo, los futuros desarrollos tecnológicos miniminizarán este inconveniente52,53.
Fig. 3. Imagen de un aneurisma de aorta abdominal obtenida por angiotomografía computarizada y con reconstrucción 3D (A). Se observa el resultado de la exclusión mediante el implante de una endoprótesis (B).
Seguimiento del tratamiento endovascular
La cirugía convencional precisa un seguimiento clínico e instrumental a largo término, pues las prótesis convencionales no están exentas de complicaciones, como infección, trombosis, seudoaneurismas o fístula aortoentérica. El EVAR, por su carácter novedoso, la fatiga de los materiales implicados en la construcción de las endoprótesis y la fijación menos activa que la sutura quirúrgica, hace aconsejable un seguimiento clínico e instrumental más cercano e intenso52. La angio-TC es la técnica de elección para el estudio preoperatorio y la detección de la mayoría de las complicaciones. Para limitar radiación y contraste, que se han relacionado con el empeoramiento de la función renal en mayor grado que la propia intervención, su indicación puede ser selectiva tras la radiografia convencional en 4 proyecciones y eco-Doppler validado (tabla 2). La radiografía permite evaluar la integridad de la estructura metálica, las plicaturas, las desconexiones y la migración de la prótesis. La eco-Doppler determina el diámetro aórtico, la permeabilidad protésica y la presencia de fugas, con una sensibilidad del 95% y una especificidad del 97%53. Sin embargo, hay limitaciones relacionadas con el explorador y también su practicabilidad en pacientes obesos. Se ha observado una sensibilidad de 94% en la detección de fugas de tipo II con angio-RM, menos nefrotóxica y con una menor presentación de artefactos con la incorporación de dispositivos de Nitinol® 33.
La arteriografía, en términos generales, debido a su invasividad y a la relativa menor sensibilidad en la identificación de fugas de tipo II, es en la práctica una técnica complementaria, restringida al escenario operatorio en el tratamiento de las fugas.
ENFERMEDAD VASCULAR RENAL
La estenosis de la arteria renal (EAR) es una manifestación común en la aterosclerosis relacionada con la HTA y el deterioro de la función renal (FR). Sin embargo, el contexto de los pacientes con EAR es complejo. Son múltiples los factores que participan en la patogenia de la HTA y la insuficiencia renal. En consecuencia, la revascularización renal no se ha mostrado efectiva en todos los casos, a pesar de la creciente realización de procedimientos percutáneos.
La EAR es un hallazgo frecuente en los pacientes con aterosclerosis y una causa infrecuente de HTA secundaria. Su prevalencia es difícil de determinar. Holley et al54 identificaron un 22,4% de casos en una serie de 295 necropsias. En mayores de 65 años se ha descrito un 6,8% de estenosis > 60% por eco-Doppler, presente en un 9,1% de los varones y un 5,5% de las mujeres55, aunque estudios autópsicos han identificado alrededor de un 30% de EAR en mayores de 60 años54. La aterosclerosis en otros territorios aumenta la prevalencia de EAR, hasta el 20% en pacientes con coronariopatía56 o el 33-50% de casos de arteriopatía periférica57. La afectación bilateral se ha descrito hasta en el 44% de los pacientes con EAR58.
En registros de hipertensión, la etiología vascular renal es la causa de menos de un 1% de los casos no seleccionados, del 5% de pacientes con otras manifestaciones de aterosclerosis y del 7-17% de los pacientes con una presión arterial diastólica > 110 mmHg o HTA refractaria59.
Etiología
La aterosclerosis se encuentra implicada en más del 60% de los casos de EAR. La displasia fibromuscular (DFM) puede llegar a constituir hasta el 30%, mientras que el resto de las causas (actínica, enfermedad de Takayasu, disección, neurofibromatosis de tipo 1) puede suponer hasta un 10%59.
Fisiopatología
En la HTA vascular renal pueden considerarse 2 modelos. En la EAR unilateral, la HTA es secundaria a la elevación de la actividad de la renina plasmática y mediada por la angiotensina II, al producirse la reabsorción de sodio tras la activación del sistema renina-angiotensina-aldosterona. En la EAR bilateral o en pacientes con un único riñón, la ausencia de un riñón contralateral impide la excreción del sodio y del volumen retenido, por lo que la actividad de la renina plasmática disminuye y el proceso se convierte en dependiente del volumen60. Se han propuesto otros mecanismos presores adicionales en la hipertensión vascular renal, como la actividad del sistema nervioso simpático, la activación de vías de estrés oxidativo, factores endoteliales y prostaglandinas61.
La progresión de la EAR y el empeoramiento de la función renal están relacionados62. Sin embargo, la isquemia postestenosis es sólo uno de los factores identificados en la patogenia del fracaso renal en el contexto de la enfermedad renal aterosclerótica, en el que también participan la HTA, la aterosclerosis del parénquima renal, la hiperlipemia y las ateroembolias observadas en casos de EAR63-65. El grado de estenosis y la gravedad de la disfunción renal no son sinónimos66, ya que el riñón se suple metabólicamente con el 10% del flujo renal67.
En casos de lesión bilateral o en pacientes con un único riñón, la expansión de volumen producida por el descenso de la natriuresis, así como la descompensación de la función ventricular izquierda en relación con elevación de la presión arterial durante ese aumento de volemia68, pueden desencadenar cuadros congestivos recidivantes no proporcionales al grado de disfunción sistólica ventricular y episodios de angina refractaria. La hipertrofia ventricular puede estar mediada por mecanismos asociados a la aldosterona69 y, ante igualdad de cifras tensionales, puede ser más grave en la HTA vascular renal que en la esencial.
Diagnóstico
El perfil del paciente con EAR por aterosclerosis es el de un varón de edad avanzada con empeoramiento de una HTA previa, en el contexto de un episodio vascular intercurrente70. La presencia de EAR no es sinónimo de enfermedad vascular renal. Por ello, la identificación de rasgos clínicos indicativos es importante para una planificación diagnóstica y una actitud terapéutica correctas.
La edad de presentación de la HTA después de los 55 años es típica del paciente aterosclerótico, a diferencia de la HTA en menores de 30 años, generalmente mujeres, característica de la DFM. Clínicamente, son indicativos del origen vascular renal, el empeoramiento súbito y persistente de una HTA conocida, y el carácter refractario al tratamiento con 3 o más fármacos hipotensores, uno de ellos un diurético. También son indicativos de un origen vascular renal la HTA maligna con evidencia de daño orgánico como fracaso renal agudo, la descompensación aguda de una insuficiencia cardiaca congestiva crónica, la aparición de un nuevo trastorno neurológico o visual y/o retinopatía avanzada (grado III/IV), y la presencia de antecedentes de aterosclerosis en otras localizaciones70.
En la HTA vascular renal se ha descrito, durante el control de la presión arterial (PA), una labilidad de la PA secundaria al aumento de la actividad simpática a modo de ausencia de descenso nocturno y los episodios de flushing e inestabilidad autonómica, también indicativos de feocromocitoma71.
La insuficiencia renal de origen isquémico se sospechará en aquellos casos de insuficiencia renal de novo o empeoramiento de la función renal tras la admini stración de inhibidores de la enzima de conversión de la angiotensina (IECA) o antagonistas de los receptores de angiotensina II (ARA-II). También son sospechosos el hallazgo de atrofia renal no explicada o una diferencia del diámetro polar de más de 1,5 cm asociada con el deterioro de la función renal o en los casos de insuficiencia renal no explicada, incluidos los que reciben tratamiento sustitutivo (hemodiálisis o trasplante).
En relación con las manifestaciones cardiológicas, se conoce que la prevalencia de enfermedad vascular renal se ha observado en hasta el 30% de los ingresos por cuadros circulatorios congestivos recidivantes o con episodios de angina refractaria72, cuya presentación remite tras la revascularización renal73. Por ello, la identificación de una EAR mediante la realización de arteriografía o una eco-Doppler renal puede estar justificada durante la exploración de pacientes con afectación coronaria multivaso, o en asociación con una arteriopatía periférica74.
La búsqueda de una EAR está justificada cuando a una sospecha razonable se le añade un beneficio potencial en el tratamiento de la PA, la función renal o el estatus cardiovascular. El diagnóstico de la enfermedad vascular renal se basa en una correcta selección clínica de los pacientes, la identificación de la estenosis y las pruebas funcionales.
Arteriografía renal
La prueba de referencia para el diagnóstico de EAR es la arteriografía. Debido a su carácter invasivo, no puede emplearse como técnica de rastreo. El tratamiento de lesiones de diagnóstico incidental es aún controvertido74,75, por lo que la realización de estudio renal durante la aortografía queda a criterio del explorador. La morbimortalidad asociada con la manipulación y la administración de contraste es baja. La incidencia de insuficiencia renal aguda inducida por contraste en individuos con función renal normal no diabéticos es menor del 3%, en diabéticos con función renal normal del 5-10%, en pacientes con insuficiencia renal aumenta a un 10-20% y se alcanza el 20-50% en los pacientes con ambos factores de riesgo76,77. En la actualidad no hay una estrategia única eficaz para la prevención de la nefropatía por contraste en pacientes con factores de riesgo, para la cual se han propuesto el empleo de contrastes no iónicos, la hidratación, la N-acetilcisteína oral o la hemofiltración.
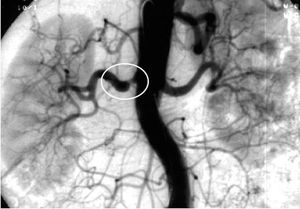
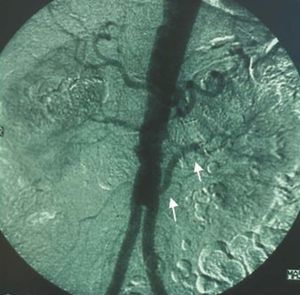
Por ello, la arteriografía está indicada en aquellos casos en los que los estudios no invasivos son equívocos o en los que hay una alta sospecha clínica y deba hacerse un estudio angiográfico concomitante (fig. 4).
Fig. 4. Angiografía de arterias renales. Obsérvese la estenosis marcada en la renal izquierda (círculo blanco) con una ligera dilatación postestenótica.
Eco-Doppler renal
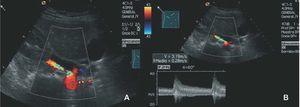
La eco-Doppler cuenta con una sensibilidad de hasta el 96% y con una especificidad de hasta el 98%78. Aunque no ofrece una valoración funcional directa, proporciona información hemodinámica y ecográfica de la arteria renal, el estado del parénquima y la anatomía renal, potenciada con el empleo de contrastes ecográficos79 (fig. 5), a diferencia de la arteriografía. Aunque algunos la proponen como estudio de elección, éste es un examen dependiente del explorador que puede no ser practicable hasta en un 20% de los pacientes seleccionados61.
Fig. 5. A: imagen de eco-Doppler color de la misma estenosis de la figura 4. B: aumento de las velocidades Doppler en la zona de estenosis.
La valoración del parénquima renal puede realizarse indirectamente en el estudio hemodinámico mediante la determinación del índice de resistencia (IR), que es indicativo de enfermedad de pequeño vaso y fibrosis de parénquima para valores > 0,80. Se postula que estos valores se asocian específicamente con un deterioro de la función renal o muerte, con unos valores de sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo del 64, el 98, el 92 y el 91%, respectivamente, frente al 88, el 91, el 73 y el 97% en la proteinuria > 1 g/día, y el 83, el 96, el 86 y el 95% en aclaramientos de creatinina < 40 ml/min80. Asimismo, se ha implicado al IR como factor predictivo de la respuesta posrevascularización en la EAR. En un estudio de 138 pacientes en los que se realizó una angioplastia transluminal percutánea (ATP) por EAR se identificó a 35 con IR > 0,80 en los que la revascularización no se acompañó de mejoría funcional y tensional, ni de la supervivencia del riñón afectado, por lo que este índice se consideró con valor predictivo para predecir el fracaso de la técnica81.
Tomografía computarizada y resonancia magnética con contraste
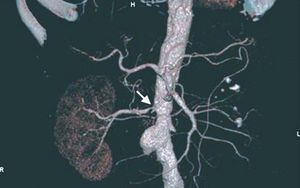
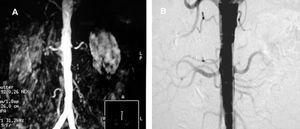
La TC con contraste y multicorte (angio-TC) y la resonancia magnética con contraste (angio-RM) valoran la afectación aórtica, la bilateralidad de las lesiones y la presencia de vasos accesorios, que son inadvertidos en el estudio ecográfico y, por supuesto, en los estudios funcionales. El tamaño renal, la anatomía renal y sus variantes (p. ej., riñón en herradura) o la estimación de la filtración pueden valorarse mediante ambas técnicas (fig. 6). El grosor cortical obtenido por TC tiene un valor en la estimación del daño parenquimatoso82. La sensibilidad y la especificidad para la angio-TC son del 92 y el 99%, respectivamente83. El empleo de radiación ionizante y de contraste iodado son sus limitaciones más importantes para utilizarla como test de rastreo, especialmente en el caso de pacientes con deterioro funcional. La angio-RM muestra unos valores semejantes de sensibilidad y especificidad, que oscilan entre el 90-100 y el 76-94%, respectivamente. A diferencia de la angio-TC, no se utilizan radiaciones ionizantes y el gadolinio empleado como contraste es menos nefrotóxico. Sin embargo, hay limitaciones para las estenosis intra-stent o las lesiones no ostiales, como las fibrodisplásicas; asimismo, tiene tendencia a la sobrevaloración de las lesiones y no informa acerca del componente cálcico de éstas84 (fig. 7).
Fig. 6. Angiotomografía computarizada de paciente con aterosclerosis difusa de los ejes iliacos, aneurisma de aorta abdominal, oclusión de la arteria renal izquierda y estenosis intensa de la arteria renal derecha (flecha).
Fig. 7. A: visualización de estenosis crítica de la arteria renal izquierda mediante angiorresonancia magnética. B: comprobación de falso positivo mediante angiografía digital.
Estudio funcional: renograma con isótopos radiactivos
Los estudios funcionales en la EAR presentan limitaciones en el diagnóstico y el pronóstico que limitan su uso como técnicas de rastreo. Cuando el tratamiento de la EAR representa a priori un beneficio inmediato esperable, como en las HTA severas con presentación en forma de edema pulmonar, estos estudios pueden obviarse61.
El renograma con isótopos radiactivos con captopril aporta información del tamaño, la perfusión y la capacidad excretora renales. Un retraso en la actividad máxima, la asimetría en la actividad pico en cada riñón, la retención cortical aumentada de marcador o la reducción de la filtración glomerular del riñón ipsolateral tras la administración de captopril son indicativos de EAR85. El valor diagnóstico es variable, con una sensibilidad del 85% (45-94%) y una especificidad del 93% (81-100%), que disminuye al 74 y al 59%, respectivamente, comparado con angiografía70. Sin embargo, en hipertensos sin EAR puede observarse asimetría en los trazados con isótopos radiactivos por enfermedad parenquimatosa, la lateralización puede no ser evidente en la estenosis bilateral o puede haber dificultad en la identificación de EAR en el riñón único86.
Medición de la renina plasmática
La estimulación del riñón enfermo con el uso de un diurético o, más comúnmente, un vasodilatador (captopril) se sucede de la elevación de la actividad de la renina sérica87.
La determinación de la renina plasmática mediante el test de captopril cuenta con una sensibilidad del 61% y una especificidad del 86% en la detección de la enfermedad vascular renal. Sin embargo, es recomendable la retirada de tratamiento hipotensor 2 semanas antes de la exploración, por lo que se puede dificultar el tratamiento de pacientes hipertensos, en los que puede emplearse antagonistas del calcio o bloqueadores alfa-1-adrenérgicos70,87.
La cateterización selectiva de la vena renal puede contrarrestar la limitación del test anterior en la identificación del lado enfermo. La lateralización del test se asocia con un pronóstico favorable de respuesta tensional a la revascularización en el 90%, mientras que cuando ésta no está presente, el valor pronóstico es mínimo (50%)61. Sin embargo, en el caso de oclusión de la arteria renal este test puede resultar útil en la identificación de un riñón presor que precise nefrectomía88. La invasividad del estudio y la necesaria suspensión del tratamiento hipotensor pueden limitar su práctica.
En general, las pruebas funcionales no permiten obtener un pronóstico de curación al no poder cuantificar la importancia de las lesiones renales parenquimatosas ni las interferencias de la HTA no vascular renal o el deterioro de la función renal previa.
Pronóstico
El comportamiento de la EAR evoluciona hacia la progresión de la estenosis y el deterioro de la función renal. Caps et al89 identificaron un empeoramiento de la estenosis del 35% a los 3 años y del 51% a los 5 años tras un seguimiento ecográfico semestral de 170 pacientes (295 riñones), con 9 (3,1%) casos de oclusión. El análisis multivariable identificó diabetes mellitus, HTA y estenosis severas como factores independientes de progresión36. Otros autores sitúan el riesgo de oclusión en hasta el 39% en lesiones > 75%90.
La EAR se ha relacionado con la insuficiencia renal terminal (IRT) en un 15% de los pacientes mayores de 50 años en hemodiálisis91. Sin embargo, el porcentaje de pacientes con EAR con deterioro funcional irreversible es cuantitativamente menor. En una serie de pacientes con 164 estenosis > 50%, la IRT se identificó como causa de muerte en un 5% de casos de 44 pacientes fallecidos tras 7 años de seguimiento, mientras que en un 75%, la causa de ésta fue un evento cardiovascular92. Esto muestra la importancia de la EAR como factor predictivo de mortalidad cardiovascular93,94. En un análisis de 3.987 coronariografías, la supervivencia a 4 años estudiada en relación con la estenosis de la AR para estenosis < 75% fue del 89%, mientras para estenosis mayores lo fue del 57% (en unilaterales del 59% y en bilaterales del 47%)93. En una serie de 258 EAR revascularizadas con stent, el deterioro en el filtrado glomerular, presente en un 84,5% previamente a la revascularización, se identificó como factor independiente de morbimortalidad cardiovascular94.
Tratamiento
Tratamiento médico
El tratamiento conservador de la EAR es el de la aterosclerosis. La suspensión del tabaco y las terapias hipotensora e hipolipemiante, pueden limitar la evolución de la aterosclerosis renal.
Los IECA, los ARA-II y los antagonistas del calcio están indicados en el tratamiento de la EAR unilateral. Los bloqueadores beta también se han mostrado efectivos en el tratamiento de la HTA asociada con EAR70.
La interferencia de los IECA en el sistema renina-angiotensina-aldosterona regula el tono vascular y el balance hidrosalino causantes de hipertensión, a la vez que tiene un efecto beneficioso sobre la proteinuria (diabética y no diabética), la hipertrofia del ventrículo izquierdo y el fallo congestivo. El empleo de IECA mejora la supervivencia de los pacientes con HTA vascular renal95. Sin embargo, en estenosis bilaterales y en pacientes con un único riñón, el tratamiento con IECA puede estar relacionado con el deterioro de la función renal, con una incidencia del 6% durante el primer año de tratamiento, que es reversible en alrededor del 90% de los casos96. Este efecto puede ser secundario al descenso del filtrado glomerular producido por los IECA y los ARA-II, a estados intercurrentes de depleción de volumen o al empleo de vasodilatadores. Por ello, el uso de vasodilatadores y diuréticos, así como el tratamiento de volumen en los pacientes tratados con IECA, deben ser cuidadoso, al igual que la suspensión de los IECA ante el aumento de las cifras de creatinina de más de un 20% o de 0,5 mg/dl, el descenso del filtrado glomerular de más de un 30% o la detección de atrofia renal61.
Indicaciones para la revascularización (tabla 3)
La revascularización de la estenosis aterosclerótica de la arteria renal esta dirigida al control de la HTA, la preservación de la función renal y el tratamiento del impacto hemodinámico de la expansión de volumen. En estenosis asintomáticas, el beneficio de la revascularización no está bien establecido en lesiones unilaterales. Aunque la curación de la HTA es rara, puede conseguirse la mejoría de las cifras tensionales y/o la reducción de los requerimientos farmacológicos. En la DFM, el control de la PA es la indicación principal, consiguiéndose en más del 90% de los casos. La función renal puede mejorar o estabilizarse, especialmente en los casos de elevación reciente de la creatinina plasmática, disminución del filtrado glomerular en el contexto de un tratamiento con IECA o ARA-II y la preservación del flujo diastólico renal (índice de resistencia bajo). Contrariamente, la presencia de proteinuria > 1 g/24 h, atrofia renal, lesión de parénquima y enfermedad arteriolar, así como la potencial ateroembolización secundaria al procedimiento endoluminal, se han relacionado con fracaso de la técnica. La reducción de la producción de renina disminuye la de angiotensina y aldosterona, lo que mejora la vasoconstricción y la expansión de volumen y restaura la sensibilidad a diuréticos. La mejoría funcional posrevascularización es notable con la insuficiencia cardiaca congestiva y la EAR97,98 (tabla 4).
La combinación de factores analíticos, histológicos, hemodinámicos y morfológicos puede ayudar a determinar la evolución posrevascularización99.
Técnicas percutáneas
A pesar de que las series de revascularización percutáneas son numerosas, no se conocen estudios aleatorizados que constaten la superioridad de la revascularización percutánea respecto al tratamiento médico en pacientes no seleccionados. El metaanálisis realizado por Nordmann y Logan100 con 210 pacientes pertenecientes a 3 estudios aleatorizados mostró una débil tendencia a disminuir PA, especialmente en los casos de HTA refractaria y EAR bilateral, y de los requerimientos farmacológicos en pacientes tratados percutáneamente. Sin embargo, no pudo demostrarse una superioridad de la angioplastia respecto los casos en los que el tratamiento hipotensor era efectivo, ni se observaron cambios en la función renal. Otros autores han descrito que el deterioro previo de la función renal se relaciona con la ausencia de cambio neto en el filtrado glomerular y la función renal posrevascularización61.
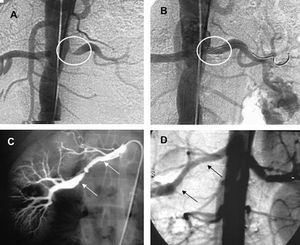
La revascularización percutánea es la técnica de elección en de la EAR por DFM, con el uso de stent para el tratamiento de dilataciones subóptimas (fig. 8). La reestenosis es menor que en la aterosclerosis, descrita en un 8% en una serie de 85 casos tras 15 meses de seguimiento medio101. En la aterosclerosis, la localización de las lesiones es mayoritariamente ostial, con mayor retroceso elástico. El empleo de stent proporciona un éxito operativo mayor, que puede alcanzar el 98%, y las reestenosis son menos frecuentes que en la angioplastia simple (el 17 frente al 26%, respectivamente)102.
Fig. 8. Tratamiento percutáneo de estenosis renal (A) con angioplastia y stent expandible con balón (B) y de una fibrodisplasia (C) mediante angioplastia simple con balón (D).
Van de Ven et al103 trataron de modo aleatorio a 85 pacientes con angioplastia con o sin stent. Aunque la tasa de complicaciones fue semejante y la permeabilidad primaria a los 6 meses era mayor en pacientes que recibieron un stent (el 75 frente al 29%, respectivamente), no había diferencias entre ambos grupos respecto al control de la PA y la función renal103.
Aunque la tasa de complicaciones es baja, pueden presentarse sangrado, lesión vascular, embolización local con infarto segmentario, ateroembolismo sistémico, disección aórtica y renal, migración del stent y trombosis, y comprometer la viabilidad renal104. En la actualidad, el papel de los sistemas de protección antiembólica está aún en desarrollo, empleándose sistemas de protección no específicos para la arteria renal.
Tratamiento quirúrgico
El tratamiento quirúrgico está indicado en la reparación concomitante de la aorta por enfermedad oclusiva aortoiliaca o aneurismática, la anatomía adversa o la afectación de las arterias renales complejas (aneurismas, arterias polares, lesión de arterias segmentarias), el fracaso de la revascularización percutánea o la imposibilidad del tratamiento percutáneo de la reestenosis. La revascularización puede realizarse mediante endarterectomía (renal o transaórtica), derivación anatómica aortorrenal o extranatómica (hepatorrenal, esplenorrenal), reimplantación, autotrasplante o la cirugía ex vivo para la reparación de arterias segmentarias. En caso de riñón presor con hipersecreción de renina, puede ser necesaria la nefrectomía. La mortalidad del tratamiento quirúrgico está influida por las comorbilidades asociadas con la aterosclerosis, así como con la complejidad de la reconstrucción, y es mayor en cirugía aortorrenal combinada (fig. 9). Hansen y Dean105 distinguieron una mortalidad operatoria del 5,3% en pacientes con cirugía combinada, respecto al 1,7 y al 0,7% en procedimientos limitados a la arteria renal y la aorta, respectivamente. Weibull et al106 aleatorizaron a 58 pacientes a tratamiento quirúrgico o percutáneo, con resultados de supervivencia y control tensional equivalentes. En nuestro medio, el progresivo abandono de la cirugía de revascularización renal en beneficio de los procedimientos percutáneos ha conducido a que la revascularización quirúrgica se practique en un número cada vez menor de centros.
Fig. 9. Ejemplo de derivación aortorrenal izquierda (flechas) en el contexto de una revascularización aortobiferomal por síndrome de Leriche.
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: Dr. V. Riambau.
Cirugía Vascular. Hospital Clínic.
Villarroel, 170. 08036 Barcelona. España.