Palabras clave
INTRODUCCIÓN
La coagulación sanguínea es un proceso en cascada en el que, mediante la activación consecutiva y amplificada de diversos factores enzimáticos, se produce la activación de la trombina. La trombina, por una parte, cataliza la conversión del fibrinógeno en fibrina y, por otra, activa las plaquetas. En la figura 1 se muestra la naturaleza en cascada de este proceso y las dianas terapéuticas actualmente disponibles para interrumpirlo. Esta revisión se centrará específicamente en la importancia de las antitrombinas orales por su capacidad para interrumpir la etapa final de la cascada de la coagulación, haciendo especial hincapié en el hecho de que la trombina se activa antes que las plaquetas, y en las bases moleculares de las antitrombinas orales.
Fig. 1. Representación de la cascada de la coagulación con los factores implicados susceptibles de ser bloqueados por los fármacos anticoagulantes actualmente disponibles. A/C: anticoagulantes; AT III: antitrombina; HBPM: heparinas de bajo peso molecular; TF: factor tisular; TFPI: inhibidor de la vía del factor tisular; rFVIIai: inhibidor del factor VII activado recombinante.
El factor tisular parece ser un elemento clave mediador de la trombogenicidad de una placa ateromatosa. Hace aproximadamente 5 años, en un estudio de Badimon et al1, investigamos el papel que podía desempeñar este factor tisular sobre la trombogenicidad de placas ateromatosas humanas y las posibilidades terapéuticas que podía ofrecer su inhibición específica. Para ello, utilizamos la cámara de perfusión ex vivo de Badimon y pusimos en contacto con sangre heparinizada segmentos arteriales humanos normales, por una parte y, por otra, segmentos arteriales humanos ateroscleróticos. La inhibición específica del factor tisular tuvo un efecto antitrombótico directo, que se pudo cuantificar como una reducción en el depósito de plaquetas marcadas radiactivamente y de fibrinógeno, y se pudo corroborar por análisis inmunohistoquímicos de las arterias perfundidas. El hallazgo más significativo de este estudio fue que las placas ateromatosas ricas en lípidos eran mucho más trombogénicas que las placas con menor desarrollo aterosclerótico, y presentaban depósitos de fibrina. Estamos familiarizados con el concepto de que la rotura de una placa y la subsiguiente formación de un trombo conducen a un síndrome coronario agudo y a la progresión de la enfermedad aterosclerótica. Sin embargo, a menudo se piensa que el primer factor implicado en la activación de la cascada de la coagulación en un síndrome coronario agudo son las plaquetas, y no hay que olvidar que es la trombina la que activa primero al fibrinógeno para dar lugar a la fibrina, y después activa las plaquetas. El estudio que acabo de mencionar demuestra la importancia de los depósitos de fibrina en el desarrollo de la trombosis coronaria aguda. Debido a que la activación plaquetaria es secundaria a la activación de la trombina, el bloqueo de la activación de la trombina tiene unas consecuencias directas sobre este fenómeno.
Dependiendo de la naturaleza molecular de la interacción entre la trombina y sus inhibidores, existen 2 enfoques terapéuticos posibles: los fármacos que actúan como inhibidores indirectos de la trombina y que requieren la presencia de la antitrombina III para poder ejercer su acción, y los fármacos que actúan como inhibidores directos de la trombina (fig. 2). Dentro del primer grupo se encuentran la heparina y el pentasacárido. Entre los inhibidores directos de la trombina disponemos de fármacos que se deben administrar por vía parenteral, como la hirudina y el hirulog y, más recientemente, de fármacos que se administran por vía oral, como el ximelagatrán. El mecanismo de acción de las antitrombinas directas que se administran por vía parenteral u oral no es el mismo. Mientras que las antitrombinas directas parenterales bloquean la parte activa de la trombina y también otras partes de la molécula que no están implicadas en su actividad trombótica, las antitrombinas directas orales se unen únicamente a la parte activa de la trombina, lo que las convierte en fármacos extraordinariamente específicos. Las características moleculares implicadas en el mecanismo de acción de estos fármacos se esquematizan en la figura 3. Estas diferencias en la interacción molecular entre las antitrombinas parenterales y las orales con su receptor están en la base de su gran especificidad.
Fig. 2. Esquema de las bases moleculares de las 2 aproximaciones terapéuticas para inhibir la trombina. Mientras que la heparina y el pentasacárido pertenecen a la categoría de los inhibidores indirectos de la trombina (porque requieren la presencia de la antitrombina III para ejercer su acción inhibitoria), la hirudina, el hirulog y el ximelagatrán son inhibidores directos que no requieren factores coadyuvantes. (Tomada de Corti et al, en prensa.)
Fig. 3. Representación esquemática de la interacción molecular de las antitrombinas directas parenterales (hirudina e hirulog) y las orales (melagatrán) con su receptor. Aunque todas las antitrombinas directas son capaces de interaccionar con su receptor (trombina) sin ayuda de ninguna molécula coadyuvante, sólo las antitrombinas directas que se administran por vía oral pueden ligarse específicamente al lugar activo de la trombina sin interaccionar con otras partes de la molécula. (Adaptada de Lefkovits J, Topol EJ. Direct thrombin inhibitors in cardiovascular medicine Circulation 1994;90:1522-36.)
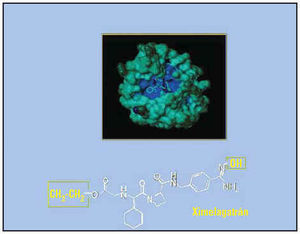
Las diferencias farmacodinámicas entre las antitrombinas directas parenterales y las orales también son significativas. Así, por ejemplo, la vida media de la antitrombina oral ximelagatrán es de 4-5 h, mucho más larga que la de la hirudina u otras antitrombinas directas parenterales. Teniendo en cuenta que su potencia antitrombótica es comparable, las ventajas del ximelagatrán son incuestionables. En un estudio de Sarich et al2 se investigaron los efectos antitrombóticos del ximelagatrán y los de la hirudina en voluntarios sanos aleatorizados para recibir uno de los 2 tratamientos farmacológicos. Los efectos antitrombóticos se analizaron a las 2 y a las 5 h después de la administración de los fármacos, como cambios en el área total del trombo y en el área total de la fibrina, utilizando la cámara de perfusión de Badimon. Los resultados de este estudio demostraron que el efecto antitrombótico de una dosis de 40-80 mg de ximelagatrán fue similar al de la hirudina, un fármaco que ha demostrado ser clínicamente efectivo en los síndromes coronarios agudos. Además, la cámara de trombosis ex vivo permitió demostrar en el laboratorio que tras 5 h de interrupción del tratamiento con hirudina se favorece la aparición de una fase trombogénica, mientras que el ximelagatrán puede permanecer en sangre hasta 12-15 h2. Así pues, numerosas evidencias experimentales sugieren que el ximelagatrán puede convertirse en una buena opción farmacológica para inhibir la trombina, aunque su utilización con fines terapéuticos está pendiente de aprobación. En la figura 4 se muestra su estructura química y una representación tridimensional de su interacción con la molécula de trombina.
Fig. 4. Imagen tridimensional de la interacción entre una antitrombina directa oral con su receptor, la trombina. Las antitrombinas directas orales son capaces de ligarse de manera altamente específica a la parte activa de la molécula de trombina, sin interaccionar con otras partes de la molécula. En la parte inferior de la imagen se muestra la estructura química del ximelagatrán, antes de ser biotransformado en su forma activa, el melagatrán
Ventajas de los inhibidores orales de la trombina
Debido a sus características moleculares, las antitrombinas orales se perfilan como unos fármacos especialmente interesantes para su aplicación en diversos contextos clínicos. Como actúan directamente sobre el receptor de la trombina, no tienen interacciones con otros fármacos. El ximelagatrán se absorbe rápidamente y es biotransformado en su forma activa, el melagatrán. Se excreta por vía renal. Su gran especificidad hace que sea un fármaco seguro, que no requiere monitorización de la coagulación y que presenta una tasa muy baja de interacciones con la dieta, el alcohol u otros medicamentos. Los estudios clínicos están demostrando su alta eficacia y una respuesta predecible a dosis fijas.
Se han realizado diversos estudios clínicos para probar la eficacia y seguridad del ximelagatrán. El estudio sueco METHRO II ha comparado el ximelagatrán (administrando primero melagatrán por vía subcutánea y después ximelagatrán por vía oral) con una heparina de bajo peso molecular, la dalteparina, en la profilaxis de la cirugía ortopédica. Los resultados de este estudio han demostrado que una dosis de ximelagatrán de 24 mg 2 veces al día es más eficaz que la heparina de bajo peso molecular para reducir la incidencia de trombosis venosa y embolia pulmonar3.
El tratamiento con ximelagatrán no sólo resulta de una eficacia terapéutica mayor en su acción antitrombótica sino que, como se ha indicado, no precisa monitorización del paciente.
Un estudio muy relacionado con el anterior es el ensayo EXULT A, que ha incluido hospitales de Estados Unidos, Canadá, Israel, México y Brasil, y ha comparado una dosis más alta de ximelagatrán (36 mg, 2 veces al día) con la warfarina en la incidencia de tromboembolia y muerte en la cirugía de rodilla4. De nuevo, el ximelagatrán demostró una mayor eficacia terapéutica que la que presentan los anticoagulantes orales en la prevención de eventos tromboembólicos asociados a la cirugía ortopédica.
El estudio THRIVE se diseñó para comparar los efectos del ximelagatrán (frente a placebo) en pacientes con trombosis venosa que habían recibido anticoagulación oral previa durante 6 meses en la incidencia de episodios tromboembólicos tras la interrupción de la anticoagulación5. Para muchos pacientes con tromboembolia venosa, la prevención secundaria con antagonistas de la vitamina K no puede prolongarse más de 6 meses debido a que el riesgo de hemorragias mayores puede contrarrestar el potencial beneficio de la reducción de recurrencias. El estudio THRIVE es un ensayo multicéntrico, doble ciego, que incluyó a 1.233 pacientes con tromboembolia venosa, aleatorizados a prolongar la terapia anticoagulante con ximelagatrán (24 mg, 2 veces al día) o a recibir placebo, durante otros 18 meses. Antes de iniciar el tratamiento se realizó una ultrasonografía bilateral de las piernas y un estudio de la perfusión pulmonar. Los resultados de este trabajo demostraron una espectacular reducción de la tasa acumulada de tromboembolia venosa recurrente en los pacientes que recibieron tratamiento con ximelagatrán oral frente a los que recibieron placebo. Es importante señalar que se trata de un estudio a largo plazo (18 meses) y que sólo se observó un aumento significativo de las enzimas hepáticas en un 6,4% de los pacientes. Además, este aumento enzimático fue transitorio y revirtió espontáneamente en la mayoría de los casos. Contrariamente a lo esperado, uno de los aspectos más llamativos de la terapia con ximelagatrán en este estudio fue la baja incidencia de hemorragias mayores, que no se diferenció de la que presentaron los pacientes que recibieron placebo (fig. 5).
Fig. 5. Complicaciones mayores (hemorragia y muerte) asociadas al tratamiento con ximelagatrán, según los resultados del estudio THRIVE III. Obsérvese que el tratamiento con la antitrombina oral no produjo un aumento significativo de las hemorragias mayores cuando se comparó con el grupo placebo.
Después de unos resultados tan esperanzadores en estos ensayos iniciales que probaron la eficacia, la dosis terapéutica efectiva y la seguridad de la anticoagulación con ximelagatrán en diversos contextos clínicos, se decidió probar la eficacia de estas antitrombinas orales en el ámbito de la fibrilación auricular y en la profilaxis de los accidentes cerebrovasculares. Con este objetivo se diseñó el estudio SPORTIF III (Stroke Prevention Using an ORal Thrombin Inhibitor in Atrial Fibrillation), que es un estudio abierto e incluye hospitales de 23 países (3.407 pacientes), y el SPORTIF V, un estudio a doble ciego realizado en Estados Unidos y Canadá (3.913 pacientes). En el SPORTIF III, los pacientes con fibrilación auricular no valvular y factores de riesgo de accidente cerebrovascular fueron aleatorizados a recibir dosis ajustadas de warfarina o una dosis fija de ximelagatrán. El tratamiento con ximelagatrán se asoció a un 41% de reducción del riesgo relativo tras 21 meses de tratamiento en la incidencia de embolia sistémica (fig. 6). La incidencia de episodios hemorrágicos mayores no fue diferente en los 2 grupos de tratamiento, aunque el análisis de la variable combinada «hemorragias mayores y menores» demostró que el tratamiento con ximelagatrán era más seguro y se asociaba a una reducción significativa de la tasa anual de estos episodios (fig. 7). En este estudio, el 6,3% de los pacientes que recibieron ximelagatrán presentó una concentración de las transaminasas hepáticas 3 veces superior a los valores normales, frente al 0,8% de los pacientes que recibieron warfarina. No obstante, en la mayoría de los casos esta elevación fue transitoria y solamente tuvo lugar durante los primeros meses de tratamiento (fig. 8).
Fig. 6. Superioridad del tratamiento con ximelagatrán respecto al tratamiento con warfarina en la prevención de accidentes cerebrovasculares y de episodios de embolia sistémica asociados a la fibrilación auricular no valvular, según resultados del estudio SPORTIF III. Tras un seguimiento de 21 meses, la terapia con la antitrombina oral redujo significativamente el riesgo relativo de embolia sistémica.
Fig. 7. Efectos adversos asociados a la terapia con ximelagatrán en comparación con los asociados a la terapia con warfarina en el tratamiento de pacientes con fibrilación auricular no valvular, según resultados del estudio SPORTIF III. El tratamiento con ximelagatrán se asoció a una tasa significativamente menor de la variable combinada «hemorragias mayores y menores» en la incidencia de episodios anuales. HIC: hemorragias intracerebrales.
Fig. 8. Elevación de las transaminasas hepáticas en pacientes tratados con warfarina o ximelagatrán, según resultados del estudio SPORTIF. Aunque el tratamiento con ximelagatrán se asoció a una mayor elevación de las enzimas hepáticas, esta elevación fue transitoria y reversible en la mayoría de los casos, y se produjo solamente durante los primeros meses de tratamiento.
El primer estudio clínico que ha investigado la eficacia de las antitrombinas orales en el tratamiento de la enfermedad arterial es el ensayo ESTEEM. Es bien conocido que el riesgo de episodios isquémicos recurrentes (precoces o tardíos) en un síndrome coronario agudo es alto. El estudio ESTEEM ha investigado la eficacia del ximelagatrán y el ácido acetilsalicílico en la prevención de la muerte, el infarto de miocardio no fatal y la isquemia severa recurrente tras un infarto de miocardio reciente. Se trata de un estudio a doble ciego, multicéntrico y controlado con placebo que incluyó a 1.883 pacientes de diversas nacionalidades que habían tenido un infarto de miocardio con o sin elevación del segmento ST. Dentro de los 14 días siguientes al episodio isquémico agudo, los pacientes fueron aleatorizados a recibir ximelagatrán a diferentes dosis (24 mg, 36 mg, 48 mg o 60 mg), 2 veces al día, o placebo, respectivamente, durante 6 meses. Todos los pacientes recibieron ácido acetilsalicílico diario, a una dosis de 160 mg. La conclusión de este estudio fue que el tratamiento con ximelagatrán tras un infarto de miocardio (con o sin elevación del segmento ST) redujo significativamente la variable combinada de «muerte-infarto de miocardio-isquemia recurrente severa» cuando se comparó con placebo6 (fig. 9). Los episodios de hemorragias mayores fueron raros (1,8%). Este estudio demuestra por primera vez que la inhibición directa de la trombina con ximelagatrán en combinación con ácido acetilsalicílico es más efectiva que el ácido acetilsalicílico solo en la prevención de episodios cardiovasculares mayores durante los 6 meses siguientes al infarto agudo de miocardio. Una vez más, el tratamiento con ximelagatrán se presenta como una opción terapéutica de bajo riesgo y alta eficacia, en este caso en el contexto de la miocardiopatía isquémica.
Fig. 9. Riesgo acumulado de muerte, o de las variables combinadas «muerte-infarto de miocardio no fatal» y «muerte-infarto de miocardio-isquemia severa recurrente», en pacientes que recibieron ximelagatrán tras un infarto agudo de miocardio (con o sin elevación del segmento ST), según resultados del estudio ESTEEM. La terapia con la antitrombina oral se asoció a una reducción en el riesgo acumulativo de las variables de estudio. (Tomada de Wallentin et al6.) IM: infarto de miocardio; IRS: isquemia recurrente severa.
Perspectivas de futuro
Tanto por sus interesantes características moleculares como por los prometedores resultados obtenidos en diversos ensayos clínicos que han evaluado su eficacia y seguridad, las antitrombinas orales tienen un gran futuro en el tratamiento de los síndromes coronarios agudos. En mi opinión, los pacientes con angina inestable o con infarto agudo de miocardio sin elevación del segmento ST se beneficiarán en un futuro próximo del tratamiento con antitrombinas orales, que sustituirán incluso a las heparinas de bajo peso molecular.
Una situación clínica más compleja se produce en los pacientes con infarto de miocardio que presentan elevación del segmento ST. En estos casos, la terapia antitrombótica coadyuvante tiene 3 fases críticas:
1. El tratamiento con fibrinolíticos (en estos momentos se está comparando la eficacia de la heparina no fraccionada con la de la enoxaparina o heparina de bajo peso molecular).
2. La angioplastia, que se beneficia del tratamiento concomitante con fármacos antagonistas de los receptores IIb/IIIa.
3. El tratamiento antitrombótico de mantenimiento.
Las ventajas de la terapia con antitrombinas orales permiten predecir que su uso se extenderá en la combinación inicial de fibrinolíticos para sustituir a los fármacos anti-IIb/IIIa. También serán muy útiles en el tratamiento antitrombótico de mantenimiento. La principal ventaja de estos cambios será la reducción de las hemorragias, tanto extracraneales como cerebrales, particularmente frecuentes a partir de los 70 años y que representan el principal riesgo asociado al tratamiento7. No está tan clara, sin embargo, la eficacia de las antitrombinas orales durante la angioplastia, en la que la medicación anti-IIb/IIIa sigue siendo una buena opción. Por otra parte, aunque las antitrombinas orales no vayan a modificar el pronóstico de los pacientes que reciben tratamiento conservador con fibrinolíticos, sí pueden desempeñar un papel importante en la reducción de las hemorragias asociadas a este tratamiento.
Finalmente, la terapia con antitrombinas orales también tiene un futuro prometedor en el tratamiento de los llamados síndromes crónicos equivalentes a los síndromes coronarios, como la enfermedad vascular periférica, la enfermedad cerebrovascular, el aneurisma de la aorta o la diabetes. Se trata de enfermedades con un riesgo equivalente al de un síndrome coronario y los pacientes que las padecen pueden beneficiarse de la terapia con antitrombinas orales que, por su respuesta rápida tras la administración, y por la baja incidencia de efectos adversos asociados a la medicación, se perfilan como los fármacos de elección en el tratamiento de estas entidades patológicas.
Correspondencia: Dr. V. Fuster.
Mount Sinai Medical Center. 1 Gustave L. Levy Place. Box 1030.
New York, NY 10029-6574. USA.