Palabras clave
INTRODUCCIÓN
El tabaquismo causa un 11% de toda la mortalidad cardiovascular1, mientras que estudios recientes indican que en España la incidencia de enfermedad cardiovascular atribuible al tabaquismo en varones es de aproximadamente un 40%2. El consumo de tabaco incrementa de manera independiente el riesgo de enfermedad aterosclerótica coronaria, cerebrovascular y periférica3, que se extiende al fumador pasivo4. Sin embargo, la patogenia de la enfermedad cardiovascular asociada con el tabaquismo no se conoce con precisión, y se la ha relacionado con la disfunción endotelial, alteraciones del balance entre coagulación y fibrinolisis y modificaciones del metabolismo lipídico5,6, manifestaciones en las que la inflamación vascular y el estrés oxidativo tendrían un papel central7.
Estudios recientes indican que una alteración del balance entre síntesis y degradación de la matriz extracelular (MEC) también podría contribuir al desarrollo de la enfermedad cardiovascular asociada al tabaquismo8.
Las metaloproteinasas (MMP), una familia de endopeptidasas que degrada diversos componentes de la MEC, se clasifican en subgrupos basados en su estructura, la especificidad por el sustrato y la unión a membranas: colagenasas (MMP-1, MMP-8, MMP-13), estromalisinas (MMP-3, MMP-10, MMP-11), gelatinasas (MMP-2, MMP-9), tipo membrana (MTMMP) y otras (matrilisina, metaloelastasa, etc.). La actividad de las MMP está regulada dentro y fuera de las células de tres maneras: transcripcional, postraduccional y a través de interacción con inhibidores específicos (TIMP)9.
Las MMP se han implicado en los procesos inflamatorios, angiogénicos y proteinolíticos que acompañan el remodelado y la rotura o erosión de la placa vulnerable también asociados con el tabaquismo8. También se ha relacionado un aumento de diversas MMP con la enfermedad cardiovascular establecida, lo que ha llevado a proponer su uso como biomarcador9-11, y es un hecho conocido que son importantes en el desarrollo de la enfermedad pulmonar obstructiva crónica (EPOC), la segunda causa de mortalidad asociada al tabaquismo12,13.
Estudios recientes de nuestro grupo han demostrado una estrecha relación entre inflamación, aterosclerosis subclínica e incremento de la MMP-10 (estromalisina 2) circulante14,15, una MMP que degrada colágenos tipo III y IV, elastina y proteoglucanos, que también se encuentra aumentada en placas de ateroma de pacientes con aterosclerosis avanzada14.
El objetivo de este trabajo es examinar, en una serie de sujetos asintomáticos, si la MMP-10 se asocia con el tabaquismo independientemente de otros factores de riesgo, en cuyo caso podría ser relevante en el proceso aterogénico a través de sus efectos en la MEC. Para ello se ha cuantificado la concentración circulante de diversas MMP y TIMP-1 en sujetos fumadores y no fumadores sin enfermedad cardiovascular establecida.
MÉTODOS
Se analizó a un grupo de 400 sujetos aparentemente sanos (media de edad [intervalo], 54,3 [20-80] años), principalmente varones, previamente caracterizado15 y con muestras recogidas de forma consecutiva en el periodo 2003-2005, que acudieron para realización de un chequeo general en la consulta externa del Departamento de Medicina Interna de la Clínica Universitaria de Navarra. Los sujetos fueron seleccionados por el médico internista responsable a partir de una población de 414 sujetos sin evidencia de enfermedad cardiovascular sintomática según los siguientes criterios: a) ausencia de historia de enfermedad coronaria, ictus o enfermedad arterial periférica, y b) electrocardiograma y radiografía de tórax normales. La enfermedad coronaria fue definida por: a) antecedente de infarto agudo de miocardio (IAM), angina o uso de nitroglicerina, y b) antecedentes de angioplastia coronaria o cirugía de bypass aortocoronario. La enfermedad cerebrovascular fue definida como antecedente de ictus, ataque isquémico transitorio o endarterectomía carotídea. Se registraron los síntomas de claudicación intermitente y se realizó una adecuada exploración para valorar los pulsos periféricos. Otros criterios de exclusión fueron: alteración importante de la función renal (filtrado glomerular < 60 ml/min), enfermedades inflamatorias crónicas y administración de antiinflamatorios, antitrombóticos o terapia hormonal en las 2 semanas previas. Los sujetos con infección aguda según criterios clínicos también fueron excluidos.
Evaluación del tabaquismo y otros factores de riesgo cardiovascular
Se utilizó un cuestionario estandarizado sobre consumo de tabaco para clasificar a los sujetos en fumadores activos (al menos 1 cigarrillo diario de promedio en el último año), nunca fumadores y ex fumadores (sin consumo de cigarrillos en el último año).
Además, se obtuvo información sobre los otros factores de riesgo aterosclerótico: diabetes mellitus, hipertensión arterial, dislipemia y obesidad. Se consideró hipertensos a los sujetos con presión arterial sistólica (PAS) > 139 mmHg y/o diastólica (PAD) > 89 mmHg y/o que tomaran antihipertensivos. La dislipemia se diagnosticó con valores de colesterol total ≥200 mg/dl, colesterol de las LDL (cLDL) ≥ 130 mg/dl, colesterol de las HDL (cHDL) £ 50 mg/dl, triglicéridos ≥ 150 mg/dl y/o empleo de hipolipemiantes. La obesidad se estimó por el índice de masa corporal (IMC) ≥ 30. La diabetes mellitus se definió con valores de glucosa > 126 mg/dl o el empleo de antidiabéticos.
Se calculó el riesgo vascular total mediante los índices REGICOR16, validado en la población española, y PROCAM17, validado en población alemana.
Se obtuvo el consentimiento informado en todos los sujetos y el estudio fue aprobado por el Comité de Ética de la institución conforme a la Declaración de Helsinki (revisión de octubre de 2000).
Procedimientos
Las muestras de plasma y suero se extrajeron en ayunas (entre las 8.00 y las 10.00) por venopunción, se centrifugaron (20 min, a 1.200 g) y se congelaron a -80 °C hasta su análisis.
Perfil metabólico
Se midió el colesterol total, el cHDL, los triglicéridos y la glucosa por técnicas estándar de laboratorio, en muestras de sangre extraídas en ayunas. El cLDL se estimó con la ecuación de Friedewald.
Marcadores inflamatorios
La actividad del fibrinógeno se midió en plasma con el método de Clauss y las concentraciones de proteína C reactiva ultrasensible (PCR-us) (Immulite Diagnostic Product Corporation, Estados Unidos), interleucina (IL) 6 (Quantikine R&D Systems, Reino Unido) y factor de von Willebrand (FvW) (Asserachrom Diagnostica Stago, Francia) se determinaron mediante ELISA siguiendo las instrucciones del fabricante. Los coeficientes de variación interanalítica e intraanalítica para los ELISA fueron < 6%.
Marcadores proteinolíticos
Se determinaron las concentraciones plasmáticas de MMP-1, MMP-9 y TIMP-1 y la concentración sérica de MMP-10 mediante ELISA (R&D systems, Estados Unidos) siguiendo las instrucciones del fabricante. Los coeficientes de variación interanalítica e intraanalítica para los ELISA fueron < 6%.
Determinación del espesor íntima-media carotídeo(EIMc)
Se midió el EIMc en todos los sujetos mediante ultrasonografía-Doppler de las arterias carótidas comunes (ACC), como se ha descrito previamente15, empleando un transductor lineal de 5-12 MHz (ATL 5000 HDI). El EIM se midió en áreas sin placa a 1 cm del bulbo carotídeo en cada ACC, y dos ecocardiografistas desconocedores de la información clínica determinaron el promedio de cada ACC.
Análisis estadístico
Los datos de las variables cuantitativas se expresan como media ± desviación estándar. Se estudió la normalidad de las variables mediante el test de Kolmogorov-Smirnov. Los valores de PCR-us fueron previamente transformados logarítmicamente para su normalización y ulterior análisis estadístico. Se analizaron las diferencias entre las medias y las proporciones en relación con el sexo y el tabaquismo mediante las pruebas de la t de Student y de la c2 respectivamente, excluyendo del análisis estadístico a los ex fumadores.
Para analizar las correlaciones entre las concentraciones de los marcadores inflamatorios, proteinolíticos y los factores de riesgo cardiovascular se utilizó el coeficiente de correlación de Pearson. Se realizó un análisis de varianza (ANCOVA) ajustando por edad, sexo y factores de riesgo cardiovascular y se calcularon las medias marginales de los fumadores y los no fumadores. Se empleó un análisis multivariable de regresión lineal para comprobar si la asociación de MMP-10 y tabaquismo era independiente de dichos factores de riesgo y la importancia relativa de cada variable independiente. Todas estas variables fueron introducidas mediante el método de pasos sucesivos. El análisis estadístico se realizó con el programa SPSS 11.0, considerando significativos valores de p < 0,05.
RESULTADOS
Se incluyó una muestra no aleatorizada de 400 sujetos sin enfermedad clínica cardiovascular (media [intervalo] de edad, 54,3 [20-80] años; el 78% varones) que acudieron para chequeo general en un único centro. Había una elevada proporción de sujetos con dislipemia (81%), hipertensión arterial (50,7%) y obesidad (32%), con una menor prevalencia de diabetes (16%). Las características clínicas y los factores de riesgo cardiovascular de la población de estudio en general y por sexos se muestran en la tabla 1. El grupo de varones (n = 311) era de menor edad (p < 0,05), con mayor predominio de fumadores y ex fumadores (p < 0,01). Este grupo presentaba una concentración de cHDL significativamente menor, junto con unos valores de triglicéridos y glucosa más elevados (p < 0,01), que las mujeres (n = 89). El grupo de varones presentaba, asimismo, unos valores significativamente mayores del índice de riesgo vascular total REGICOR (p < 0,01), así como del EIMc (p < 0,01).
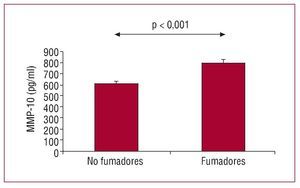
La tabla 2 muestra las diferencias en factores de riesgo cardiovascular, marcadores inflamatorios y proteinolíticos entre el grupo de fumadores activos (n = 118) y nunca fumadores (n = 195). El grupo de fumadores era más joven y predominaban los varones (p < 0,001). Mientras que no se observaron diferencias entre grupos en la prevalencia de otros factores de riesgo cardiovascular ni en la concentración de fibrinógeno, PCR-us, FvW, IL-6, MMP-9 y TIMP-1, los valores de MMP-1 (p < 0,05) y MMP-10 estaban significativamente más elevados (p < 0,001) en el grupo de fumadores, sin diferencias significativas en el EIMc. Se procedió posteriormente a un análisis de las correlaciones observadas para ambas MMP en la población analizada (tabla 3). La MMP-1 se correlacionó con el cLDL (p < 0,01), el colesterol total y el TIMP-1 (p < 0,05), mientras que la MMP-10 mostró correlación significativa con la edad (p < 0,05), el cHDL (p < 0,05), el fibrinógeno (p < 0,01), el EIMc (p < 0,05) y el TIMP-1 (p < 0,01), así como con los índices de riesgo vascular total PROCAM y REGICOR (p < 0,01). Tras ajustar para edad, sexo y los factores de riesgo cardiovascular con significación en el análisis univariable, únicamente se mantuvo la significación estadística para la MMP-10, que estaba más elevada (p < 0,001) en el grupo de fumadores (fig. 1). Finalmente, se realizó un análisis de regresión múltiple en el que se definieron los coeficientes de regresión estandarizados, para valorar la importancia relativa de cada variable asociada de forma independiente con la concentración de MMP-10. Como muestra la tabla 4, las variables que contribuyeron de manera significativa a la variabilidad de las concentraciones de esta MMP fueron la edad (15%; p < 0,01) y, de manera aún más importante, el tabaquismo (28%; p < 0,001).Fig. 1. Concentraciones de MMP-10 en sujetos fumadores y no fumadores sin enfermedad cardiovascular. Se realizó un análisis de covarianza (ANCOVA) ajustando por los factores de riesgo cardiovascular significativos en el análisis univariable.
DISCUSIÓN
En una serie de sujetos asintomáticos desde el punto de vista cardiovascular, la concentración de MMP-10 (estromalisina 2) circulante estaba significativamente elevada en los fumadores respecto a los no fumadores. La asociación entre MMP-10 y tabaquismo fue independiente de otros factores de riesgo tradicionales. De hecho, el tabaquismo fue la variable que contribuyó en mayor medida a explicar la variabilidad en la concentración de MMP-10. Estos resultados indican que la elevación de la MMP-10 puede constituir un factor adicional de riesgo cardiovascular asociado al tabaquismo en sujetos sin enfermedad cardiovascular sintomática, con el interés añadido de que esta molécula es un mediador en los procesos de degradación de la MEC, erosión y rotura relacionados con los síndromes aterotrombóticos8,9. También se observó correlación entre MMP-10 y el riesgo cardiovascular total, estimado mediante los índices PROCAM y REGICOR, pero fue de escasa magnitud, por lo que su significado clínico es incierto. Finalmente, la MMP-10 correlacionó con el EIMc, un marcador de aterosclerosis subclínica, como se ha descrito previamente15. En el análisis multivariable posterior, la edad (15%) y el tabaquismo (28%) fueron las variables que contribuyeron en mayor medida al incremento de la concentración de MMP-10 circulante.
Hemos encontrado, asimismo, una relación entre MMP-1 (colagenasa 1) y el tabaquismo, lo que confirma los datos de estudios previos18-21, pero no respecto a otras MMP o el TIMP-1. En conjunto, los resultados de este estudio indican que una alteración del balance entre síntesis y degradación de la MEC, por incremento de diversas MMP, puede tener un papel importante en la génesis de la alteraciones cardiovasculares asociadas con el consumo de tabaco en sujetos asintomáticos8.
El tabaquismo incrementa de manera independiente el riesgo de enfermedad aterosclerótica coronaria, cerebrovascular y periférica, así como la prevalencia de aneurismas aórticos22,23. La coincidencia de factores tradicionales, como el colesterol o la hipertensión arterial, no explica adecuadamente el incremento del riesgo cardiovascular asociado al tabaquismo24,25. Sin embargo, se ha observado sinergia entre diversas MMP y tabaquismo en relación con la enfermedad cardiovascular26,27. Una excesiva respuesta inflamatoria y oxidativa, mediada por citocinas y factores de transcripción, tipo NF-kB o AP-1, parece ser importante en la sobreexpresión celular de MMP en el contexto del tabaquismo8,28-32. Tampoco se puede descartar que la mayor concentración de MMP-10 sea de origen pulmonar, teniendo en cuenta la estrecha relación entre tabaquismo y EPOC13.
En nuestro estudio, la MMP-10 emerge como una proteinasa particularmente relacionada con el consumo de tabaco. Se trata de una peptidasa liberada por el endotelio en respuesta a estímulos inflamatorios, que puede tener importante participación en el remodelado vascular y la aparición de complicaciones aterotrombóticas9,33. Estudios recientes de nuestro grupo han demostrado un incremento de las concentraciones circulantes en sujetos asintomáticos, con factores de riesgo cardiovascular y aterosclerosis subclínica15, así como en pacientes con enfermedad aterosclerótica establecida14. Es interesante que la MMP-10 también se ha asociado con aneurismas aórticos34. Los resultados de este estudio enfatizan la relevancia de esta MMP en el subgrupo de fumadores, mientras que otros marcadores inflamatorios y de daño endotelial como el fibrinógeno, la IL-6 y el FvW, asociados con aterosclerosis subclínica en sujetos asintomáticos35,36, serían de menor utilidad para la valoración del riesgo cardiovascular relacionado con el tabaquismo. Si bien se observó una correlación de MMP-10 con la edad en la población del estudio, es interesante señalar el aumento observado en el grupo de fumadores, que era precisamente el de menor edad. Estos resultados se confirmaron en el análisis multivariable tras ajustar para esta variable.
Se han propuesto diversos mecanismos para explicar la inducción de MMP por el tabaquismo in vitro e in vivo6,37,38. La exposición in vitro de células endoteliales al humo del tabaco induce la expresión de MMP-1, MMP-8 y MMP-919,32; de forma similar, el humo del tabaco estimula la producción de MMP-1 por fibroblastos humanos21. Asimismo, un incremento del cadmio inhalado con el humo del tabaco podría inducir proteinolisis, como se ha demostrado en la EPOC13, pero también podría participar en la enfermedad cardiovascular, como se ha observado por el aumento tanto en la aorta de sujetos fumadores39 como en la circulación de pacientes con enfermedad arterial periférica40.
A diferencia de otros estudios clínicos en sujetos con enfermedad cardiovascular26,27,29,38, no hemos encontrado diferencias entre fumadores y no fumadores en otras MMP, como MMP-9, ni en TIMP-1, hecho que puede estar en relación con el tipo de muestra analizada y la exclusión de pacientes con aterosclerosis clínica.
El estudio tiene varias limitaciones. El carácter transversal no permite establecer asociaciones etiológicas entre los valores de marcadores proteinolíticos y el riesgo cardiovascular, por lo que son necesarios estudios prospectivos. Dado el escaso número de mujeres incluidas y que no se aleatorizó la muestra, los resultados no se pueden extrapolar a la población general. Finalmente, los valores de algunas MMP experimentan variaciones circadianas que pueden no detectarse en una muestra puntual, si bien todas las extracciones se realizaron en la misma franja horaria41.
CONCLUSIONES
El grupo de sujetos fumadores asintomáticos presentó un aumento de MMP-10 que fue independiente de otros factores tradicionales de riesgo aterosclerótico. La estrecha relación entre consumo de tabaco y MMP-10 y entre ésta y la regulación de la MEC podría indicar un papel clave de esta MMP en el proceso aterosclerótico asociado al tabaquismo.
ABREVIATURAS
EIMc: espesor íntima-media carotídeo.
IL-6: interleucina 6.
MEC: matriz extracelular.
MMP: metaloproteinasa.
MT-MMP: metaloproteinasa de tipo membrana. TIMP: inhibidor tisular de las metaloproteinasas.
Full English text available from: www.revespcardiol.org
Financiado por UTE proyecto CIMA (Universidad de Navarra, Pamplona, Navarra, España) y Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III (RECAVA RD06/0014/0008). Correspondencia: Dr. J.A. Páramo.
Laboratorio de Aterosclerosis. Área de Ciencias Cardiovasculares, CIMA. Avda. Pío XII, 55. 31008 Pamplona. Navarra. España.
Correo electrónico: japaramo@unav.es
Recibido el 20 de febrero de 2008.
Aceptado para su publicación el 29 de agosto de 2008.