Palabras clave
INTRODUCCIÓN
Aunque la utilización de stents farmacológicos para el tratamiento de la estenosis coronaria ha reducido dramáticamente la necesidad de nueva revascularización con relación a los stents metálicos1-3, la reestenosis intra-stent continúa siendo un problema clínico y biológico en vigencia4. Además, su tratamiento es dificultoso, sobre todo cuando se desarrolla en stents farmacológicos, por lo cual una estratificación adecuada es importante para identificar a los pacientes más vulnerables.
En los últimos años varios marcadores bioquímicos han sido cuidadosamente investigados, entre éstos la proteína C reactiva (PCR) de alta sensibilidad, que es actualmente reconocida como un poderoso predictor de eventos cardiovasculares, incluyendo ictus, enfermedad coronaria y vascular periférica y muerte súbita cardiaca5,6.
Estudios histológicos han demostrado que la intervención coronaria percutánea produce una reacción inflamatoria significativa en la pared vascular con elevación local de marcadores bioquímicos, infiltración leucocitaria y crecimiento de tejido neointimal7-10. El concepto de inflamación en la patogenia de la reestenosis ha sido demostrado en varios estudios10,11. En este sentido, se observó una elevación plasmática de la PCR tras el implante de stents, con pico a las 48 h y descenso dentro de las 2 semanas12,13. Sin embargo, existen resultados contradictorios sobre la asociación entre la concentración de PCR con el desarrollo de proliferación neointimal y reestenosis intra-stent14-18. En relación con los nuevos stents farmacológicos, como el stent ZoMaxx™ (Abbott) con liberación de zotarolimus, que recientemente demostró un importante efecto antiproliferativo19,20, la evidencia es escasa y no existen publicaciones que relacionen el valor de PCR con la proliferación intimal tras el implante de este tipo de stents.
El objetivo de este estudio fue evaluar la asociación entre la concentración plasmática de PCR basal y el volumen de hiperplasia neointimal por ecografía intracoronaria (EIC) a los 4 meses de seguimiento en pacientes tratados con implante de un stent liberador de zotarolimus.
MÉTODOS
Se incluyó a los pacientes tratados consecutivamente en nuestro centro con implante de un stent ZoMaxx™, entre febrero y junio de 2005.
Los pacientes presentaban angina estable, inestable o isquemia silente documentada, con estenosis de novo > 50% (por angiografía cuantitativa) en una arteria coronaria nativa, con diámetro del vaso > 2,5 mm y longitud de la lesión < 18 mm. Se excluyó a los pacientes con infarto agudo de miocardio, con fracción de eyección del ventrículo izquierdo < 30% o estenosis del tronco de coronaria izquierda > 50%. También se excluyó a los pacientes con insuficiencia renal (creatinina basal > 1,9 mg/dl), con enfermedad del tejido conectivo o en tratamiento con corticoides.
Se realizó angiografía cuantitativa antes e inmediatamente después del procedimiento y a los 4 meses de seguimiento. El ecografía intracoronaria fue realizado tras la implantación del stent (basal) y a los 4 meses de seguimiento.
Se determinó el valor sérico de PCR (mg/l) ultrasensible inmediatamente antes de la implantación del stent, dentro de la sala de hemodinámica, a través de un acceso venoso periférico previamente obtenido. Para el análisis de la PCR se utilizó el método por sustrato quimioluminiscente (IMMULITE® DPC, Estados Unidos), con un valor de corte de 0,1 mg/l. De acuerdo con el valor de PCR obtenido, se dividió a la población en cuartiles y se compararon los cuatro grupos.
Procedimiento
Todos los stents ZoMaxx™ utilizados medían 3 mm de diámetro y 18 mm de longitud. Este nuevo stent farmacológico utiliza como plataforma el stent TriMaxx™ (Abbott), compuesto por dos láminas de acero inoxidable y una lámina medial de tantalio, con un espesor de las astas de 0,74 µm. El polímero es un compuesto biológico de fosforilcolina, no reabsorbible, con una capa extra superficial que permite la liberación controlada del fármaco dentro de los primeros 30 días19. El fármaco liberado es el zotarolimus, un derivado sintético del sirolimus con propiedad antiinflamatoria y antiproliferativa similar a éste, que demostró recientemente eficacia en la inhibición de la proliferación neointimal en humanos19,20.
Antes de la intervención percutánea, los pacientes recibieron aspirina (200 mg) y dosis de carga de clopidogrel (300 mg) al menos 2 h antes o ticlopidina (500 mg) 48 h antes. Luego del procedimiento se recomendó mantener el uso de aspirina indefinidamente y de clopidogrel (75 mg/día) o ticlopidina (500 mg/día) por lo menos 3 meses.
Todas las intervenciones se realizaron de acuerdo con las guías actuales y las lesiones fueron predilatadas en todos los casos, utilizando un catéter balón de longitud menor o igual que 15 mm.
Se definió éxito del procedimiento a la presencia de estenosis residual < 30% con flujo TIMI (Thrombolysis In Myocardial Infarction) 3 en ausencia de complicaciones mayores intrahospitalarias.
Se realizó seguimiento clínico, con angiografía coronaria y EIC a los 4 meses luego del procedimiento.
Todos los pacientes fueron correctamente informados y aceptaron el protocolo por escrito.
El análisis cuantitativo de la angiografía y del ecografía intracoronaria fue realizado por un operador experimentado, ciego a los resultados y a los valores de PCR.
Angiografía coronaria cuantitativa
Se realizó angiografía cuantitativa antes y después de la implantación del stent y al seguimiento. Para el análisis off-line se utilizó un sistema computarizado con detección automática de contornos (Cardiovascular Mensurances System versión 5.1). Se determinó la pérdida tardía, definida como la diferencia entre el diámetro luminal mínimo (DLM) después de la implantación del stent y el DLM en el seguimiento; la ganancia neta, definida como la diferencia entre el DLM al seguimiento y el DLM antes de la implantación del stent, y la reestenosis binaria, definida como una estenosis de la arteria tratada > 50% en el seguimiento (por angiografía).
ecografía intracoronaria tridimensional
Los procedimientos con ultrasonido se realizaron tras la administración intracoronaria de 0,1-0,2 mg de nitroglicerina. Para la evaluación de los segmentos arteriales se utilizó un transductor de 40 MHz con tracción automática a 0,5 mm por segundo (CVIS and Galaxy 2, Boston Scientific Corporation). Las imágenes obtenidas fueron grabadas en vídeo VHS de alta calidad o en CD/DVD para su análisis off-line.
Las imágenes fueron digitalizadas para el análisis cuantitativo y cualitativo de acuerdo con el American College of Cardiology's Clinical Expert Consensus Document21. Se utilizó un sistema computarizado de detección automática de contornos para la reconstrucción tridimensional de los segmentos evaluados (Echoplaque, Indec Systems, Inc, Mountain View, CA).
Se realizaron mediciones del área de sección transversal cada 0,5 mm incluyendo la membrana elástica externa (vaso), el stent, la luz y la placa (placa más media). Mediante la fórmula de Simpson se calcularon los volúmenes del vaso, del stent, del lumen y de la placa. El volumen de la placa (placa detrás del stent) se definió como «volumen del vaso menos volumen del stent». El volumen de hiperplasia intimal fue calculado como «volumen del stent volumen del lumen». Para eliminar la posible influencia del tamaño del vaso, se calculó el porcentaje de obstrucción del stent, como «volumen de hiperplasia intimal/volumen del stent ƒ 100».
Análisis estadístico
Las variables continuas se muestran como media y desviación estándar. Las variables categóricas se presentan como valores y porcentajes.
Para evaluar las diferencias entre los 4 grupos (cuartiles) se utilizó el test de análisis de la variancia (one-way ANOVA) y el test post-hoc Student-Newman-Keuls cuando ANOVA fue positivo. Las variables categóricas fueron comparadas mediante el test de la χ2 o de Fisher. Se realizaron análisis de correlación (coeficiente de Pearson) y de regresión lineal entre el valor de PCR y el volumen de hiperplasia intimal.
Para evaluar la posible asociación independiente entre las variables basales (clínicas, angiográficas o de EIC) y el volumen de hiperplasia intimal, se construyó un modelo de regresión lineal múltiple. Se especificó un modelo máximo de 8 variables (una por cada 5 casos), seleccionando las variables que en estudios previos fueron relacionadas con la proliferación intimal y reestenosis. Además, el modelo se ajustó por edad y sexo. Las variables fueron: a) diabetes mellitus; b) valor de PCR; c) diámetro de referencia del vaso preimplante; d) presión de liberación del stent; e) diámetro luminal mínimo postimplante; f) estenosis residual postimplante; g) volumen del lumen postimplante, y h) volumen de la placa postimplante. El análisis fue construido partiendo del modelo máximo y por exclusión (backward) de variables. Los diferentes modelos se compararon utilizando el contraste de F parcial.
Para todos los análisis se consideró significativo un valor de p < 0,05 a dos colas y se utilizó el sistema estadístico comercial Statistical Package for Social Sciences (SPSS Inc., versión 13.0).
RESULTADOS
Cuarenta pacientes fueron tratados exitosamente con implante de un stent ZoMaxx™. En 37 pacientes (92,5%) se realizó seguimiento angiográfico y con EIC a los 4 meses.
El valor medio de PCR basal fue 0,67 ± 0,96 mg/l. De acuerdo con el valor obtenido, se dividió a la población en cuartiles, siendo la media de PCR para el primer cuartil (1C) de 0,05 ± 0,03 mg/l, para el segundo cuartil (2C) de 0,23 ± 0,07 mg/l, para el tercer cuartil (3C) de 0,62 ± 0,2 mg/l y para el cuarto cuartil (4C) de 1,8 ± 1,3 mg/l (p < 0,001 entre 1C, 2C y 3C frente a 4C).
No hubo diferencias significativas en las demás características basales entre los grupos, incluyendo la prevalencia de diabetes, el índice de masa corporal, la concentración de colesterol y el tratamiento con estatinas (tabla 1). La media de edad fue 58 ± 8 años, el 55% de los pacientes eran varones, el 40% presentaba diabetes mellitus y el 62% estaba en tratamiento con estatinas.
Todas las lesiones fueron predilatadas, siendo la longitud media del balón utilizado 13,05 ± 2,6 mm y el diámetro medio, 2,5 ± 0,35 mm. La presión media de predilatación fue baja (6,3 ± 2 atm), mientras que la presión media de liberación del stent fue 12,98 ± 3,3 atm.
Los volúmenes basales del vaso, el stent, la placa y el lumen medidos por EIC fueron similares entre los grupos, evidenciándose una tendencia no significativa a mayor volumen en el 4C. A los 4 meses de seguimiento, se observó una diferencia significativa en el volumen del vaso y la placa entre 1C y 2C frente a 4C, debido a una leve disminución en el volumen del vaso y de la placa en 1C y 2C y a un leve aumento en estos volúmenes en 4C (tabla 2). Asimismo, observamos por análisis apareados post-hoc (t de Student para muestras apareadas) que no hubo diferencia significativa tanto en el volumen del vaso como en el volumen de la placa entre posprocedimiento (basal) y seguimiento en cada uno de los cuartiles (para volumen del vaso: 1C: p = 0,06, 2C: p = 0,36, 3C: p = 0,56, 4C: p = 0,65; para volumen de placa: 1C: p = 0,06, 2C: p = 0,65, 3C: p = 0,26, 4C: p = 0,2). En relación con el volumen de la luz, se observó una diferencia significativa en el análisis apareado entre basal y seguimiento en el 3C y 4C (170 ± 42 µl frente a 151 ± 43 µl, p = 0,02 para 3C; 204 ± 77 µl frente a 189 ± 71 µl, p = 0,01 para 4C).
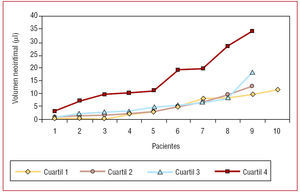
El volumen de hiperplasia intimal fue 4,8 ± 4,2 µl para 1C, 4,9 ± 4 µl para 2C, 5,9 ± 4,3 µl para 3C y 15,8 ± 10 µl para 4C (p < 0,01 entre 1C, 2C y 3C frente a 4C, fig. 1), esta diferencia se mantuvo cuando se comparó el porcentaje de obstrucción del stent, siendo 3,3 ± 3,8%, 3,4 ± 2,9%, 3,7 ± 2,8% y 8,0 ± 4% respectivamente (p < 0,01 entre 1C, 2C y 3C frente a 4C, tabla 2).
Fig. 1. Distribución del volumen de hiperplasia intimal (µl) en los diferentes cuartiles. Se observa diferencia significativa entre el cuartil 4 y los restantes (ANOVA, p = 0,001).
Los resultados de la angiografía cuantitativa antes y después de la implantación del stent fueron similares entre los grupos y tampoco se observaron diferencias significativas cuando se compararon los resultados del seguimiento, como la pérdida tardía intra-stent, el porcentaje de estenosis y la tasa de reestenosis binaria (tabla 3).
En la figura 2 se observa una correlación positiva entre la concentración de PCR y el volumen de hiperplasia intimal (r = 0,64; IC del 95%, 0,40-0,80; p < 0,0001). De la misma manera, como se observa en la figura 3 existió correlación positiva entre el valor de PCR y el porcentaje de obstrucción del stent (r = 0,54; IC del 95%, 0,26-0,73; p = 0,0005).
Fig. 2. Correlación entre proteína C reactiva (PCR) (mg/l) y volumen de hiperplasia intimal (µl). Se observa correlación positiva significativa entre el valor de PCR basal y el volumen de hiper plasia intimal al seguimiento.
Fig. 3. Correlación entre proteína C reactiva (PCR) (mg/l) y la obstrucción del stent (%). Se observa correlación positiva significativa entre el valor de PCR basal y el porcentaje de obstrucción del stent en el seguimiento.
En ambas figuras existe un valor extremo (outlyer) que representa un paciente de 55 años, con el valor basal de PCR más elevado de la serie (5,2 mg/l) que presentó al seguimiento un volumen de hiperplasia neointimal de 34 µl con un porcentaje de obstrucción del stent del 14,2%. Eliminando este valor extremo, la correlación se mantiene estadísticamente significativa, con coeficiente de Pearson de 0,41 (p = 0,027) para PCR y volumen de hiperplasia intimal y de 0,39 (p = 0,03) para PCR y porcentaje de obstrucción del stent.
En relación con los datos de la angiografía cuantitativa, no hubo correlación significativa entre el valor de la PCR basal y la pérdida tardía intra-stent (r = 0,19; p = 0,26).
En el análisis de regresión lineal múltiple, las variables basales asociadas independientemente con el volumen de hiperplasia intimal fueron: el volumen de la luz por EIC tras el implante (ß = 0,06; p = 0,003), la presión de liberación del stent (ß = 0,58; p < 0,02) y el valor de la PCR (ß = 3,9; p = 0,0001). El coeficiente de determinación del modelo ajustado por edad y sexo fue 0,67; p < 0,001 (tabla 4).
TABLA 4.Análisis multivariado de regresión lineal
Aunque no estaba predeterminado en el protocolo, se obtuvo el valor de la PCR a los 4 meses de seguimiento en 23 de los 40 pacientes, siendo el valor medio 0,45 ± 0,62 mg/l, evidenciándose por análisis apareados post-hoc una disminución significativa del valor de la PCR a los 4 meses comparado con el valor basal de estos 23 pacientes (p = 0,01).
DISCUSIÓN
A pesar de la importancia de la PCR como predictor de eventos en la enfermedad coronaria, existen pocos estudios diseñados para evaluar la relación del valor basal de la PCR con la magnitud de la proliferación neointimal intra-stent desarrollada en pacientes tratados con stents farmacoactivos.
De esta manera, realizamos el primer trabajo que relaciona directamente el volumen de hiperplasia neointimal evaluado por ecografía intracoronaria con el valor de la PCR obtenida inmediatamente antes de la implantación de un stent liberador de zotarolimus. Observamos una correlación positiva significativa entre el valor de PCR y el volumen de hiperplasia intimal presente a los 4 meses de seguimiento.
El stent liberador de zotarolimus demostró recientemente resultados satisfactorios a corto y medio plazo20,22,23. Meredith et al22 comunicaron para el stent liberador de zotarolimus Endeavor® (Medtronic) una pérdida tardía intra-stent de 0,33 ± 0,36 mm y un porcentaje de obstrucción evaluado con EIC de 4,5 ± 6,1% a los 4 meses de seguimiento. Estos datos son consistentes con los resultados obtenidos en el presente análisis.
La reestenosis intra-stent es primariamente un proceso de hiperplasia neointimal excesiva que involucra una cascada de eventos, incluyendo infiltración leucocitaria en la pared vascular, migración y proliferación rápida de células de músculo liso9,24. Este proceso se inicia como respuesta a la lesión aguda con rotura de la pared vascular asociada a la intervención percutánea, con progresión rápida dentro de los primeros 4-8 meses luego del procedimiento9.
La PCR es un reactante de fase aguda que en los últimos años ha sido relacionado directamente como marcador de riesgo coronario12,13,25. Estudios recientes documentaron una respuesta inflamatoria sistémica determinada por una elevación de la PCR tras el implante de stents coronarios, tanto metálicos12 como farmacológicos13, con un pico a las 48 h de la implantación del stent y descenso hasta casi los valores basales a las 2 semanas del procedimiento12,13.
Varios estudios recomiendan la aplicación de la PCR como marcador independiente de eventos, incluyendo muerte cardiaca, infarto de miocardio y reestenosis, tras la intervención percutánea en los síndromes coronarios26-32. Sin embargo, los datos que justificarían su utilización como predictor de reestenosis tras el implante de stents coronarios han sido contradictorios33. En este sentido, Angioi et al34 comunicaron un aumento del riesgo de reestenosis angiográfica en los pacientes con elevación de la PCR basal. Walter et al15 demostraron que el aumento de la PCR preprocedimiento se relacionó con la reestenosis angiográfica en pacientes tratados con stents metálicos. Resultados similares fueron observados por Jeong et al35 en 272 pacientes sometidos a angioplastia con balón y por Rahel et al36 en su estudio que incluyó a 600 pacientes. Recientemente, Dibra et al37 demostraron que la magnitud de la diferencia entre el valor de la PCR posprocedimiento y basal se asoció con la reestenosis en pacientes tratados con stents metálicos. De forma coincidente con nuestros resultados, Hong et al18 observaron, en stents metálicos, una correlación positiva entre el valor basal de la PCR y el área de hiperplasia intimal intra-stent a los 6 meses de seguimiento evaluada por ecografía intracoronaria.
En relación con los resultados negativos, el estudio GENERATION38, con 483 pacientes, no encontró asociación entre la PCR y la reestenosis intra-stent, aunque el seguimiento angiográfico fue sólo del 67%. La falta de asociación entre la PCR preprocedimiento y la reestenosis angiográfica fue también comunicada por Horne et al16 en 415 pacientes sometidos a angioplastia con balón, aterectomía o implante de stent, y recientemente por Rittersma et al17 en 345 pacientes tratados con stents metálicos y seguimiento angiográfico en el 100%.
A pesar de estos resultados contradictorios, el probable papel de la PCR en la reestenosis fue demostrado por Ishikawa et al39, quienes observaron una correlación significativa entre la reestenosis tras aterectomía direccional y el grado de inmunorreactividad de la PCR en el tejido intimal extraído. En este sentido, Inoue et al40 reportaron recientemente un aumento la concentración de PCR en el sitio de lesión tras el implante de stents metálicos que se correlacionó con la pérdida tardía.
En el presente análisis observamos que la concentración plasmática de PCR obtenida antes del implante de stents liberador de zotarolimus se relacionó independientemente con la magnitud de la proliferación neointimal a los 4 meses de seguimiento. De esta forma, los pacientes con concentraciones más elevadas de PCR tuvieron mayor cantidad de proliferación neointimal evaluada por EIC.
En el seguimiento, además de existir una diferencia significativa en el volumen de hiperplasia intimal y del porcentaje de obstrucción del stent entre los grupos, se encontró una diferencia significativa en el volumen del vaso y de la placa, entre el 1C y el 2C frente al 4C. Podemos observar, que esta diferencia se debió a una leve disminución del volumen del vaso y de la placa en el 1C y el 2C asociado a un leve aumento en dichos volúmenes en el 4C. Consideramos que la diferencia observada en el volumen del vaso y de la placa entre los grupos al seguimiento puede corresponder a un hallazgo, y debido a la falta de poder de este análisis no podemos atribuir esta diferencia a un comportamiento vascular diferente entre los grupos, ya sea por remodelado del vaso o regresión de la placa. Además, el análisis apareado post-hoc demostró que la diferencia en el volumen del vaso y de la placa entre la medición basal y del seguimiento no fue significativa en ninguno de los cuartiles.
En el análisis de regresión múltiple, el valor de la PCR, el volumen del lumen postimplante y la presión de liberación del stent fueron predictores independientes del volumen de hiperplasia intimal. Consideramos que los pacientes que presentaban un estado inflamatorio más activo al momento del implante del stent, expresado por el valor basal de la PCR, desarrollaron cuantitativamente mayor proliferación neointimal, mientras que la mayor presión de liberación del stent, aunque permitiría alcanzar mayor volumen del lumen, produce mayor daño en la pared arterial y desencadena una respuesta proliferativa más acentuada.
Contrariamente, no hubo relación entre el valor de la PCR y la pérdida tardía intra-stent. En este sentido, si bien existe correlación entre la pérdida tardía intra-stent y el volumen de hiperplasia intimal tanto en stents metálicos como farmacológicos41,42, la EIC genera una imagen tridimensional que evalúa más homogéneamente la proliferación neointimal a lo largo de toda la extensión del stent, permitiendo una medición cuantitativa precisa de la neoíntima, mientras que la angiografía cuantitativa, a través del diámetro luminal mínimo y la pérdida tardía, determina bidimensionalmente el punto más crítico de estenosis, que a los 4 meses de la implantación de un stent farmacológico no es un valor considerable. Es decir que, con relación a esta supuesta contradicción, la EIC sería una herramienta más sensible para la evaluación cuantitativa precoz de la proliferación neointimal luego del implante de stents farmacológicos.
Limitaciones
El tamaño de la muestra analizada constituye la limitación más importante de este análisis y este estudio no tiene el poder suficiente para establecer conclusiones clínicas.
Debido a que el proceso de proliferación intimal se estabiliza entre los 4 y 8 meses, la evaluación a los 4 meses podría enmascarar parte del crecimiento de la neoíntima.
Serán necesarios estudios con mayor número de pacientes y con seguimiento más prolongado para determinar el valor clínico de estos hallazgos.
CONCLUSIONES
En este estudio observamos que el valor de la proteína C reactiva medida inmediatamente antes de la implantación de stents con liberación de zotarolimus es un determinante independiente del volumen de hiperplasia neointimal intra-stent a los 4 meses de seguimiento.
Estos resultados podrían contribuir a mejorar nuestro entendimiento sobre la fisiopatología y la prevención de la proliferación neointimal tras el implante de stent liberador de zotarolimus.
AGRADECIMIENTOS
A los doctores Marcos Franchetti, Guilherme Attizzani, João G. Loures, Edmilson Ishii y Arturo Quispe por la contribución intelectual y técnica.
Véase editorial en págs. 903-6
Correspondencia: Dr. A.A.C. Abizaid.
Av. Dr. Dante Pazzanese 500, Ibirapuera (CEP 04012-909).
São Paulo. Brasil.
Correo electrónico: aabizaid@uol.com.br
Recibido el 18 de diciembre de 2006.
Aceptado para publicación el 10 de mayo de 2007.