Sra. Editora:
La microalbuminuria no puede ser ajena al cardiólogo, pues se cree que es un predictor de enfermedad coronaria en diabéticos tipo 2. Se acepta que los inhibidores del receptor tipo 1 de la angiotensina II (ARA-II) muestran nefroprotección en diabéticos tipo 2 con microalbuminuria, tras conocerse el Irbesartan Patients with Diabetes and MicroAlbuminuria (IRMA-2)1. En pacientes con macroalbuminuria, los estudios Reduction of Endpoints in NIDDM with Angiotensin II Antagonist Losartan (RENAAL)2 e Irbesartan in Diabetic Nephropathy Trial (IDNT)3 demostraron reducción en la progresión a enfermedad renal terminal. Sin embargo, en diabéticos sin microalbuminuria, el Diabetic Retinopathy Candesartan Trial (DIRECT)4 no mostró reducción significativa en la microalbuminuria.
Recientemente se ha publicado el estudio Randomized Olmesartan And Diabetes Microalbuminuria Prevention (ROADMAP)5. Es interesante que se observara que el uso del olmesartán se asociaba a una reducción significativa de la incidencia de microalbuminuria (relativa, un 23%) respecto a placebo. Sin embargo, también se apreció aumento de la incidencia de muerte de causa cardiovascular con olmesartán (15 frente a 3 pacientes; p=0,01), sobre todo a expensas de la muerte cardiaca súbita (7 pacientes frente a 1) y la debida a infarto de miocardio (5 pacientes frente a 0). En cuanto a la mortalidad por cualquier causa, fue desfavorable (no significativamente) para el olmesartán (26 frente a 15 pacientes).
En un intento de clarificar esta reciente alarma, pretendimos evaluar la seguridad en términos de mortalidad del uso de ARA-II en pacientes diabéticos tipo 2 con normoalbuminuria, microalbuminuria o macroalbuminuria en un análisis conjunto.
En el presente metaanálisis se incluyeron todos los estudios aleatorizados y controlados con placebo sobre diabéticos tipo 2 que emplearan un ARA-II en el grupo de intervención, publicados en revistas peer-review, en inglés o español y que presentaran datos de mortalidad (al menos por cualquier causa). Realizamos una revisión sistemática en MEDLINE/PubMed e ISI Web-of-Knowledge hasta abril de 2011. Los términos de búsqueda fueron losartan, irbesartan, valsartan, olmesartan, candesartan, eprosartan, telmisartan, combinados con nefropatía diabética y ensayo aleatorizado. Asimismo se revisaron metaanálisis y revisiones recientes.
Se calculó el riesgo relativo (RR) con el intervalo de confianza del 95% empleando la ponderación de Mantel-Haenszel. Se valoró la heterogeneidad con el test Q (Cochrane) y los estadísticos H e I2. El sesgo de publicación se evaluó mediante los métodos de Egger y Macaskill. Se realizó asimismo un análisis de sensibilidad. Se empleó SPSS v.15 y la macro de Domenech JM (Macro!MAR for SPSS Statistics, V2010.04.15. UAB).
Del total de 459 artículos localizados, sólo cinco cumplieron los criterios de inclusión1, 2, 3, 4, 5 (1,1%) que incluyeron a 9.603 pacientes (Tabla 1). Las razones fundamentales para la exclusión fueron: a) diseño no aleatorizado; b) ausencia de grupo placebo; c) ausencia de datos de mortalidad, y d) estudios «no informativos» (cero eventos mortales en los grupos de intervención y control). Salvo en el estudio de Haller5, en los demás manuscritos1, 2, 3, 4 no se encontraron datos específicos individualizados sobre mortalidad «de causa cardiovascular».
Tabla 1. Características basales de los pacientes diabéticos tipo 2 en cada uno de los estudios elegidos (en el grupo de placebo)
| Brenner et al 2 | Parving et al 1 | Lewis et al 3 | Bilous et al 4 | Haller et al 5 | |
| Nombre de estudio/grupo | RENAAL | IRMA-2 | IDNT | DIRECT-Protect2 | ROADMAP |
| Año de publicación | 2001 | 2001 | 2001 | 2009 | 2011 |
| ARA-II estudiado | Losartán | Irbesartán | Irbesartán | Candesartán | Olmesartán |
| Tamaño muestral total a | 1.513 | 590 | 1.148 | 1.905 | 4.447 |
| Edad, años | 60±7 | 58,3±8,7 | 58,3±8,2 | 56,8±7,9 | 57,8±8,6 |
| Raza blanca, % | 49,6 | 98 | 78 | 96 | 100 |
| Varones, % | 64,8 | 68,7 | 71 | 51 | 45,3 |
| IMC | 29±6 | 30,3±4,4 | 30,5±5,9 | 29,4±4,8 | 30,9±4,9 |
| Enfermedad coronaria, % | 22,1 | 4,5 | 29 b | ND | 24,4 |
| Infarto de miocardio, % | 12,3 | 1,5 | ND | ND | 5,4 |
| ACV o AIT | 0,1 | 3,5 | ND | ND | 2,2 |
| Enfermedad arterial periférica, % | ND | 4 | ND | ND | 0,4 |
| Creatinina, μmol/l | 168±44,2 | 88,4±8,8 | 149,4±50,4 | 90,1±15,2 | 77,5±17,1 |
| Glucohemoglobina, % | 8,4±1,6 | 7,1±1,6 | 8,2±1,7 | 8,2±1,6 | 7,7±1,6 |
| Albuminuria a | Macroalbuminuria | Microalbuminuria | Macroalbuminuria | Normoalbuminuria | Normoalbuminuria |
| Hipertensión al reclutamiento a | Sí | Sí | Sí | 62% | NR |
| Seguimiento medio, años a | 3,4 | 2 | 2,6 | 4,7 | 3,2 |
| Mortalidad grupo intervención, n/N | 158/751 | 3/389 | 87/579 | 37/949 | 26/2.232 |
| Mortalidad grupo placebo, n/N | 155/762 | 1/201 | 93/569 | 35/953 | 15/2.215 |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; ARA-II: bloqueador del receptor tipo 1 de la angiotensina II; IMC: índice de masa corporal; ND: no declarado.
a Grupo de intervención con cada ARA-II y grupo sin intervención (placebo).
b Descrita en la publicación original como «historia de enfermedad cardiovascular».Se presenta la media±desviación típica para las variables continuas y el porcentaje para las categóricas.
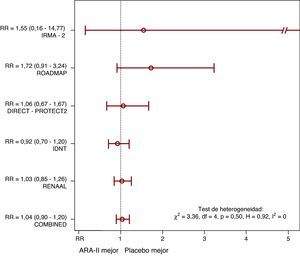
De 4.900 pacientes del grupo con ARA-II, 311 (6,3%) murieron en el seguimiento (por cualquier causa), comparado con 299 de 4.700 (6,4%) en el grupo placebo (RR de Mantel-Haenszel=1,04; p=0,61) (Figura 1). Aunque los estudios con menor riesgo basal (ROADMAP5 e IRMA-21) tendieron a presentar un RR más desfavorable para los ARA-II, no hubo evidencia de heterogeneidad significativa. El análisis de sensibilidad fue concordante y no se observó sesgo de publicación.
Figura 1. Efecto comparativo de bloqueadores del receptor tipo 1 de la angiotensina II en diabéticos tipo 2 sobre la mortalidad por cualquier causa (se presentan los riesgos relativos). ARA-II: bloqueadores del receptor tipo 1 de la angiotensina II; RR: riesgo relativo.
El inesperado hallazgo del estudio ROADMAP5 sobre el aumento de mortalidad de causa cardiovascular en pacientes sometidos a olmesartán entra en conflicto con ensayos recientes, principalmente con el ONgoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial (ONTARGET)6, que incluyó a 9.612 diabéticos y en el cual el efecto beneficioso de telmisartán fue similar al de ramipril —que previamente había demostrado sus bondades en reducción del infarto de miocardio y mortalidad—. Se ha razonado que parte de ese exceso de eventos ocurría en pacientes con cardiopatía isquémica previa y en los que además el olmesartán indujo un mínimo efecto hipotensor o una potente reducción de la presión arterial, devolviendo al escenario la controvertida «curva en J» de mortalidad y cardiopatía isquémica5, 6.
Concluimos que, si bien estudios previos han mostrado suficientemente que el uso de ARA-II en un espectro de diabéticos tipo 2 con diferente grado de afección vascular enlentece la enfermedad renal, el presente metaanálisis no muestra un beneficio, pero tampoco un perjuicio en cuanto a supervivencia total. Futuros estudios serán necesarios para aclarar si los conflictivos resultados del estudio ROADMAP5 son un motivo de preocupación por tratarse de un efecto específico del olmesartán —algo que no podemos descartar— o un simple hallazgo por azar. Se abre además el interesante interrogante de si la microalbuminuria sigue siendo una buena variable intermedia respecto del devenir cardiovascular.
Autor para correspondencia: lconsue@gmail.com