La enolasa neuronal específica (ENE) es un marcador pronóstico en pacientes con parada cardiorrespiratoria extrahospitalaria (PCR-EH) tratados con hipotermia moderada terapéutica (HMT). Objetivos: analizar la correlación entre cambios dinámicos en ENE y eventos principales; y determinar los tiempos de medición de ENE que mejor pronostican el estado neurológico.
MétodosEstudio de cohortes multicéntrico de pacientes ingresados después de un PCR-EH con ritmo desfibrilable y tratados con HMT. Se determinó la ENE sérica en dos fechas y se calculó Δ-ENE (%) como 100 x (Δ-ENE 2-Δ-ENE 1) / Δ-ENE 1. La mortalidad y el estado neurológico, según la escala Cerebral Performance Category (CPC), se evaluaron durante la hospitalización y a los 6 meses.
ResultadosSe incluyeron 166 pacientes ingresados en cuatro hospitales. La mortalidad intrahospitalaria fue del 31.9%. El 58,2% tuvo buena recuperación neurológica (CPC 1-2). El incremento de ENE se asoció, en el análisis de regresión logística, con mayor mortalidad hospitalaria y peor CPC al alta y a los 6 meses (p<0,001). Δ-ENE positiva obtuvo un OR=9,28 (95%IC 4,40-19,57) para mortalidad, OR=11,23 (95%IC 5,24-24,11) para CPC 3-5 al alta y OR=11,14 (95% IC 5,05-24,55) para CPC 3-5 a 6 meses (p<0,001). Una primera determinación de ENE realizada 18 a 24 horas y una segunda 69 a 77 horas después del PCR-EH, mostraron una área bajo la curva ROC buena en la predicción de CPC al alta (0,9389 y 0,9909 respectivamente, 0,8096).
ConclusionesEl cambio dinámico de ENE es un buen marcador de eventos clínicos después de un PCR-EH por ritmo desfibrilable en pacientes tratados con HMT. Las mediciones de ENE en intervalos específicos después del PCR-EH pueden incrementar la precisión pronóstica.
Palabras clave
La lesión neurológica es la principal causa de muerte en las personas que sobreviven inicialmente a una parada cardiorrespiratoria extrahospitalaria (PCR-EH)1. La hipotermia moderada terapéutica (HMT) se utiliza ampliamente en el intento de mejorar la función neurológica y la supervivencia de los pacientes que sobreviven a una PCR-EH con ritmo desfibrilable, a pesar de la controversia existente acerca del manejo de la temperatura2,3.
Se han propuesto varios marcadores del mal pronóstico neurológico, como la exploración clínica, la electroencefalografía y los potenciales evocados somatosensitivos los primeros días siguientes a la PCR-EH4,5.
Algunos de estos instrumentos diagnósticos no siempre están disponibles y los resultados podrían verse afectados por los sedantes. Por consiguiente, los biomarcadores desempeñan un papel complementario en la evaluación del pronóstico neurológico. La enolasa neuroespecífica (ENE), que es la isoforma de enolasa producida por los tejidos neuronales y neuroendocrinos, es el mejor estudiado de estos biomarcadores6. En los pacientes que sobreviven a una PCR-EH y están en coma, la ENE es un marcador del daño cerebral hipóxico.
En los pacientes no tratados con HMT, las determinaciones de la concentración de ENE en suero a las 24-48 h de la PCR-EH han predicho la mortalidad hospitalaria7 y la mortalidad o el estado de pérdida del conocimiento persistente al cabo de 1 mes, con un valor umbral de 33 ng/ml8,9. Un metanálisis10 que muestra la utilidad de la ENE para predecir los resultados neurológicos ha respaldo aquellos resultados.
En la era de la HMT, con un periodo inicial de sedación o bloqueo neuromuscular en el que la evaluación neurológica resulta especialmente difícil, la determinación de la ENE puede ser de mayor utilidad aún.
Dado que hay controversia sobre qué valores absolutos utilizar como umbral para predecir el pronóstico neurológico, varios estudios han evaluado la capacidad predictiva de la cinética de la ENE, con resultados prometedores11-16. Sin embargo, hay pocos estudios en que hayan considerado únicamente las PCR-EH por ritmo desfibrilable14. Otros estudios se han centrado en la capacidad de las determinaciones secuenciales de la ENE de predecir la mortalidad17. Es poco lo que se sabe acerca del momento para una determinación de la ENE que permita predecir mejor los resultados.
Este estudio tiene un doble objetivo: primero, establecer la correlación entre los cambios en las concentraciones séricas de ENE y los resultados neurológicos al alta y a los 6 meses de seguimiento en una cohorte de supervivientes a una PCR-EH por ritmo desfibrilable, en coma persistente y tratados con HMT, y en segundo lugar, establecer el momento para una determinación de la ENE que permita predecir mejor los resultados al alta.
MÉTODOSPoblación del estudioEste estudio multicéntrico de cohorte y prospectivo se llevó a cabo en el área de Barcelona (España). Se incluyó a pacientes consecutivos (edad ≥ 16 años) ingresados entre mayo de 2011 y enero de 2017 en las unidades de cuidados críticos cardiacos (UCC) de 4 hospitales de referencia después de sufrir una PCR-EH por ritmo desfibrilable a los que se aplicó el protocolo completo de HMT y de los que se disponía de al menos 2 determinaciones de la ENE en suero durante la hospitalización. Se trató a los pacientes según la práctica clínica actual de cada hospital y el momento de determinación de la ENE quedó al criterio del médico encargado del tratamiento. Se obtuvieron los datos de seguimiento a los 6 meses tras el alta del hospital mediante los sistemas de registro electrónico de la historia clínica.
El estudio recibió la autorización del Comité de Ética de Investigación del Hospital Vall d’Hebron.
Protocolo de hipotermia moderada terapéuticaTras la evaluación de la pérdida de conocimiento persistente, la fase de enfriamiento inicial se realizó con la infusión de una solución salina fría. Al ingreso de los pacientes en la UCC, se utilizó un sistema de enfriamiento intravascular (CoolGard Thermal Regulation System, Alsius Corporation; Irvine, Estados Unidos) o un sistema de enfriamiento con almohadillas cutáneas (Arctic Sun Temperature Management System, Medivance; Louisville, Estados Unidos) con un objetivo de temperatura de 33°C. El protocolo utilizado en todos los hospitales participantes incluía la hipotermia a 33°C durante 24 h, con un recalentamiento progresivo controlado a una velocidad de 0,25°C/h hasta alcanzar una temperatura ≥ 36,5°C.
Determinaciones de la enolasa neuroespecíficaLas determinaciones de la ENE en suero se realizaron en muestras de sangre recién obtenidas mediante un análisis de quimioluminiscencia Liaison XL (DiaSorin; Saluggia, Italia). El valor umbral de la normalidad era 18 ng/ml. La variable Δ-ENE se definió como el cambio porcentual de la ENE entre el primer valor y el segundo y se calculó con la fórmula 100×(ENE2 – ENE1) / ENE1 (%). La Δ-ENE se utilizó también en el análisis en forma de variable binaria: Δ-ENE ≤ 0 (ENE invariable o decreciente) y Δ-ENE> 0 (ENE creciente).
VariablesSe obtuvieron los datos de las siguientes variables: parámetros demográficos, factores de riesgo cardiovascular, tiempo transcurrido entre la PCR-EH y el inicio del soporte vital (reanimación cardiopulmonar), tiempo transcurrido entre la PCR-EH y el restablecimiento de la circulación espontánea, tiempo transcurrido entre la PCR-EH y el inicio de la HMT, pH y lactato (mmol/l) en sangre arterial a la llegada, tiempo transcurrido entre la PCR-EH y la primera toma de muestras para la determinación de la ENE, tiempo transcurrido entre la PCR-EH y la segunda toma de muestras para la determinación de la ENE y tiempo transcurrido entre la primera determinación de la ENE y la segunda.
ObjetivosSe analizó la mortalidad hospitalaria y sus causas (neurológicas, cardiacas o multifactoriales). La función neurológica se evaluó con la escala Cerebral Performance Category (CPC)18, que clasifica a los pacientes en 5 categorías diferentes, de CPC 1 (discapacidad inexistente o leve) a CPC 5 (muerte cerebral). El adjunto de Neurología, que no conocía los valores de ENE, llevó a cabo la evaluación hospitalaria de la escala de CPC. La evaluación se realizó en el momento del alta o antes de la muerte, y también a los 6 meses de seguimiento mediante la historia clínica electrónica.
Distribución de la toma de muestras para determinar la enolasa neuroespecífica y mejor momento de determinaciónSe realizó un análisis exploratorio de la distribución temporal de la toma de muestras para determinar la ENE. Para establecer el momento de realización de las determinaciones de ENE que podía predecir con mayor exactitud los resultados, se seleccionaron varios periodos de determinación diferentes según la mediana de las distribuciones de obtención de muestras para la determinación de ENE1 y ENE2. Se estableció que cada intervalo de evaluación debía incluir un mínimo de 20 pacientes. Para el intervalo entre la PCR-EH y la determinación ENE1, se analizaron intervalos de 6 h de amplitud, y para el intervalo entre la PCR-EH y la determinación ENE2, dado que el intervalo intercuartílico era más amplio, se evaluaron intervalos de 8 h.
Análisis estadísticoLas variables cuantitativas se expresan en forma de mediana [intervalo intercuartíico]. Para nuestro análisis, la CPC se trató como una variable binaria: se consideró que los pacientes con CPC 1-2 tenían un buen resultado neurológico y que aquellos con CPC 3-5 tenían un mal resultado neurológico. Se realizó un análisis de regresión logística binaria, con el resultado clínico bueno o malo como variable dependiente y la Δ-ENE como variable independiente; la diabetes mellitus (variable dicotómica), la edad, el pH y el lactato se consideraron posibles variables que incluir en el modelo predictivo (selección escalonada retrógrada, p <0,05 para la inclusión y p ≥ 0,10 para la exclusión).
Para evaluar qué momentos para las determinaciones secuenciales de la ENE predecían mejor los resultados, se crearon curvas de características operativas del receptor para la Δ-ENE y se compararon las áreas bajo la curva (AUC) de diferentes lapsos entre PCR-EH y ENE1 y entre PCR-EH y ENE2 con el AUC de la cohorte total.
El análisis de los datos se realizó con el programa Stata/IC 14.2 (StataCorp LP).
RESULTADOSFormaron la cohorte 166 pacientes. En 1 paciente, la CPC al alta no se conocía debido a que el paciente necesitó una sedación prolongada y ventilación mecánica invasiva a causa de un volet costal y fue trasladado a su país natal en esta situación antes de que pudiera determinarse la CPC. Así pues, finalmente se dispuso de 165 pacientes para el análisis. No se dispuso de la CPC a los 6 meses de 15 pacientes; por consiguiente, el análisis pudo completarse en 150 de los 165 pacientes (figura 1). De otro paciente más no se dispuso de información sobre el momento de determinación, por lo que para esta parte del análisis hubo 164 pacientes evaluables.
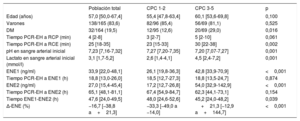
Características inicialesLas características basales de los pacientes se muestran en la tabla 1. La mediana de edad de la cohorte era 57 (intervalo, 16-88) años. Eran varones el 83,6% de los pacientes y el 19,5% tenía diabetes mellitus. La mediana de tiempo transcurrido entre la PCR-EH y el inicio del soporte vital fue de 4min, y transcurrieron 25min entre la PCR-EH y el restablecimiento de la circulación espontánea. La acidosis metabólica a la llegada de los pacientes fue notable, con una mediana de pH de 7,23; en 13 pacientes (7,9%), el pH sanguíneo fue <7,0. La concentración basal de lactato en sangre arterial era alta (> 2,0 mmol/l) en el 67,3% de los pacientes; 19 (11,5%) tenían una concentración de lactato> 8,0 mmol/l.
Comparación de los pacientes con una CPC baja o alta en el momento del alta
| Población total | CPC 1-2 | CPC 3-5 | p | |
|---|---|---|---|---|
| Edad (años) | 57,0 [50,0-67,4] | 55,4 [47,8-63,4] | 60,1 [53,6-69,8] | 0,100 |
| Varones | 138/165 (83,6) | 82/96 (85,4) | 56/69 (81,1) | 0,525 |
| DM | 32/164 (19,5) | 12/95 (12,6) | 20/69 (29,0) | 0,016 |
| Tiempo PCR-EH a RCP (min) | 4 [2-8] | 3 [2-7] | 5 [2-10] | 0,061 |
| Tiempo PCR-EH a RCE (min) | 25 [18-35] | 23 [15-33] | 30 [22-38] | 0,002 |
| pH en sangre arterial inicial | 7,23 [7,16-7,32] | 7,27 [7,20-7,35] | 7,20 [7,07-7,27] | 0,001 |
| Lactato en sangre arterial inicial (mmol/l) | 3,1 [1,7-5,2] | 2,6 [1,4-4,1] | 4,5 [2,4-7,2] | 0,001 |
| ENE1 (ng/ml) | 33,9 [22,0-48,1] | 26,1 [19,8-36,3] | 42,8 [33,9-70,9] | <0,001 |
| Tiempo PCR-EH a ENE1 (h) | 18,8 [13,0-26,0] | 18,5 [12,7-27,3] | 18,8 [13,5-24,7] | 0,874 |
| ENE2 (ng/ml) | 27,0 [15,4-45,4] | 17,2 [12,7-26,8] | 54,0 [32,9-142,9] | <0,001 |
| Tiempo PCR-EH a ENE2 (h) | 65,1 [48,1-81,1] | 67,4 [54,9-84,7] | 62,3 [44,1-73,1] | 0,154 |
| Tiempo ENE1-ENE2 (h) | 47,6 [24,0-49,5] | 48,0 [24,6-52,6] | 45,2 [24,0-48,2] | 0,039 |
| Δ-ENE (%) | −16,7 [−38,8 a+21,3] | −33,3 [−49,0 a −14,0] | +21,3 [−12,9 a+144,7] | <0,001 |
CPC: Cerebral Performance Category; DM: diabetes mellitus; ENE: enolasa neuroespecífica; ENE1: primera determinación de ENE; ENE2: segunda determinación de ENE; PCR-EH: parada cardiorrespiratoria extrahospitalaria; RCE: reanudación de la circulación espontánea; RCP: reanimación cardiopulmonar.
En esta tabla se muestran las características basales, la concentración sérica de ENE y los intervalos de determinación en la cohorte total del estudio y también en los subgrupos de pacientes con buen o mal resultado neurológico al alta.
Δ-ENE (cambio relativo de la ENE)=100×(ENE2 – ENE1) / ENE1.
Los valores expresan n/N (%) o mediana [intervalo intercuartílico].
Los pacientes con mal estado neurológico al alta tenían diabetes con más frecuencia, más tiempo entre la PCR-EH y el restablecimiento de la circulación espontánea, menor pH y mayor concentración de lactato a la llegada (tabla 1). Además, la edad más avanzada y el mayor tiempo entre la PCR-EH y el inicio del soporte vital mostraron tendencia a un peor pronóstico, aunque sin alcanzar la significación estadística.
Concentraciones de enolasa neuroespecíficaLa ENE1 se obtuvo una mediana de 18,8 [13,0-26,0] h tras la PCR-EH y la ENE2, tras una mediana de 65,1 [48,1-81,1] h. La mediana de tiempo entre las 2 determinaciones fue de 47,6 [24,0-49,5] h. Los gráficos de cajas en los que se muestra la distribución de los tiempos de PCR-EH a ENE1 y de PCR-EH a ENE2 se presentan en la figura 1 del material adicional.
La mediana de ENE1 fue de 33,9 ng/ml, mientras que la de ENE2 fue de 27,0 ng/ml. La Δ-ENE mostró gran variabilidad, con una mediana del−16,7% [−38,8% a 21,3%]. Un total de 108 pacientes (el 65,5% de la cohorte) tuvieron un valor de Δ-ENE negativo (disminución de la concentración de ENE) y 57 (34,6%) presentaron un valor positivo (aumento de la concentración). La mediana de Δ-ENE en el grupo de Δ-ENE ≤ 0 fue−34,7% [−49,6% a−17,6%]. En el grupo de Δ-ENE> 0, la mediana fue del 75,0% [20,6%-204,1%].
ObjetivosLa mortalidad hospitalaria fue del 31,9% (53 de 166 pacientes). La principal causa de muerte fue la encefalopatía posanóxica grave (44 casos; 83,0%); la muerte de causa cardiaca se produjo solo en 2 pacientes (3,8%).
En el conjunto de la cohorte, la distribución de las puntuaciones de la CPC al alta fue la siguiente: CPC 1, 72 pacientes (43,6%); CPC 2, 24 (14,6%); CPC 3, 11 (6,7%); CPC 4, 33 (20,0%), y CPC 5, 25 (15,2%). Más de la mitad de los pacientes (96; 58,2%) presentaron una buena recuperación neurológica según la escala CPC.
En la cohorte total, 89 pacientes (59,3%) continuaban con vida y tenían buen estado neurológico a los 6 meses (CPC 1 o 2). De los pacientes que sobrevivieron hasta el alta, 88 de 97 (90,7%) presentaron una recuperación neurológica a los 6 meses.
Δ-ENE y resultadosEn valores absolutos, tanto la ENE1 como la ENE2 mostraron una asociación significativa con la mortalidad y la CPC al alta y a los 6 meses. Por lo que respecta a la CPC al alta, la mediana de ENE1 fue de 26,1 ng/ml en los pacientes con CPC 1-2 y 42,8 ng/ml en aquellos con CPC 3-5 (p <0,001). La mediana de ENE2 fue de 17,2 ng/ml para la CPC 1-2 y 54,0 ng/ml para la CPC 3-5 (p <0,001).
En los pacientes con CPC 1-2, la mediana de Δ-ENE fue del−33,3% [−49,0% a −14,0%], y con CPC 3-5, del+21,3% [−12,9% a+144,7%]. La mediana de Δ-ENE en los pacientes que sobrevivieron hasta ser dados de alta fue del −28,3% [−44,0% a −10,2%], y en los que fallecieron durante el ingreso, del+28,1% [−6,6% a+160,9%].
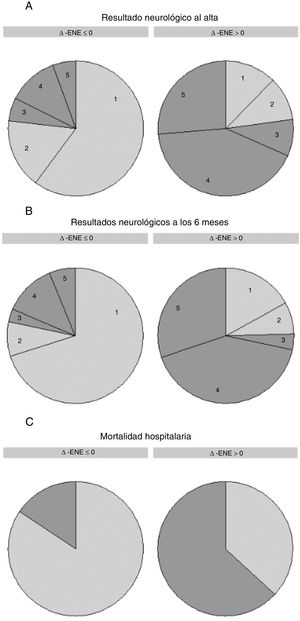
En el análisis univariable, la Δ-ENE mostró una asociación significativa con la mortalidad hospitalaria por cualquier causa (para un aumento del 1%, odds ratio [OR]=1,013; intervalo de confianza del 95% [IC95%], 1,007-1,018; p <0,001), la CPC 3-5 al alta (OR=1,017; IC95%, 1,010-1,025; p <0,001) y la CPC 3-5 a los 6 meses (OR=1,015; IC95%, 1,008-1,023; p <0,001). Así pues, un aumento de la Δ-ENE se asoció con mal resultado neurológico, mientras que una disminución se asoció con buen resultado neurológico. Los valores de OR son más fáciles de interpretar cuando la Δ-ENE se trata como una variable binaria (Δ-ENE> 0 [ENE creciente] frente a Δ-ENE ≤ 0 [ENE invariable o decreciente]): OR=9,28 (IC95%, 4,40-19,57) para la mortalidad hospitalaria, OR=11,24 (IC95%, 5,24-24,11) para la CPC 3-5 al alta y OR=11,14 (IC95%, 5,05-24,55) para la CPC 3-5 a los 6 meses (figura 2).
Δ-ENE y resultados. Pronóstico neurológico al alta (A), pronóstico neurológico a los 6 meses (B) y mortalidad hospitalaria (C) clasificados según el cambio relativo de los valores séricos de ENE [Δ-ENE=100×(ENE2 – ENE1) / ENE1]. Δ-ENE ≤ 0 indica unas concentraciones invariables o que se reducen, mientras que Δ-ENE> 0 indica unas concentraciones de ENE crecientes. El pronóstico neurológico se evaluó con la escala CPC; los valores indicados en el gráfico corresponden a la escala CPC 1-5. El buen resultado neurológico se indica en gris claro (CPC 1 y 2) y el mal resultado neurológico, en gris oscuro (CPC 3-5). CPC: Cerebral Performance Category; ENE: enolasa neuroespecífica; ENE1: primera determinación de ENE; ENE2: segunda determinación de ENE.
La Δ-ENE positiva tuvo una sensibilidad del 63,8% en la predicción de la CPC 3-5 y la negativa tuvo una especificidad del 86,5% para la CPC 1-2; el valor predictivo positivo fue del 77,2% y el valor predictivo negativo fue del 76,9%. El AUC para la Δ-ENE fue 0,8096 (IC95%, 0,7414-0,8779) para la cohorte total.
El modelo final para el análisis de regresión logística multivariante incluyó la edad y el pH de la sangre arterial a la llegada (tabla 1 del material adicional). La Δ-ENE continuó siendo un significativo factor predictivo del pronóstico neurológico al alta: OR=1,016 (IC95%, 1,008-1,024; p <0,001) por cada aumento del 1%. Lo mismo ocurrió con la Δ-ENE como variable binaria, según se ha descrito anteriormente: OR=11,58 (IC95%, 4,89-27,41; p <0,001).
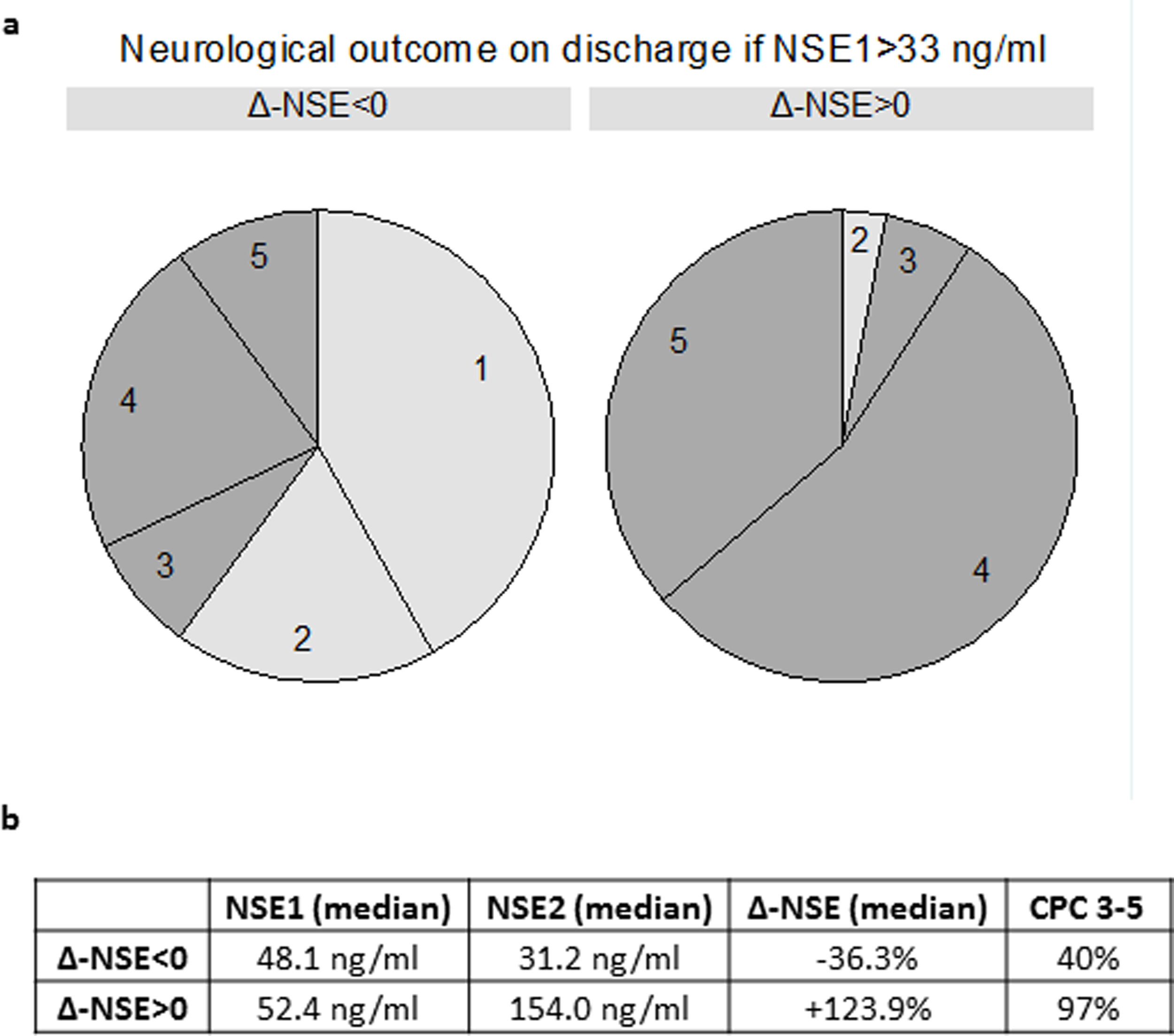
Al analizar solo a los pacientes con un primer valor de ENE alto> 33 ng/ml, el aumento de la ENE mostró una asociación invariable con mal pronóstico neurológico (32 de 33 pacientes con CPC 3-5). En cambio, el 60,0% de los pacientes con una ENE1> 33 ng/ml y una disminución de la ENE presentaron un buen pronóstico (CPC 1-2) (figura 2 del material adicional). Dos ejemplos extremos fueron 2 pacientes con un primer valor de ENE de 79,3 y 109,5 ng/ml respectivamente, que fueron dados de alta con una CPC 1 después de mostrar una clara disminución de la ENE (hasta 11,4 y 33,2 ng/ml respectivamente).
En comparación con la ENE2 como valor absoluto, la Δ-ENE predijo la CPC al alta de los pacientes con una ENE2 moderadamente alta (31 pacientes con una ENE2 de 30-50 ng/ml; p=0,0185). En este grupo de pacientes, la ENE2 no tuvo una capacidad predictiva estadísticamente significativa (p=0,2124).
Por último, se elaboró un modelo de regresión logística que incluía la Δ-ENE, la edad, la diabetes, la primera presión arterial, la primera concentración de lactato y el tiempo entre la PCR-EH y el restablecimiento de la circulación espontánea, y se comparó con el mismo modelo sin la Δ-ENE. El AUC para el modelo completo fue 0,8078 y para el modelo sin la Δ-ENE, 0,7372 (lo cual no era significativamente inferior, p=0,2887).
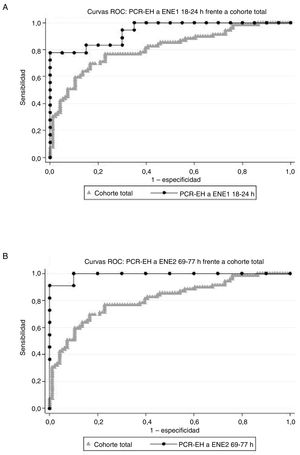
Tiempo PCR-EH a ENE1 y tiempo ENE1 a ENE2El segundo objetivo del presente estudio es determinar qué intervalos entre tomas de muestras predicen mejor la CPC 3-5. Se consideraron 2 grupos de intervalos: entre la PCR-EH y la primera obtención de muestras para la determinación de la ENE y entre la primera determinación y la segunda. En la comparación del análisis del AUC de características operativas del receptor, el mejor intervalo PCR-EH a ENE1 fue el de 18 a 24 h (AUC=0,9389; IC95%, 0,8692-1,000, con la inclusión de 38 pacientes). El mejor intervalo de PCR-EH a ENE2 fue el de 69 a 77 h (AUC=0,9910; IC95%, 0,9657-1,000 con 21 pacientes). Sin embargo, había un notable solapamiento del IC en todos los intervalos evaluados. Las AUC de los 2 intervalos seleccionados fueron mayores que el AUC de la cohorte total (AUC=0,8096; IC95%, 0,7414-0,8779) (figura 3) y fueron aún mejores que el AUC correspondiente a los valores absolutos (0,7640 para la ENE1 y 0,8986 para la ENE2), aunque dado el pequeño tamaño muestral de todos los intervalos, las diferencias no alcanzaron significación estadística. En la tabla 2 del material adicional se muestran los intervalos evaluados.
Curvas ROC. Cambio relativo en los valores séricos de ENE [Δ-ENE=100×(ENE2 – ENE1) / ENE1], como predictor de los resultados neurológicos evaluados mediante la escala CPC, considerando como buen resultado neurológico la CPC 1 o 2 y como mal resultado neurológico la CPC 3-5. Comparación de las curvas ROC de la cohorte total y de los 2 subgrupos: (A) Δ-ENE con el primer análisis de la ENE realizado a las 18-24 h de la PCR-EH y (B) Δ-ENE con el segundo análisis de ENE realizado a las 69-77 h de la PCR-EH. La cohorte total indica la Δ-ENE en el conjunto de la población del estudio. CPC: Cerebral Performance Category; ENE: enolasa neuroespecífica; ENE1: primera determinación de ENE; ENE2: segunda determinación de ENE; PCR-EH: parada cardiorrespiratoria extrahospitalaria; ROC: características operativas del receptor.
Nuestro estudio aporta una información adicional importante respecto al uso clínico de la ENE en los pacientes que sobreviven a una PCR-EH en ritmo desfibrilable tratados con HMT. La elevación de los valores absolutos de ENE1 y especialmente de ENE2 mostró una asociación intensa con mal pronóstico, y la Δ-ENE tuvo un valor pronóstico comparable al de la ENE2. La Δ-ENE aportó una información adicional útil, en comparación con la de la ENE2 sola, en especial en el subgrupo de pacientes con una ENE2 moderadamente elevada. Así, la Δ-ENE reclasifica al 60% de los pacientes con una ENE1> 33 ng/ml y a un porcentaje inferior pero relativamente alto (43%) de pacientes con ENE2 <33 ng/ml. Además, hasta donde nosotros sabemos, este es uno de los primeros estudios que establece una recomendación sobre el intervalo más apropiado para la obtención de muestras de sangre para el análisis de la ENE en esta población.
La mayoría de los ensayos con HMT sobre la ENE se han centrado en los valores absolutos. Algunos estudios han establecido un valor de corte de 28-31 ng/ml a las 48 h11,19 o 72 h20 para el mal resultado neurológico a los 6 meses. En el ensayo TTM (Targeted Temperature Management), los valores umbral para el mal resultado neurológico a los 6 meses fueron más altos: 35 ng/ml (24 h), 61 ng/ml (48 h) y 54 ng/ml (72 h), y la mejor AUC se observó a las 48 y a las 72 h12. Más recientemente, un umbral de 19,4 ng/ml en el día 4 se ha asociado con mal resultado neurológico a los 30 días, con sensibilidad y especificidad> 90%21.
La falta de datos concluyentes acerca de los valores de corte plantea la cuestión de la importancia de los cambios dinámicos para la predicción de los resultados. Storm et al.13 observaron que un aumento del 33,1% entre las determinaciones realizadas al ingreso y a las 48 h tenía una especificidad del 100%, con una sensibilidad del 63-67% respecto a los resultados al alta. Como se ha mencionado antes, incluso un aumento pequeño de los valores de ENE (> 2 μg/l) entre las 24 y las 48 h mostró una correlación intensa con un mal resultado neurológico (OR=9,8)11. Tiainen et al. observaron que las concentraciones decrecientes de ENE se asociaban con la recuperación de la conciencia, la recuperación neurológica y la supervivencia14. Zellner et al.15 analizaron también la cinética de la ENE en una cohorte de 78 pacientes e indicaron una sensibilidad del 89% y una especificidad del 85% respecto al estado neurológico a los 6 meses. Un estudio publicado en 2014 puso de manifiesto que los cambios de la ENE entre los días 1 y 2 podían ser más fiables que los valores absolutos para predecir los resultados neurológicos a los 2 meses, con una mejor AUC (0,86). Entre los pacientes con un buen pronóstico neurológico hubo algunos con unos valores absolutos muy altos en las primeras 24 h16. Por último, un estudio recientemente publicado por Vondrakova et al.21, en el que se analizaron los valores absolutos de la concentración de ENE y los cambios relativos de la ENE, mostró que un valor de ENE> 20 ng/ml el día 4 junto con un aumento de las concentraciones de ENE (> 0,0 ng/ml) del tercer día al cuarto predijo un mal resultado neurológico (sensibilidad del 73%, especificidad del 100%). Este es el motivo de analizar cualquier aumento frente a cualquier disminución (valor de corte de la Δ-ENE, 0%) al tratar la Δ-ENE como variable binaria.
En el ensayo TTM12, se llevó a cabo un análisis específico respecto a los cambios dinámicos de la ENE. Los pacientes con un mal resultado presentaron un aumento de los valores de ENE de una mediana de 34-35 ng/ml a una de 60-66 ng/ml entre las 24 y las 48 h, y los pacientes con un buen pronóstico neurológico presentaron una disminución uniforme de las concentraciones de ENE. En un posterior análisis post hoc22 se observó que las determinaciones secuenciales de la ENE aumentaban significativamente la exactitud pronóstica general, en comparación con un solo análisis a las 48 h en pacientes que continuaban estando inconscientes el día 3 (AUC, 0,88 frente a 0,84).
Gillick y Rooney han publicado recientemente un estudio que se centró en la capacidad de la cinética de la ENE de predecir la mortalidad hospitalaria. Tanto la ENE a las 48 h del ingreso como la Δ-ENE predijeron el resultado, con unos valores de corte de 69,8 (ENE a las 48 h) y 9,4 ng/ml (Δ-ENE) para una especificidad=1,0017.
El papel específico de la cinética de la ENE en la PCR-EH por ritmo desfibrilable no está bien estudiado, ya que todos los estudios antes mencionados incluyeron también ritmos no desfibrilables en diferentes porcentajes, excepto el descrito por Tiainen et al.14. En ese estudio, la sensibilidad fue difícil de determinar debido al pequeño tamaño de la muestra. Nuestro estudio, que se centró en esta población específica y más homogénea, ha demostrado que los cambios de la ENE son un factor independiente predictivo de la mortalidad y el estado neurológico al alta y a los 6 meses.
En publicaciones previas, la ENE se determinó en diferentes intervalos tras el ingreso, y se compararon los cambios durante los primeros días de hospitalización. El periodo más ampliamente estudiado fue el que va de las 24 a las 48 h tras el ingreso; según lo indicado por diversos estudios, la cinética de la ENE entre estos intervalos fue útil para predecir los resultados11,14-16. En otros estudios, la primera muestra se obtuvo al ingreso y se comparó con una segunda muestra obtenida 48 h después13,17, con unos resultados similares. Stammet et al.12 demostraron que una disminución de la ENE en cualquier periodo (24-48 h o 48-72 h) se asocia con buen pronóstico en el conjunto de la cohorte (normotermia e hipotermia), mientras que la predicción de un mal resultado neurológico con el aumento era significativa en todos los grupos y periodos excepto el de 48-72 h en el grupo de normotermia. En general, el cambio de la ENE tuvo AUC de 0,80 y 0,84 (subgrupos de 33 y 36°C respectivamente) entre las 24 y las 48 h, pero esto se redujo a menos de 0,70 de las 48 a las 72 h. Por último, en una de las publicaciones más recientes21, la segunda determinación de la ENE se realizó en un momento bastante tardío (día 4 tras la PCR-EH) con objeto de obtener la diferencia de ENE con el máximo valor predictivo.
La introducción de un periodo menos rígido para la determinación puede ser útil, ya que en la práctica clínica las determinaciones de la ENE no siempre se realizan exactamente a las 24 h o a las 48 h del ingreso. Por este motivo se consideró que sería útil analizar los intervalos óptimos para realizar la prueba. Según nuestros resultados, la primera muestra para la determinación de la ENE debiera obtenerse entre 18 y 24 h tras la PCR-EH. En cambio, el segundo análisis podría realizarse más tarde de lo indicado en otros estudios: 69 a 77 h tras la PCR-EH (52-72 h después de la ENE1).
Aunque la población de nuestro estudio era muy seleccionada, nuestros resultados concuerdan con los de estudios publicados anteriormente, y consideramos que nuestros resultados en lo relativo a la capacidad predictiva de la Δ-ENE podrían ser aplicables a todos los pacientes con una PCR-EH.
Las principales limitaciones de nuestro estudio son el tamaño muestral relativamente pequeño, aunque similar al de publicaciones previas, y la falta de un momento predefinido para realizar las determinaciones. Esto implica que haya una heterogeneidad apreciable en los intervalos de tiempo utilizados. Dicha heterogeneidad refleja lo que sucede en la práctica clínica, pero exige una interpretación cautelosa del AUC en los subgrupos de tiempo. Los resultados observacionales deberán ser validados prospectivamente en cohortes de pacientes más amplias para establecer de manera definitiva los intervalos óptimos. Debemos admitir también la posibilidad de un sesgo de selección que podría excluir a los pacientes con lesiones cerebrales más graves que fallecen precozmente sin posibilidad de obtener 2 determinaciones de la ENE. Por último, de los pacientes cuya muerte se atribuyó a una encefalopatía posanóxica, no se sabe a quiénes se limitaron las medidas terapéuticas.
CONCLUSIONESEn los pacientes tratados con HMT después de una PCR-EH por ritmo desfibrilable, los cambios dinámicos de la ENE pueden ser un buen predictor de la mortalidad hospitalaria y del estado neurológico al alta y a los 6 meses de seguimiento. La realización de la primera determinación de la ENE a las 18-24 h de la PCR-EH y la segunda a las 69-77 h de la PCR-EH parece mejorar la exactitud en la determinación del pronóstico.
CONFLICTO DE INTERESESTodos los autores certifican que no tienen ninguna filiación ni relación con ninguna organización o entidad que tenga interés económico alguno (como honorarios, subvenciones de formación, participación en paneles de conferenciantes, afiliación, empleo, consultoría, propiedad de acciones u otros intereses en el capital y testimonio experto o acuerdos de patentes-licencias) ni intereses no económicos (como relaciones personales o profesionales, filiación, conocimientos o creencias) en el tema o los materiales que se comentan en este artículo.
- –
La evaluación del pronóstico neurológico de los pacientes que sobreviven a una PCR-EH resulta difícil. La ENE es un biomarcador bien estudiado que se utiliza ampliamente en algoritmos de pronóstico multimodales. Dado que no hay un valor de corte bien establecido de la ENE para un buen pronóstico neurológico, algunos estudios han evaluado los cambios dinámicos de las concentraciones de ENE en comparación con el empleo de un solo valor absoluto, con resultados prometedores. Sin embargo, los cambios de la ENE rara vez se han estudiado en la población específica de pacientes que han sobrevivido a una PCR-EH por ritmo desfibrilable y han sido tratados con un protocolo de hipotermia moderada terapéutica. Otra cuestión no resuelta es qué momento de determinación de la ENE permite predecir mejor los resultados.
- –
Este es un estudio multicéntrico que incluye a una población homogénea de pacientes que han sobrevivido a una PCR-EH por ritmo desfibrilable y han sido tratados con un protocolo de hipotermia moderada terapéutica. En los análisis de regresión logística simple y multivariante de nuestra serie, un aumento de los valores de ENE se asoció con mayor mortalidad hospitalaria y peor estado neurológico al alta y a los 6 meses. Se propone también un tiempo específico para realizar la determinación de la ENE: una primera determinación de la ENE 18-24 horas tras la PCR-EH y una segunda a las 69-77 h de la PCR-EH parecen mejorar la exactitud de la determinación del pronóstico.
Estamos en deuda con el Dr. G. Permanyer-Miralda y con la Sra. Mary O’Neill por su ayuda. Este trabajo se llevó a cabo en el marco del programa de doctorado de medicina de la Universitat Autònoma de Barcelona.


![Δ-ENE y resultados. Pronóstico neurológico al alta (A), pronóstico neurológico a los 6 meses (B) y mortalidad hospitalaria (C) clasificados según el cambio relativo de los valores séricos de ENE [Δ-ENE=100×(ENE2 – ENE1) / ENE1]. Δ-ENE ≤ 0 indica unas concentraciones invariables o que se reducen, mientras que Δ-ENE> 0 indica unas concentraciones de ENE crecientes. El pronóstico neurológico se evaluó con la escala CPC; los valores indicados en el gráfico corresponden a la escala CPC 1-5. El buen resultado neurológico se indica en gris claro (CPC 1 y 2) y el mal resultado neurológico, en gris oscuro (CPC 3-5). CPC: Cerebral Performance Category; ENE: enolasa neuroespecífica; ENE1: primera determinación de ENE; ENE2: segunda determinación de ENE. Δ-ENE y resultados. Pronóstico neurológico al alta (A), pronóstico neurológico a los 6 meses (B) y mortalidad hospitalaria (C) clasificados según el cambio relativo de los valores séricos de ENE [Δ-ENE=100×(ENE2 – ENE1) / ENE1]. Δ-ENE ≤ 0 indica unas concentraciones invariables o que se reducen, mientras que Δ-ENE> 0 indica unas concentraciones de ENE crecientes. El pronóstico neurológico se evaluó con la escala CPC; los valores indicados en el gráfico corresponden a la escala CPC 1-5. El buen resultado neurológico se indica en gris claro (CPC 1 y 2) y el mal resultado neurológico, en gris oscuro (CPC 3-5). CPC: Cerebral Performance Category; ENE: enolasa neuroespecífica; ENE1: primera determinación de ENE; ENE2: segunda determinación de ENE.](https://static.elsevier.es/multimedia/03008932/0000007300000003/v1_202002210636/S0300893219300508/v1_202002210636/es/main.assets/thumbnail/gr2.jpeg?xkr=eyJpdiI6IjhTOXAwVkVlWFhZR0o3NXhCc0t1eWc9PSIsInZhbHVlIjoiMloxano5TnNTVjRLbm9WYUFVeENBUTltdXhjSlNTOXhsTXRpSWpYQmRxUT0iLCJtYWMiOiJjNzJmOWRkNTM2ODdjMDczMTU4M2Q0OWZiNTI3NGYzNjRkOWQwMDVmOWM4NDVjNGVhZjVlY2JkMjY0YWIzNmIzIiwidGFnIjoiIn0=)
![Curvas ROC. Cambio relativo en los valores séricos de ENE [Δ-ENE=100×(ENE2 – ENE1) / ENE1], como predictor de los resultados neurológicos evaluados mediante la escala CPC, considerando como buen resultado neurológico la CPC 1 o 2 y como mal resultado neurológico la CPC 3-5. Comparación de las curvas ROC de la cohorte total y de los 2 subgrupos: (A) Δ-ENE con el primer análisis de la ENE realizado a las 18-24 h de la PCR-EH y (B) Δ-ENE con el segundo análisis de ENE realizado a las 69-77 h de la PCR-EH. La cohorte total indica la Δ-ENE en el conjunto de la población del estudio. CPC: Cerebral Performance Category; ENE: enolasa neuroespecífica; ENE1: primera determinación de ENE; ENE2: segunda determinación de ENE; PCR-EH: parada cardiorrespiratoria extrahospitalaria; ROC: características operativas del receptor. Curvas ROC. Cambio relativo en los valores séricos de ENE [Δ-ENE=100×(ENE2 – ENE1) / ENE1], como predictor de los resultados neurológicos evaluados mediante la escala CPC, considerando como buen resultado neurológico la CPC 1 o 2 y como mal resultado neurológico la CPC 3-5. Comparación de las curvas ROC de la cohorte total y de los 2 subgrupos: (A) Δ-ENE con el primer análisis de la ENE realizado a las 18-24 h de la PCR-EH y (B) Δ-ENE con el segundo análisis de ENE realizado a las 69-77 h de la PCR-EH. La cohorte total indica la Δ-ENE en el conjunto de la población del estudio. CPC: Cerebral Performance Category; ENE: enolasa neuroespecífica; ENE1: primera determinación de ENE; ENE2: segunda determinación de ENE; PCR-EH: parada cardiorrespiratoria extrahospitalaria; ROC: características operativas del receptor.](https://static.elsevier.es/multimedia/03008932/0000007300000003/v1_202002210636/S0300893219300508/v1_202002210636/es/main.assets/thumbnail/gr3.jpeg?xkr=eyJpdiI6Imp5QVdWcjlidk1OejNZN2x2RTZubFE9PSIsInZhbHVlIjoiNXpNNmxYU1ovS2lVZ3lpbTVmWEp3ZUdQSTYyQUNiOHYzNUtDTVY0eFNYOD0iLCJtYWMiOiI2N2UxZTQ3M2I3ODg2OTI1NTUxYjkyOWYzZWU0M2FhMDdlMzgwMGQ5YWRlMTg0MGM0MTZmMzFiNDFlOWY0ODM4IiwidGFnIjoiIn0=)