Palabras clave
INTRODUCCIÓN
El uso de stents ha sido uno de los grandes avances en el tratamiento de pacientes con coronariopatía1. Además de sus muchas ventajas, los stents presentan algunos problemas, como la aparición de reestenosis y la trombosis2-9. Tras la implantación de un stent, la respuesta vascular (reestenosis y remodelado) a la lesión va encaminada a cicatrizar la herida y se caracteriza principalmente por un incremento de las células de músculo liso y de matriz extracelular10.
En el estudio Taxus II se observó una reducción significativa del tamaño luminal en el borde proximal, tanto con stents metálicos como con stents liberadores de paclitaxel, mientras que en el borde distal sólo se observó reducción en el grupo con stents metálicos. Esto se debió principalmente a un aumento del tamaño de la placa que no fue plenamente compensado por el remodelado de la pared del vaso11.
En la actualidad, el análisis espectral de los datos de radiofrecuencia (DRF) procedentes de la ecografía intravascular (EIV)12,13 se ha convertido en una herramienta para evaluar la composición tisular de las arterias coronarias. De esta manera pueden analizarse no sólo cambios geométricos seriados, sino también su composición.
Sin embargo, en los vasos con un stent implantado, el análisis sólo puede realizarse en los segmentos adyacentes (bordes) del stent, ya que no es posible analizar con esta técnica el área real ni sus alrededores por las siguientes razones: a) los struts del stent se clasifican erróneamente como «calcio denso»; b) el análisis de DRF de EIV no está validado de forma adecuada en este contexto, y c) los struts superficiales del stent pueden interferir en la retrodispersión (backscattering) del tejido ubicado detrás de ellos.
Formulamos la hipótesis de que el tejido implicado en el aumento de la placa en los bordes del stent, según la evaluación de los DRF de EIV, es principalmente un tejido fibrolipídico, descrito de forma general como haces de fibra colágena poco compactados con regiones de depósito lipídico y matriz extracelular sin áreas necróticas14.
Por lo tanto, buscamos in vivo posibles cambios geométricos con el transcurso del tiempo y modificaciones en la composición tisular en el borde del stent liberador de paclitaxel de acuerdo con el análisis de los DRF de EIV.
MÉTODOS
Selección de pacientes
El estudio BETAX (BEside TAXus®) lo constituye una cohorte longitudinal y prospectiva de pacientes no consecutivos sometidos a intervención coronaria por indicación clínica y que fueron tratados con stent Taxus® (Taxus® Express2TM; Boston Corporation, Na-tick, Massachusetts, Estados Unidos). Sólo los pacientes que dieron su consentimiento informado por escrito fueron incluidos en el estudio. Participaron pacientes con angina estable y con síndromes coronarios agudos. Se consideraron síndromes coronarios agudos la angina inestable, el infarto de miocardio sin elevación del segmento ST y el infarto de miocardio con elevación del segmento ST. La captura de imágenes con EIV se realizó transcurridos 6 meses de la implantación del stent. Nuestro comité de ética local aprobó el protocolo.
Adquisición y análisis de DRF de EIV
Los detalles referentes a la validación de la técnica en segmentos coronarios humanos explantados y tras aterectomía in vivo se han publicado con anterioridad12-14. De forma breve, se utiliza el análisis espectral de los DRF de la EIV para elaborar mapas tisulares que se correlacionan con un espectro específico de la señal de radiofrecuencia y a los que se asignan códigos de color (fibroso [verde], fibrolipídico [verdoso-amarillo], núcleo necrótico [rojo] y calcio denso [blanco])12,13.
Los DRF-EIV se obtuvieron con un sistema de retroceso motorizado a velocidad constante (continous pullback) (Eagle-EyeTM 20 MHz Volcano Therapeutics, Rancho Cordova, California, Estados Unidos) mediante una consola específica de EIV (Volcano Therapeutics, Rancho Cordova, California, Estados Unidos). Las grabaciones se almacenaron en un DVD y se enviaron a Corelab (Erasmus Medical Center/Car-dialysis, Rotterdam, Países Bajos) para su análisis.
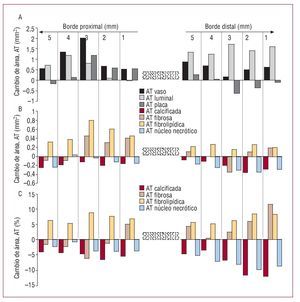
Los segmentos proximales de 5 mm y distales de 5 mm adyacentes al stent se fraccionaron posteriormente en cinco subsegmentos de 1 mm (fig. 1).
Fig. 1. A: cambios de área en las mediciones geométricas de las zonas proximal y distal de 5 mm del stent Taxus. B y C: cambios temporales absolutos y relativos en la composición de la placa. AT: área transversal.La tasa de muestreo durante el pullback se calibró al punto máximo de la onda R, por lo que depende de la frecuencia cardiaca. Por ejemplo, durante una frecuencia cardiaca constante de 60 lat/min, los datos se recogen cada 0,5 mm.
Se obtuvieron datos geométricos y de composición tisular para cada área transversal (AT) y se expresaron como áreas medias y porcentajes para cada componente DRF-EIV.
Análisis estadístico
Las variables discretas se presentan como recuentos y porcentajes. Las variables continuas se presentan como medias ± desviación estándar. Un valor p (bilateral) < 0,05 determinó la significación estadística. Se comprobaron los supuestos de normalidad después de una transformación basada en p > 0,20 en la prueba de Kolmogorov-Smirnov y mediante una evaluación visual de los gráficos Q-Q de los residuos. En consecuencia, se realizó una transformación logarítmica de las variables con distribución asimétrica.
La comparación entre las determinaciones basales y las del seguimiento se realizó mediante una prueba de la t de Student para datos apareados.
Los análisis estadísticos se realizaron con el software SPSS versión 11.5.
RESULTADOS
En total, se incluyó en el estudio a 30 pacientes, pero en último término sólo 24 (26 segmentos con stents) fueron analizados, dado que 2 pacientes rechazaron el seguimiento angiográfico y la calidad de la imagen EIV fue deficiente en otros 4 pacientes (por velocidad de retirada no constante y artefactos en la EIV). Las características basales de los pacientes participantes se muestran en la tabla 1. La media de edad era 57,6 ± 11,2 años, la mayoría eran varones (75%) y el 66% de los pacientes presentaba angina estable. En el 46,2% de los casos se estudió la arteria coronaria descendente anterior; en el 26,9%, la arteria circunfleja, y en el 26,9%, la coronaria derecha. El número medio de stents por paciente fue 1,5 ± 0,7. Hasta el momento no se ha observado ningún caso de trombosis del stent.
Hallazgos DRF-EIV. Cambios en los parámetros geométricos y de composición dentro de los segmentos proximales y distales y entre ellos desde el inicio del estudio al seguimiento
Al inicio del estudio, el AT media del vaso (16,5 ± 4,9 frente a 11,5 ± 4 mm2; p < 0,001), de la placa (7,7 ± 3,6 frente a 5,3 ± 2,7 mm2; p < 0,001) y luminal (8,8 ± 2,6 frente a 6,2 ± 1,7 mm2; p < 0,001) en todo el segmento de 5 mm del borde proximal eran mayores que en el segmento distal. Lo mismo sucede en la exploración de seguimiento para las mediciones de AT media del vaso (17,5 ± 5,9 frente a 12,8 ± 4 mm2; p < 0,001), de la placa (8,2 ± 4,4 frente a 5,1 ± 2,6 mm2; p < 0,001) y luminal (9,3 ± 3 frente a 7,7 ± 4 mm2; p < 0,001) (tabla 2).
En los bordes proximales y distales, se observó un remodelado vascular expansivo y seriado durante el seguimiento, con un aumento significativo del AT media del vaso en toda la zona del segmento proximal (p = 0,031) y una tendencia al aumento en el segmento distal (p = 0,06).
Puesto que el AT de la placa apenas aumenta, este remodelado dio lugar a un aumento significativo del AT media luminal (tabla 2).
En cuanto a la composición tisular, el porcentaje de tejido calcificado al inicio del estudio era similar (el 10,7% ± 11,5% frente al 11% ± 14,2%; p = 0,80) en ambos segmentos, y lo mismo ocurre respecto al núcleo necrótico (el 17% ± 13,5% frente al 18,5% ± 16,5%; p = 0,23); por el contrario, el porcentaje de tejido fibroso (el 57,9% ± 19,3% frente al 47,8% ± 29,2%; p < 0,001) y fibrolipídico (el 11,7% ± 11,9% frente al 7% ± 9,3%; p < 0,001) es mayor en el segmento proximal.
Durante el seguimiento, se observó que todos los tipos tisulares eran más extensos en el segmento proximal respecto al distal: tejido calcificado (el 5,8% ± 8,2% frente al 3,3% ± 6,3%; p < 0,001), núcleo necrótico (el 14,2% ± 13,8% frente al 10,8% ± 12,6%; p < 0,001), tejido fibroso (el 56,9% ± 18,4% frente al 53% ± 28,7%; p < 0,001) y tejido fibrolipídico (el 18,7% ± 13,4% frente al 13,7% ± 13,1%; p < 0,001) (tabla 2).
En general, el tejido fibrolipídico mostró un incremento significativo en los segmentos proximales y distales, mientras que el tejido calcificado y el núcleo necrótico parecieron disminuir con el tiempo. El tejido fibroso no mostró cambios significativos con el transcurso del tiempo (tabla 2).
Análisis subsegmentario de los cambios longitudinales acaecidos en los segmentos de 5 mm de los bordes proximales y distales
La diferencia absoluta media del AT del vaso (seguimiento - inicio del estudio) fue positiva en todos los segmentos proximales y distales; esto iba acompañado de una diferencia absoluta media positiva en el AT luminal; el incremento más destacado del AT de la placa (aunque no significativo) se observó en los primeros tres subsegmentos proximales (fig. 1). En particular, en los primeros 2 mm del borde proximal, la pared del vaso creció para compensar el crecimiento de placa (subsegmento proximal 1 mm, D+0,52 y D+0,54 mm2; subsegmento proximal 2 mm, D+0,65 y D+0,58 mm2; cambios en el área del vaso y cambios en el área de la placa respectivamente) sin que el tamaño luminal se viese afectado (subsegmento proximal 1 mm, D-0,02 mm2; subsegmento proximal 2 mm, D+0,07 mm2 en el cambio del área luminal), mientras en los 3 subsegmentos siguientes se observó sobrecompensación, puesto que la pared del vaso creció más que la placa (subsegmento proximal 3 mm, D+1,98 y D+1,18 mm2; subsegmento proximal 4 mm, D+1,32 y D+0,12 mm2; subsegmento proximal 5 mm, D+0,54 y D+0,14 en los cambios en el área del vaso y en los cambios en el área de la placa, respectivamente), lo que resulta en un aumento del tamaño luminal (subsegmento proximal 3 mm, D+0,81 mm2; subsegmento proximal 4 mm, D+1,21 mm2, y subsegmento proximal 5 mm, D+0,69 mm2). En el borde distal, la sobrecompensación se observó en los cinco subsegmentos, dando lugar a un aumento del tamaño luminal (subsegmento distal 1 mm, D+0,88; D+0,23 y D+1,35 mm2; subsegmento distal 2 mm, D+0,67; D+0,04 y D+1,24 mm2; subsegmento distal 3 mm, D+0,17; D-0,63 y D+1,72 mm2; subsegmento distal 4 mm, D+0,51; D-0,36 y D+1,42 mm2; subsegmento distal 5 mm, D+0,63; D-0,10 y D+1,61 mm2 en cambios en el área del vaso, la placa y el lumen respectivamente).
A los 6 meses de seguimiento, el porcentaje de tejido fibrolipídico se incrementó en todos los subsegmentos, aunque el tejido fibroso mostró un comportamiento más heterogéneo, con el tejido calcificado y el núcleo necrótico disminuido en los diez subsegmentos analizados (fig. 1).
DISCUSIÓN
Los hallazgos más relevantes de este estudio fueron los siguientes: a) en el borde proximal y distal, se observaron remodelados vasculares expansivos de forma seriada, con un aumento del área media del vaso y luminal en todo el borde desde el inicio del estudio al seguimiento; b) en los primeros tres subsegmentos adyacentes a la zona proximal del stent se observó el aumento más prominente del área media de la placa, lo que coincide con los resultados obtenidos en los estudios Taxus II y Taxus IV11,15, y c) por lo general, se observó un aumento significativo del tejido fibrolipídico en los segmentos proximal y distal, mientras que el tejido calcificado y el núcleo necrótico se vieron reducidos con el transcurso del tiempo.
Los cambios seriados en la composición tisular pueden variar dependiendo de su ubicación (borde proximal o borde distal), las condiciones de la fuerza de cizallamiento16, las características morfológicas (grado de obstrucción) del segmento y la composición tisular presentadas al inicio del estudio. Por último, también influye el grado de lesión de las paredes del vaso después de la dilatación17. El proceso de respuesta a la lesión tras un implante de stent ha sido ampliamente descrito10 en estudios histológicos en modelos animales y humanos. La reestenosis es secundaria a la acumulación de células de músculo liso y matriz extracelular, que contiene proteoglucanos, ácido hialurónico y colágeno (tipos I y III). Dicha matriz extracelular modula el crecimiento neointimal y el remodelado10. El tipo tisular en DRF de EIV que se correlaciona con la matriz extracelular es el tejido fibrolipídico, que resultó ser uno de los que más aumentó en este estudio, y se observó también un remodelado positivo en ambos bordes del stent a los 6 meses. Se ha propuesto el remodelado seriado como el mejor enfoque para evaluar los cambios geométricos acontecidos en la pared del vaso18. En este sentido, otros estudios previos con el stent Taxus® han descrito este fenómeno en los bordes. En particular, en el Taxus II11 sólo se observó remodelado positivo en el borde distal tanto en el grupo con Taxus de liberación lenta como con el de liberación moderada, debido a un aumento del tamaño de la placa, pero apenas se produjeron cambios en el tamaño luminal. Por otra parte, en el Taxus IV15 no se observaron apenas modificaciones en el tamaño del vaso en el borde proximal, pero sí una tendencia hacia el remodelado negativo en el borde distal. Es difícil poner en perspectiva estos tres estudios, ya que todos ellos cuentan con un tamaño de muestra diferente, y los autores de Taxus IV admitieron un posible sesgo en la selección. Por lo tanto, aunque este estudio presenta una muestra pequeña, ha logrado una caracterización más completa de los cambios seriados.
En este estudio, no se implantó un stent en las zonas con considerables núcleos necróticos (borde proximal, 17% ± 13,5%; borde distal, 18,5% ± 16,5%); por otra parte, no se observó ninguna trombosis debida a los stents en esta pequeña cohorte de pacientes. Como mecanismos patológicos de la trombosis por stent se han propuesto la implantación de stents en placas con núcleos necróticos y prolapso tisular considerables, así como la perturbación de las placas en la proximidad del segmento19 arterial con stent20. La técnica DRF-EIV es capaz de caracterizar el núcleo necrótico con gran sensibilidad y especificidad14 y además proporciona un análisis geométrico de cada marco, lo que permite evaluación combinada del núcleo necrótico y del tamaño de la placa. Por lo tanto, la captura de imágenes DRFEIV antes de implantar un stent puede aportar datos sobre la extensión de la placa y del núcleo necrótico dentro y más allá del segmento donde se realizará el implante. Esta última evaluación es importante, ya que últimamente la implantación de stents se ha realizado de segmentos arteriales «normales» a «normales» en la angiografía; sin embargo, debe evitarse la perturbación de zonas adyacentes con abundancia de núcleos necróticos que en la angiografía aparecen como zonas «sin enfermedad». En efecto, se ha informado que la cobertura incompleta de las placas ateroscleróticas coronarias con stents farmacoactivos puede repercutir a largo plazo en los sucesos clínicos, especialmente en las placas con un núcleo necrótico considerable19. No obstante, en este estudio se observó una disminución del núcleo necrótico en ambos extremos durante el seguimiento. Queda por dilucidar si este hecho está relacionado con la presencia del stent en sí o incluso con el tipo de fármaco que libere.
Las limitaciones de este estudio son diversas. En primer lugar, la cohorte de pacientes es pequeña, pero ello se debe a la naturaleza exploratoria con la que se concibió el estudio, sin intención de establecer una hipótesis estadística formal. En segundo lugar, hubiera sido ideal estudiar los efectos de todo el segmento cubierto con stent además de los bordes; pero como ya mencionamos, no existe una validación de la caracterización tisular de los tejidos situados detrás de los pun-tales del stent, ya que éstos podrían interferir con el proceso de backscattering (retrodispersión) del tejido situado detrás. Para el seguimiento, 6 meses puede resultar un período relativamente corto para evaluar plenamente los cambios tisulares acaecidos en los bordes del stent, sobre todo si se tiene en cuenta que se aconseja un seguimiento angiográfico más largo para la mejor valoración de las respuestas vasculares en estas zonas.
CONCLUSIONES
Se observó un remodelado vascular expansivo y seriado en los bordes proximal y distal del stent, para acomodar un crecimiento tisular principalmente causado por un aumento del tejido fibrolipídico.
Full English text available from: www.revespcardiol.org
VÉASE EDITORIAL EN PÁGS. 1001-6
ABREVIATURAS
AT: área transversal.
DRF: datos de radiofrecuencia.
EIV: ecocardiografía intravascular.
Correspondencia:
Dr. P.W. Serruys.
Thoraxcenter, Bd583a.
Dr. Molewaterplein
40. 3015-GD. Rotterdam. Países Bajos.
Correo electrónico: p.w.j.c.serruys@erasmusmc.nl
Recibido el 30 de noviembre de 2007.
Aceptado para su publicación el 13 de marzo de 2008.