Aunque la incidencia de las enfermedades cardiovasculares asociadas clásicamente al virus de la inmunodeficiencia humana (VIH) ha disminuido de forma considerable con la terapia antirretroviral, el riesgo cardiovascular, y en especial el de cardiopatía isquémica, es más elevado en los pacientes con infección por VIH que en los individuos no infectados. Esto se debe a la interacción de factores dependientes del paciente con factores dependientes del virus, así como factores asociados a la terapia antirretroviral. Con el aumento de la esperanza de vida y la cronicidad de la infección por el VIH, la enfermedad cardiovascular ha pasado a ser una causa importante de morbilidad y mortalidad en los pacientes con VIH. En los países desarrollados, la manifestación cardiovascular más frecuente del VIH es la cardiopatía isquémica. En la actualidad, no es infrecuente encontrar pacientes con VIH que tienen un síndrome coronario agudo y, dada la importancia de las interacciones farmacocinéticas de los fármacos antirretrovirales, es importante conocer qué tratamientos cardiovasculares son seguros en este grupo de pacientes. El enfoque ideal sería tratar de mitigar el riesgo cardiovascular en los pacientes con VIH mediante el empleo de medidas de prevención primaria específicas. Todas estas cuestiones se abordan en esta revisión que tiene como objetivo ser útil al cardiólogo clínico que afronta el tratamiento de pacientes con VIH que presentan cardiopatía isquémica o tienen un riesgo cardiovascular elevado en la práctica clínica diaria.
Palabras clave
El problema de las enfermedades cardiacas asociadas al virus de la inmunodeficiencia humana (VIH) se ha abordado de una forma general en el artículo de Boccara y Cohen1 publicado en Revista Española de Cardiología. Estos autores resaltan el aumento del riesgo cardiovascular (CV) existente en la población con VIH en comparación con el de la población general. En esta revisión, presentamos una revisión detallada de los mecanismos y la evaluación adecuada del riesgo CV en los pacientes con VIH, haciendo especial hincapié en las interacciones farmacológicas de la terapia antirretroviral con la medicación utilizada en la prevención CV primaria y secundaria, aspecto este que consideramos esencial en el control del riesgo CV de los pacientes con VIH.
LA ENFERMEDAD CARDIOVASCULAR COMO CAUSA DE MUERTE EN LOS PACIENTES CON VIHLa infección por VIH y el estadio más avanzado de dicha infección, el síndrome de inmunodeficiencia adquirida (sida), tienen repercusiones sanitarias y sociales a nivel mundial y continúan planteando un verdadero reto al sistema de salud2. Los datos de Naciones Unidas ponen de manifiesto que en la actualidad hay más de 35 millones de personas en todo el mundo que viven con el VIH; en España se diagnostican cada día 10 nuevos casos3.
La era del VIH se inició oficialmente el 5 de junio de 1981 cuando el Center for Disease Control and Prevention de los Estados Unidos convocó una conferencia de prensa en la que se presentaron 5 casos de neumonía causados por Pneumocystis carinii (denominado actualmente Pneumocystis jiroveci). En los meses siguientes se hallaron varios casos de sarcoma de Kaposi. Aunque los médicos estaban familiarizados tanto con la neumonía por P. carinii como con el sarcoma de Kaposi, la aparición conjunta de ambas entidades en varios pacientes fue un hecho que llamó la atención. La mayoría de los pacientes eran varones homosexuales sexualmente activos, muchos de los cuales tenían también otras enfermedades crónicas que más tarde se identificaron como infecciones oportunistas. Los análisis de sangre indicaron que estos pacientes no tenían un número suficiente de un tipo de células sanguíneas denominadas linfocitos T CD4. La mayor parte de estos pacientes fallecían en el plazo de pocos meses. La era de la terapia antirretroviral se inició 5 años después, con el primer ensayo clínico llevado a cabo con zidovudina en 1986. Posteriormente se desarrollaron nuevos fármacos antirretrovirales, pero durante los 10 primeros años este tratamiento antirretroviral resultó ineficaz. El tratamiento antirretroviral de gran actividad (TARGA) se instauró en 1996. Antes de la introducción del TARGA, la mortalidad era de 20 casos por 100.000 personas al año. Tras la introducción del TARGA, se redujo a 2 casos por 100.000 personas al año4.
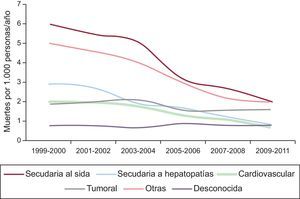
Según lo indicado por el estudio Data Collection on Adverse Effect of Anti-HIV Drugs (DAD)5, en el que se incluyó a pacientes con infección por VIH tratados con TARGA entre marzo de 1999 y febrero de 2011 en diferentes continentes, las causas de muerte más frecuentes en los pacientes con VIH (figura 1) eran el sida, seguido del cáncer, la hepatopatía y en cuarto lugar, las enfermedades CV (11% de la mortalidad total). En este grupo de pacientes, el infarto agudo de miocardio (IAM) suponía un 54,5% de la mortalidad CV. En dicho estudio, la mortalidad, en especial la mortalidad asociada al sida, se redujo de forma progresiva, debido principalmente al uso generalizado de una terapia antirretroviral de eficacia creciente en los países desarrollados. Con el empleo del TARGA, la esperanza de vida ha aumentado considerablemente, hasta el punto de que se aproxima a la de la población general. La mortalidad CV se redujo también significativamente en los pacientes con VIH durante el periodo de realización del estudio DAD, con una reducción de más del 65% entre 1999 y 2011. Aunque las muertes por causas CV disminuyeron también durante este intervalo de tiempo en la población general, la reducción fue aún mayor en los pacientes con VIH. Esta disminución no se explica solo por el TARGA en sí; es consecuencia también del aumento de uso de los exámenes de detección sistemática y del control temprano de los factores de riesgo CV, así como del aumento de las medidas preventivas a lo largo del periodo de estudio (p. ej., dejar de fumar, dieta, ejercicio, tratamiento hipolipemiante), que condujeron a una reducción de la incidencia de la enfermedad CV. Por tanto, en los países desarrollados, la morbilidad y la mortalidad en los pacientes infectados por VIH han dejado de depender exclusivamente de las manifestaciones características del sida (como las enfermedades oportunistas), tal cual ocurría en los primeros años, y en cambio, la enfermedad CV ha pasado a ser una causa importante de muerte6.
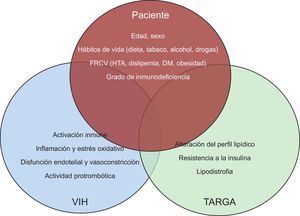
PATOGENIA DE LA ENFERMEDAD CARDIOVASCULAR EN LOS PACIENTES CON VIHEl riesgo CV aumenta en los pacientes infectados por VIH. Dicho riesgo se debe a lo siguiente: a) factores intrínsecos del paciente, como la mayor prevalencia de los factores clásicos de riesgo CV, b) factores asociados al propio VIH, como la activación inmunitaria, la inflamación y la inmunodeficiencia, y c) factores asociados a la terapia antirretroviral, principalmente por sus alteraciones metabólicas (figura 2)7.
Interacción entre las características de los pacientes, la infección por VIH y la terapia antirretroviral en la aparición de la enfermedad cardiovascular. DM: diabetes mellitus; FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial; TARGA: tratamiento antirretroviral de gran actividad; VIH: virus de la inmunodeficiencia humana.
- •
La edad se asocia a una disfunción orgánica progresiva. Con la mayor esperanza de vida y la cronicidad de la infección, los pacientes con VIH tienen una mayor propensión a desarrollar enfermedad CV, que anteriormente se veía limitada por su esperanza de vida más corta como consecuencia de la infección en sí por VIH.
- •
Se ha demostrado que el sexo masculino se asocia a un aumento del riesgo de enfermedad CV, debido principalmente al efecto protector de los estrógenos durante el periodo de fertilidad de la mujer. Dado que la infección por VIH es más frecuente en los varones, esto conlleva un aumento del riesgo CV en comparación con el de la población general.
- •
El consumo de drogas, cuya incidencia es mayor en los pacientes con VIH que en la población general, se ha asociado a un aumento del riesgo de enfermedad CV.
- •
Los pacientes infectados por VIH tienen unos valores de presión arterial superiores a los de la población general. Se cree que esto se debe en gran parte al efecto del propio VIH, así como a la terapia antirretroviral, aunque por el momento no se ha identificado ningún fármaco antirretroviral como agente causal.
- •
La incidencia de la dislipemia está también aumentada en los pacientes infectados por el VIH, principalmente en relación con el TARGA. Estas cuestiones se comentan con mayor detalle en los apartados siguientes.
- •
La incidencia de la resistencia a la insulina y de la diabetes mellitus (DM) ha aumentado también en los pacientes con exposición al TARGA.
- •
Los pacientes con VIH presentan cambios en la distribución de la grasa corporal, debido en parte a todas las anomalías metabólicas antes mencionadas. La lipodistrofia, que consiste en una acumulación anormal de la grasa corporal, con un predominio a nivel abdominal y visceral y pérdida de la grasa de las mejillas y las extremidades, es característica de los pacientes con VIH y se produce de forma secundaria al empleo de algunos fármacos antirretrovirales; su presencia se asocia a un aumento del riesgo de enfermedad CV.
Así pues, los pacientes con VIH muestran una prevalencia superior de los factores de riesgo CV tradicionales8. Uno de los subanálisis del estudio DAD investigó el papel de los factores de riesgo CV tradicionales en los pacientes con VIH que presentaban un IAM y recibían tratamiento con TARGA. La edad, el sexo masculino, el tabaquismo, la hipertensión, la DM, la dislipemia y el hecho de tener una puntuación de Framingham de moderada a alta se asociaron a un aumento del riesgo de IAM en los pacientes con VIH, en comparación con la población general9.
Contribución de la infección por VIHTras ajustar por los factores de riesgo CV tradicionales, los pacientes con infección por VIH presentan un riesgo de enfermedad CV un 50% superior al de las personas no infectadas10. Este riesgo aumenta notablemente si el número de células CD4 es más bajo. El papel que desempeña el VIH en la enfermedad CV depende de varios factores:
- •
En primer lugar, la replicación viral estimula la activación inmunitaria. Se ha propuesto que el aumento de los valores de linfocitos activados CD4 y CD8 se asocia a un mayor grado de disfunción endotelial y un aumento de la tasa de eventos aterotrombóticos. Sin embargo, varios estudios relacionados con esta cuestión han mostrado resultados poco homogéneos. Por lo que respecta a la inmunidad innata, recientemente se ha observado una relación entre la activación de los monocitos/macrófagos y la aterosclerosis medida con el grosor de íntima-media de la arteria carótida11,12.
- •
En un estudio reciente se observó una asociación entre la infección por citomegalovirus en pacientes con VIH asintomáticos y el aumento de la aterosclerosis y la enfermedad CV subclínica. Se obtuvieron resultados similares respecto a la infección por el virus herpes simple tipo 2 y también con la infección por el virus de la hepatitis C13.
- •
El VIH fomenta la vasoconstricción, la inflamación y la disfunción endotelial a través de la proteína TAT. Así pues, el VIH fomenta el depósito de lípidos y la formación de la placa ateroesclerótica14.
- •
Por último, la cuestión que tal vez sea más llamativa es que la inflamación secundaria a la infección desempeña un papel importante en el desarrollo de la aterosclerosis. La inflamación afecta a las células endoteliales y fomenta un estado de hipercoagulabilidad que conduce a la aterosclerosis y la rotura de las placas15.
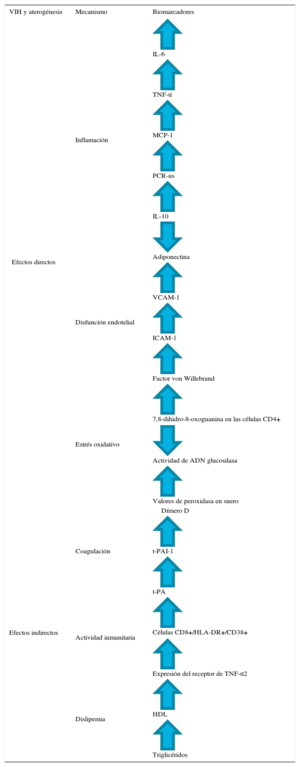
En la tabla 1 se resumen los diferentes biomarcadores en los que se han observado alteraciones en ensayos clínicos de pacientes con VIH y sin tratamiento antirretroviral. El VIH causa una desregularización de la coagulación, con un aumento de los marcadores de la fibrinolisis, como el dímero D o el factor von Willebrand16. En este sentido, se ha observado que el TARGA reduce el grado de inflamación y la activación inmunitaria. Sin embargo, ambos procesos persisten en un nivel más elevado en los pacientes con VIH que en la población general y, por consiguiente, el riesgo CV sigue siendo también más alto17.
Biomarcadores en pacientes con VIH sin terapia antirretroviral y su papel en la aterosclerosis
| VIH y aterogénesis | Mecanismo | Biomarcadores |
|---|---|---|
| Efectos directos | Inflamación | IL-6 |
| TNF-α | ||
| MCP-1 | ||
| PCR-us | ||
| IL-10 | ||
| Adiponectina | ||
| Disfunción endotelial | VCAM-1 | |
| ICAM-1 | ||
| Factor von Willebrand | ||
| Estrés oxidativo | 7,8-dihidro-8-oxoguanina en las células CD4+ | |
| Actividad de ADN glucosilasa | ||
| Valores de peroxidasa en suero | ||
| Efectos indirectos | Coagulación | Dímero D |
| t-PAI-1 | ||
| t-PA | ||
| Actividad inmunitaria | Células CD8+/HLA-DR+/CD38+ | |
| Expresión del receptor de TNF-α2 | ||
| Dislipemia | HDL | |
| Triglicéridos |
HDL: lipoproteínas de alta densidad; HLA-DR: antígeno leucocitario humano-relacionado con antígeno D; ICAM: molécula de adhesión intercelular; IL: interleucina; MCP-1: proteína quimioatrayente monocitaria-1; PCR-us: proteína C reactiva de alta sensibilidad; TNF: factor de necrosis tumoral; t-PA: activador de plasminógeno tisular; t-PAI-1: inhibidor de activador de plasminógeno de tipo tisular 1; VCAM: molécula de adhesión celular vascular.
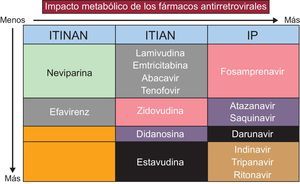
La terapia antirretroviral se asocia a un aumento del riesgo de enfermedad CV en los pacientes con VIH, si bien el mecanismo no se conoce todavía por completo. Cada fármaco antirretroviral difiere de los demás en la forma en que contribuye a incrementar el riesgo CV, principalmente al causar trastornos lipídicos y metabólicos, como la resistencia a la insulina (figura 3)18,19.
En la actualidad, existen en España 6 grupos terapéuticos de fármacos antirretrovirales, con mecanismos de acción diferentes, lo que a veces permite combinarlos para potenciar sus acciones terapéuticas. Los inhibidores de la transcriptasa inversa análogos nucleósidos (ITIAN) y los inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINAN) retardan la acción de la enzima transcriptasa inversa, que es la enzima utilizada por el VIH para cambiar su ARN en ADN viral e impiden la creación de nuevo material genético; de esta forma, el VIH no es capaz de controlar el centro de mando de la célula CD4. Los inhibidores de la proteasa (IP) impiden el ensamblaje de nuevos virus, mediante la inhibición de la enzima proteasa empleada por el VIH para cortar y ensamblar nuevas partículas virales. Aunque haya nuevas partículas virales, estas no pueden ensamblarse de la forma correcta y el virus defectuoso no es capaz de infectar otras células. Los inhibidores de fusión actúan en la primera etapa del ciclo de replicación del VIH bloqueando el VIH en una fase del ciclo de vida del virus completamente diferente de la de los demás fármacos. Esto es muy importante para el tratamiento de las personas que han desarrollado una resistencia a otros fármacos o no los toleran.
En la tabla 2 se resumen los principales fármacos empleados en el TARGA, junto con sus efectos adversos metabólicos y CV más frecuentes20. El tratamiento preferido suele ser una combinación de 2 inhibidores de la transcriptasa inversa análogos de nucleósidos (generalmente tenofovir y emtricitabina, aunque también es frecuente la asociación de abacavir y lamivudina) con un inhibidor de la integrasa (p. ej., dolutegravir o elvitegravir potenciados con cobicistat), o un IP (p. ej., darunavir o ritonavir), o un ITINAN (p. ej., rilpivirina o efavirenz), aunque hay otras combinaciones que pueden usarse como alternativa21.
Fármacos antirretrovirales y su riesgo cardiovascular
| Inhibidores de la proteasa | |
| Atazanavir | Dislipemia, disminución de la filtración glomerular |
| Darunavir | Dislipemia |
| Fosamprenavir | Dislipemia |
| Indinavir | Dislipemia, diabetes mellitus |
| Lopinavir | Dislipemia, disminución de la filtración glomerular |
| Saquinavir | Dislipemia |
| Tipranavir | Dislipemia, hemorragia intracraneal |
| Inhibidores de la transcriptasa inversa no análogos nucleósidos | |
| Efavirenz | Dislipemia |
| Etravirina | |
| Neviparina | |
| Rilpivirina | Disminución de la filtración glomerular |
| Inhibidores de CCR5 | |
| Maraviroc | Cardiopatía isquémica |
| Inhibidores de la integrasa | |
| Dolutegravir | Disminución de la filtración glomerular |
| Elvitegravir | Disminución de la filtración glomerular |
| Raltegravir | |
| Inhibidores de la transcriptasa inversa análogos nucleósidos | |
| Abacavir | Cardiopatía isquémica |
| Estavudina | Dislipemia |
| Didanosina | Cardiopatía isquémica, dislipemia |
| Emtricitabina | |
| Lamivudina | |
| Tenofovir | Disminución de la filtración glomerular |
| Zidovudina | Dislipemia |
| Inhibidores de fusión | |
| Enfuvirtida | |
| Potenciadores | |
| Cobicistat | Disminución de la filtración glomerular |
| Ritonavir | Disminución de la filtración glomerular |
Aunque el TARGA no es capaz de erradicar la infección por el VIH, mantiene la supresión de la replicación viral, restableciendo y preservando el estado inmunitario mediante el aumento del número de linfocitos CD4. De esta forma, el TARGA reduce la morbilidad y la mortalidad asociadas al VIH, así como otras comorbilidades, y mejora la calidad de vida. La administración de TARGA se recomienda actualmente para todos los pacientes con infección por el VIH, con independencia de los valores de CD4, si bien la calidad de la evidencia existente al respecto difiere según cuál sea el recuento de células CD4. El estudio SMART puso de manifiesto que la terapia antirretroviral debe prescribirse de forma indefinida, excepto en el caso de que se produzcan determinados incidentes22,23.
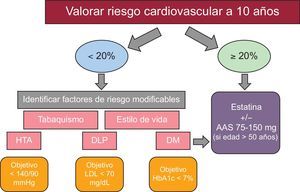
PREVENCIÓN DE LA ENFERMEDAD CARDIOVASCULARSegún lo indicado por las guías de práctica más recientes de la European Society of AIDS21, se recomienda una monitorización anual centrada en los factores de riesgo CV tradicionales (hipertensión, DM, dislipemia), con una evaluación de los cambios de la composición corporal y también realizando un electrocardiograma. Es imprescindible evaluar el riesgo CV en el momento del diagnóstico de la infección por VIH y antes de la introducción del TARGA. Para la evaluación del riesgo CV no está indicada una ecocardiografía de forma sistemática en pacientes con VIH asintomáticos. Además, se recomienda la evaluación del riesgo CV con la puntuación de Framingham en todos los varones de edad superior a 40 años y en las mujeres de más de 50 años sin enfermedad CV. Aunque la utilidad de la puntuación de Framingham en los pacientes con VIH es subóptima debido a que tiende a infravalorar el riesgo de enfermedad CV, su empleo es razonable como primera evaluación del riesgo CV. Existe una calculadora de riesgo online que permite estimar el riesgo CV con la puntuación de Framingham, así como con la puntuación EuroSIDA y la puntuación de riesgo del DAD, que puede consultarse en la página web de farmacovigilancia del VIH24,25. En todos los pacientes con un riesgo CV elevado (> 20%), se recomienda un ajuste del TARGA (p. ej., contemplar la posible sustitución de zidovudina o abacavir por tenofovir, o el uso de un tratamiento sin ITINAN), además de una adherencia estricta a los objetivos terapéuticos CV20,26,27, con las intervenciones de estilo de vida apropiadas (tabla 3).
Intervenciones de estilo de vida en pacientes con VIH
| Asesoramiento alimentario | • La intervención alimentaria no debe interferir en las necesidades de alimentación requeridas para una absorción adecuada de los fármacos antirretrovirales • Mantener un consumo calórico equilibrado con el gasto energético • Limitar el consumo de grasas saturadas, colesterol y carbohidratos refinados • Reducir el consumo total de grasas a < 30% y el colesterol de la dieta a < 300 mg/d • Recomendar el consumo de verduras, frutas y cereales y leguminosas con fibra • Reducir el consumo de bebidas y alimentos con azúcares añadidos • Elegir y preparar alimentos con poca sal o sin sal. El objetivo es consumir < 1.500mg de sodio al día • Recomendar el consumo de pescado, aves (sin piel) y carne magra • Contemplar una consulta a un dietista y llevar un diario de consumo de alimento y bebida de 1 semana para detectar calorías «ocultas» • Evitar las comilonas («dieta yo-yo») • En las personas con emaciación y dislipemia asociadas al VIH, abordar primero la emaciación y considerar la remisión a un dietista • A las personas con un sobrepeso evidente se les debe recomendar una reducción de peso. No se recomiendan las dietas de hambre (posible disminución de los mecanismos de defensa inmunitarios). Debe abordarse la desnutrición si se observa su presencia • El consumo de alcohol debe limitarse a no más de 1 bebida al día en las mujeres y 2 bebidas al día en los varones (< 20-40 g/día). • En concreto, en las personas con hepatopatía, problemas de adherencia, aumento insuficiente de las células CD4, tumores, tuberculosis previa, diarrea y otros trastornos asociados a un consumo elevado de alcohol, debe recomendarse una reducción o abandono total del consumo de alcohol |
| Fomento del ejercicio | • Fomentar un estilo de vida activo para prevenir y tratar la obesidad, la hipertensión y la diabetes • Recomendar una actividad física de nivel moderado y autocontrolada (p. ej., subir escaleras, ir en bicicleta o caminando al trabajo, ciclismo, natación, senderismo) • Recomendar un ejercicio regular, de intensidad moderada, más que un ejercicio enérgico • Alcanzar una buena forma cardiovascular (p. ej., caminar diariamente 30 min a paso ligero > 5 días a la semana) • Mantener la fuerza muscular y la flexibilidad articular |
VIH, virus de la inmunodeficiencia humana.
En la figura 4 se muestra un esquema para la prevención de la enfermedad CV. El tratamiento farmacológico para el control de los factores CV tradicionales se reserva para determinados subgrupos en los que los posibles beneficios superan los efectos adversos. En algunas personas se obtiene un efecto beneficioso con el empleo de varias intervenciones combinadas. Por cada 10mmHg de reducción de la presión sistólica, por cada 39mg/dl (1 mmol/l) de reducción del colesterol total y por el uso de ácido acetilsalicílico, el riesgo de cardiopatía isquémica se reduce en un 20-25% con cada intervención, y este efecto es aditivo28,29. Los estudios observacionales sugieren que dejar de fumar reduce el riesgo de cardiopatía isquémica en aproximadamente un 50%, y este efecto es aditivo también respecto al de otras intervenciones30.
La incidencia de la DM es 4 veces superior en los pacientes con VIH en comparación con la población general31. Dado el aumento de riesgo de resistencia a la insulina, se recomienda la determinación de la glucohemoglobina al inicio del TARGA, y entre 4 y 12 semanas después del inicio de un nuevo tratamiento, así como cada 3-6 meses con un TARGA estable. Es importante señalar que los valores de glucohemoglobina en los pacientes infectados por el VIH que reciben una terapia antirretroviral, en especial con abacavir, tienden a infravalorar la diabetes tipo 2. Además, el estado prediabético es importante también, puesto que tanto la intolerancia a la glucosa como el deterioro de la glucosa basal en ayunas aumentan la morbilidad y la mortalidad CV y elevan el riesgo de presentar DM en entre 4 y 6 veces. A estas personas se les debe recomendar un cambio de estilo de vida y se deben evaluar y tratar sus factores de riesgo CV. Para el tratamiento, se recomienda el mismo algoritmo terapéutico que para la población sin VIH, y la primera opción recomendada para el tratamiento farmacológico es el empleo de metformina (es importante tener presente que puede agravar la lipodistrofia). La insulina es el tratamiento de elección cuando no hay respuesta a otros fármacos antidiabéticos. Las demás opciones terapéuticas se plantean como último paso terapéutico ya que no hay ensayos clínicos en pacientes infectados por el VIH.
Tanto el virus VIH como su tratamiento pueden inducir una dislipemia, con un aumento de la frecuencia de patrones con valores bajos de lipoproteínas de alta densidad y altos de lipoproteínas de baja densidad, de colesterol total y de triglicéridos. El TARGA interfiere en la acción de los fármacos hipolipemiantes, en especial las estatinas, y ambos tratamientos son metabolizados por el citocromo P450 (excepto la pravastatina)32. Hasta el momento no se dispone de ensayos clínicos que hayan demostrado una reducción de los eventos CV con los fármacos hipolipemiantes en pacientes infectados por el VIH y, por consiguiente, sus indicaciones son las mismas que en los pacientes no infectados y se basan en un cálculo del riesgo CV global. En estudios pequeños se ha evidenciado que la atorvastatina a una dosis de 40mg reduce el volumen de placa no calcificada, mientras que la rosuvastatina a una dosis de 10mg reduce el índice de íntima-media carotídeo. Así pues, las estatinas son el tratamiento de elección, puesto que son seguras y eficaces (excepto la simvastatina y la lovastatina debido a su riesgo de toxicidad superior con los IP), y deben prescribirse a todas las personas con una enfermedad vascular establecida y/o con DM o un riesgo elevado de enfermedad CV, con independencia de los valores de lípidos existentes. El fármaco de elección es la atorvastatina, dado su perfil de eficacia, su tolerabilidad, la experiencia existente con su uso y el precio. En la actualidad se está realizando un ensayo clínico (RETRIEVE: Randomized Trial to Prevent Vascular Events in HIV), que tiene como objetivo incluir en la aleatorización a 6.500 pacientes con VIH y sin enfermedad CV, para comparar una estatina con un placebo, con objeto de analizar detalladamente la utilidad de las estatinas en la prevención primaria en pacientes infectados por el VIH. La ezetimiba puede usarse en pacientes infectados por el VIH que no toleran las estatinas, o puede añadirse a una estatina cuando las reducciones obtenidas de las lipoproteínas de baja densidad son insuficientes a pesar del empleo de la dosis máxima tolerada de la estatina. Los fibratos (gemfibrozilo y fenofibrato) pueden usarse para el tratamiento de la hipertrigliceridemia grave (> 500mg/dl) que es refractaria a la dieta, así como en las personas con antecedentes de pancreatitis asociada a ella. La combinación de estatinas y fibratos no se recomienda ya que favorece sistemáticamente la toxicidad de ambos fármacos. En los pacientes con múltiples factores de riesgo CV, recomendamos iniciar un TARGA con fármacos que tengan un buen perfil metabólico. En los pacientes que ya están siendo tratados con un TARGA y desarrollan trastornos metabólicos o presentan un empeoramiento del riesgo CV, se recomienda evaluar un cambio de los fármacos antirretrovirales, incluso antes de iniciar un tratamiento hipolipemiante, siempre que no se comprometa su efectividad.
Se ha descrito la presencia de hipertensión en más del 28% de los pacientes infectados por el VIH, con una tasa que aumenta a medida que avanza la edad en esta población33. El abordaje terapéutico y los objetivos del tratamiento son los mismos que en la población general. El umbral de presión arterial es < 140/90mmHg y < 130/80mmHg se considera apropiado en los pacientes diabéticos. Por lo que respecta al tratamiento, los fármacos de elección parecen ser los inhibidores de la enzima de conversión de la angiotensina, debido a su perfil de seguridad y sus efectos beneficiosos metabólicos (en especial en los pacientes prediabéticos y diabéticos). Los antagonistas de receptores de angiotensina II pueden usarse también de forma segura (en especial el valsartán, el candesartán y el olmesartán). Con los antagonistas del calcio, se necesitan ajustes de dosis y vigilar los posibles efectos adversos, dadas sus posibles interacciones. Los bloqueadores beta, en especial el atenolol, son seguros, mientras que hay poca información sobre las interacciones farmacológicas de los diuréticos, en especial con los IP, aunque parecen ser seguros.
INFARTO AGUDO DE MIOCARDIOLos pacientes con infección por VIH tienen un riesgo CV superior al de la población general, con un aumento de 1,5-2 veces en el riesgo de IAM y a una edad más temprana34. En el estudio DAD, la frecuencia de los IAM aumentó de 0,27 por 1.000 personas por año en los individuos de entre 25 y 30 años, a 16,99 por 1.000 personas por año en los de edad superior a 70 años35. Se ha propuesto que los cambios inmunológicos que se producen en los pacientes con VIH son similares a los que se dan con la edad (disminución del número de células CD4), lo que sugiere que el virus causa un envejecimiento prematuro del sistema inmunitario, un proceso denominado inmunosenescencia. La tasa de incidencia de IAM fue de 0,43 casos por 1.000 personas/años en los individuos con unos antecedentes de infección por VIH de 5 años o menos, de 0,86 casos por 1.000 personas/años en los que tenían unos antecedentes de 5 a 10 años de infección por VIH, de 1,06 casos por 1.000 personas/años en los que tenían antecedentes de 10 a 15 años, y de 2,65 casos por 1.000 personas/años en los que habían vivido con el VIH durante más de 15 años. Una posible explicación es la exposición a los fármacos antirretrovirales36,37. El estudio HOPS puso de manifiesto una asociación entre el tratamiento con IP y la aparición de un IAM, que se mantenía inalterada tras introducir un ajuste respecto a otros factores de riesgo CV38. Por otra parte, el riesgo de IAM aumentaba significativamente cuando los recuentos de células CD4 disminuían a menos de 100μl. Después de introducir un ajuste respecto a la edad, la exposición a fármacos antirretrovirales, el valor mínimo del recuento de células CD4 y los valores actuales de células CD4, se observó que unos antecedentes de 10 años de infección por el VIH aumentaban el riesgo de IAM de la misma forma que un aumento de edad de 10 años, por lo que un individuo de 40 años que se hubiera infectado a la edad de 30 años tenía un riesgo de IAM similar al de una persona de 50 años sin infección por VIH. Así pues, los médicos deben tener en cuenta el momento en el que se ha producido la infección por el VIH como un factor de riesgo CV independiente, y deben fomentar un estilo de vida saludable desde la perspectiva CV (p. ej., control del peso, dieta saludable para el corazón, ejercicio, dejar de fumar) en los pacientes con infección por VIH de larga evolución.
Con objeto de comparar el pronóstico de los pacientes con VIH tras sufrir un IAM con el de los pacientes sin infección por el virus, un equipo de investigadores de Estados Unidos evaluó la mortalidad asociada a IAM en un grupo de pacientes entre los años 1997 y 2006, utilizando los datos de la Nationwide Inpatient Sample39. Los pacientes infectados por el VIH fueron de una edad significativamente inferior (48 y 54 años, respectivamente; p < 0,001) y mostraron una menor probabilidad de que se les realizara una angiografía coronaria (48 frente a 63%). Después de un ajuste de los resultados en cuanto a edad, sexo, origen étnico, comorbilidades, tipo de hospital y número de intervenciones hospitalarias practicadas a los participantes, el riesgo de muerte en el hospital por IAM fue un 38% superior en el grupo con infección por VIH (odds ratio = 1,38; intervalo de confianza del 95%, 1,01-1,87; p=0,04). En consecuencia, durante la hospitalización debida a un IAM, la mortalidad de los pacientes con VIH es superior a la de la población general, y ello debe ser tenido en cuenta por los médicos que tratan a pacientes con VIH hospitalizados por esta causa. Además, la mortalidad no solo es superior durante el periodo de hospitalización, sino también durante todo el seguimiento, con tasas más elevadas de reestenosis del stent, así como un mayor número de reingresos por causas CV, según se ha evidenciado en el registro de Francia, cuyos resultados de comparar a 608 pacientes infectados por el VIH con IAM con 1.216 pacientes no infectados se publicaron en el año 201340.
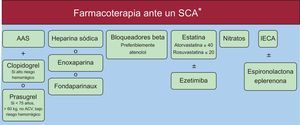
En consecuencia, dado que la enfermedad coronaria aterosclerótica se produce de manera más temprana y tiene un peor pronóstico en los pacientes con VIH, debemos centrar nuestros esfuerzos en un tratamiento más agresivo de estos pacientes, tanto desde el punto de vista de las medidas intervencionistas, como por lo que respecta al tratamiento médico. Así pues, en los pacientes infectados por el VIH que presentan un IAM debe realizarse de forma temprana una angiografía coronaria y una revascularización percutánea, con el empleo de stents farmacoactivos de nueva generación. Por lo que respecta al tratamiento antitrombótico, debe administrarse un tratamiento antiagregante plaquetario combinado doble, con clopidogrel o prasugrel (debe usarse este último fármaco en los pacientes con un riesgo de hemorragia bajo, edad < 75 años, peso > 60 kg y sin antecedentes de ictus previo). El ticagrelor tiene importantes interacciones con los IP. Se debe tratar a estos pacientes con bloqueadores beta (atenolol como fármaco de primera elección) y estatinas potentes (atorvastatina 40mg o rosuvastatina 10-20mg), así como con inhibidores de la enzima de conversión de la angiotensina y eplerenona, según haya o no indicación. Por lo que respecta a las medicaciones antianginosas, el uso de nitratos es seguro, pero no deben indicarse fármacos como la ranolazina y la ivabradina en pacientes tratados con IP (figura 5).
Fármacos que se deben tener en cuenta en los pacientes con un SCA. AAS: ácido acetilsalicílico; IECA: inhibidores de la enzima de conversión de la angiotensina; SCA: síndrome coronario agudo. *No recomendado el uso de ivabradina o ranolazina en pacientes tratados con inhibidores de la proteasa.
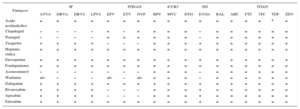
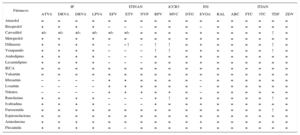
Hay un número considerable de pacientes con infección por VIH a los que se trata con varias medicaciones, además de los fármacos antirretrovirales. Las interacciones de los fármacos antirretrovirales entre sí o con otros medicamentos pueden tener repercusiones clínicas importantes. Las interacciones más significativas suelen ser farmacocinéticas (y dan lugar a un cambio de la concentración), sobre todo las que afectan al metabolismo. En la tabla 4, la tabla 5 y la tabla 6 se muestran las interacciones más frecuentes de los fármacos CV con la terapia antirretroviral, utilizando un código de colores: el rojo indica que no se recomienda la combinación de los fármacos, el naranja indica que el fármaco se recomienda con un ajuste de la dosis, el amarillo indica la existencia de una interacción débil que no requiere ajuste de la dosis, y el verde indica una ausencia de interacción. Antes de prescribir un tratamiento CV a un paciente con infección por el VIH, es necesario asegurarse de que no hay interacciones relevantes con el TARGA, con objeto de elegir el tratamiento que tenga el mejor perfil de efectividad/seguridad.
Interacción de los fármacos antirretrovirales con los antiagregantes plaquetarios y los anticoagulantes
| Fármacos | IP | ITINAN | iCCR5 | INI | ITIAN | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ATV/r | DRV/c | DRV/r | LPV/r | EFV | ETV | NVP | RPV | MVC | DTG | EVG/c | RAL | ABC | FTC | 3TC | TDF | ZDV | |
| Ácido acetilsalicílico | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | * | = |
| Clopidogrel | – | – | – | – | + | – | + | = | = | = | – | = | = | = | = | = | = |
| Prasugrel | – | – | – | – | = | = | = | = | = | = | – | = | = | = | = | = | = |
| Ticagrelor | + | + | + | + | – | – | – | = | = | = | + | = | = | = | = | = | = |
| Heparina sódica | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = |
| Enoxaparina | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = |
| Fondaparinaux | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = |
| Acenocumarol | – | – | – | – | – | – | – | = | = | = | – | = | = | = | = | = | = |
| Warfarina | +/– | – | – | – | +/– | – | +/– | = | = | = | – | = | = | = | = | = | = |
| Dabigatrán | + | + | + | + | = | = | = | + | = | = | + | = | = | = | = | = | = |
| Rivaroxabán | + | + | + | + | – | – | – | = | = | = | + | = | = | = | = | = | = |
| Apixabán | + | + | + | + | – | – | – | = | = | = | + | = | = | = | = | = | = |
| Edoxabán | + | + | + | + | = | = | = | = | = | = | + | = | = | = | = | = | = |
3TC: lamivudina; ABC: abacavir. ATV/r: atazanavir potenciado con ritonavir; DRV/c: darunavir potenciado con cobicistat; DRV/r: darunavir potenciado con ritonavir; DTG: dolutegravir; EFV: efavirenz; ETV: etravirina; EVG/c: elvitegravir potenciado con cobicistat; FTC: emtricitabina; iCCR5: inhibidor de receptor de coquimiocina 5; INI: inhibidores de la integrasa; IP: inhibidores de la proteasa; ITIAN: inhibidores de transcriptasa inversa análogos de nucleósidos; ITINAN: inhibidores de transcriptasa inversa no análogos de nucleósidos; LPV/r: lopinavir potenciado con ritonavir; MVC: maraviroc; NVP: nevirapina.
Código de colores: el rojo indica que no se recomienda la combinación de los fármacos, el naranja indica que el fármaco se recomienda con un ajuste de la dosis, el amarillo indica la existencia de una interacción débil que no requiere ajuste de la dosis, y el verde indica una ausencia de interacción. Esta tabla se muestra a todo color solo en la versión electrónica del artículo.
– Indica una posible disminución del fármaco de la primera columna.
+ Indica un posible aumento del fármaco de la primera columna.
+/– Indica un posible aumento o disminución del fármaco de la primera columna (no predecible).
= Ausencia de interacción significativa.
* Nefrotoxicidad.
Interacción de los fármacos antirretrovirales con otros fármacos cardiovasculares
| Fármacos | IP | ITINAN | iCCR5 | INI | ITIAN | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ATV/r | DRV/c | DRV/r | LPV/r | EFV | ETV | NVP | RPV | MVC | DTG | EVG/c | RAL | ABC | FTC | 3TC | TDF | ZDV | |
| Atenolol | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = |
| Bisoprolol | + | + | + | + | – | – | – | = | = | = | – | = | = | = | = | = | = |
| Carvedilol | +/– | +/– | +/– | +/– | +/– | +/– | = | = | = | = | + | = | = | = | = | ↑ | = |
| Metoprolol | + | + | + | + | = | = | = | = | = | = | + | = | = | = | = | = | = |
| Diltiazem | + | + | + | + | – | – ↑ | – | ↑ | ↑ | = | + | = | = | = | = | ↑ | = |
| Verapamilo | + | + | + | + | – | – | – | ↑ | ↑ | = | + | = | = | = | = | ↑ | = |
| Amlodipino | + | + | + | + | – | – | – | = | = | = | + | = | = | = | = | = | = |
| Lecarnidipino | + | + | + | + | – | – | – | = | = | = | + | = | = | = | = | = | = |
| IECA | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = |
| Valsartán | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = |
| Irbesartán | – | – | – | – | + | + | = | = | = | = | – | = | = | = | = | = | = |
| Losartán | – | – | – | – | + | + | = | = | = | = | – | = | = | = | = | = | = |
| Nitratos | – | – | – | – | + | + | + | = | + | = | – | = | = | = | = | = | = |
| Ranolazina | + | + | + | + | – | – | – | + | ↑ | = | + | = | = | = | = | ↑ | = |
| Ivabradina | + | + | + | + | – | – | – | + | = | = | + | = | = | = | = | = | = |
| Furosemida | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | ↑ | = |
| Espironolactona | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = |
| Amiodarona | + | + | + | + | = | = | = | = | = | = | + | = | = | = | = | + | = |
| Flecainida | + | + | + | + | = | – | = | = | = | = | + | = | = | = | = | = | = |
3TC: lamivudina; ABC: abacavir; ATV/r: atazanavir potenciado con ritonavir; DRV/c: darunavir potenciado con cobicistat; DRV/r: darunavir potenciado con ritonavir; DTG: dolutegravir; EFV: efavirenz; ETV: etravirina; EVG/c: elvitegravir potenciado con cobicistat; FTC: emtricitabina; iCCR5: inhibidor de receptor de coquimiocina 5; IECA: inhibidores de la enzima de conversión de la angiotensina; INI: inhibidores de la integrasa; IP: inhibidores de la proteasa; ITIAN: inhibidores de transcriptasa inversa análogos de nucleósidos; ITINAN: inhibidores de transcriptasa inversa no análogos de nucleósidos; LPV/r: lopinavir potenciado con ritonavir; MVC: maraviroc; NVP: nevirapina; RAL: raltegravir; RPV: rilpivirina; TDF: tenofovir; ZDV: zidovudina.
Código de colores: el rojo indica que no se recomienda la combinación de los fármacos, el naranja indica que el fármaco se recomienda con un ajuste de la dosis, el amarillo indica la existencia de una interacción débil que no requiere ajuste de la dosis, y el verde indica una ausencia de interacción. Esta tabla se muestra a todo color solo en la versión electrónica del artículo.
– Indica una posible disminución del fármaco de la primera columna.
+ Indica un posible aumento del fármaco de la primera columna.
+/– Indica un posible aumento o disminución del fármaco de la primera columna (no predecible).
↑ Indica un posible aumento de los valores plasmáticos del fármaco antirretroviral.
= Ausencia de interacción significativa.
Interacción de los fármacos antirretrovirales con los fármacos hipolipemiantes
| Fármacos | IP | ITINAN | iCCR5 | INI | ITIAN | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ATV/r | DRV/c | DRV/r | LPV/r | EFV | ETV | NVP | RPV | MVC | DTG | EVG/c | RAL | ABC | FTC | 3TC | TDF | ZDV | |
| Atorvastatina | + | + | + | + | – | – | – | = | = | = | + | = | = | = | = | = | = |
| Fluvastatina | = | = | = | = | + | + | = | = | = | = | + | = | = | = | = | = | = |
| Lovastatina | + | + | + | + | – | – | – | = | = | = | + | = | = | = | = | = | = |
| Pitavastatina | + | + | + | + | = | = | = | = | = | = | + | = | = | = | = | = | = |
| Pravastatina | = | + | + | = | – | = | = | = | = | = | + | = | = | = | = | = | = |
| Rosuvastatina | + | + | + | + | = | = | = | = | = | = | + | = | = | = | = | = | = |
| Simvastatina | + | + | + | + | – | – | – | = | = | = | + | = | = | = | = | = | = |
| Fenofibrato | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = |
| Gemfibrozilo | – | – | – | – | = | = | = | = | = | ↑ | = | ↑ | = | = | = | = | = |
| Ezetimiba | + | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = | = |
3TC: lamivudina; ABC: abacavir; ATV/r: atazanavir potenciado con ritonavir; DRV/c: darunavir potenciado con cobicistat; DRV/r: darunavir potenciado con ritonavir; DTG: dolutegravir; EFV: efavirenz; ETV: etravirina; EVG/c: elvitegravir potenciado con cobicistat; FTC: emtricitabina; iCCR5: inhibidor de receptor de coquimiocina 5; INI: inhibidores de la integrasa; IP: inhibidores de la proteasa; ITIAN: inhibidores de transcriptasa inversa análogos de nucleósidos; ITINAN: inhibidores de transcriptasa inversa no análogos de nucleósidos; LPV/r: lopinavir potenciado con ritonavir; MVC: maraviroc; NVP: nevirapina; RAL: raltegravir; RPV: rilpivirina; TDF: tenofovir; ZDV: zidovudina.
Código de colores: el rojo indica que no se recomienda la combinación de los fármacos, el naranja indica que el fármaco se recomienda con un ajuste de la dosis, el amarillo indica la existencia de una interacción débil que no requiere ajuste de la dosis, y el verde indica una ausencia de interacción. Esta tabla se muestra a todo color solo en la versión electrónica del artículo.
– Indica una posible disminución del fármaco de la primera columna.
+ Indica un posible aumento del fármaco de la primera columna.
+/– Indica un posible aumento o disminución del fármaco de la primera columna (no predecible).
= Ausencia de interacción significativa.
Otro aspecto a tener en cuenta es la elevada prevalencia de la coinfección de VIH y virus de la hepatitis C, ya que ambos virus tienen vías de transmisión comunes. En consecuencia, dado que a menudo se administran conjuntamente tratamientos para ambas entidades en estos pacientes, y puesto que recientemente se han comercializado nuevos tratamientos para la hepatitis C, es esencial tener en cuenta las posibles interacciones entre el TARGA y estos nuevos fármacos41.
CONCLUSIONESEn la actualidad, la enfermedad CV más frecuente asociada al VIH en los países desarrollados con acceso a la terapia antirretroviral es la cardiopatía isquémica. Los pacientes con VIH tienen un perfil cardiovascular más desfavorable como consecuencia de la propia infección y del tratamiento antirretroviral, y su pronóstico es también menos favorable que el de los pacientes no infectados. Además, cuando se tratan pacientes con VIH que presentan cardiopatía isquémica, los médicos deben estar familiarizados con las interacciones farmacológicas existentes entre la terapia antirretroviral y los fármacos antitrombóticos, así como con aquellos tratamientos utilizados para controlar el riesgo cardiovascular.
CONFLICTO DE INTERESESNinguno.