Palabras clave
INTRODUCCIÓN
En 1980 se publicaron los primeros casos1 de cirugía para los pacientes con hipoplasia de cavidades izquierdas, aunque con mortalidad hospitalaria al principio elevada2. La alternativa del trasplante neonatal3, inicialmente prometedora, se vio pronto limitada por la escasez de donantes de bajo peso. En los últimos años, la evolución de las técnicas quirúrgicas4 y la mejora de los resultados en el estadio I del Norwood5 han permitido ofrecer expectativas reales de supervivencia a los neonatos con hipoplasia de cavidades izquierdas. Sin embargo, en la evolución de los pacientes que sobreviven a la cirugía neonatal, el desarrollo de obstrucción en el arco aórtico, distorsión de las arterias pulmonares6-8, disfunción ventricular derecha o insuficiencia tricuspídea puede impedir que se complete el Fontan y condicionar una mortalidad interestadios superior a la observada en otras formas de circulación univentricular9. La detección precoz de estas complicaciones mediante técnicas de imagen (ecografía, resonancia magnética [RM], tomografía computarizada [TC] multicorte) y su tratamiento mediante técnicas de hemodinámica intervencionista son cruciales para mejorar la supervivencia a largo plazo y la calidad de vida de estos pacientes. De ahí que el seguimiento de estos niños tras el estadio I siga siendo un reto para los equipos médico-quirúrgicos implicados en su tratamiento.
MÉTODOS
Desde diciembre de 1992 a diciembre de 2006, 30 pacientes con diagnóstico de hipoplasia de cavidades izquierdas fueron sometidos a cirugía tipo Norwood: 24 mediante técnica de Norwood clásico y 6 mediante Norwood modificado (técnica de Sano), con una supervivencia del 56% (17 de 30). Entre febrero de 1993 y diciembre de 2006 se realizaron 25 procedimientos intervencionistas, previos a la realización de Glenn o Fontan, en 14 de los 17 pacientes que habían sobrevivido a la cirugía neonatal. Revisamos las historias, los informes quirúrgicos y los hallazgos angiohemodinámicos de estos 14 pacientes. Los diagnósticos neonatales fueron: atresia mitroaórtica con tamaño de aorta ascendente entre 1,5 y 5 mm de diámetro (n = 11), síndrome de Shone (n = 1), atresia mitral con comunicación interventricular e hipoplasia del arco aórtico (n = 1) y ventrículo único con hipoplasia del arco (n = 1). Se había intervenido a 10 de los pacientes con la técnica de Norwood clásica (fístula Blalock-Taussig modificada derecha) y a 4 con la técnica modificada de Sano (conducto de ventrículo derecho a arterias pulmonares). La edad a la que se realizó el cateterismo intervencionista osciló entre los 2 meses y los 11,9 años (media, 2,1 años) y el peso fue 3,3-31 (9,7 ± 6,7) kg. El tiempo de seguimiento desde la cirugía neonatal ha sido de 3,7 ± 4,3 años (intervalo, 6 meses-13,5 años). Los cateterismos se realizaron con anestesia general e intubación orotraqueal y profilaxis antibiótica con cefazolina, y mediante punción percutánea de arteria femoral y vena femoral o vena yugular. En el estudio hemodinámico tras el estadio I se prestó especial atención a descartar la obstrucción en la neoaorta (gradiente pico, > 15 mmHg), gradiente interauricular, función ventricular derecha, estado de la fístula Blalock-Taussig o el conducto ventrículo derecho-arteria pulmonar, presiones y resistencias pulmonares, y anatomía del árbol pulmonar. Tras el estadio II (Glenn) se estudió, además, la estenosis de la anastomosis de vena cava superior-arteria pulmonar derecha, posibles fístulas venovenosas desde el territorio de la vena cava superior, la anatomía de la vena cava inferior y las venas suprahepáticas, y la permeabilidad de los accesos arteriales femorales y los venosos femorales y yugulares. En el seguimiento tras los procedimientos intervencionistas se empleó ecocardiografía en todos, RM en 8, TC multicorte en 1 y cateterismo en 5.
RESULTADOS
Recoartación
En 8 (57%) de los 14 pacientes se observó obstrucción significativa en el neoarco aórtico (gradiente pico ventrículo derecho-aorta descendente ≥ 15 mmHg, con imagen angiográfica de reducción del calibre > 50%). No encontramos diferencia significativa en la incidencia de recoartación entre los pacientes en los que se había utilizado tejido heterólogo para la reconstrucción del arco aórtico (5/9) y los que no (3/5). El tiempo transcurrido entre la cirugía Norwood I y el diagnóstico de recoartación fue de 9,5 meses (4 meses-2,5 años). Se realizaron 9 angioplastias a 7 pacientes (en uno de ellos se desestimó la angioplastia por inestabilidad hemodinámica y fue remitido a cirugía), utilizando la arteria femoral (vía retrógrada) en 7 y la vía venosa femoral (vía retrógrada) en 2 (por estenosis de arteria femoral). Se consiguió angioplastia inicialmente efectiva en 6/7 pacientes (85%) (fig. 1), pero 2 presentaron en el seguimiento nueva recoartación y fueron sometidos a una segunda angioplastia, que fue efectiva en uno de ellos; se derivó al otro a cirugía. Las características de los pacientes en los que se realizó angioplastia de recoartación, así como los datos angiohemodinámicos, se resumen en la tabla 1.
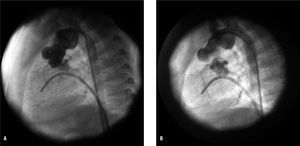
Fig. 1. A: recoartación en paciente de 4 meses y 3,3 kg de peso (técnica quirúrgica: reconstrucción de arco sin tejido heterólogo), con máximo gradiente de 35 mmHg y diámetro de la lesión de 2,8 mm. B: tras la angioplastia con balón Tyshak mini (Numed®) de 7 mm, gradiente de 0 mmHg y diámetro de la estenosis de 5 mm.
Angioplastias de arterias pulmonares
En cuanto a la afección de las arterias pulmonares, se realizaron 10 angioplastias en 7 pacientes (3 casos presentaron restenosis precoz tras una angioplastia inicialmente efectiva). De los 10 niños a los que se había realizado Norwood clásico (fístula Blalock-Taussig a arteria pulmonar derecha), encontramos desconexión de arteria pulmonar izquierda en 2 pacientes y en un tercero, estenosis crítica en su origen. En este último caso se realizó angioplastia con balón a través de la fístula quirúrgica, con buen resultado, pero en pocos meses evolucionó a desconexión de la arteria pulmonar izquierda, por lo que finalmente se le realizó Fontan fenestrado al pulmón derecho; actualmente la paciente permanece con saturación del 85% y en grado funcional I. Otros 3 pacientes con Norwood clásico precisaron, después del estadio II y antes de la realización del Fontan, angioplastia con stent de arterias pulmonares, que se realizó por vía venosa yugular (a través del Glenn) con stents EV3 de 26 mm (n = 1), CP de Numed (n = 1, fig. 2) y Palmaz P188 (n = 1). En uno de ellos se redilató el stent al año de su implantación y en los tres se completó el Fontan con éxito.
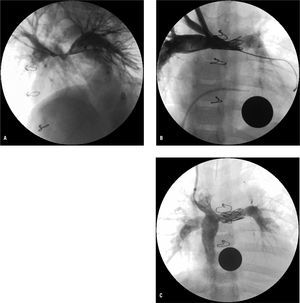
Fig. 2. A: angiografía (oblicua anterior izquierda) en paciente de 3 años, con Norwood clásico y Glenn, que desarrolló hipoplasia severa de la zona de confluencia entre ambas arterias pulmonares. B: angiografía anteroposterior tras angioplastia con balón y posterior implantación de stent CP de 22 mm (Numed®). C: angiografía en vena cava inferior tras completar el Fontan, 6 meses después de la redilatación del stent.
De los 4 pacientes operados con la técnica de Sano, 3 precisaron angioplastia de arterias pulmonares, que se realizó en 2 casos con catéter balón (debido al escaso peso de los pacientes y el pequeño tamaño de sus arterias pulmonares) a través del conducto o del Glenn, y en otro paciente al que se había realizado doble Glenn por persistencia de vena cava superior izquierda, se implantó stent CP de Numed de 22 mm de longitud sobre «balón en balón» de 8 mm en el segmento de las arterias pulmonares comprendido entre las dos cavas, que había ido quedando progresivamente hipoplásico (fig. 3). Los detalles angiohemodinámicos y de la técnica empleada en las angioplastias de arterias pulmonares se exponen en la tabla 2.
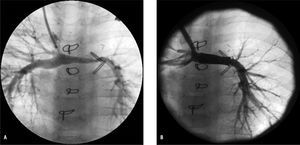
Fig. 3. A: angiografía en vena cava superior en paciente con Norwood Sano y Glenn, con doble vena cava superior, que desarrolla hipoplasia de arteria pulmonar izquierda (calibre mínimo de 2,2 mm). B: angiografía postangioplastia con stent CP de Numed de 22 mm de longitud implantado sobre balón en balón de 8 mm; la arteria pulmonar izquierda presenta ahora calibre mínimo de 6,4 mm.
Embolizaciones
Un paciente con Glenn precisó embolización (con coils) de colaterales venosas desde la vena cava superior derecha al territorio de vena cava inferior, que mejoró su saturación del 75 al 84%; otra niña con Glenn desarrolló repermeabilización de una vena cava superior izquierda a seno coronario (embolización con dispositivo oclusor Amplatzer para ductus 6/4 por vía venosa anterógrada desde la vena femoral; fig. 4); en otro paciente con Glenn al que se había realizado fístula Blalock-Taussig izquierdo para favorecer el desarrollo de su arteria pulmonar izquierda, que presentaba hipoplasia importante, ésta fue posteriormente embolizada con oclusor Amplatzer para ductus 6/4 al completar el Fontan.
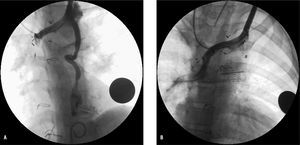
Fig. 4. A: angiografía en vena innominada en paciente con Glenn, que muestra repermeabilización de una vena cava superior izquierda a seno coronario. B: angiografía en vena innominada tras embolización con dispositivo oclusor Amplatz para ductus 6/4, implantado desde vena femoral mediante asa venovenosa.
Angioplastia con catéter balón del Glenn
Se practicó en 2 pacientes, y fue efectiva en ambos (desaparición del gradiente y del síndrome de vena cava superior) y sin reestenosis en el seguimiento.
Fibrinolisis
Una paciente de 16 meses de edad y 8 kg de peso, con doble cava superior, presentó trombosis de vena cava superior izquierda y arteria pulmonar izquierda en el noveno día del postoperatorio del Glenn; para evitar la reintervención quirúrgica, se realizó fibrinolisis con urocinasa a través de catéter de 5 Fr en vena cava superior izquierda, sin que se produjeran complicaciones hemorrágicas. Otros hallazgos en los estudios angiográficos de estos pacientes, y sobre los que no se realizaron técnicas intervencionistas, fueron: estenosis de troncos supraaórticos en 6 pacientes, estenosis en las arterias femorales (n = 2), trombosis venosa femoral (n = 5) o de vena subclavia (n = 1).
Como complicaciones de los cateterismos intervencionistas se registraron: isquemia arterial en 2 pacientes, tratada en un caso con perfusión de heparina durante 24 h y en otro con fibrinolisis con activador tisular del plasminógeno (r-TPA); parada cardiaca o bradicardia que precisó reanimación (n = 4), bloqueo auriculoventricular transitorio (n = 1).
DISCUSIÓN
Aunque la presentación de nuestros resultados quirúrgicos en el estadio I de la cirugía de Norwood no es el motivo de este trabajo, la supervivencia del 56% que presentamos refleja nuestra curva de aprendizaje y el escaso número de pacientes operado en ese período y coincide con los resultados publicados recientemente por otro equipo médico-quirúrgico español10.
La aparición de gradientes obstructivos en el arco aórtico es una de las complicaciones más frecuentemente observadas tras la cirugía tipo Norwood y su detección no es siempre fácil mediante ecocardiografía11. El desarrollo de recoartación se ha relacionado en estos pacientes con disfunción ventricular derecha, insuficiencia tricuspídea, disminución del flujo sistémico y aumento de la mortalidad interestadios8,12, por lo que la indicación de angioplastia en estos enfermos se hace con gradientes inferiores a los empleados para la recoartación simple (no asociada a cardiopatía compleja), siempre y cuando la imagen angiográfica sea también indicativa de estenosis significativa (disminución del calibre aórtico > 40-50%12). Debido a la frecuente existencia de estenosis de troncos supraaórticos, la ausencia o escasa magnitud del gradiente tensional no invasivo no descartó la indicación de angioplastia si el gradiente hemodinámico y la imagen angiográfica indicaban estenosis significativa. La incidencia publicada de recoartación oscila entre el 9,2 y el 45%13-15, diferencias que se explican por las distintas técnicas quirúrgicas empleadas en la reconstrucción del arco16, la experiencia de los equipos quirúrgicos (menor incidencia de recoartación en las series más largas), las diferentes definiciones de recoartación empleadas (en algunos trabajos se consideran gradientes hemodinámicos > 25, 17 o 20 mmHg13, en otros > 10 o 15 mmHg18 o incluso criterios angiográficos16), y los distintos tiempos de seguimiento. La elevada incidencia de recoartación observada en nuestra serie se explica por incluirse a pacientes con gradientes ≥ 15 mmHg, tener un tiempo de seguimiento superior al de algunas de las series y, por supuesto, por ser una serie poco extensa y que incluye nuestra experiencia inicial en el estadio I del Norwood. Nuestros resultados en la angioplastia con balón de la recoartación, con una eficacia inicial del 85%, son superponibles a los publicados por otros autores (82%-100%)12,13,18,19, así como la incidencia de nueva recoartación tras la primera angioplastia (el 28% en nuestra serie y entre el 2013 y el 44% en la literatura)19. Las peculiaridades anatómicas de la neoaorta, así como la corta edad a la que los pacientes presentan la recoartación, determinaron en algunos casos necesidad de emplear balones de tamaño relativamente grande para el peso de los niños, lo que derivó en complicaciones arteriales agudas (2/7 pacientes) y estenosis de arterias femorales a largo plazo. La introducción en los últimos años de catéteres de menor perfil (Tyshak mini, Numed®) ha permitido disminuir la incidencia de este tipo de complicaciones. El abordaje anterógrado, desde la vena femoral, permite la utilización de introductores de mayor perfil, pero es más difícil la estabilización del balón durante la angioplastia y comporta el riesgo de lesión de las válvulas tricúspide y pulmonar (que ahora son las sistémicas, y cuya competencia es fundamental para la fisiología tipo Fontan). Además, y coincidiendo con lo publicado12,18,20,21, la angioplastia percutánea en estos pacientes se asocia, con mayor frecuencia que en otros pacientes recoartados, a inestabilidad hemodinámica e incluso necesidad de reanimación cardiopulmonar durante el procedimiento. En nuestra experiencia, esta complicación se observó en 2 pacientes; en uno pudo completarse la angioplastia y el otro fue remitido a cirugía.
En cuanto a la afección de las arterias pulmonares, la técnica modificada de Sano (shunt desde el ventrículo derecho) evitó en nuestros pacientes el problema de la desconexión o hipodesarrollo de la arteria pulmonar izquierda, pero no evitó las estenosis de arterias pulmonares en la zona de inserción del conducto22. La incidencia de estenosis significativa de ramas pulmonares tras la cirugía Norwood (antes del Glenn o Fontan o incluso después de éste) referida en la literatura oscila entre el 40 y el 62%23,24. En nuestra serie observamos especial tendencia a presentar estenosis severas y/o hipodesarrollo en la zona de confluencia entre ambas arterias pulmonares, donde pueden quedar restos de tejido ductal, y que resulta más difícilmente accesible al cirujano por quedar posterior a la neoaorta ascendente, habitualmente dilatada. Otro factor posiblemente implicado en el hipodesarrollo de esta zona es la presencia de doble cava superior, pues tras el Glenn el flujo de cada vena cava superior se dirige a la arteria pulmonar ipsolateral; 2 de los 3 pacientes que precisaron stent en esa zona presentaban doble cava superior. Otra de las peculiaridades de las angioplastias de arterias pulmonares realizadas en pacientes tras los estadios I o II es que presentan elevada incidencia de reestenosis (posiblemente por persistencia de tejido ductal), pero también suele tratarse de pacientes de bajo peso y pequeño tamaño de las arterias pulmonares que no permiten en algunos casos la implantación de stents redilatables. Para el seguimiento de estas estenosis tras la angioplastia, es fundamental la utilización de la RM o angiografía por TC. La implantación de stents de menor tamaño (coronarios o periféricos) y que precisan introductores de menor tamaño podría ser una opción, pero limitan el desarrollo de la arteria y con el crecimiento somático del paciente acaban creando una estenosis. En nuestros pacientes, intentamos utilizar la angioplastia con balón en los pacientes más pequeños (aunque precisaran redilatación por reestenosis a corto o medio plazo), y retrasar la implantación del stent para emplear stents redilatables (Palmaz, Ev3 o CP de Numed) a través de vainas de 10-11 Fr, que se introdujeron sin complicaciones por la vena yugular en niños de hasta 10 kg de peso. Quizá en el futuro el empleo de nuevos stents pediátricos, como los reabsorbibles25 (Biotronik) o redilatables de bajo perfil (growth stent)26, aún en fase de ensayo clínico, podrían facilitar y mejorar el tratamiento de estas lesiones. Por otra parte, la implantación de stents en la zona de la confluencia de las arterias pulmonares puede condicionar la técnica quirúrgica empleada en el estadio III: en 2 de nuestros pacientes con el stent en esta posición el conducto extracardiaco desde vena cava inferior tuvo que ser anastomosado a la arteria pulmonar derecha, frente a la conexión del Glenn (fig. 2B), y el postoperatorio transcurrió sin complicaciones.
El desarrollo de colaterales venosas o la recanalización de conexiones embriológicas desde el territorio de la vena cava superior son complicaciones descritas tras la cirugía tipo Glenn27, más frecuentes en los pacientes con gradiente transpulmonar (resistencia arteriolar pulmonar, es decir, diferencia entre la presión pulmonar media y la presión media de la aurícula izquierda) más elevado28, que en ocasiones puede precisar embolización al causar hipoxemia significativa, como ocurrió en 2 de nuestros pacientes.
El papel de la hemodinámica intervencionista es crucial en el seguimiento de los pacientes que tras el estadio I del Norwood (cirugía neonatal con reconstrucción compleja del arco aórtico y suturas en el árbol pulmonar) han de conseguir las condiciones óptimas para el Fontan. La mejora en las técnicas quirúrgicas y el aumento en la experiencia de los equipos probablemente disminuyan la incidencia a corto plazo de recoartación o distorsión de ramas pulmonares, pero no hay que olvidar que los pacientes experimentan un importante crecimiento somático antes y después de completar el estadio III.
En el futuro, las nuevas técnicas híbridas para el estadio I (banding de las arterias pulmonares más stent en el ductus, angioplastia de coartación y ampliación del tabique interauricular por vía percutánea)29, aunque aún en fase de ensayo clínico, podrían acrecentar todavía más el papel de la hemodinámica intervencionista en el manejo de la hipoplasia de cavidades izquierdas.
CONCLUSIONES
Tras la cirugía tipo Norwood, debe realizarse una valoración angiohemodinámica precoz para detectar y tratar estenosis de arterias pulmonares y/o del arco aórtico. Aunque la angioplastia de la recoartación puede ser efectiva, la reestenosis es frecuente. La técnica de Sano evita la desconexión de la pulmonar izquierda, pero pueden aparecer también estenosis de arterias pulmonares. Tras el estadio II, debe estudiarse si hay colaterales venovenosas, pues éstas con frecuencia precisan embolización. El cateterismo terapéutico en estos pacientes comporta una incidencia de complicaciones mayor que en otros grupos de pacientes.
Full English text available from: www.revespcardiol.org
ABREVIATURAS
AV: auriculoventricular.
BIB balón: «balón en balón».
RM: resonancia magnética.
TC: tomografía computarizada.
Correspondencia: Dra. M.J. del Cerro Marín.
Servicio de Cardiología Pediátrica. Hospital Infantil La Paz.
P.o de la Castellana, 261. 28046 Madrid. España.
Correo electrónico: mcerro.hulp@salud.madrid.org
Recibido el 14 de mayo de 2007.
Aceptado para su publicación 10 octubre de 2007.