Palabras clave
INTRODUCCIÓN
La coronariografía es un procedimiento diagnóstico seguro, cuyo riesgo de complicaciones mayores (infarto agudo de miocardio y accidente cerebrovascular) es inferior al 0,5%, con una mortalidad menor del 0,2%1.
La ceguera cortical tras procedimientos con contraste es poco frecuente. Fue descrita inicialmente en 1970 en exploraciones neurológicas2; sin embargo, su descripción tras el cateterismo cardiaco apenas ha sido comunicada. En este artículo mostramos nuestra experiencia de 3 casos tras 22.300 coronariografías realizadas desde 1995.
CASOS CLÍNICOS
Caso 1
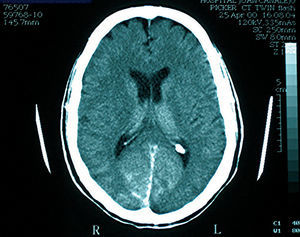
Paciente de 61 años sin alergias, hipercolesterolémico y ex fumador. Tras una coronariografía previa realizada sin complicaciones, fue sometido a triple bypass aortocoronario 1 año antes, con implantación de arteria mamaria interna (AMI) izquierda a descendente anterior (DA) e injerto libre de AMI derecha secuencial a primera diagonal (D1) y segunda marginal (OM2). Ingresa por sintomatología atípica para coronariografía, realizada por vía femoral derecha; se objetiva enfermedad de 2 vasos con oclusión de DA en origen, estenosis del 90% de D1 y el 75% en circunfleja (CX) proximal. Los injertos eran permeables y sin lesiones. Se emplearon 300 ml de contraste no iónico (Omnipaque 350 mg/ml) y 5.000 U de heparina no fraccionada. Durante la cateterización de la AMI izquierda, el paciente presentó deterioro transitorio del nivel de conciencia y posterior déficit visual bilateral completo, sin otra focalidad neurológica. Se realizó arteriografía cerebral, sin hallazgos patológicos. Durante las horas siguientes presentó cefalea, con recuperación progresiva de la visión a las 12 h. La función renal, previa y posterior al cateterismo, era normal. La tomografía computarizada (TC) cerebral a las 48 h mostró realce persistente en región occipital (fig. 1). Tres días después fue dado de alta habiendo recuperado la totalidad de la visión. Cuatro años después fue sometido a un nuevo cateterismo, sin complicaciones.
Fig. 1. Tomografía computarizada simple realizada 48 h tras el procedimiento en el caso 1: se aprecia realce persistente en la región occipital.
Caso 2
Paciente de 75 años, hipertenso, hipercolesterolémico y fumador. Ingresado por IAM sin Q. Se realizó cateterismo cardiaco por vía radial derecha, que evidenció enfermedad coronaria de 2 vasos con estenosis del 99% en CX media y OM2, así como estenosis del 75% en la coronaria derecha (CD) media y distal. Al final del diagnóstico, el paciente presentó un episodio de desorientación temporoespacial de unos minutos de duración y refirió como único déficit neurológico una pérdida de visión completa, por lo que se decidió la suspensión del procedimiento. Durante la prueba se emplearon 170 ml de contraste no iónico (Omnipaque 350 mg/ml), 5.000 U de heparina no fraccionada y cocktail espasmolítico (2,5 mg de verapamilo y 200 µg de nitroglicerina intraarterial). La exploración neurológica fue, por lo demás, normal. La función renal era normal tanto antes como tras el cateterismo. A las 10 h presentó recuperación progresiva de la agudeza visual, y en la TC craneal realizada a las 12 h no se apreciaron alteraciones significativas. A las 48 h la recuperación era completa. Una semana después se llevó a cabo nuevo cateterismo y se trataron las lesiones descritas sin complicaciones.
Caso 3
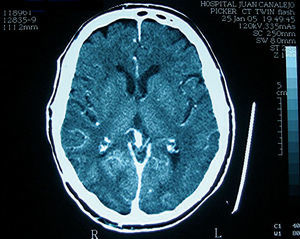
Paciente de 78 años, hipertenso y dislipémico. Sometido 9 antes años a cuádruple bypass aortocoronario con injerto terminolateral de AMI izquierda a DA media y 3 injertos de safena a D1, primera arteria coronaria obtusa marginal y descendente posterior. En los últimos años fue diagnosticado de síndrome nefrótico de etiología no filiada, en situación actual de insuficiencia renal crónica severa (aclaramiento de creatinina, 22 ml/min; creatinina sérica basal, 3 mg/dl), pendiente de iniciar diálisis. Ingresó por angina de reposo, y se realizó coronariografía por vía radial izquierda, que objetivó estenosis del 90% en injerto de AMI izquierda. Fue tratado con angioplastia coronaria transluminal percutánea (ACTP) e implante de stent. Se emplearon 624 ml de contraste no iónico (Omnipaque 350 mg/ml), 7.000 U de heparina no fraccionada, 200 µg de nitroglicerina y cocktail espasmolítico. No hubo complicaciones durante la prueba. A las 6 h refirió pérdida de visión bilateral, y el resto de la exploración neurológica fue rigurosamente normal. En la TC realizada tras 2 h del inicio de los síntomas, se aprecia impregnación de contraste en el árbol arterial y los senos venosos durales intracraneales, con realce persistente en la región occipital (fig. 2). A las 24 h, una exploración oftalmológica reveló cataratas subcapsulares posteriores y retinopatía diabética de grado I; persistía la pérdida completa de visión, que el paciente negaba en ese momento. Debido al empeoramiento de su función renal, se inició diálisis convencional.
Fig. 2. Tomografía computarizada simple realizada 2 h después del procedimiento en el caso 3: muestra impregnación de contraste en el árbol arterial y senos venosos durales e intracraneales con realce en región occipital.
En los días siguientes fue recuperando agudeza visual, y se le dio el alta a los 10 días, con recuperación prácticamente completa de la agudeza visual previa al procedimiento.
DISCUSIÓN
La ceguera cortical se caracteriza por una pérdida de percepción visual mientras se conservan intactas la motilidad ocular y la respuesta pupilar. Ha sido descrita como complicación rara del IAM, con una incidencia de un 0,3-1% de las angiografías cerebrales y vertebrales3. La incidencia estimada en la angiografía coronaria es de un 0,05%4.
Su fisiopatología es desconocida, y se han propuesto varios mecanismos, como la toxicidad directa del contraste5, microembolias6, hipoxia o edema cerebral. El empleo de soluciones hiperosmolares aumenta la permeabilidad de la barrera hematoencefálica, especialmente débil en la región occipital, lo que facilita el paso de contraste en el área del córtex visual por la baja localización durante el procedimiento7. La menor inervación simpática del territorio vertebral en comparación con el carotídeo parece favorecer este fenómeno8. La susceptibilidad a la permeabilidad de la barrera hematoencefálica es mayor en pacientes con hipertensión crónica9. La insuficiencia renal y la cantidad e hiperosmolalidad del contraste también han sido propuestas como favorecedoras de esta complicación. El hecho de que la mayoría de los casos descritos tengan bypass aortocoronario de AMI puede explicarse por la inyección de contraste a través de la arteria vertebral durante el intento de cateterización del ostium de la AMI, y la necesidad de mayor cantidad de contraste en estos pacientes.
Los casos presentados coinciden con los pocos que se ha publicado. Habitualmente los síntomas se inician durante el procedimiento o en las 12 h posteriores, con sintomatología variable que puede incluir cefalea, desorientación, náuseas, vómitos o disminución del nivel de conciencia, acompañando a una pérdida completa de visión de instauración rápida. En ocasiones, como se aprecia en nuestro tercer caso, el paciente puede negar la pérdida de visión que por la exploración es evidente, síntoma conocido como síndrome de Anton. El déficit visual se recupera progresivamente entre 6 y 48 h tras el procedimiento, y no se ha demostrado que el empleo de diuréticos, corticoides, antihistamínicos o dextranos acelere la recuperación10. Mediante la TC se aprecia en 2 de los pacientes un área de hipercaptación de contraste en la región occipital, que se resolvió en controles posteriores; las descripciones radiológicas de las TC anormales de nuestros casos coinciden con la mayoría de los publicados.
Hinchey et al11 describieron el síndrome de leucoencefalopatía posterior reversible (SLPR), consistente en un cuadro neurológico similar al descrito pero en un contexto clínico diferente (individuos hipertensos, con insuficiencia renal crónica o en tratamiento con inmunosupresores) y no sometidos a exploraciones con contraste. No está aclarado si ambos están relacionados, y se aprecian diferencias en su evolución, con una recuperación más lenta en los pacientes afectos de SLPR12.
Se trata de un trastorno raro, cuya frecuencia aumentará probablemente en los próximos años como consecuencia de la generalización de este tipo de exploraciones. Es de capital importancia reconocer su curso transitorio que no contraindica posteriores exploraciones, pues no se ha descrito recurrencias en un segundo procedimiento con contraste. Aunque su etiología y su tratamiento continúan siendo un misterio, parece razonable extremar las precauciones en la cateterización de la AMI en pacientes con revascularización miocárdica a través de este vaso, así como la utilización de contrastes de baja osmolalidad en cantidades reducidas.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. J. García de Lara.
Unidad de Hemodinámica. Hospital Virgen de la Arrixaca.
Ctra. de Madrid, s/n. 30120 Murcia. España.
Correo electrónico: garciadelara@secardiologia.es
Recibido el 19 de febrero de 2007.
Aceptado para publicación el 29 de junio de 2007.