Los pacientes ancianos con fibrilación auricular están en mayor riesgo de eventos cardioembólicos y hemorragia mayor que los más jóvenes. El cierre de la orejuela izquierda (COI) podría ser una opción atractiva para estos pacientes, pero hay pocos datos sobre los resultados del COI de pacientes de 85 o más años. El objetivo del presente estudio es evaluar la seguridad y la eficacia del COI de pacientes de 85 o más años.
MétodosSe analizó a 1.025 pacientes incluidos en el registro EWOLUTION que se habían sometido al COI, se identificó a 84 de edad ≥ 85 años y se los comparó con el grupo de menos edad.
ResultadosLos pacientes de 85 o más años tenían mayores riesgos estimados de accidente cerebrovascular y de hemorragias que los pacientes más jóvenes (edad ≥ 85 frente a <85 años: CHA2DS2-VASc, 5,2±1,2 frente a 4,4±1,6; p <0,0001; HAS-BLED, 2,7±1,1 frente a 2,3±1,2; p=0,003). Las tasas de éxito del procedimiento fueron altas y similares en ambos grupos (el 98,8 frente al 98,5%; p=0,99). No hubo diferencias en las tasas de eventos adversos relacionados con el dispositivo o el procedimiento a los 7 días (el 2,6 frente al 3,1%; p=0,80). A pesar del mayor riesgo basal de accidente cerebrovascular, en el seguimiento no hubo diferencias entre los grupos en la tasa de ictus anualizada (0,8 frente a 1,3/100 pacientes-año; p=0,649).
ConclusionesEl COI de los pacientes de edad ≥ 85 años es seguro y eficaz a pesar del alto riesgo de eventos embólicos y hemorrágicos de estos pacientes. El COI puede ser una alternativa razonable a la anticoagulación oral para estos pacientes.
Palabras clave
El cierre de la orejuela izquierda (COI) se ha convertido en una alternativa no farmacológica de prevención del ictus en pacientes de alto riesgo con fibrilación auricular no valvular a los que se considera poco adecuados para un tratamiento prolongado con anticoagulantes orales. Según varios estudios aleatorizados llevados a cabo en múltiples centros, el procedimiento es seguro, eficaz y no inferior al tratamiento con antagonistas de la vitamina K para prevenir el ictus1-3, y el seguimiento a largo plazo indica que el COI4 puede reducir la mortalidad cardiovascular. Como resultado, las guías internacionales actuales y los documentos de consenso recomiendan considerar el COI para los pacientes con alto riesgo y fibrilación auricular no valvular que tengan contraindicaciones o no sean aptos para el tratamiento prolongado con anticoagulantes orales, con alto riesgo hemorrágico o que prefieran una alternativa5,6.
Hay pocos datos sobre los resultados del COI en pacientes ancianos. En este grupo de pacientes, prevenir el ictus representa un desafío importante dado que en los pacientes de edad avanzada son mayores tanto el riesgo de sufrir eventos cardioembólicos como el de sufrir una hemorragia mayor. Los pacientes ancianos pueden ser candidatos idóneos para el COI, ya que esto permitiría interrumpir el tratamiento con anticoagulantes orales mientras se mantiene la protección cardioembólica. No obstante, puesto que estos pacientes son en general más frágiles y, por lo tanto, tienen mayor predisposición a sufrir complicaciones en los procedimientos intervencionistas, se hallan infrarrepresentados en la mayoría de los ensayos y registros. Este análisis comparó y contrastó los resultados del COI entre pacientes de edad ≥ 85 años y pacientes más jóvenes.
MÉTODOSEl presente estudio es un subanálisis del registro EWOLUTION. El estudio se ajusta a las normas internacionales para estudios científicos, los principios de la Declaración de Helsinki, con la aprobación del comité de ética local en todos los centros participantes. Todos los pacientes proporcionaron el consentimiento informado antes de someterse al procedimiento. El estudio fue financiado por la Boston Scientific Corporation. El diseño y los resultados iniciales y anuales del registro EWOLUTION se han publicado previamente7,8.
El EWOLUTION se diseñó como un estudio de cohortes no aleatorizado, prospectivo y multicéntrico. La inclusión de los pacientes de cada uno de los centros participantes si a juicio del médico responsable eran aptos para recibir el dispositivo Watchman según las recomendaciones locales e internacionales apropiadas y si eran mayores de edad para otorgar el consentimiento informado. El seguimiento de los pacientes se basó en la práctica estándar de cada institución, por lo general una visita médica entre 1 y 3 meses después de la intervención y anualmente a partir de entonces, estudios de imagen de la orejuela izquierda para evaluar el flujo residual alrededor del dispositivo y revisiones anuales de seguimiento. La relación entre cada uno de los eventos adversos y el dispositivo/intervención fue evaluada por el centro participante. El equipo de seguridad médica patrocinador del estudio revisó los eventos y los informes relevantes.
El objetivo del estudio era obtener datos sobre el éxito y las complicaciones de la intervención, así como resultados a largo plazo de los pacientes, incluidas las hemorragias y la incidencia de ictus/accidente isquémico transitorio (AIT)/embolia sistémica (ES). Las definiciones de evento adverso y evento adverso grave (EAG) y sus requisitos de notificación se basan en la ISO 14155 y la MEDDEV 2.7/3 12/2010. La hemorragia se valoró de acuerdo con los criterios del Bleeding Academic Research Consortium9; la definición de hemorragia mayor (que incluye hemorragia mortal y potencialmente mortal) se adapta a las modificaciones y mejoras específicas del COI descritas por Tzikas et al.10 en el documento de consenso sobre definiciones, criterios de valoración y requisitos para la obtención de datos. El ictus se clasificó de acuerdo con los criterios del Valve Academic Research Consortium11.
Una organización de investigación por contrato externa controló permanentemente todos los centros, que fueron visitados entre 1 y 5 veces, dependiendo del número de pacientes incluidos y de la revisión del cumplimiento, para asegurar la exactitud y la integridad de los presentes datos de seguimiento. El equipo de seguridad médica patrocinador del estudio revisó todos los eventos y los documentos de fuentes relevantes.
A efectos del presente estudio, la cohorte total se dividió en 2 grupos (< 85 años frente a ≥ 85 años). Este límite de edad arbitrario se eligió para seleccionar a un grupo de pacientes con alto riesgo, a pesar de que el tamaño de la muestra se vería limitado. Las variables continuas se expresan como media±desviación estándar y las categóricas, como número total y porcentaje. Se compararon las características basales entre los grupos utilizando el análisis ANOVA para las variables continuas y la aproximación de Monte Carlo de la prueba exacta de Fisher para las variables categóricas. La tasa de eventos se calculó mediante el método de Kaplan-Meier. Los valores de p se basan en pruebas de rangos logarítmicos para el análisis entre el tiempo transcurrido y el evento. El análisis estadístico se llevó a cabo con la versión 9.4 del SAS (SAS Institute Inc.; Cary, Carolina del Norte, Estados Unidos).
RESULTADOSUn total de 1.025 pacientes fueron programados para el implante en un total de 47 centros de 13 países distintos. Los datos previos y posteriores al implante se hallan disponibles para 1.025 y 1.020 pacientes respectivamente, puesto que 5 pacientes se retiraron del estudio después de proporcionar el consentimiento informado sin que llegara a realizarse ningún intento de implante, tal como se ha descrito anteriormente8.
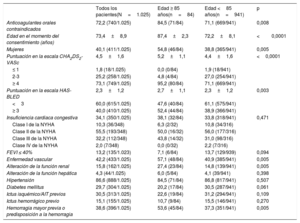
En la cohorte total, había 84 pacientes de edad ≥ 85 años. La demografía inicial y los factores de riesgo estratificados por grupos de edad se resumen en la tabla 1. Frente a los pacientes más jóvenes, en el grupo ≥ 85 años era mayor el riesgo de ictus (CHA2DS2-VASc 5,2±1,2 frente a 4,4±1,6; p <0,0001) y también el riesgo de hemorragia (HAS-BLED 2,7±1,1 frente a 2,3±1,2; p=0,003). Era considerablemente más probable también que los pacientes ancianos fueran mujeres, tuvieran antecedentes de enfermedad vascular o disfunción renal, ya hubieran sufrido una hemorragia mayor o tuvieran predisposición a las hemorragias y, como resultado, fuera más probable que se los considerase no aptos para el tratamiento con anticoagulantes orales.
Características basales
| Todos los pacientes(N=1.025) | Edad ≥ 85 años(n=84) | Edad <85 años(n=941) | p | |
|---|---|---|---|---|
| Anticoagulantes orales contraindicados | 72,2 (740/1.025) | 84,5 (71/84) | 71,1 (669/941) | 0,008 |
| Edad en el momento del consentimiento (años) | 73,4±8,9 | 87,4±2,3 | 72,2±8,1 | <0,0001 |
| Mujeres | 40,1 (411/1.025) | 54,8 (46/84) | 38,8 (365/941) | 0,005 |
| Puntuación en la escala CHA2DS2-VASc | 4,5±1,6 | 5,2±1,1 | 4,4±1,6 | <0,0001 |
| ≤ 1 | 1,8 (18/1.025) | 0,0 (0/84) | 1,9 (18/941) | |
| 2-3 | 25,2 (258/1.025) | 4,8 (4/84) | 27,0 (254/941) | |
| ≥ 4 | 73,1 (749/1.025) | 95,2 (80/84) | 71,1 (669/941) | |
| Puntuación en la escala HAS-BLED | 2,3±1,2 | 2,7±1,1 | 2,3±1,2 | 0,003 |
| <3 | 60,0 (615/1.025) | 47,6 (40/84) | 61,1 (575/941) | |
| ≥ 3 | 40,0 (410/1.025) | 52,4 (44/84) | 38,9 (366/941) | |
| Insuficiencia cardiaca congestiva | 34,1 (350/1.025) | 38,1 (32/84) | 33,8 (318/941) | 0,471 |
| Clase I de la NYHA | 10,3 (36/348) | 6,3 (2/32) | 10,8 (34/316) | |
| Clase II de la NYHA | 55,5 (193/348) | 50,0 (16/32) | 56,0 (177/316) | |
| Clase III de la NYHA | 32,2 (112/348) | 43,8 (14/32) | 31,0 (98/316) | |
| Clase IV de la NYHA | 2,0 (7/348) | 0,0 (0/32) | 2,2 (7/316) | |
| FEVI ≤ 40% | 13,2 (135/1.023) | 7,1 (6/84) | 13,7 (129/939) | 0,094 |
| Enfermedad vascular | 42,2 (433/1.025) | 57,1 (48/84) | 40,9 (385/941) | 0,005 |
| Alteración de la función renal | 15,8 (162/1.025) | 27,4 (23/84) | 14,8 (139/941) | 0,005 |
| Alteración de la función hepática | 4,3 (44/1.025) | 6,0 (5/84) | 4,1 (39/941) | 0,398 |
| Hipertensión | 86,6 (888/1.025) | 84,5 (71/84) | 86,8 (817/941) | 0,507 |
| Diabetes mellitus | 29,7 (304/1.025) | 20,2 (17/84) | 30,5 (287/941) | 0,061 |
| Ictus isquémico/AIT previos | 30,5 (313/1.025) | 22,6 (19/84) | 31,2 (294/941) | 0,109 |
| Ictus hemorrágico previo | 15,1 (155/1.025) | 10,7 (9/84) | 15,5 (146/941) | 0,270 |
| Hemorragia mayor previa o predisposición a la hemorragia | 38,6 (396/1.025) | 53,6 (45/84) | 37,3 (351/941) | 0,005 |
AIT: accidente isquémico transitorio; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: New York Heart Association.
Los valores expresan media±desviación estándar o % (n/N).
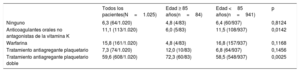
Se intentó el implante en un total de 1.020 pacientes y el dispositivo se implantó satisfactoriamente en 1.005 de los 1.020 pacientes (98,5%). Las razones de que las tentativas de implante no fueran satisfactorias fueron una anatomía poco adecuada de la orejuela izquierda (5/15, el 0,5% de las tentativas de implante) o que no se cumplían todos los criterios de estabilidad y liberación del dispositivo (9/15, el 0,9% de las tentativas de implante). En uno de los casos fue necesario interrumpir el implante debido a un derrame pericárdico, probablemente causado por el catéter pigtail. No se observaron diferencias entre los grupos con respecto al éxito de la intervención (edad ≥ 85 frente a <85 años, el 98,8 frente al 98,5%; p=0,99). Se alcanzó el sellado completo o un tamaño del chorro ≤ 5mm en el 100% de los pacientes de edad ≥ 85 años y el 99,8% de los menores de 85 años, sin diferencias entre los grupos (p=0,99). El tratamiento antitrombótico posterior al implante se resume en la tabla 2.
Tratamiento antitrombótico posterior al implante
| Todos los pacientes(N=1.025) | Edad ≥ 85 años(n=84) | Edad <85 años(n=941) | p | |
|---|---|---|---|---|
| Ninguno | 6,3 (64/1.020) | 4,8 (4/83) | 6,4 (60/937) | 0,8124 |
| Anticoagulantes orales no antagonistas de la vitamina K | 11,1 (113/1.020) | 6,0 (5/83) | 11,5 (108/937) | 0,0142 |
| Warfarina | 15,8 (161/1.020) | 4,8 (4/83) | 16,8 (157/937) | 0,1168 |
| Tratamiento antiagregante plaquetario | 7,3 (74/1.020) | 12,0 (10/83) | 6,8 (64/937) | 0,1456 |
| Tratamiento antiagregante plaquetario doble | 59,6 (608/1.020) | 72,3 (60/83) | 58,5 (548/937) | 0,0025 |
No se observaron diferencias en la incidencia de eventos adversos relacionados con el dispositivo o con el procedimiento en los siguientes 7 días (el 2,6% del grupo ≥ 85 años frente al 3,1% del <85 años; p=0,80). La distribución de los eventos ocurridos durante el procedimiento en los 2 grupos de edad se muestra en la tabla 3. No se produjeron ictus, defunción, taponamiento o embolización del dispositivo en el grupo de pacientes de edad ≥ 85 años.
Eventos cardiacos adversos mayores en los primeros 7 días tras el implante y otros eventos adversos graves relacionados con el dispositivo/procedimiento
| Todos los pacientesN=18 (1,8%) | Edad ≥ 85 añosn=2 (2,4%) | Edad <85 añosn=16 (1,7%) | |
|---|---|---|---|
| Eventos cardiacos adversos mayores en los primeros 7 días | |||
| Todas las defunciones* | 4 | Ninguna | 4 |
| Hemorragia mayor | 9 | 2 | 7 |
| Taponamiento cardiaco/DP significativo | 3 | Ninguno | 3 |
| Embolización del dispositivo que requiriera cirugía | 1 | Ninguna | 1 |
| Captura con lazo del dispositivo embolizado | 1 | Ninguna | 1 |
| Ictus | Ninguno | Ninguno | Ninguno |
| Embolia sistémica | Ninguna | Ninguna | Ninguna |
| Infarto de miocardio | Ninguno | Ninguno | Ninguno |
| Otros eventos que requieren cirugía/intervención importante | Ninguno | Ninguno | Ninguno |
| N=15 (1,5%) | n=1 (1,2%) | n=14 (1,5%) | |
|---|---|---|---|
| Otros EAG periprocedimentales en los primeros 7 días | |||
| Complicaciones vasculares a nivel de la ingle | 4 | Ninguna | 4 |
| Embolia gaseosa (coronaria) | 2 | Ninguna | 2 |
| DP menor (no tratado) | 2 | Ninguno | 2 |
| Nuevas intervenciones debidas al sellado incompleto | 2 | Ninguna | 2 |
| Hemorragia menor (no tratada)/hematoma | 2 | Ninguna | 2 |
| AIT | 1 | 1 | Ninguno |
| Hipotensión | 1 | Ninguna | 1 |
| Reacción adversa a la anestesia | 1 | Ninguna | 1 |
AIT: accidente isquémico transitorio; DP: derrame pericárdico; EAG: eventos adversos graves.
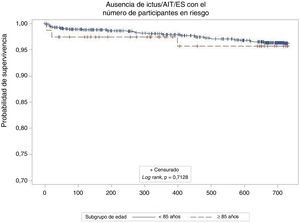
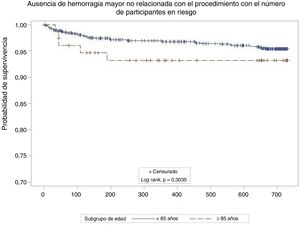
En el seguimiento —media, 732 [intervalo intercuartílico, 677-757] días— no se observaron diferencias en la incidencia anual de ictus (≥ 85 frente a <85 años, 0,8 frente a 1,3/100 pacientes-año; p=0,649) o ictus/AIT/ES entre grupos (2,5 frente a 2,0/100 pacientes-año; p=0,712) (figura 1). Esto representa una reducción del riesgo relativo del 80% comparado con la incidencia de ictus calculada en ausencia de tratamiento preventivo del ictus para puntuaciones parecidas de la escala CHA2DS2-VASc12 en ambos grupos (12,2 esperado frente a 2,5 observado en los de 85 o más años; 9,9 esperado frente a 2,0 observado en los menores de 85 años). Se produjeron 3 ictus hemorrágicos en la cohorte más joven, pero ninguno en la cohorte de personas más ancianas. No se observaron diferencias en la incidencia de hemorragia mayor no relacionada con el procedimiento (5,1 frente a 2,6/100 pacientes-año; p=0,286) (figura 2). Esto supone reducciones del riesgo relativo del 12 y el 48% comparado con la incidencia de hemorragia calculada para puntuaciones similares de la escala HAS-BLED en pacientes de 85 o más años y menpres de 85 años respectivamente. En el seguimiento fallecieron 22 pacientes (29,6%) del grupo de más edad y 135 (15,3%) del de menpres de 85 años. Se disponía de información sobre el ecocardiograma transesofágico de seguimiento del 79% de los pacientes del grupo de más edad y el 88% de los menores de 85 años. No se observaron diferencias en la incidencia de trombosis del dispositivo (el 3,9% frente al 4,3%; p=0,8755).
Este estudio demuestra que el COI es una intervención segura y eficaz en pacientes ancianos (edad ≥ 85 años). Las principales observaciones del presente estudio son las siguientes: la tasa de éxito del COI es comparable en los pacientes de 85 o más años y los menores de 85; la incidencia de EAG relacionados con el procedimiento y/o el dispositivo durante la intervención o en los 7 días posteriores es también comparable entre grupos; a pesar del mayor riesgo inicial de ictus de los pacientes ancianos, la reducción observada de ictus/AIT/ES con el COI en este grupo de edad es comparable a la observada en pacientes más jóvenes.
En los pacientes ancianos es mayor el riesgo de eventos cardioembólicos y hemorragias mayores, y en consecuencia, el COI podría ser una alternativa atractiva para estos pacientes. No obstante, dada la existencia de enfermedades concomitantes, este grupo de pacientes no está representado en la mayoría de los ensayos y registros. La media de edad fue 75±8,5 años en el registro AMPLATZER Amulet13, 75±8 años en el registro AMPLATZER Cardiac Plug14, 71,8±8,8 años en el PROTECT AF1 y 74,0±7,4 años en el ensayo PREVAIL2.
Por lo que se sabe, solo Freixa et al.15 han explorado la seguridad y la eficacia del COI en pacientes ancianos (edad <75 años frente a ≥ 75 años); estos mostraron que el COI se relacionaba con un éxito parecido de la intervención en pacientes de edad <75 y ≥ 75 años, y que la incidencia de ictus y de hemorragia mayor eran parecidas entre grupos durante el seguimiento. Del mismo modo, el presente estudio ha puesto de manifiesto el éxito de la intervención en pacientes ancianos (el 100% en ≥ 85 años) sin diferencias entre pacientes más jóvenes y de más edad. Además, el COI sería seguro en pacientes ancianos sin ictus relacionado con el procedimiento ni mortalidad en el grupo de pacientes de edad ≥ 85 años. Por otra parte, no se observaron diferencias entre ambos grupos en lo que respecta a la incidencia de los EAG relacionados con la intervención y/o el dispositivo durante la intervención o en los 7 días posteriores.
La puntuación media de la escala CHA2DS2-VASc de 5,2±1,2 en pacientes ≥ 85 años indica un riesgo muy alto de eventos tromboembólicos, lo que corresponde a una incidencia anual calculada y esperada de ictus/AIT/ES de 12,2/100 pacientes/año12 sin tratamiento preventivo de ictus. No obstante, la incidencia anual de ictus/AIT/ES observada en este grupo fue tan solo de 2,5/100 pacientes/año, lo que se traduce en una reducción del riesgo relativo del 80%. Aunque la puntuación CHA2DS2-VASc fue inferior en el grupo de menores de 85 años (4,4±1,6; p <0,001), no se observaron diferencias en las incidencias anuales de ictus/AIT/ES entre los grupos (2,5 frente a 2,0; p=0,712).
Este análisis indica que el COI es seguro y eficaz en pacientes ancianos. En muchas ocasiones, se considera a los pacientes ancianos no aptos para el tratamiento con anticoagulantes orales, aunque a menudo tampoco se los considera aptos para el COI dada la mayor presencia de enfermedades concomitantes y una mayor mortalidad que en los pacientes más jóvenes, y como resultado se los deja sin protección contra el ictus. En el presente estudio, el grupo de pacientes de edad ≥ 85 años presentaba más enfermedades concomitantes que el de pacientes más jóvenes. No obstante, estas diferencias no se tradujeron en diferencias en los resultados clínicos. En el grupo de los pacientes muy ancianos, fueron similares las tasas de éxito y de complicaciones durante la intervención, y tras 1 año de seguimiento, no se observaron diferencias en la incidencia de ictus/AIT/ES.
Este subanálisis del estudio EWOLUTION proporciona más resultados del COI en este subgrupo de pacientes con necesidad de un tratamiento alternativo a la anticoagulación oral prolongada. Se ha demostrado en un contexto de caso real que, pese a conseguirse un mejor control de la anticoagulación con el tratamiento con warfarina, los pacientes ancianos tienen mayor riesgo de hemorragias mayores16.
Además, los pacientes ancianos incluidos en los ensayos clínicos, como los estudios sobre anticoagulantes orales de acción directa, gozan en general de una salud relativamente buena y se adhieren al tratamiento farmacológico; por el contrario, la interrupción del tratamiento o la falta de adherencia a los anticoagulantes orales de acción directa en las poblaciones de más edad es algo habitual en estudios de casos reales17,18.
Limitaciones del estudioEste es un análisis de subgrupos del registro prospectivo EWOLUTION con un tamaño muestral pequeño. Las limitaciones de este análisis incluyen la naturaleza observacional del diseño. El tratamiento antitrombótico posterior a la intervención no fue uniforme, sino a juicio de los médicos.
CONCLUSIONESEste análisis indica que el COI es una intervención segura y eficaz en pacientes ancianos (edad ≥ 85 años). No se observaron diferencias con respecto al éxito o las complicaciones de la intervención en estos pacientes comparados con pacientes más jóvenes (edad <85 frente a ≥ 85 años), y tras el seguimiento de 2 años, no se observaron diferencias en la incidencia de ictus/AIT/ES, a pesar del alto riesgo de eventos embólicos de los pacientes muy ancianos. El COI puede ser una opción atractiva para los pacientes ancianos con fibrilación auricular no valvular de alto riesgo, dadas las complicaciones y riesgos de la anticoagulación oral en esta población creciente.
FINANCIACIÓNEl estudio EWOLUTION fue financiado por Boston Scientific Inc., Minneapolis, Estados Unidos.
CONFLICTO DE INTERESESI. Cruz-González es supervisor y asesor de Boston Scientific y de Abbott Vascular; HI es supervisor de Watchman and Lotus (BSC) y ha recibido retribuciones personales de Boston Scientific, ajenas al estudio presentado; B. Schmidt ha recibido retribuciones personales de Boston Scientific y de Abbot Vascular, ajenas al estudio presentado; K. Stein es un empleado y socio de BSC; L.V. Boersma ha recibido retribuciones personales de Boston Scientific y de Medtronic, ajenas al estudio presentado.
- –
Los pacientes ancianos con fibrilación auricular tienen un mayor riesgo de sufrir eventos cardioembólicos y hemorragias mayores que los pacientes más jóvenes.
- –
El COI ofrece una protección no farmacológica contra el ictus que elimina la necesidad de la anticoagulación oral.
- –
El COI podría ser una alternativa atractiva a la anticoagulación oral para los pacientes ancianos.
- –
Este estudio muestra la seguridad y la eficacia del COI en pacientes muy ancianos.
Los siguientes investigadores e instituciones participaron en el registro EWOLUTION. Los investigadores aparecen después de cada uno de los centros que vienen listados por orden alfabético.
Al Qassimi Hospital: Arif Al Nooryani; Asklepios Klinik Saint Georg: Felix Meincke; Asklepios Klinik Weissenfels: Thomas Fiedler; Ospedale di Cirie: Gaetano Senatore; Beaumont Hospital: David Foley; Cardioangiologisches Centrum Bethanien: Boris Schmidt; CHRU de Lille: François Brigadeau; CHU Grenoble Hôpital Michallon: Pascal Defaye; CHU Henri Mondor: Emmanuel Teiger; CHU Hôpital de la Timone: Jean-Louis Bonnet; Dominikus- Krankenhaus: Christof Wald; Elisabeth Krankenhaus Essen: Thomas Schmitz; Erasmus MC - University Medical Center Rotterdam: Tamas Szili-Torok; Evangelisches Krankenhaus Bielefeld: Wladimir Tschishow; Fondazione Centro San Raffaele: Patrizio Mazzone; Freeman Hospital: David Crossland; Herzkatheter Asklepios Wandsbek: Martin W. Bergmann; Hôpital Bichat: Alec Vahanian; Hospital Clínico Salamanca: Ignacio Cruz-González; Hôpital du Haut Lévêque: Jean-Benoit Thambo; Johannes Gutenberg Universität Mainz: Tommaso Gori; John Radcliffe Infirmary Oxford II: Timothy Betts; King Fahed Medical City Prince Salman Cardiac Center: Faisal Al Smadi; Klinikum Neuperlach: Harald Mudra; Krankenhaus Barmherzige Bruder: Robin Molitoris; Medisch Centrum Leeuwarden: Richard Folkeringa; Medisch Spectrum Twente: Yorick Stevenhagen; NCN Nouvelles Cliniques Nantaises: Daniel Gras; Onze Lieve Vrouw Ziekenhuis: Tom De Potter; Ospedale Ferrarotto: Corrado Tamburino; Ospedale Sacro Cuore Don Calabria: Giulio Molon; Regional Vascular Center: Vladimir Protopopov; Royal Victoria Hospital: Mark Spence; University Hospital of Lord's Transfiguration Poznan: Marek Grygier; Hospital de Santa Maria: Eduardo Infante Oliveira; St Antonius Ziekenhuis: Lucas Boersma; St Katharinen Krankenhaus: Horst Sievert; State Cardiology Research Center: Evgeny Merkulov; State Research Institute of Circulation Pathology: Evgeny Pokushalov; Szpital Uniwersytecki: Adam Sukiennik; The Brompton Hospital: Tom Wong; Universitätsmedizin Greifswald: Mathias Busch; Universitätsmedizin Berlin - Charité Virchow Standort: Leif-Hendrik Boldt; UniversitätsKlinikum Bonn: Georg Nickenig; Universität Leipzig: Martin Neef; Vivantes Klinikum Am Urban: Hüseyin Ince; Vivantes Klinikum im Friedrichshain: Stephan Kische.