Estudios aleatorizados han mostrado la eficacia del cierre percutáneo del foramen oval permeable (FOP) en pacientes de edad ≤ 60 años con ictus criptogénico. El objetivo de este estudio es determinar la seguridad y la eficacia a largo plazo del cierre percutáneo del FOP en pacientes mayores de 60 años con ictus criptogénico.
MétodosDe 475 pacientes consecutivos con ictus criptogénico que se sometieron al cierre del FOP, 90 eran mayores de 60 años (media, 66±5 años) y se los comparó con los 385 del grupo de edad ≤ 60 años (media, 44±10 años).
ResultadosLos pacientes mayores de 60 años tuvieron mayor prevalencia de factores de riesgo cardiovascular (FRCV) (hipertensión, dislipemia y diabetes; p <0,01). No hubo diferencias en cuanto a complicaciones periprocedimiento. El seguimiento medio fue de 8 (4-12) años y hubo 17 muertes, todas de causa no cardiovascular (el 7,8% de los mayores de 60 años y el 2,6% de los de edad ≤ 60 años; HR=4,12; IC95%, 1,56-10,89). Tuvieron un ictus recurrente 4 pacientes (el 2,2% de los mayores de 60 años frente al 0,5% de los de edad ≤ 60 años; HR=5,08; IC95%, 0,71-36,2), y un accidente isquémico transitorio (AIT) 12 pacientes (el 3,3 frente al 2,3%; HR=1,71; IC95%, 0,46-6,39). Hubo tendencia a una mayor incidencia de ictus/AIT en los mayores de 60 años (el 5,5 frente al 2,6%; HR=2,62; IC95%, 0,89-7,75; p=0,081), que no persistió tras ajustar por FRCV (HR=1,97; IC95%, 0,59-6,56; p=0,269).
ConclusionesEl cierre percutáneo del FOP en pacientes mayores de 60 años con ictus criptogénico resultó seguro y se asoció con una baja incidencia de eventos isquémicos a largo plazo. Sin embargo, en los pacientes mayores de 60 años se observó una tendencia a mayor incidencia de ictus/AIT probablemente relacionada con mayor prevalencia de FRCV.
Palabras clave
En los pacientes con un ictus criptogénico, hasta 4 ensayos aleatorizados y los metanálisis posteriores han mostrado recientemente una reducción significativa de los eventos de ictus isquémico recurrente tras el cierre percutáneo del foramen oval permeable (FOP)1–6. En todos los ensayos aleatorizados excepto uno se excluyó a los pacientes de más de 60 años, y en el único en el que se incluyó a pacientes de más edad, la media fue de alrededor de 50 años3. Así pues, aunque se ha establecido el cierre del FOP como nuevo patrón de referencia para el tratamiento de pacientes jóvenes con ictus criptogénicos y FOP, no hay recomendaciones definitivas respecto al tratamiento de los pacientes de más de 60 años7–9. Algunos estudios han puesto de relieve que los pacientes de edad avanzada con ictus criptogénicos muestran una prevalencia de FOP muy superior (en comparación con los pacientes con ictus de causa conocida), similar a la observada en los pacientes de menos edad10,11, pero los datos existentes sobre la evolución clínica aguda y a medio plazo de los pacientes de más edad tratados con un cierre del FOP son escasos12–16. Además, hasta la fecha no se han realizado estudios centrados especificamente en los resultados a largo plazo en pacientes de más de 60 años.
El objetivo de nuestro estudio es evaluar los resultados clínicos a largo plazo tras el cierre percutáneo del FOP en pacientes de edad avanzada (> 60 años) con una embolia criptogénica.
MÉTODOSSe incluyó en el estudio a un total de 475 pacientes consecutivos a los que se practicó el cierre de un FOP entre 2001 y 2018 a causa de una embolia criptogénica (ictus, accidente isquémico transitorio [AIT], embolia periférica). Un neurólogo estableció un diagnóstico de presunción de embolia paradójica tras un examen de selección que incluyó exploraciones de resonancia magnética cerebral y/o tomografía computarizada cerebral, registro Holter de 24 h, ecocardiografía transtorácica (ETT), ecocardiografía transesofágica (ETE) y Doppler transcarotídeo. El diagnóstico de FOP se estableció en función de la presencia de un cortocircuito derecha-izquierda en la exploración de ETE con una prueba de contraste de solución salina agitada, con y sin maniobra de Valsalva. El cortocircuito se clasificó como pequeño, moderado o grande, con o sin aneurisma del tabique auricular17.
El tipo y el tamaño del dispositivo implantado se dejó a criterio del médico que realizaba la intervención. Se realizó una ETT tras la intervención en todos los pacientes antes del alta del hospital, habitualmente unas pocas horas después de la intervención, con objeto de confirmar la posición del dispositivo, evaluar el cortocircuito residual y descartar el derrame pericárdico. El tratamiento médico al alta fue (por lo general) con ácido acetilsalicílico (indefinidamente) y se agregó clopidogrel a algunos pacientes (durante un periodo de 6 meses), según la preferencia del médico que realizaba la intervención. Se prescribió anticoagulación si había otras razones médicas que la requirieran (embolia pulmonar, trombosis venosa profunda). Tras 1 y 6 meses de la intervención, los pacientes acudieron a una visita clínica y se les realizó una exploración ecocardiográfica (ETT y/o ETE). Todos los datos de la intervención y del seguimiento realizado al cabo de 1 y 6 meses se introdujeron prospectivamente en una base de datos dedicada.
El seguimiento corrió a cargo del neurólogo/cardiólogo que había remitido al paciente o del médico que realizó el cierre del FOP, junto con el médico de familia responsable del paciente, pero no hubo unos plazos preestablecidos para las visitas clínicas durante el periodo de seguimiento después del primer año. Se revisaron las historias clínicas de todos los pacientes y se recogieron los datos de todos los eventos clínicos y de las medicaciones actuales. Asimismo, se realizó una visita clínica o una llamada telefónica de manera sistemática a todos los pacientes con datos de seguimiento no disponibles. Se preguntó a cada paciente sobre las posibles recidivas de ictus, AIT o embolia periférica, nuevas hospitalizaciones (y su causa), hemorragia, arritmias y eventos cardiacos, migraña y medicación actual. Cuando en función de las respuestas al cuestionario se sospechaba un evento, se consultó el registro médico completo del centro que atendía al paciente. Se consultó al médico de atención primaria del paciente y al cardiólogo/neurólogo responsable si era necesaria alguna información adicional.
Todos los eventos neurológicos (ictus, AIT) fueron diagnosticados por un neurólogo y se definieron según los criterios TOAST18. Todos los eventos hemorrágicos se registraron y clasificaron según los criterios BARC19.
Análisis estadísticoLas variables cualitativas se presentan en forma de número (%). Las variables continuas se expresan en forma de media±desviación estándar o mediana [intervalo intercuartílico], según la distribución de valores de la variable. Los análisis de comparaciones de grupos se realizaron con la prueba de la t de Student o la prueba de suma de rangos de Wilcoxon para las variables continuas, y con la prueba de la χ2 o la prueba exacta de Fisher para las variables cualitativas. Se realizó un análisis con puntuación de propensión para introducir un ajuste respecto a las diferencias entre los grupos (grupo de edad ≤ 60 años frente a grupo de edad> 60 años) en cuanto a las características iniciales. Para ello se seleccionaron las variables índice de masa corporal, tabaquismo, hipertensión, dislipemia, diabetes, embolia pulmonar y tratamiento antitrombótico, mediante un análisis de regresión logística. Se compararon los resultados clínicos de los 2 grupos con el empleo de modelos de riesgos proporcionales. Se realizaron otras comparaciones con la prueba de Tukey. Se resumieron también las tasas de eventos clínicos con el empleo de estimaciones de Kaplan-Meier, y se realizaron comparaciones de los grupos con la prueba de orden logarítmico (log-rank test). Los resultados se consideraron significativos con un valor de p <0,05. Todos los análisis se llevaron a cabo con el empleo del programa estadístico SAS versión 9.4 (SAS Institute Inc.; Cary, North Carolina, Estados Unidos).
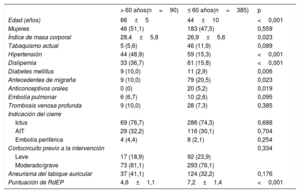
RESULTADOSCaracterísticas inicialesDe un total de 475 pacientes a los que se practicó el cierre del FOP, 90 (18,9%) tenían más de 60 años en el momento de la intervención (media de edad, 66±5 años, frente a 44±10 años en el grupo de edad ≤ 60 años). Las características iniciales de los pacientes según la edad en el momento de realizar el cierre del FOP se indican en la tabla 1.
Características clínicas iniciales según la edad (> 60 años frente a ≤ 60 años)
| > 60 años(n=90) | ≤ 60 años(n=385) | p | |
|---|---|---|---|
| Edad (años) | 66±5 | 44±10 | <0,001 |
| Mujeres | 46 (51,1) | 183 (47,5) | 0,559 |
| Índice de masa corporal | 28,4±5,8 | 26,9±5,6 | 0,023 |
| Tabaquismo actual | 5 (5,6) | 46 (11,9) | 0,089 |
| Hipertensión | 44 (48,9) | 59 (15,3) | <0,001 |
| Dislipemia | 33 (36,7) | 61 (15,8) | <0,001 |
| Diabetes mellitus | 9 (10,0) | 11 (2,9) | 0,006 |
| Antecedentes de migraña | 9 (10,0) | 79 (20,5) | 0,023 |
| Anticonceptivos orales | 0 (0) | 20 (5,2) | 0,019 |
| Embolia pulmonar | 6 (6,7) | 10 (2,6) | 0,095 |
| Trombosis venosa profunda | 9 (10,0) | 28 (7,3) | 0,385 |
| Indicación del cierre | |||
| Ictus | 69 (76,7) | 286 (74,3) | 0,688 |
| AIT | 29 (32,2) | 116 (30,1) | 0,704 |
| Embolia periférica | 4 (4,4) | 8 (2,1) | 0,254 |
| Cortocircuito previo a la intervención | 0,334 | ||
| Leve | 17 (18,9) | 92 (23,9) | |
| Moderado/grave | 73 (81,1) | 293 (76,1) | |
| Aneurisma del tabique auricular | 37 (41,1) | 124 (32,2) | 0,176 |
| Puntuación de RdEP | 4,6±1,1 | 7,2±1,4 | <0,001 |
AIT: accidente isquémico transitorio; RdEP: riesgo de embolia paradójica.
Los valores se presentan en forma de n (%) o de media±desviación estándar.
No hubo diferencias estadísticamente significativas entre los grupos por lo que respecta a sexo, enfermedad tromboembólica venosa, tabaquismo actual, indicación para realizar el cierre, intensidad del cortocircuito del FOP en la situación inicial o presencia de aneurismas del tabique auricular. Sin embargo, en el grupo de más edad fue más probable la presencia de factores de riesgo cardiovascular, como hipertensión, dislipemia, diabetes e índice de masa corporal superior. En los pacientes de más edad hubo también una puntuación de riesgo de embolia paradójica (RdEP) más alta.
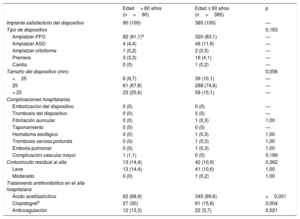
Resultados de la intervenciónNo hubo diferencias estadísticamente significativas entre los grupos por lo que respecta a los resultados de la intervención y hospitalarios (tabla 2). El implante del dispositivo fue satisfactorio en todos los casos y se observó una tasa de cortocircuito residual al alta similar (baja) en ambos grupos. En la inmensa mayoría de pacientes de ambos grupos se utilizó el dispositivo Amplatzer PFO (Abbott; Chicago, Illinois, Estados Unidos). Hubo tan solo un episodio de fibrilación auricular (FA) tras el cierre, en un paciente del grupo de menos edad que presentó un hematoma esofágico secundario a la introducción de la sonda de ETE y tuvo una recuperación completa simplemente bajo observación. Se identificó una tendencia a un tamaño mayor del dispositivo en el grupo de más edad.
Características de la intervención y resultados hospitalarios según la edad del paciente
| Edad> 60 años (n=90) | Edad ≤ 60 años (n=385) | p | |
|---|---|---|---|
| Implante satisfactorio del dispositivo | 90 (100) | 385 (100) | — |
| Tipo de dispositivo | 0,163 | ||
| Amplatzer PFO | 82 (91,1)a | 320 (83,1) | — |
| Amplatzer ASD | 4 (4,4) | 46 (11,9) | — |
| Amplatzer cribiforme | 1 (0,2) | 2 (0,5) | — |
| Premere | 3 (3,3) | 16 (4,1) | — |
| Cardia | 0 (0) | 1 (0,2) | — |
| Tamaño del dispositivo (mm) | 0,056 | ||
| <25 | 6 (6,7) | 39 (10,1) | — |
| 25 | 61 (67,8) | 288 (74,8) | — |
| > 25 | 23 (25,6) | 58 (15,1) | — |
| Complicaciones hospitalarias | |||
| Embolización del dispositivo | 0 (0) | 0 (0) | — |
| Trombosis del dispositivo | 0 (0) | 0 (0) | — |
| Fibrilación auricular | 0 (0) | 1 (0,3) | 1,00 |
| Taponamiento | 0 (0) | 0 (0) | — |
| Hematoma esofágico | 0 (0) | 1 (0,3) | 1,00 |
| Trombosis venosa profunda | 0 (0) | 1 (0,3) | 1,00 |
| Embolia pulmonar | 0 (0) | 1 (0,3) | 1,00 |
| Complicación vascular mayor | 1 (1,1) | 0 (0) | 0,189 |
| Cortocircuito residual al alta | 13 (14,4) | 42 (10,9) | 0,362 |
| Leve | 13 (14,4) | 41 (10,6) | 1,00 |
| Moderado | 0 (0) | 1 (0,2) | 1,00 |
| Tratamiento antitrombótico en el alta hospitalaria | |||
| Ácido acetilsalicílico | 62 (68,9) | 345 (89,6) | <0,001 |
| Clopidogrelb | 27 (30) | 61 (15,8) | 0,004 |
| Anticoagulación | 12 (13,3) | 22 (5,7) | 0,021 |
Los valores se presentan en forma de n (%) o de media±desviación estándar.
Por lo que respecta al tratamiento antitrombótico en el momento del alta del hospital, la prescripción de ácido acetilsalicílico fue más frecuente en los pacientes de menos edad, mientras que la de clopidogrel y anticoagulación oral fue más común en los de más edad. Dado que ninguno de los pacientes presentó FA durante el proceso de evaluación, una tasa superior de antecedentes de embolia pulmonar y trombosis venosa periférica en el grupo de más edad (a pesar de que las diferencias entre los grupos no eran significativas) puede haber conducido a la mayor frecuencia de uso de anticoagulación en el momento del alta. Tras el cierre del FOP, el tratamiento antitrombótico se dejó al criterio del neurólogo o cardiólogo que habían remitido al paciente. Finalmente, no hubo ninguna otra razón, aparte del cierre del FOP, para prescribir un tratamiento antiagregante plaquetario combinado doble a algunos pacientes.
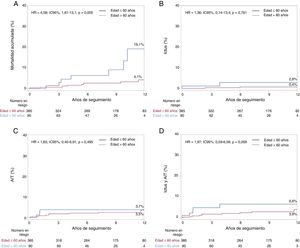
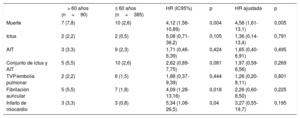
SeguimientoLa mediana de seguimiento en el conjunto de la población del estudio fue de 8 [4-12] años. El seguimiento fue completo en todos los pacientes excepto 21 (el 4,4% de pérdidas de seguimiento; 19 [4,9%] y 2 [2,2%] pacientes de los grupos de menos y más edad respectivamente), con lo que hubo un total de 366 y 88 pacientes con un seguimiento completo en los grupos de menos y más edad respectivamente. Los principales resultados clínicos en función de la edad del paciente (≤ 60 frente a> 60 años) se presentan en la tabla 3. La mortalidad por cualquier causa fue mayor en el grupo de más edad (hazard ratio [HR]=4,12; intervalo de confianza del 95% [IC95%], 1,56-10,89; p=0,004) y las diferencias persistieron tras el ajuste (HR=4,58, IC95%, 1,61-13,1; p=0,005). La totalidad de las 17 muertes ocurridas fueron de origen no cardiovascular (cáncer en 7, demencia grave en 1, accidente de tráfico en 1, hipertensión pulmonar crónica en 1, hemorragia intracerebral debida a aneurisma en 1, suicidio en 3, causa desconocida en 3). Un total de 4 pacientes presentaron eventos de ictus recurrente (0,8%) durante el periodo de seguimiento, sin que hubiera diferencias significativas entre los grupos (el 2,2 y el 0,5% de los grupos de más y menos edad respectivamente; HR=5,08; IC95%, 0,71-36,2; p=0,105). Todos los ictus se consideraron no relacionados con el FOP (1 ictus 5 años después del cierre del FOP se consideró aterotrombótico en un paciente con hasta 4 factores de riesgo cardiovascular; otro paciente presentó un ictus debido a una disección vertebral; 1 ictus se asoció con una trombosis de una bioprótesis de válvula aórtica; 1 paciente presentó ictus recurrente sin una etiología clara). Se produjeron eventos de AIT en 12 pacientes (2,5%), sin que hubiera diferencias entre los grupos (el 3,3 frente al 2,3% de los grupos de más y menos edad respectivamente; HR=1,71; IC95%; 0,46-6,39; p=0,424). En el análisis univariante, el criterio de valoración combinado de ictus y AIT tendió a ser superior en el grupo de pacientes de más edad (el 5,5 frente al 2,6%; HR=2,62; IC95%, 0,89-7,75; p=0,081), pero esta tendencia no persistió después del ajuste (HR=1,97; IC95%, 0,59-6,56; p=0,269). Los eventos de FA y de infarto de miocardio fueron más frecuentes en el grupo de más edad, pero las diferencias no se mantuvieron tras el ajuste. Las curvas de Kaplan-Meier correspondientes a los eventos clínicos principales tras el ajuste hasta los 12 años de seguimiento se presentan en la figura 1.
Resultados clínicos a largo plazo tras el cierre del foramen oval permeable, según la edad del paciente
| > 60 años (n=90) | ≤ 60 años (n=385) | HR (IC95%) | p | HR ajustada | p | |
|---|---|---|---|---|---|---|
| Muerte | 7 (7,8) | 10 (2,6) | 4,12 (1,56-10,89) | 0,004 | 4,58 (1,61-13,1) | 0,005 |
| Ictus | 2 (2,2) | 2 (0,5) | 5,08 (0,71-36,2) | 0,105 | 1,36 (0,14-13,4) | 0,791 |
| AIT | 3 (3,3) | 9 (2,3) | 1,71 (0,46-6,39) | 0,424 | 1,65 (0,40-6,91) | 0,495 |
| Conjunto de ictus y AIT | 5 (5,5) | 10 (2,6) | 2,62 (0,89-7,75) | 0,081 | 1,97 (0,59-6,56) | 0,269 |
| TVP/embolia pulmonar | 2 (2,2) | 6 (1,5) | 1,88 (0,37-9,39) | 0,444 | 1,26 (0,20-8,11) | 0,801 |
| Fibrilación auricular | 5 (5,5) | 7 (1,8) | 4,09 (1,28-13,16) | 0,018 | 2,26 (0,60-8,50) | 0,225 |
| Infarto de miocardio | 3 (3,3) | 3 (0,8) | 5,34 (1,08-26,5) | 0,04 | 3,27 (0,55-19,7) | 0,195 |
AIT: accidente isquémico transitorio; HR: hazard ratio; IC95%: intervalo de confianza del 95%; TVP: trombosis venosa profunda.
Los valores se presentan en forma de n (%).
Estimaciones de Kaplan-Meier de los eventos clínicos en un seguimiento de 12 años tras aplicar un ajuste respecto a las diferencias de las características iniciales entre los grupos. Gráficos de Kaplan-Meier que muestran lo siguiente: mortalidad acumulada (A), ictus (B), AIT (C), e ictus y AIT (D) en un seguimiento de 12 años según la edad (≤ 60 años o> 60 años). AIT: accidente isquémico transitorio; HR: hazard ratio; IC95%: intervalo de confianza del 95%. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
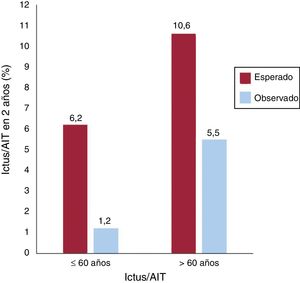
Para situar estos resultados en perspectiva, se comparó la tasa de eventos de ictus/AIT en la población de nuestro estudio con la esperada según la puntuación RdEP20 (figura 2). Según esta puntuación, la tasa de ictus/AIT en el seguimiento de 2 años habría sido del 6,2 y el 10,6% empleando solo tratamiento médico, frente a las tasas observadas del 1,2 y el 5,5% en los grupos de cierre del FOP de menos y más edad respectivamente (p=0,001 en ambos casos).
DISCUSIÓNLos principales resultados de nuestro estudio pueden resumirse como sigue: a) los pacientes de más edad con embolia criptogénica y FOP tenían una carga superior de factores de riesgo cardiovascular; b) el cierre del FOP fue seguro en los pacientes de más edad, sin que hubiera diferencias en las complicaciones periintervención respecto a lo observado en los pacientes de menos edad; c) en el seguimiento a largo plazo (mediana, 8 años) tras el cierre del FOP, la tasa general de mortalidad fue más alta en los pacientes de más edad, pero las diferencias se debieron a causas de muerte no cardiovasculares (principalmente cáncer), y d) la tasa de ictus/AIT recurrente fue baja (muy inferior a la predicha según la puntuación RdEP), pero hubo una tendencia a una incidencia superior de ictus/AIT recurrentes en los pacientes de más edad, que parecía estar relacionada en parte con la carga de factores de riesgo cardiovascular (no se observaron diferencias en la tasa de ictus isquémicos recurrentes entre los grupos tras aplicar un ajuste por las diferencias iniciales en los factores de riesgo cardiovascular).
Varios estudios han mostrado que el cierre percutáneo de un FOP es una intervención segura en los pacientes jóvenes (edad <60 años). Sin embargo, los datos existentes sobre las complicaciones periintervención en pacientes de más edad son escasos y contradictorios. Merkler et al.21 mostraron un riesgo superior de complicaciones hospitalarias en los pacientes de más edad tratados con cierre del FOP, de tal manera que la tasa de complicaciones periintervención era el doble de la observada en los pacientes de edad <60 años. En cambio, de manera similar a los resultados de nuestro estudio, Wahl et al.15 describieron ausencia de aumento del riesgo periintervención en los pacientes de más edad con cierre de FOP. Estos datos son tranquilizadores e importantes, en especial teniendo en cuenta la falta de datos aleatorizados y de recomendaciones de guías específicas sobre el cierre del FOP en los pacientes mayores7,8.
Nuestro estudio es el primero que aporta datos a largo plazo tras el cierre del FOP en pacientes de edad superior a 60 años. Se observó una diferencia media de edad de aproximadamente 20 años entre los pacientes más jóvenes (< 60 años) y los mayores, y no es de extrañar que la tasa de mortalidad a largo plazo en estos últimos fuera muy superior a la existente en la población más joven. Es de destacar que todas las muertes que se produjeron después del cierre del FOP fueron de origen no cardiovascular (con el cáncer como causa de muerte más frecuente), y la tasa de mortalidad de los pacientes de más edad fue similar a la descrita por el Institut de la Statistique du Québec en la población canadiense de Quebec de iguales edad y sexo (el 6,6% de probabilidad de muerte en los 5 años siguientes al día en el que cumplían 65 años los varones y el 4,4% las mujeres)22. Así pues, la diferencia de mortalidad observada entre los pacientes de menos y más edad en este estudio parece deberse al mayor riesgo de muerte de las personas de más edad.
La tasa de eventos tromboembólicos recurrentes en el seguimiento a largo plazo tras el cierre del FOP en los pacientes de más edad fue baja, con tan solo 2 ictus y 3 episodios de AIT durante el periodo de seguimiento. Esto representa una tasa de 0,3 ictus/100 personas-año y 0,8 ictus o AIT/100 personas-año, que es muy inferior a la incidencia estimada según la puntuación RdEP, lo cual indica que los efectos beneficiosos proporcionados por el cierre del FOP pueden extenderse más allá del límite de los 60 años. En estudios previos se ha observado una incidencia baja de eventos isquémicos después de transcurridos de 1 a 3 años tras el cierre del FOP en pacientes de edad avanzada13–15 y los resultados de nuestro estudio amplían estos resultados positivos a un seguimiento a largo plazo (> 5 años) de estos pacientes. Sin embargo, se observa una tendencia a una mayor incidencia de eventos cerebrovasculares (ictus/AIT) en los pacientes de más edad (en comparación con los más jóvenes). El hecho de que esta tendencia desapareciera tras el ajuste respecto a los factores de riesgo cardiovascular indica un posible papel de la carga ateroesclerótica en algunos de los eventos isquémicos observados en los pacientes mayores.
Es bien sabido que la prevalencia de los factores de riesgo cardiovascular (en especial hipertensión y diabetes) aumenta de manera constante con la edad, y la prevalencia observada en nuestra población de pacientes mayores es similar a la descrita en la población canadiense del mismo intervalo de edad23. Sin embargo, las prevalencias de factores de riesgo como la dislipemia (35,6%), la hipertensión (48,9%) o la diabetes (10%) fueron muy superiores a las observadas en los pacientes más jóvenes. Además, Alsheikh-Ali et al.24 señalaron que, en los pacientes con ictus criptogénico, un 20% (16-25%) y un 48% (34-66%) de los FOP probablemente sean hallazgos casuales en los pacientes de menos y más edad respectivamente. Tiene interés señalar que estas tasas disminuyen a un 9% (4-18%) en los pacientes de menos edad y a un 26% (12-56%) en los de más edad cuando se detecta la presencia concomitante de un aneurisma del tabique auricular. Esto resalta la necesidad de una evaluación cuidadosa del paciente por un equipo interdisciplinario en el que estén representados neurólogos y cardiólogos y el punto de vista del propio paciente, tal como se ha descrito en guías recientes7,8. Por otra parte, se observó una mayor incidencia de episodios de FA en los pacientes de más edad en los años siguientes al cierre del FOP, lo cual resalta nuevamente la importancia del examen de detección de una posible FA en estos pacientes antes del cierre del FOP. Además, estos datos plantean la cuestión del uso de un seguimiento cardiaco a más largo plazo o incluso considerar el empleo de monitores cardiacos insertables en algunos de estos pacientes25.
Las limitaciones de este estudio son las inherentes a los estudios retrospectivos. Aunque el número de pacientes en los que se perdió el seguimiento fue muy bajo (en especial teniendo en cuenta el seguimiento a largo plazo), no se puede descartar por completo la posibilidad de que no se detectaran algunos eventos adversos. Sin embargo, esto habría sido muy improbable por lo que respecta a los eventos de carácter mayor y los que necesitaron rehospitalización. Por otra parte, se revisaron las historias clínicas para obtener datos sobre las hospitalizaciones de los pacientes a lo largo del tiempo. Por último, se contactó también con el cardiólogo/neurólogo que había remitido al paciente, con los médicos de familia y con los farmacéuticos si había alguna duda respecto a los eventos aparecidos y/o la medicación utilizada. Los datos de ecocardiografía fueron los presentados por el centro y no se realizó un análisis centralizado de ellos.
CONCLUSIONESEste estudio muestra que el cierre del FOP en pacientes de más de 60 años es una intervención segura y que se asocia a una tasa baja de eventos en un seguimiento a largo plazo. Estos resultados resaltan la necesidad de diseñar futuros ensayos aleatorizados con la inclusión de pacientes de más edad con FOP y embolias criptogénicas. Mientras no se disponga de ellos, este estudio indica que puede considerarse el posible empleo del cierre del FOP en los pacientes de más edad con embolias criptogénicas. Sin embargo, la presencia y el número de factores de riesgo cardiovascular que favorecen el origen aterotrombótico de los eventos cerebrovasculares debe tenerse en cuenta en el proceso de toma de decisiones clínicas para estos pacientes. Además, debe llevarse a cabo un examen de detección cuidadoso de eventos arrítmicos (en especial de FA) en el proceso de estudio diagnóstico antes del cierre del FOP.
FINANCIACIÓNJ. Rodés-Cabau ocupa la Cátedra de Investigación Fondation Famille Jacques Larivière para el desarrollo de intervenciones para las cardiopatías estructurales. J. Wintzer-Wehekind contó con el apoyo de una subvención de la Association de Recherche Cardio-vasculaire des Alpes. A. Alperi y D. del Val disfrutaron de una subvención de la Fundación Alfonso Martín Escudero, Madrid, España.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Hasta 4 estudios aleatorizados recientes han establecido la superioridad del cierre del FOP en comparación con el tratamiento médico para prevenir los eventos isquémicos recurrentes en pacientes de menos de 60 años con ictus criptogénico y FOP.
- –
Incluso los pacientes de edad avanzada con ictus criptogénico presentan una prevalencia de FOP muy superior a la de los pacientes con ictus de causa conocida.
- –
Debido principalmente a la falta de datos, las guías recientes han descartado o no han realizado recomendaciones sólidas respecto al cierre del FOP en los pacientes de más de 60 años.
- –
En los pacientes de más de 60 años, el cierre del FOP fue seguro y se asoció con una tasa baja de eventos de ictus/AIT.
- –
Los pacientes de más de 60 años tenían una carga superior de factores de riesgo cardiovascular, lo cual puede conllevar una tasa más elevada de recurrencias de eventos cerebrales isquémicos.
- –
Los pacientes con un ictus criptogénico y foramen oval permeable no deben ser excluidos de la intervención de cierre del FOP simplemente por la edad.