El cierre percutáneo de las fugas periprotésicas presenta tasas de éxito variables, la falta de dispositivos específicamente diseñados para este procedimiento ha limitado sus resultados. El Amplatzer Vascular Plug III, por sus características, parece un dispositivo ideal para este procedimiento, pero los datos disponibles se limitan a casos aislados o pequeñas series. El propósito de este estudio es analizar la factibilidad y la eficacia del cierre percutáneo de fugas periprotésicas con este dispositivo.
MétodosSe analizan resultados de seguridad y eficacia durante el procedimiento y a 90 días de las fugas periprotésicas mitrales y aórticas cerradas percutáneamente con este dispositivo en nuestro centro.
ResultadosSe trataron 34 fugas periprotésicas, 7 a nivel aórtico y 27 a nivel mitral, correspondientes a 33 pacientes. El éxito técnico fue del 93,9% (en 2 pacientes se realizó un segundo procedimiento programado) y el éxito del procedimiento (reducción ≥ 1 grado de regurgitación) en el 90,9%. En 4 pacientes se observaron complicaciones relacionadas con el procedimiento (transfusión en 3 pacientes y cirugía por interferencia con los discos en 1 paciente). No se observó ningún caso de muerte, infarto de miocardio o accidente cerebrovascular periprocedimiento. A 90 días la supervivencia fue del 100%, y en el 90,3% de los pacientes mejoró la clase funcional; 4 pacientes sufrieron complicaciones vasculares (seudoaneurisma) en el seguimiento.
ConclusionesEl cierre percutáneo de la fugas periprotésicas con el Amplatzer Vascular Plug III es un procedimiento factible, seguro y con elevadas tasas de éxito clínico y ecocardiográfico.
Palabras clave
Las fugas periprotésicas (FPP) son una complicación relativamente frecuente de la cirugía de recambio valvular1. Aunque la mayoría de las FPP son pequeñas y asintomáticas, un 2-5%2–4 son clínicamente relevantes y se asocian con complicaciones importantes, como insuficiencia cardiaca (IC), anemia hemolítica, arritmias y endocarditis infecciosa5,6.
Clásicamente, el tratamiento de elección para pacientes con FPP sintomáticas ha sido la reintervención quirúrgica, bien reparando la dehiscencia valvular, bien sustituyendo la prótesis1. Recientemente, el tratamiento percutáneo de las FPP ha surgido como una alternativa terapéutica para pacientes con alto riesgo quirúrgico7. En general, este procedimiento se asocia con resultados satisfactorios a corto y largo plazo2,8. Sin embargo, el porcentaje de éxito de la técnica es muy variable2,9. Multitud de dispositivos, no diseñados específicamente para este cometido, se han utilizado para el tratamiento de las FPP. El Amplatzer Vascular Plug III (AVP III) (St. Jude Medical), por sus características y su diseño, es un dispositivo ideal para este procedimiento y se ha empleado recientemente off-label para el cierre de FPP. Hasta el momento, los resultados disponibles con este dispositivo se limitan a pequeñas series o casos aislados10–13.
El objetivo de este trabajo es evaluar los resultados en el cierre de FPP con el dispositivo AVP III en una de las series de cierre de FPP más extensas publicadas hasta el momento.
MÉTODOSPoblaciónDesde el caso inicial realizado en julio de 2009 y hasta marzo de 2013, se realizó el cierre percutáneo de 34 FPP consecutivas, correspondientes a 33 pacientes. Todos ellos tenían FPP que condicionaban regurgitaciones sintomáticas graves (IC y/o anemia hemolítica que precisaba transfusión periódica de hematíes). Se discutió el caso de cada paciente en sesión medicoquirúrgica y se consideró candidato a cierre percutáneo de las FPP. A los pacientes con FPP únicas o múltiples que en su conjunto afectasen a más de un tercio de la circunferencia del anillo protésico no se los consideró candidatos a cierre percutáneo. Todos los pacientes firmaron el consentimiento informado para la realización del procedimiento.
Definición de las variables analizadasSe definió FPP, como la presencia de un jet de regurgitación por ecocardiografía Doppler originado entre el borde del anillo protésico y el tejido nativo circundante. La gravedad de la regurgitación se definió según los parámetros establecidos por la Sociedad Americana de Ecocardiografía14. La localización de las FPP mitrales se definió siguiendo la clasificación propuesta previamente por Cortes et al15 y la de las FPP aórticas, siguiendo la clasificación adoptada por Ruiz et al2.
El diagnóstico de IC se realizó según los criterios clásicos de Framingham, y el estado funcional basal y durante el seguimiento se valoró siguiendo la clasificación de la New York Heart Association. Se definió anemia hemolítica si la hemoglobina plasmática era ≤ 14g/dl en varones o ≤ 12g/dl en mujeres, existían datos de perfil hemolítico (lactato deshidrogenasa ≥ 600 U/l, haptoglobina ≤ 10mg/dl) y el paciente había recibido alguna transfusión de hematíes en los últimos 6 meses.
Se definió éxito técnico cuando se consiguió implantar el dispositivo correctamente en las FPP sin producir interferencia con los discos protésicos y sin necesidad de conversión emergente a cirugía convencional. Se consideró éxito del procedimiento si, además de los criterios anteriores, se observaba en el ecocardiograma una disminución ≥ 1 grado en la regurgitación valvular.
Se consideraron eventos relacionados con el procedimiento las complicaciones ocurridas durante este y en las siguientes 24 h (muerte relacionada con el procedimiento, muerte cardiovascular, eventos cerebrovasculares agudos, infarto de miocardio, taponamiento cardiaco, complicaciones vasculares a nivel del acceso vascular que precisaran cirugía o transfusión de hematíes y conversión emergente a cirugía tradicional).
Técnica y características del procedimientoEn todos los pacientes, el procedimiento se realizó con anestesia general y guiado con ecocardiografía transesofágica (ETE), bidimensional en los primeros 6 casos y tridimensional en tiempo real en el resto (81,8%).
El cierre percutáneo de las FPP aórticas se realizó en todos los casos a través de un abordaje retrógrado, según las técnicas descritas previamente2,9,16,17. Brevemente, se avanza hasta la aorta un catéter con una guía hidrófila, que se utiliza para cruzar la FPP; una vez cruzada la fuga con la guía hidrófila, se avanza el catéter y, una vez en el ventrículo, se realiza el intercambio a una guía de mayor soporte que permite el avance a través de la fuga de la vaina de liberación del dispositivo. Sobre dicha vaina, se introduce el dispositivo y se implanta desplegando secuencialmente el disco distal en la cara ventricular y el disco proximal en la cara aórtica de la fuga.
El cierre de las FPP mitrales se realizó utilizando una vía retrógrada o anterógrada, dependiendo de la anatomía del paciente y de la ubicación de las FPP según las técnicas descritas previamente2,9,16. Brevemente, en el abordaje anterógrado se realiza una punción transeptal y, desde la aurícula izquierda, se cruza con una guía la FPP hasta el ventrículo izquierdo, mientras que en el abordaje retrogrado se pasa la guía desde el ventrículo izquierdo a través de la fuga hasta la aurícula izquierda. Se estableció circuito arteriovenoso en todos los pacientes (capturando con lazo la guía en la aurícula izquierda en el abordaje retrogrado y en la aorta en el abordaje anterógrado) y se avanzó la vaina de liberación desde aurícula a ventrículo.
En pacientes con FPP mitrales y portadores de prótesis aórtica bidiscal, después de intentar un acceso anterógrado sin éxito, se realizó un abordaje retrógrado cruzando por la apertura central de prótesis aórtica con un catéter hidrófilo y una guía recta, y se siguieron los mismos pasos que en otros abordajes retrógrados.
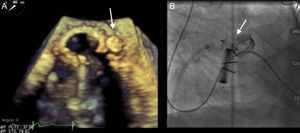
En todos los casos se utilizó el dispositivo AVP III. Se trata de un dispositivo de nitinol de forma ovalada que tiene una altura de 6,5 mm, y sus tamaños varían de 4-14 mm en el eje largo y de 2-5 mm en el eje corto. Según el tamaño del dispositivo, las vainas de liberación varían de 4 a 7 Fr (figura 1).
El tamaño de la FPP, y por lo tanto el tamaño del dispositivo a implantar, se valoró mediante ETE. En los pacientes en que se realizó ETE tridimensional, se utilizaron las imágenes adquiridas en 3 dimensiones con color. La medición de las características anatómicas (área, anchura y longitud) de cada FPP se hizo a partir de la imagen obtenida del volumen completo utilizando la herramienta de reconstrucción multiplanar, de modo que los planos longitudinal y coronal se crucen en la zona de la dehiscencia visualizando el flujo regurgitante, mientras que se usa el plano transversal o eje corto para medir el orificio regurgitante en el punto de origen.
A todos los pacientes se les administró heparina intravenosa tras realizar la punción transeptal para conseguir un tiempo de coagulación activado de 250 s, y tras el procedimiento se introdujo la anticoagulación oral y se mantuvo el tratamiento con heparina hasta conseguir niveles adecuados con los anticoagulantes orales.
Seguimiento clínico y ecocardiográficoSe revisó a los pacientes en la consulta de cardiología y se realizó ETE a los 90 días del procedimiento. Las variables recogidas fueron las siguientes: clase funcional de la New York Heart Association, necesidad de transfusión de hematíes, muerte por todas las causas, muerte cardiovascular, eventos cerebrovasculares agudos, infarto de miocardio, necesidad de cirugía cardiaca, complicaciones vasculares que precisaran transfusión de hematíes o cirugía y grado de regurgitación valvular18.
Se consideró éxito clínico en el seguimiento cuando se constató una mejoría clínica ≥ 1 grado en la clase funcional de la New York Heart Association, en los siguientes 90 días tras el procedimiento de cierre.
Análisis estadísticoSe realizó un estudio descriptivo retrospectivo. Las variables continuas se presentan en forma de media±desviación estándar y las cualitativas, en forma de número absoluto y porcentaje. El análisis estadístico se llevó a cabo con el programa SPSS 16.0 (IBM SPSS Statistics).
RESULTADOSDurante el periodo analizado, se realizó el cierre percutáneo de 34 FPP, 7 en posición aórtica y 27 a nivel mitral, correspondientes a 33 pacientes. En un paciente se cerraron dos FPP en distintas localizaciones en el mismo procedimiento. Las características demográficas y clínicas basales están resumidas en la tabla 1.
Características demográficas y clínicas de los pacientes
| Pacientes con intención de tratar, n | 33 |
| Edad (años) | 71±9 |
| Varones, % | 45 |
| Pacientes con 1 válvula protésica | 29 (87,8) |
| Pacientes con 2 válvulas protésicas | 4 (12,2) |
| Pacientes con ≥ 2 esternotomías previas | 3 (9) |
| Tiempo desde última cirugía al procedimiento de cierre (meses), mediana | 110 |
| Portadores de MP | 4 (12,2) |
| Prótesis valvulares | |
| Mecánicas | 32 (96,9) |
| Biológicas | 1 (3,1) |
| Aórticas mecánicas | 7 (21,2) |
| Mitrales mecánicas | 25 (75,7) |
| Mitrales biológicas | 1 (3) |
| Indicación del procedimiento | |
| IC | 7 (21,2) |
| AH | 1 (3) |
| IC+AH | 25 (75,7) |
| Clase funcional basal ≥ 3 | 31 (93,9) |
| Comorbilidades | |
| Antecedentes de CI | 5 (15,1) |
| Hipertensión | 17 (51,5) |
| DM2 | 9 (27,3) |
| HAP* | 22 (66,7) |
| FA | 18 (54,5) |
| IRC (FG<60 ml/min) | 9 (27,3) |
| EuroSCORE (%) | 20±9 |
AH: anemia hemolítica; CI: cardiopatía isquémica; DM2: diabetes mellitus tipo 2; FA: fibrilación auricular; FG: filtrado glomerular; HAP: hipertensión arterial pulmonar; IC: insuficiencia cardiaca; IRC: insuficiencia renal crónica; MP: marcapasos permanente.
Salvo otra indicación, los datos expresan n (%) o media ± desviación estándar.
*Presión sistólica de la arteria pulmonar estimada por ecocardiografía ≥ 40 mmHg.
El 45% de los pacientes eran varones y la media de edad, 71±9 años. La indicación más frecuente del procedimiento fue la presencia concomitante de IC y anemia hemolítica (75,7%). En el 21,2% de los casos, la indicación del cierre fue exclusivamente la IC y solo 1 paciente fue derivado para cierre por anemia hemolítica sintomática y necesidad de transfusiones periódicas. La población tratada presentaba una elevada comorbilidad y un alto riesgo quirúrgico. El EuroSCORE logístico medio estimado antes del procedimiento fue del 20±9%.
Implantes, complicaciones y resultados inmediatosEn el caso de las FPP aórticas, en todos los pacientes se realizó un abordaje retrogrado. De las FPP mitrales, en el 57,7% de los pacientes se realizó por vía retrógrada, en el 26,9% se utilizó un abordaje anterógrado y en el 15,4% de los pacientes el cierre se realizó por vía retrógrada cruzando la prótesis aórtica mecánica (figura 2). En 1 paciente se implantaron, mediante abordaje anterógrado, dos dispositivos contiguos para cierre de una FPP. Las características del procedimiento se resumen en la tabla 2.
Características del procedimiento
| Anestesia general | 33 (100) |
| Ecocardiografía | |
| ETE bidimensional+intracardiaca | 1 (3) |
| ETE bidimensional | 5 (15,1) |
| ETE tridimensional | 27 (81,8) |
| Acceso vascular | |
| Femoral derecho | 32 (97) |
| Humeral derecho | 1 (3) |
| Fugas perivalvulares con intención de tratar | |
| Total | 34 (100) |
| Aórticas | 7 (20,6) |
| Mitrales | 27 (79,4) |
| Localización de las FPP | |
| Aórticasa | |
| 11-3 | 2 (28,6) |
| 3-7 | 1 (14,2) |
| 7-11 | 4 (57,1) |
| Mitralesb | |
| 9-12 (anterior) | 12 (44,5) |
| 6-9 (lateral) | 7 (25,9) |
| 3-6 (posterior) | 7 (25,9) |
| 12-3 (septal) | 1 (3,7) |
| Técnica utilizada | |
| FPP aórticas | |
| Retrógrada | 7 (100) |
| FPP mitrales | |
| Anterógrada | 7 (26,9) |
| Retrógrada | 15 (57,7) |
| Retrógrada cruzando la prótesis aórtica mecánica | 4 (15,4) |
| Tamaño del dispositivo AVP III empleado (%) | |
| 8/4 | 26 |
| 6/3 | 20 |
| 12/5 | 16,6 |
| 10/5 | 13,3 |
| 12/3 | 10 |
| 14/5 | 0,6 |
| Otros | 13,3 |
| Éxito técnico | 31 (93,9) |
| Éxito técnico según la localización de la FPP | |
| Aórticas | 7 (100) |
| Mitrales | 26 (92,3) |
| Éxito del procedimiento | 30 (90,9) |
| Regurgitación valvular tras el implante | |
| De grave a ≤ ligera | 24 (77,4) |
| De grave a moderada | 6 (19,3) |
| Sin cambios | 1 (3,2) |
AVP III: Amplatzer Vascular Plug III; ETE: ecocardiografía transesofágica; FPP: fugas periprotésicas.
Salvo otra indicación, los datos expresan n (%).
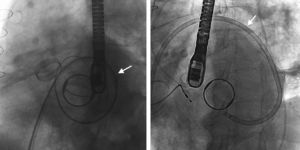
En 4 de los 33 pacientes, no se consiguió inicialmente el éxito del implante. En 1 caso el dispositivo se movilizó tras la liberación y condicionó interferencia con los discos protésicos mitrales, no fue posible recapturarlo y la paciente fue remitida a cirugía emergente. En 1 paciente fue imposible cruzar las FPP (FPP anterior en prótesis biológica sin estructura radiopaca) y se programó para intervención quirúrgica. En un paciente no se pudo realizar en un primer momento la punción transeptal (septo interauricular aneurismático), por lo que se repitió el procedimiento utilizando un catéter dirigible (Agilis, St. Jude Medical) y se realizó sin complicaciones (figura 3). En un paciente, el dispositivo interfería con los discos mitrales por el ángulo de acceso a las FPP, por lo que no se liberó y se repitió el procedimiento de manera programada realizando una punción transeptal más alta con ayuda de un catéter dirigible, lo que permitió la liberación del dispositivo sin complicaciones. En resumen, el éxito técnico se consiguió en el 93,5% de los pacientes, aunque en 2 de ellos fue necesario un segundo procedimiento programado. En todos los casos excepto uno, el éxito del implante se acompañó de una disminución ≥ 1 grado de la regurgitación (éxito del procedimiento del 90,9%).
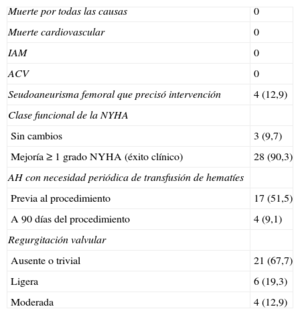
Se presentaron complicaciones relacionadas con el procedimiento en 4 pacientes. Como se ha comentado, 1 paciente precisó cirugía; 3 pacientes precisaron transfusión de hematíes en las primeras 24 h tras el procedimiento por hematoma en zona de punción; todos eran pacientes con anemia hemolítica y cifras de hemoglobina bajas antes del procedimiento, y se decidió la transfusión para facilitar la recuperación. No se constató ningún caso de muerte, infarto agudo de miocardio, accidente cerebrovascular o necesidad de cirugía vascular.
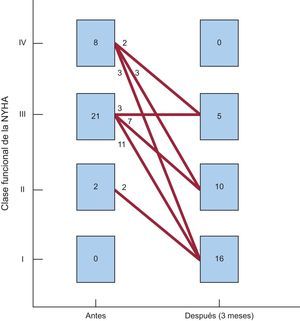
Seguimiento clínico y ecocardiográfico a 90 díasEn 28 de los 31 pacientes (90,3%) en los que se implantó el dispositivo, se comprobó una mejoría ≥ 1 grado en la clase funcional (éxito clínico a 90 días). Sólo 3 pacientes no experimentaron mejoría de la clase funcional después del procedimiento (figura 4). Además, la necesidad de transfusiones periódicas disminuyó significativamente con el procedimiento de cierre, del 51,5 al 9,1% (tabla 3).
Seguimiento clínico y ecocardiográfico a 90 días
| Muerte por todas las causas | 0 |
| Muerte cardiovascular | 0 |
| IAM | 0 |
| ACV | 0 |
| Seudoaneurisma femoral que precisó intervención | 4 (12,9) |
| Clase funcional de la NYHA | |
| Sin cambios | 3 (9,7) |
| Mejoría ≥ 1 grado NYHA (éxito clínico) | 28 (90,3) |
| AH con necesidad periódica de transfusión de hematíes | |
| Previa al procedimiento | 17 (51,5) |
| A 90 días del procedimiento | 4 (9,1) |
| Regurgitación valvular | |
| Ausente o trivial | 21 (67,7) |
| Ligera | 6 (19,3) |
| Moderada | 4 (12,9) |
ACV: accidente cerebrovascular; AH: anemia hemolítica; IAM: infarto agudo de miocardio; NYHA: New York Heart Association.
Los datos expresan n (%).
Se presentaron complicaciones durante el seguimiento en 4 pacientes (12,9%), todas ellas de etiología vascular (seudoaneurisma femoral). Dos de ellos eran pacientes a los que se realizó cierre de FPP aórtica y se usó una vaina de liberación de 8 Fr, lo que podría haber favorecido la aparición del seudoaneurisma. En los otros 2 casos (cierres de FPP mitrales), el acceso femoral izquierdo se utilizó para realizar el circuito arteriovenoso con introductores de 6 Fr; en 1 caso se realizó cierre con dispositivo y en el otro, compresión manual; ambos pacientes presentaban obesidad como factor de riesgo de complicaciones vasculares. En 3 pacientes se realizó cirugía tradicional y en el otro se optó por tratamiento percutáneo con trombina, todos con buen resultado. No se registraron fallecimientos, infarto de miocardio, accidente cerebrovascular o necesidad de cirugía cardiaca durante el seguimiento (tabla 3).
En el ETE de seguimiento, el 67,7% de los pacientes no tenían regurgitación valvular detectable o era trivial y en el 19,3% la regurgitación era leve. Sólo 4 pacientes (12,9%) presentaron una regurgitación valvular moderada (tabla 3).
DISCUSIÓNLas principales conclusiones de nuestra experiencia en el cierre de FPP con el dispositivo AVP III son que: a) el cierre percutáneo de las FPP es un procedimiento seguro y con baja tasa de complicaciones graves; b) el éxito técnico del procedimiento es alto, y c) los resultados a corto plazo son favorables en el cierre de FPP tanto mitrales como aórticas, con mejoría significativa en el grado de regurgitación, la clase funcional de la New York Heart Association y la necesidad de transfusión.
Aunque se desconoce el porcentaje exacto de FPP tras la cirugía valvular, ya que varía considerablemente entre las distintas series19,20, algunos estudios han puesto de manifiesto que la presencia de FPP sintomáticas graves se asocia a menor morbimortalidad si se tratan de manera invasiva que con el manejo conservador21.
El tratamiento clásico de las FPP es la cirugía; sin embargo, este tipo de cirugía se asocia a un riesgo considerable de complicaciones graves y de necesidad de reintervención. Además, los resultados publicados son variables3,22–24. En la práctica clínica, un número considerable de pacientes con FPP sintomáticas no llegan a ser intervenidos debido a sus múltiples comorbilidades y al elevado riesgo quirúrgico estimado, con el mal pronóstico que ello conlleva21. En este escenario, el uso de una técnica menos invasiva, como el cierre percutáneo, se presenta como una alternativa terapéutica muy atractiva para el tratamiento de estos pacientes.
Desde la descripción del primer procedimiento de cierre percutáneo de una FPP25, ha habido creciente interés por esta técnica y un incremento sustancial en el número de casos tratados. Las tasas de éxito y complicaciones varían de manera sustancial según las series consultadas. La variabilidad en la morfología de las FPP, sus tamaños y los distintos accesos y técnicas usados para su tratamiento podrían explicar esta variabilidad. Además, las experiencias publicadas hasta el momento no incluyen un gran número de pacientes, y en la mayoría de las ocasiones corresponden a los datos de un único centro, lo que dificulta la extrapolación de los resultados.
Hay que destacar que la morfología ovalada o en media luna de la mayoría de las FPP hace difícil encontrar un dispositivo específico que se adapte a estos defectos. Por esta razón se ha utilizado para el tratamiento de las FPP multitud de dispositivos no diseñados específicamente para este cometido15,25–29. El AVP III, por sus características y su diseño, es un dispositivo ideal para el cierre de FPP. Sin embargo, la experiencia publicada con este dispositivo se concentra en casos aislados y series con muy pocos pacientes10,12,30–32.
Al igual que en las series de cierre percutáneo de FPP publicadas previamente2,16,33, en nuestro estudio la indicación más frecuente del procedimiento fue la concomitancia de IC y anemia hemolítica, y la población tratada presentaba elevada comorbilidad y alto riesgo quirúrgico.
En nuestra serie el éxito técnico fue del 93,9%, ligeramente superior a los de las series más extensas, publicadas recientemente por Ruiz et al2 (86%) y Sorajja et al16 (89%). Sin embargo, hay que tener en cuenta que en dichas series no se utilizó el dispositivo AVP III y el acceso fue transapical en muchos de los casos, lo que limita la comparación.
El elevado porcentaje de éxito puede explicarse por diferentes motivos. En nuestra serie, todos los procedimientos fueron guiados con ETE (ETE tridimensional en tiempo real en la mayoría de ellos). En este sentido, la participación de especialistas en ecocardiografía, familiarizados con la visualización de estos defectos y dispositivos de cierre, probablemente sea uno de los aspectos fundamentales para conseguir una elevada tasa de éxito. El diagnóstico ecocardiográfico de las FPP resulta complejo en bastantes ocasiones34,35. La incorporación de ETE tridimensional ha permitido visualizar la totalidad de la válvula protésica y ha aumentado la definición y la caracterización de las FPP36. También la ecocardiografía ha adquirido un destacado papel durante el procedimiento de cierre, ya que sirve de guía al operador durante las diferentes fases de la intervención, entre ellas: la elección del lugar adecuado para la punción transeptal auricular, la guía del catéter y del dispositivo hacia las FPP, la elección del dispositivo de cierre y la evaluación inmediata del resultado del cierre37,38. La serie que presentamos es relativamente reciente (años 2009-2013), y esto ha permitido que los pacientes se beneficiasen de los avances técnicos introducidos en los últimos años y de la experiencia de otros autores que han descrito las posibles complicaciones de esta técnica y sus soluciones; además, el operador principal había realizado o colaborado previamente en otros centros en este tipo de intervenciones, lo que puede influir positivamente en los resultados presentados, al no incluir la curva de aprendizaje completa. Finamente, el uso en todos los casos del dispositivo AVP III puede haber influido en los resultados. Dadas sus características, este dispositivo probablemente se acopla a los FPP mejor que otros dispositivos usados previamente. El dispositivo Amplatzer ASD Occluder (St. Jude Medical) tiene una gran distancia entre la cintura y los discos (12-14 mm en la mayoría de los dispositivos), lo que puede aumentar la interferencia con los discos protésicos; el Amplatzer PDA Occluder (St. Jude Medical) de primera generación solo tenía un disco de retención, lo que podría incrementar el riesgo de embolización; el Vascular Plug II y el VSD Occluder (St. Jude Medical) son circulares, por lo que podrían ser adecuados para los pocos casos en que las FPP tengan esa forma. Con respecto al AVP III, aunque los datos son escasos, los resultados son esperanzadores; Nietlispach et al12, que describieron la experiencia inicial con este dispositivo, obtuvieron el éxito técnico en el 100% de los 5 pacientes en los que lo implantaron; Smolka et al11, en el 90% de 11 pacientes y Ozkan et al10, en el 100% de 3 pacientes.
Las vasculares fueron, al igual que en otras series, las complicaciones que con mayor frecuencia se asociaron al procedimiento. Hay que destacar que todos los pacientes estaban en tratamiento con acenocumarol, lo que pudo influir en el desarrollo de estas complicaciones. No se observó ningún caso de muerte, infarto de miocardio o accidente cerebrovascular periprocedimiento. En el seguimiento a 90 días, la supervivencia fue del 100%, y en el 90,3% de los pacientes había mejorado la clase funcional ≥ 1 grado.
LimitacionesEs un estudio descriptivo unicéntrico por lo que las conclusiones extraídas pueden no ser trasladables a otros escenarios. No es un estudio aleatorizado, por lo que no se ha comparado la eficacia del AVP III frente a otros dispositivos. El pequeño número de pacientes hace difícil extraer conclusiones con respecto a los factores que influyeron en la aparición de complicaciones vasculares. El seguimiento presentado es a corto plazo, la repercusión clínica y ecocardiográfica de este procedimiento a medio y largo plazo con el dispositivo AVP III se desconoce.
CONCLUSIONESEl cierre percutáneo de las FPP en pacientes con alto riesgo quirúrgico mediante el dispositivo AVP III es una técnica segura y eficaz, con buenos resultados clínicos y ecocardiográficos a corto plazo.
CONFLICTO DE INTERESESEl Dr. Cruz Gonzalez tiene un contrato de asesoría con St. Jude Medical. El resto de los autores no tienen ningún conflicto de intereses.