Palabras clave
DESARROLLO HISTÓRICO
Los objetivos de este capítulo son, por un lado, explicar las razones médicas para la aparición de esta «revolución miniinvasiva» en el campo de la cirugía coronaria que, sin lugar a dudas, responde a una problemática, y por otro, comentar el estado actual y los resultados de las diversas alternativas técnicas surgidas.
El nacimiento: «adaptarse y evolucionar o morir»
Inicialmente, la cirugía de revascularización coronaria fue realizada sobre el corazón en movimiento. Esto creaba diferentes e importantes problemas: por un lado, el movimiento del vaso que se iba a suturar comprometía en gran medida la fiabilidad de las anastomosis, por otro, el flujo sanguíneo del propio vaso o de la circulación colateral dificultaba la visión y, por último, para poder alcanzar determinadas ramas en la cara lateral o posterior del corazón éste debía ser luxado o desplazado, con el consiguiente deterioro hemodinámico.
Probablemente, el paso más importante para el desarrollo de la actual cirugía coronaria fue la aplicación clínica de las técnicas de circulación extracorpórea (CEC), iniciadas por Gibbon en 1953, ya que se hizo posible la realización de la cirugía coronaria sobre un campo quieto, sin sangre y con la posibilidad de ser manipulado libremente para exponer cualquier vaso coronario. Otro paso esencial para la difusión de esta cirugía fue la introducción de la angiografía coronaria por Sones y Shirey. Por primera vez se hacia posible definir y cuantificar in vivo las obstrucciones coronarias y determinar su impacto sobre el pronóstico del paciente.
Diversos factores han sido implicados en la morbilidad y la mortalidad de la cirugía coronaria; entre ellos podemos apuntar las alteraciones fisiopatológicas desencadenadas por la CEC, el daño isquémico durante la parada cardíaca, la hipotermia y la esternotomía media. A pesar de estos aspectos adversos, la estrategia esencial de esta cirugía, si exceptuamos la protección miocárdica, no ha presentado cambios en los últimos 25 años. De especial importancia en el capítulo de la morbilidad son las complicaciones neurológicas, cifradas en un 6,1% por Roach et al1, en un estudio multicéntrico prospectivo con 2.108 pacientes. Estas complicaciones son atribuidas a embolias de las placas de ateroma por la manipulación de la aorta ascendente, a microembolias o a bajas presiones de perfusión cerebral durante la CEC. La tendencia a operar a pacientes cada vez de mayor edad hace previsible una exacerbación de estas complicaciones. Roach et al1 concluyen en su publicación: «las complicaciones cerebrales tras la cirugía coronaria son relativamente frecuentes y serias, están asociadas con un incremento sustancial de la mortalidad, mayor estancia hospitalaria y consumo de recursos sanitarios a medio y largo plazo. Deben desarrollarse nuevas estrategias diagnósticas y terapéuticas para disminuir estas complicaciones».
A principios de la década de los noventa se produce la confluencia de dos estrategias quirúrgicas que abren nuevas alternativas terapéuticas en la cirugía coronaria. En primer lugar, por razones principalmente socioeconómicas, durante más de 10 años, la cirugía coronaria sin CEC era realizada con éxito, en pacientes seleccionados, en algunos centros de América del Sur2-6. Por otro lado, el segundo aspecto que confluye en estos años es la extensión a la cavidad torácica de la cirugía videoasistida y las técnicas miniinvasivas ya usadas en otros campos de la cirugía. La cirugía toracoscópica inspiró en 1991 el desarrollo, en la Universidad de Stanford, de la cirugía coronaria videoasistida con miniincisiones torácicas y a corazón parado, la denominada «cirugía coronaria Port-access». Sin embargo, debe resaltarse que, en la estrategia de Stanford, la CEC y la parada cardiopléjica del corazón continúan siendo partes fundamentales del procedimiento, por lo que no se elimina la morbilidad generada por ellas7,8.
A este contexto no es ajeno el intervencionismo percutáneo coronario. La difusión alcanzada por la angioplastia con balón y la introducción del stent para la reducción de la reestenosis producen una importante modificación cuantitativa y cualitativa en el case-mix de la cirugía coronaria. Ante una terapia de muy baja morbimortalidad y buenos resultados clínicos precoces, pero con una importante incidencia de reestenosis y necesidad de nuevos procedimientos a corto plazo y de unos desconocidos resultados clínicos o angiográficos a medio y largo plazo (superiores a 3-4 años), la cirugía coronaria debía evolucionar en dos sentidos: por un lado, buscando la máxima durabilidad mediante una extensión de la revascularización arterial y el uso intraoperatorio de lupas de gran magnificación (x5,5), y por otro, con una reducción de la agresión quirúrgica que permita una mejor y más rápida recuperación en el paciente de bajo riesgo, una reducción de la morbimortalidad en el de alto riesgo e incluso abordar a pacientes hasta este momento considerados inoperables. Es evidente que en la consecución de este segundo objetivo no se puede comprometer la calidad de la intervención, pues afectaría a la durabilidad del procedimiento.
Un problema en la terminología
La terminología utilizada en la última década es tremendamente confusa, quizá por un deliberado mal uso del término «miniinvasivo». El concepto de «invasividad» en una técnica quirúrgica esta íntimamente unido al de la «morbilidad» que ésta genera. En la cirugía coronaria convencional, como hemos mencionado con anterioridad, los tres orígenes de la morbilidad son: la esternotomía media, la CEC y la manipulación de la aorta, aunque con diferente peso específico según las características individuales de cada paciente. Las alternativas posibles para hacer la cirugía coronaria «menos invasiva», es decir, para reducir su morbilidad, serían: reducir las incisiones buscando alternativas a la esternotomía media, eliminar la CEC y no manipular la aorta, ni para su canulación ni como origen de los injertos. La aplicación práctica de estas ideas ha llevado a un amplio rango de alternativas técnicas «menos agresivas»:
1. Cirugía coronaria sin CEC por esternotomía media, off-pump CABG (OPCABG) en la bibliografía inglesa.
2. Cirugía coronaria sin CEC por miniincisiones, conocidas bajo el término genérico MIDCABG (Minimally Invasive Direct Coronary Artery Bypass Grafting), entre las cuales se han descrito diferentes vías de abordaje: paraesternal derecha, izquierda, minitoracotomía anterior derecha, y la vía de mayor difusión y experiencia clínica, la minitoracotomía anterior izquierda para suturar la arteria mamaria interna (AMI) a la arteria descendente anterior bajo visión directa, conocida bajo el término CABG-LAST OPERATION (Coronary Artery Bypass Grafting Left Anterior Small Thoracotomy).
En este grupo la disección de la AMI se realiza de forma parcial o total bajo visión directa, o de forma completa bajo visión videoasistida o mediante videotoracoscopia.
Una variante técnica desarrollada tras la difusión del MIDCABG es la conocida con el nombre de revascularización «híbrida»9,10, consistente en realizar revascularización de la arteria descendente anterior con técnicas de «cirugía miniinvasiva», y el resto de los vasos mediante angioplastia coronaria percutánea (ACTP). Dado el desarrollo, la fiabilidad y la seguridad alcanzados por las técnicas de cirugía sin CEC por esternotomía media, con abordaje de todas las zonas del corazón, incluso en pacientes de alto riesgo, en nuestra opinión, la revascularización híbrida debe ser una alternativa de segunda elección, limitada a casos excepcionales.
3. Técnica Port-access CABG (PACABG), en la que se usa CEC por vía femoro-femoral, parada cardíaca global y, como vía de abordaje, minitoracotomía anterior izquierda, similar a la del grupo anterior.
Las ventajas y desventajas de cada una de estas técnicas se comparan con las de la cirugía coronaria convencional en la tabla 1.
La consolidación: «de la aventura al viaje organizado»
En la segunda mitad de la década de los noventa asistimos a un importantísimo desarrollo tecnológico dirigido a contrarrestar los problemas técnicos que se planteaban para realizar la cirugía sin CEC. En este sentido, aparecen numerosos estabilizadores epicárdicos para reducir el movimiento regional, shunts intracoronarios para permitir la perfusión mientras se realiza la anastomosis, sopladores para eliminar la sangre de la anastomosis, posicionadores para ayudar en la luxación del corazón, medidores de flujo para garantizar la calidad de la anastomosis e instrumental quirúrgico específico11-14. Pasamos de una «cirugía coronaria sin CEC artesanal», con un enorme peso de la experiencia y habilidad del cirujano, un alto contenido de improvisación y poco reproducible, a una «cirugía coronaria sin CEC reglada y protocolizada», lo que garantiza el mantenimiento de la calidad de los resultados y la generalización del uso de esta técnica a más pacientes y cirujanos.
La técnica de la cirugía coronaria sin CEC por estereotomía media no es una adaptación de la técnica convencional, aunque ambas coinciden en la manipulación de arterias coronarias, injertos venosos o arteriales y en la construcción de anastomosis entre ambos. Ambas modalidades difieren en los conocimientos, la mentalización y la técnica. Se trata, pues, de una nueva técnica que requiere un aprendizaje y un entrenamiento específicos, que deben ser realizados sin comprometer los resultados. Esta dificultad ha sido uno de los aspectos que de forma más importante ha limitado su generalización.
A nuestro entender, en esta protocolización de la cirugía coronaria sin CEC han sido determinantes dos aspectos técnicos: el aprendizaje de la manipulación del corazón para su exposición y reducción del movimiento cardíaco, y el control cualitativo de la permeabilidad de la anastomosis mediante Doppler intraoperatorio.
Exposición y reducción regional del movimiento cardíaco
El renovado interés por la cirugía coronaria con el «corazón en movimiento» ha llevado a una amplia evaluación de diferentes posibilidades y dispositivos para la reducción «global» o «regional» del movimiento cardíaco.
En un primer momento se utilizaron bloqueadores beta para disminuir la frecuencia cardíaca e incluso bolos de adenosina para crear períodos transitorios de parada cardíaca, que se aprovechaban para dar puntos de sutura.
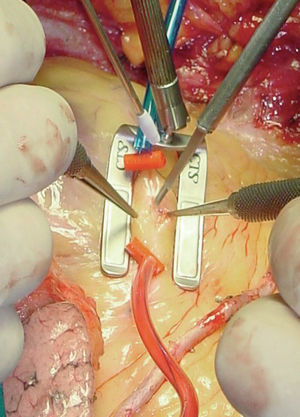
Posteriormente se han desarrollado dispositivos de inmovilización local de la zona anastomosada que permiten que el resto del corazón lata en condiciones más fisiológicas, conocidos bajo el término genérico de «estabilizadores epicárdicos». De los muchos que se encuentran comercializados, unos actúan básicamente mediante compresión regional del corazón, de los cuales el de mayor difusión clínica es el Guidant OPCABG System (fig. 1), y otros fijan el epicardio mediante succión del tejido, entre los que destacamos los conocidos con el nombre Octopus (Medtronic Inc., Minneapolis, MN) en sus diferentes versiones (fig. 2).
Fig. 1. Dispositivo de inmovilización regional por presión Guidant Ultima. Posición para realizar la anastomosis a la arteria descendente anterior. Se observan los puntos de oclusión arterial y la disección de la arteria.
Fig. 2. Dispositivo de inmovilización regional por succión Octopus. Posición para realizar la anastomosis a la arteria descendente anterior con la arteria mamaria interna.
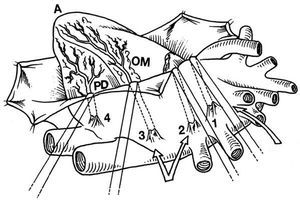
Estos dispositivos y el uso de puntos de tracción de pericardio, o una cinta de algodón en el seno transverso, facilitan la rotación y la luxación cardíaca, necesaria para el acceso a los vasos de la cara lateral y posterior del corazón (fig. 3)13,14.
Fig. 3. Luxación del corazón para la exposición de la cara lateral e inferoposterior del corazón mediante los puntos de tracción del pericardio. Puntos de Lima. Tomada de Baumgartner et al44.
Control cualitativo y cuantitativo de la anastomosis: medición del flujo en los injertos mediante Doppler intraoperatorio
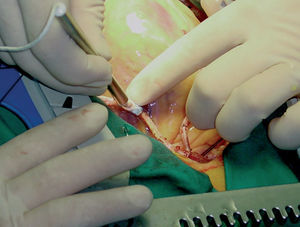
Pretendemos desarrollar una técnica quirúrgica que, por su complejidad, puede comprometer los resultados de permeabilidad de los injertos. Dado que disponemos de una técnica alternativa, cirugía con CEC, que ha demostrado buenos resultados a corto y largo plazo, en nuestra opinión es obligatoria, en la cirugía sin CEC, la evaluación intraoperatoria de cada anastomosis (fig. 4)15-21.
Fig. 4. Medición intraoperatoria del flujo del bypass.
La modificación del patrón del flujo sanguíneo que presentan los injertos al ser anastomosados al corazón, con una disminución de la onda sistólica y la aparición de una onda predominante diastólica, nos permite una evaluación cualitativa de su permeabilidad (fig. 5). Además, los equipos disponibles en el mercado realizan diferentes medidas cuantitativas de flujos e índices, el más empleado de los cuales es el flujo medio y el índice de pulsatilid ad (IP) (permeabilidad < 3). Siempre debemos dar más valor, a la hora de determinar la permeabilidad de una anastomosis, a la presencia de una predominante onda diastólica en el flujo, pues el valor cuantitativo del flujo está influido por el calibre del vaso y el grado de estenosis en la arteria coronaria, que puede condicionar en algunos casos la presencia de flujo competitivo.
Fig. 5. Flujo del bypass obtenido con Flowmeter intraoperatorio donde se aprecia la presencia de una onda diastólica predominante. Dato cualitativo de permeabilidad.
INDICACIONES
Este apartado está en constante actualización debido a la influencia de las mejoras técnicas en los inmovilizadores, que amplían el número de pacientes susceptibles de cirugía sin CEC pero, a su vez, se deberán modificar las indicaciones según los resultados obtenidos a corto y largo plazo. Los resultados obtenidos en la cirugía sin CEC en la era previa a los estabilizadores son subóptimos, principalmente por unos resultados técnicos deficitarios y una revascularización incompleta.
A priori, cualquier paciente candidato a cirugía tradicional es susceptible de ser intervenido sin CEC. En la evaluación preoperatoria, tan sólo la función ventricular y la angina inestable son datos que nos deben alertar sobre las dificultades de exposición de la cara lateral e inferior del corazón, pero la experiencia está demostrando que, tras la revascularización de la cara anterior, para la que se precisa una mínima distorsión, se consigue una gran estabilidad hemodinámica que permite el abordaje de las restantes zonas. Por tanto, la situación preoperatoria del paciente no es excluyente para la cirugía sin CEC; es más, estos pacientes son los que obtendrán, de poder realizarse esta técnica, el mayor beneficio potencial.
Se han apuntado unas características anatómicas de las arterias coronarias que dificultan la realización de la cirugía sin CEC, como son extensa calcificación, el trayecto intramiocárdico o los vasos de fino calibre. Si bien estas características deben tenerse muy en cuenta en la cirugía por minitoracotomía anterior izquierda, tras pasar un período de aprendizaje no deben considerarse contraindicaciones absolutas si el abordaje es la esternotomía media.
Datos iniciales de algunos grupos quirúrgicos o cirujanos individuales apuntan la posibilidad de realizar sin CEC el 75-98% del total de la cirugía coronaria, lo que tendrá un importante impacto en la reducción de costes y en el consumo de recursos sanitarios de la cirugía cardíaca22-32. En el ámbito mundial se calcula que el 20-30% de la cirugía coronaria se realiza sin CEC, en algunos países sobrepasa el 50% y en algunas unidades alcanza el 98% de casos no seleccionados.
En la actualidad, para nuestro grupo, la técnica quirúrgica de elección para la revascularización miocárdica es la revascularización arterial con doble arteria mamaria interna sin CEC y, por tanto, de entrada, en todos los pacientes se planifica esta intervención. Con la experiencia hemos encontrado que la isquemia intraoperatoria refractaria a tratamiento médico y balón de contrapulsación es la única causa que puede hacer imposible prescindir de la CEC.
CIRUGÍA CORONARIA SIN CEC: NUEVOS CONCEPTOS EN EL MANEJO ANESTÉSICO Y POSTOPERATORIO
Reducción de la agresión quirúrgica: algo más que eliminar la CEC
Un programa de cirugía cardíaca sin CEC precisa una planificación adecuada multidisciplinaria intraoperatoria y postoperatoria para lograr unos objetivos claramente definidos. Pretendemos no sólo una reducción en la agresión al paciente que posibilite una disminución de la morbimortalidad, sino también una aceleración del proceso quirúrgico que permita una reducción del consumo de recursos hospitalarios (principalmente estancia en camas de críticos), de costes y del período de recuperación del paciente.
Al contrario de lo que sucedía en la cirugía cardíaca con CEC, donde el papel desempeñado por el anestesiólogo modificaba poco los resultados finales de un programa quirúrgico, la formación y experiencia del anestesiólogo, tanto en el tiempo quirúrgico como en el postoperatorio, es un factor determinante para conseguir los mejores resultados en la cirugía sin CEC.
La cirugía cardíaca tiene unas consideraciones específicas desde el punto de vista anestésico; éstas se deben precisar en términos de prevención de la isquemia miocárdica, mantenimiento de la profundidad de la anestesia, estabilidad hemodinámica, disminución de la respuesta al estrés quirúrgico y planificación de los cuidados postoperatorios.
Elección de la técnica anestésica
La elección de cualquier técnica anestésica se encuentra condicionada por los objetivos que se pretenden conseguir. El manejo anestésico durante la cirugía sin CEC comprende las características generales de cualquier acto anestésico, analgesia, amnesia, inconsciencia e inmovilidad y, además, proporcionar máxima estabilidad hemodinámica durante la manipulación del corazón y protección miocárdica durante los pinzamientos coronarios. Sin embargo, este manejo anestésico aumenta su complejidad al precisar que el paciente despierte lo más precozmente posible y con un dolor postoperatorio nulo33-46.
Anestesia multimodal
En los últimos años se han introducido las técnicas de anestesia multimodal en cirugía cardíaca, que consisten en la realización de técnicas de anestesia regional combinadas con anestesia general con la finalidad de disminuir la respuesta al estrés quirúrgico, sin estar obligados a administrar dosis elevadas de agentes opiáceos, y proporcionar una analgesia excelente en los períodos intraoperatorio y postoperatorio33-35.
Anestesia epidural torácica-anestesia general. Los beneficios de estas técnicas son la reducción de la demanda de oxígeno miocárdico secundaria a la disminución de las resistencias vasculares, de la frecuencia cardíaca y de la supresión de la respuesta simpática a la estimulación quirúrgica. Otros efectos beneficiosos son el aumento de la perfusión miocárdica y esplácnica derivado de la simpatectomía producida en el tórax y la disminución de la respuesta al estrés quirúrgico. Se ha demostrado que los pacientes con anestesia epidural tienen valores más bajos de adrenalina, glucosa, cortisol y noradrenalina en comparación con los pacientes anestesiados con dosis elevadas de fentanilo. El mayor desarrollo de la anestesia multimodal no se debe únicamente a sus ventajas desde el punto de vista de la fisiología cardíaca, sino que también es debido a que es una técnica ideal para la analgesia y la fisioterapia ventilatoria en el período postoperatorio.
Esta técnica es de elección si se pretende la extubación del paciente al final de la intervención.
Anestesia general-opiáceos intratecales. El objetivo de la administración de opiáceos intratecales consiste en proporcionar una analgesia intensa durante el período preoperatorio mediante la administración de una única dosis (generalmente morfina en dosis de 0,3-0,5 mg) intratecal antes de la intervención quirúrgica. Las ventajas de la técnica son inferiores a la anestesia epidural al no producir simpatectomía torácica ni selectividad analgésica; sin embargo, la analgesia es adecuada. Otro inconveniente son los efectos secundarios centrales de los opiáceos, principalmente la depresión respiratoria, puede retrasar el despertar, la deambulación, la ingesta y el alta del paciente.
Anestesia general y bloqueos periféricos: intercostal, interpleural o paravertebral. Consiste en la asociación de una técnica de anestesia general superficial y un bloqueo sensitivo unilateral que producen una excelente analgesia intraoperatoria y postoperatoria en los casos en los que la cirugía se realiza por una toracotomía lateral (anastomosis de un único vaso, descendente anterior o coronaria derecha).
Anestesia general
Recientemente, la introducción del remifentanilo, un opiáceo de acción ultracorta, con unas características farmacodinámicas intraoperatorias próximas al opiáceo ideal, puede modificar las técnicas de inducción y mantenimiento en la anestesia cardíaca. El uso intraoperatorio de este opiáceo permite realizar anestesias basadas principalmente en la analgesia y sin riesgo de depresión ventilatoria prolongada. La interacción farmacológica con inhalatorios e intravenosos nos permite disminuir las dosis de fármacos hipnóticos que tienen efectos vasodilatadores o inotrópicos negativos. Esto favorece la estabilidad hemodinámica y disminuye la respuesta simpático-adrenérgica al estrés quirúrgico. El principal inconveniente del remifentanilo es el tratamiento del dolor postoperatorio debido a que el paciente, tras la retirada del fármaco, no tiene analgesia residual. Las técnicas de analgesia combinadas, mencionadas con anterioridad, epidural o intradural, prácticas de analgesia preventiva y la administración combinada de antiinflamatorios no esteroideos (AINE) y opiáceos son más eficaces para controlar el dolor postoperatorio que la administración única intraoperatoria de opiáceos36.
Monitorización y manejo hemodinámico
La monitorización anestésica no difiere de la estándar en cirugía cardíaca: electrocardiograma de 3-12 derivaciones, pulsioximetría, capnografía (gráfica de eliminación de CO2), presión arterial invasiva y presión venosa central o presiones en la arteria pulmonar. La introducción de una sonda Doppler esofágica o de un catéter de gasto cardíaco continuo o SvO2 es de gran utilidad para el conocimiento de las variaciones del gasto cardíaco que se pueden motivar por las variaciones de posición del corazón y/o del paciente y minimizar la isquemia mesentérica y/o cerebral.
La ecocardiografía transesofágica nos ayuda a visualizar las cámaras cardíacas durante las diferentes fases de la intervención y, así, a dirigir los cambios de posición.
Las variaciones hemodinámicas se producen principalmente por disminución de la precarga del ventrículo izquierdo motivada por compresión del ventrículo derecho al manipular el corazón; un Trendelemburg de 30-40º suele restaurar la precarga y el gasto. Suele ser frecuente la administración de dosis bajas de catecolaminas alfa-beta (efedrina o adrenalina) para restaurar el gasto cardíaco y la presión arterial media en aquellas situaciones en las que los cambios de posición no son totalmente efectivos.
Miocardioprotección y anestesia
Las técnicas anestésicas expuestas proporcionan cierta miocardioprotección desde un punto de vista clásico, al disminuir el consumo de oxígeno miocárdico y mejorar el aporte de O2. Estas técnicas disminuyen la frecuencia cardíaca y la poscarga del ventrículo izquierdo, producen vasodilatación coronaria mejorando el flujo colateral y con un manejo hemodinámico adecuado se puede mejorar la presión de perfusión miocárdica. La administración de esmolol (un bloqueador beta de acción ultracorta) durante el período intraoperatorio nos sirve para disminuir la frecuencia cardíaca y el consumo de oxígeno miocárdico durante la revascularización coronaria; dosis bajas de este agente son de gran utilidad principalmente cuando no se administran agentes anestésicos con propiedades bradicardizantes. Otros agentes empleados con frecuencia son los antagonistas del calcio, que tienen un efecto antianginoso y espasmolítico sobre los vasos coronarios, como el diltiazem (5-10 mg/h) o la nicardipina (0,4-0,6 mg/h). No obstante, se puede proporcionar una mayor protección miocárdica ante la isquemia si se conocen ciertas características de los agentes anestésicos volátiles; así, se ha demostrado que uno o varios períodos de isquemia-reperfusión prolongan la tolerancia del miocardio a la isquemia (precondicionamiento isquémico). Evidencias recientes indican que los canales ATP-K y los receptores adenosina A1 modulan una fase de memoria aguda que prolonga la tolerancia a la isquemia. Los anestésicos volátiles ejercen efectos cardioprotectores durante la isquemia-reperfusión por un mecanismo de acción similar a las maniobras de precondicionamiento (isquemia durante más de 3 min seguida de reperfusión) y se ha demostrado en estudios en animales un cierto efecto sumatorio en la tolerancia a la isquemia.
Planificación de los cuidados postoperatorios
La planificación de los cuidados postoperatorios comienza en el momento en que el paciente entra en el quirófano; ciertas particularidades, como pueden ser evitar la hipotermia (calentamiento de líquidos intravenosos, temperatura del quirófano, calentamiento activo del paciente, etc.), la aplicación de la técnica anestésica más adecuada para conseguir la extubación al final de la intervención o a las pocas horas en la unidad de reanimación y una analgesia excelente son detalles que, si son olvidados, no permiten realizar una extubación, una fisioterapia y una deambulación precoces.
La profilaxis de las arritmias supraventriculares no se diferencia de la empleada en cirugía con CEC y debería comenzar ya en la intervención; los antagonistas del calcio, el sulfato de magnesio, etc., son fármacos frecuentemente empleados. Sin embargo, la administración de bloqueadores beta es, en la actualidad, una de las prácticas más frecuentes. La disponibilidad de esmolol nos permite utilizar bloqueadores beta en el paciente hasta que estos fármacos puedan ser administrados vía oral, con la particularidad de que, si se producen situaciones de bajo gasto, los efectos son fugaces tras suspender su administración.
CIRUGÍA CORONARIA ARTERIAL CON DOBLE ARTERIA MAMARIA INTERNA SIN CEC
Reducción de la morbilidad en cirugía coronaria: nuestra visión del problema
Como hemos comentado en el apartado anterior, la reducción de la agresión quirúrgica en cirugía coronaria es algo más que eliminar la conexión del paciente a la bomba de CEC. Debemos planificar la intervención con un doble objetivo: eliminar o reducir todas las fuentes de morbilidad y buscar la mayor permeabilidad precoz y tardía de los injertos mediante el uso extensivo de injertos arteriales.
En nuestra opinión, para reducir verdaderamente la morbimortalidad de la cirugía de revascularización miocárdica con CEC no sólo debe prescindirse de ésta, sino que debe eliminarse el clampaje lateral de la aorta y la necesidad de utilizar vena safena. Además, el manejo anestésico de estos pacientes debe favorecer la extubación precoz, como paso imprescindible para reducir la morbilidad en el postoperatorio.
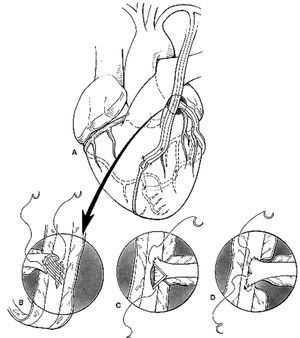
El razonamiento anteriormente expuesto se ve reflejado en nuestra técnica de elección en cirugía coronaria: la revascularizac ión miocárdica arterial completa con doble AMI, dispuestas como injerto en «Y» o «T» (técnica de Tector48,49), sin el uso de CEC (fig. 6).
Fig. 6. Diagrama de la revascularización con ambas arterias mamarias internas como injerto en «T». La arteria mamaria interna izquierda se utiliza para revascularizar la cara anterior y la arteria mamaria interna derecha para las caras lateral e inferior del corazón. Tomada de Tector A et al48-49.
Cirugía coronaria arterial sin CEC con doble arteria mamaria: técnica quirúrgica
Ambas AMI son disecadas «esqueletizadas» (sin fascia, venas y músculo) mediante lupas de magnificación (x3,5 a x5,5), con el objeto de preservar la vascularización del esternón, mejorar su calibre y longitud y facilitar la construcción del injerto en «T» y las anastomosis secuenciales. Realizamos la heparinización, inicialmente con 1,5 mg/kg de peso, necesaria para alcanzar un tiempo de coagulación activado (TCA) > 300 s, y esta cifra se mantiene durante todo el período en el que se realizan oclusiones arteriales. Ambas AMI se irrigan con suero salino caliente y solución salina de papaverina en un proporción 1:30, sin realizar manipulación farmacológica intraarterial. Se exploran las arterias coronarias diana y se confirma la estrategia quirúrgica.
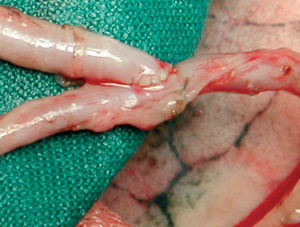
Tras seccionar con clips metálicos la porción proximal de la AMI derecha, se realiza la construcción del injerto en «T» (anastomosis término-lateral perpendicular) o en «Y» (anastomosis término-lateral en paralelo), según el plan quirúrgico, suturando el injerto libre de AMI derecha (AMID) sobre la AMI izquierda (AMII) a la altura de la orejuela izquierda, tras pasar esta última por una incisión lateral del pericardio. La anastomosis término-lateral, de unos 8 mm de longitud, se realiza con sutura continua de monofilamento de 8-0 y se comprueba la pulsatilidad o el flujo de ambos brazos del injerto (fig. 7). En casos seleccionados ha sido necesario construir un segundo injerto en «Y», con un pequeño segmento de AMII o AMID de 2-4 cm de longitud, sobre una porción más distal de la AMII, para la revascularización de ramos diagonales que discurren casi perpendiculares a la arteria descendente anterior.
Fig. 7. Anastomosis término-lateral en paralelo («Y») entre la arteria mamaria interna derecha como injerto libre y la arteria mamaria izquierda.
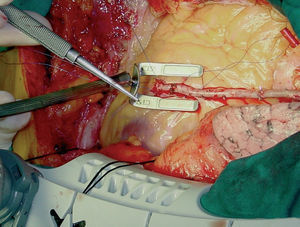
Siempre realizamos, en primer lugar, la revascularización de la cara anterior del corazón comenzando, si es preciso, por las arterias diagonales y a continuación la arteria descendente anterior (fig. 8). Posteriormente se realizan las anastomosis de las caras lateral (fig. 9), posterolateral e inferior (fig. 10), por este orden. En la mayoría de los pacientes se ha realizado la revascularización de la descendente anterior con la AMII, pero en algunos pacientes, en los que se precisó mayor longitud o mejor calidad del injerto a este territorio, se prefirió usar la AMID.
Fig. 8. Anastomosis completada de la arteria mamaria interna izquierda esqueletonizada a la arteria descendente anterior sin circulación extracorpórea mediante el inmovilizador de compresión Guidant Ultima.
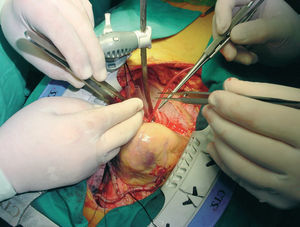
Fig. 9. Exposición, inmovilización y anastomosis secuencial de la arteria mamaria derecha a la segunda arteria marginal. Posición verticalizada del corazón.
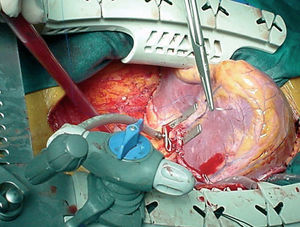
Fig. 10. Exposición, inmovilización y anastomosis terminal de la arteria mamaria derecha a la arteria descendente posterior. Posición verticalizada extrema del corazón (ápex hacia la cabeza del paciente).
En los primeros casos, la estrategia de exposición de las arterias coronarias estaba basada en el uso de 4 cintas de algodón: 2 que se pasan por el seno transverso y otras 2 por debajo de la vena cava inferior. Posteriormente, hemos modificado la técnica de elevación y rotación del corazón para acceder a las caras lateral, posterolateral e inferior del corazón, adoptando la técnica descrita por Lima49. Se basa en la colocación de 2-3 puntos de seda para elevar el lado izquierdo del pericardio, el primero por encima de la vena pulmonar superior izquierda, el segundo próximo a la vena pulmonar inferior izquierda y el tercero en la vecindad de la vena cava inferior. Con la tracción alternativa o simultánea de estos puntos se consigue elevar y rotar hacia la derecha la base del corazón y colocar el ápex fuera del tórax. En la actualidad, algunos grupos han simplificado esta maniobra colocando tan sólo unas cintas de algodón que traccionan desde el seno transverso o mediante el uso de ventosas en el ápex («posicionadores»). Esta posición genera una dificultad al llenado del ventrículo derecho que es compensada con un Trendelemburg de 20º, con lo que se consigue una adecuada estabilidad hemodinámica. A lo largo de nuestra experiencia se han utilizado diversos inmovilizadores, que han aparecido en el mercado con mejoras tecnológicas, utilizándose en la actualidad el CTS Última y el Octopus-3.
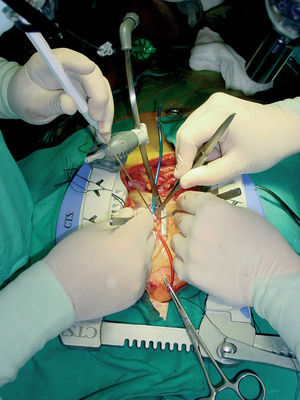
Una vez conseguida una adecuada exposición e inmovilización de la arteria coronaria diana con una buena hemodinámica, se procede a la oclusión de la arteria coronaria mediante un torniquete de monofilamento de 4-0 apoyado en un trozo de silicona para no dañar la arteria. Sólo excepcionalmente se realiza oclusión distal de las arterias coronarias y no se emplean oclusores o shunts intravasculares para evitar el daño arterial intraluminal.
Todas las anastomosis se realizan con una sutura continua de monofilamento de 8-0 (Surgipro, Autosuture, Estados Unidos) y lupas de magnificación (x3,5 a x5,5), y se elimina la sangre de la arteriotomía mediante un «soplador» de aire húmedo (Clear View Blower/Mister, Medtronic DLP, Grand Rapids, MI) (fig. 11). Según la posición de las arterias coronarias y la longitud del injerto (AMI) hemos usado tanto anastomosis latero-laterales (secuenciales) en paralelo o perpendiculares (diamante), como término-laterales, igualmente en paralelo o perpendiculares.
Fig. 11. Visión completa de los elementos útiles para la realización de la cirugía coronaria sin circulación extracorpórea: inmovilizador regional Guidant, puntos de oclusión coronaria y soplador.
Al finalizar cada anastomosis se realiza una evaluación cuantitativa y cualitativa mediante un medidor de flujo (Transonic System, Ithaca NY).
Cirugía coronaria arterial sin CEC: protocolo de antiagregación y anticoagulación
Otra característica importante de la circulación sin CEC es la anticoagulación durante la intervención quirúrgica y la reversión de ésta tras la revascularización coronaria. En este sentido, es muy interesante la publicación de Mariani et al50, en la que se demuestra la presencia de una actividad procoagulante en la cirugía coronaria sin CEC, similar a la que se produce en otras cirugías mayores o en el intervencionismo coronario. Hay que tener en cuenta que no se produjo un daño plaquetario por la CEC. Para nosotros, la estrategia fundamental consiste en no suspender los antiagregantes antes de la intervención e incluso administrar antiagregantes intravenosos al finalizar la cirugía.
SITUACIÓN ACTUAL
¿Por qué la cirugía coronaria convencional no es sustituida, en un breve período, por la cirugía coronaria sin CEC?
La técnica microquirúrgica que supone la realización de una anastomosis coronaria es uno de los campos de mayor interés para un cirujano cardíaco. En el ámbito de la cirugía coronaria convencional, la conexión del paciente a la máquina de CEC es parte de la actividad sistemática y los efectos secundarios que se puedan derivar son vividos como inevitables y, en todo caso, fruto de la «mala suerte», pero nunca como un error personal. Realizar una anastomosis coronaria sobre un corazón en movimiento sin el apoyo de la CEC supone no sólo importantes cambios técnicos para el cirujano sino, además, importantes cambios psicológicos. Un cirujano y un grupo quirúrgico que carezcan de compromiso y entusiasmo por aprender difícilmente podrán realizar de forma satisfactoria esta «reconversión» hacia una nueva técnica. Como grupo, deben estar dispuestos a aceptar algún revés hasta la consecución de su objetivo. En un medio en el que todo el mundo va a comparar, desde el primer día y con un espíritu severamente crítico, la cirugía sin CEC con la cirugía coronaria tradicional, puede llegar a ser muy difícil soportar una curva de aprendizaje.
En una especialidad como la cirugía, sujeta a normas bastante conservadoras, es lógico y deseable que todo cambio sea minuciosamente analizado. Por todo esto, es ilógico pensar que toda la comunidad cardioquirúrgica dé la bienvenida al unísono a una nueva técnica. No ocurrió con la introducción de la AMI como injerto coronario ni ha ocurrido con la cirugía sin CEC.
¿Qué ha ocurrido con la cirugía coronaria sin CEC en los últimos 10 años?
Como ya hemos mencionado, sobre todo se ha visto involucrada en un proceso de estandarización. Este proceso ha tenido lugar desde que en 1996-1997 se ha introducido toda la tecnología necesaria para una correcta exposición e inmovilización de la arteria coronaria, sutura del injerto y análisis de su calidad.
Por tanto, el período de verdadero interés abarca las series publicadas con pacientes intervenidos en los últimos 7 años. En las publicaciones anteriores claramente se evidencia una revascularización limitada, incompleta y con peores resultados que la cirugía cardíaca convencional, pero realizada en pacientes sesgados hacia el altísimo riesgo y con precario desarrollo tecnológico51,52.
Evidencia científica en la actualidad. Conferencia de Consenso ISMICS 2004
De los más de 1.200 trabajos publicados y recogidos en MEDLINE sobre la cirugía coronaria sin CEC, sólo alrededor de 90 pueden ser considerados «valiosos» desde el punto de vista de la evidencia científica y, de ellos, 37 son aleatorizados.
Para el análisis, la ordenación y la transmisión a la comunidad científica de la información derivada de estos trabajos se realizó, en mayo de 2004 en París, bajo los auspicios de la ISMICS (International Society for Minimal Invasive Cardiac Surgery), una Conferencia de Consenso cuyo objetivo era, siguiendo la metodología de la medicina basada en la evidencia, la revisión sistemática y, cuando fuese apropiado, realizar metaanálisis de la evidencia aleatorizada (nivel A) y no aleatorizada (nivel B) que compara cirugía coronaria sin CEC con cirugía coronaria convencional, con el fin de clarificar su papel en los pacientes de bajo y alto riesgo.
La conferencia fue planificada y estructurada siguiendo la normativa de la ACC/AHA para la confección de guías de práctica clínica.
Tras la búsqueda de la información en 7 bases de datos distintas se realizó una revisión sistemática y un metaanálisis de los 37 trabajos aleatorizados con pacientes de variado riesgo que comparan ambas técnicas. Además, se identificaron 2 metaanálisis de estudios no aleatorizados con pacientes de variado riesgo. No se encontraron revisiones sistemáticas, trabajos aleatorizados ni metaanálisis con pacientes de alto riesgo, por lo que se realizó un metaanálisis sobre esta cuestión.
El objetivo primario a analizar fue la mortalidad global a los 30 días y después de 1 año en ambas técnicas. Como objetivos secundarios se analizaron la incidencia de accidente cerebrovascular postoperatorio, disfunción cognitiva, infarto agudo de miocardio, recurrencia de angina, reintervención coronaria, necesidad de inotrópicos, necesidad de balón de contrapulsación, fibrilación auricular, fallo renal, mediastinitis, infección respiratoria, reintervención por sangrado, necesidad de transfusión, estancia en unidad de críticos, estancia hospitalaria, costes y calidad de vida.
A la espera de la publicación escrita definitiva de las conclusiones y recomendaciones de la Conferencia de Consenso ISMICS 2004, que se espera para los próximos meses, se puede afirmar en la actualidad que hay consenso en que: «la cirugía coronaria sin CEC es segura y efectiva, y no hay diferencias significativas en la mortalidad con la cirugía coronaria convencional en las series con pacientes de variado riesgo. Se puede conseguir una revascularización completa con ambas técnicas53-55, sin diferencias significativas en los estudios con pacientes de variado riesgo. No hay diferencias significativas en los resultados clínicos56, angiográficos precoces53-55 y a los 6-12 meses entre ambas técnicas57-60. En aspectos como el deterioro cognitivo61-64, el consumo de hemoderivados65,66, la isquemia miocárdica y el análisis de costes sale favorecida la cirugía sin CEC67-69. Los estudios retrospectivos no aleatorizados con ajuste de riesgo de grandes bases de datos encuentran una reducción en la mortalidad hospitalaria en pacientes de alto riesgo intervenidos con cirugía sin CEC70-76».
Al analizar estudios con resultados diferentes de los expresados se denota una clara conclusión: la cirugía coronaria sin CEC en manos de un cirujano experimentado puede ser realizada con resultados buenos y predecibles. Esto no se cumple para cirujanos inexpertos, lo que enfatiza la import ancia de los programas de formación específica para esta nueva técnica quirúrgica77.
En mayo de 2005, la American Heart Association ha publicado un scientific statement sobre la comparación entre OPCABG con CCC78. Las conclusiones expresadas básicamente coinciden en su totalidad con las conclusiones reflejadas anteriormente de la Conferencia de Consenso ISMICS 2004. En esencia, a la técnica OPCABG se le atribuyen ventajas clínicas, mientras que a la CCC se le atribuye la ventaja de la sencillez técnica. En nuestra experiencia, las dificultades técnicas pueden ser superadas con un adecuado aprendizaje; sin embargo, las ventajas clínicas no pueden ser sustituidas ni infravaloradas.
Resultados de los 1.000 primeros pacientes intervenidos en el Complejo Hospitalario Juan Canalejo
La cirugía coronaria con revascularización arterial completa sin CEC ha tenido un crecimiento exponencial en nuestro servicio, situándose en los últimos años por encima del 96% del total de la cirugía coronaria aislada. De forma muy resumida exponemos los resultados de los primeros 1.000 pacientes intervenidos con esta técnica.
Desde abril de 1998 hasta enero de 2004 se ha revascularizado sin CEC a un total de 1.000 pacientes, de los cuales 828 eran varones (82,8%), con una edad media de 67 ± 9,5 años (rango, 23-90). El 66% presentaba angina inestable, el 29,3% diabetes y el 14,7% arteriopatía periférica. El 20% presentaba lesión de tronco común, el 57% lesión de triple vaso y el 18% enfermedad de dos vasos con función ventricular media de 60% ± 13% (rango, 15-88). Ambas arterias mamarias fueron disecadas sin pedículo y anastomosadas como injerto en «Y» o «T» para alcanzar los diferentes territorios. La permeabilidad de las anastomosis se evaluó mediante Doppler intraoperatorio.
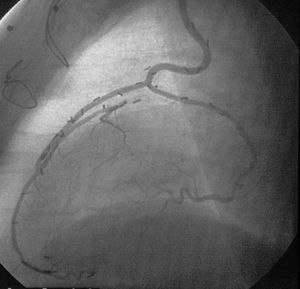
Se realizó un total de 2.740 anastomosis distales, con una media de 2,74 (rango, 1-5) por paciente, recibiendo 3 o más puentes el 62% de los pacientes. En cuanto a la morbilidad quirúrgica, 66 (6,6%) pacientes presentaron fibrilación auricular postoperatoria; 32 (3,2%), infarto perioperatorio; 12 (1,2%), mediastinitis; 14 (1,4%), reoperación por sangrado, y 4 (0,4%), accidente cerebrovascular permanente. La mortalidad hospitalaria fue del 3,5% (35 pacientes). En el año 2000 se realizó un estudio aleatorizado de permeabilidad en pacientes con más de 6 meses de seguimiento que demostró una permeabilidad del 98%79 (fig. 12). Con 6 años de seguimiento máximo la incidencia de nueva revascularización es del 1,5%.
Fig. 12. Imagen angiográfica de uno de nuestros pacientes revascularizado sin circulación extracorpórea. Injerto de arteria mamaria interna (AMI) izquierda a arteria descendente anterior e injerto de AMI derecha como injerto libre en «T» desde la AMI izquierda a la primera arteria marginal.
EL FUTURO DE LA CIRUGÍA CORONARIA SIN CEC
En los próximos años, el impacto de las nuevas técnicas de angioplastia coronaria sobre el perfil clínico y anatómico de los pacientes en los que se indicará cirugía coronaria será aún mayor. La cirugía coronaria será mucho más exigente para poder ofertar adecuados resultados. En este contexto y con las evidencias actuales, es lógico pensar que las ventajas que ofrece la cirugía sin CEC ganarán peso en el futuro, pero el aprendizaje, la «reconversión», debe iniciarse en la actualidad.
De forma más importante, la entrada de nuevas generaciones de jóvenes cirujanos cardíacos entrenados desde su inicio en estas nuevas técnicas puede incrementar de forma exponencial su perfeccionamiento y difusión. Es obligación de las sociedades científicas nacionales de cirugía cardíaca, la industria y los cirujanos senior de las instituciones favorecer medi ante la formación esta transformación.
CONCLUSIONES
1. La cirugía coronaria sin CEC se realiza en cientos de centros en el mundo. Alcanza en la actualidad el 20-30% del total. Se han publicado más de 1.200 trabajos en revistas internacionales.
2. La selección de los pacientes está en relación con la experiencia del cirujano. Es posible realizar una revascularización arterial completa sin selección del paciente.
3. Reduce algunos aspectos de la morbilidad y el consumo de recursos sanitarios en los pacientes de bajo riesgo y reduce la morbimortalidad en los de alto riesgo.
4. «La cirugía coronaria sin CEC esta aquí para quedarse.»
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: Dr. J. Cuenca.
Servicio de Cirugía Cardíaca. Hospital Juan Canalejo.
As Xubias, 64. 15006 A Coruña. España.
Correo electrónico: josecuenca@cardiocrunia.com