La nueva guía sobre el tratamiento del síndrome coronario agudo sin elevación del segmento ST (SCASEST) incluye un total de 131 recomendaciones, 3 menos que la anterior, publicada en 2016, y un número menor de recomendaciones absolutas (el 70% de clase I y el 8% de clase III). Sorprende que, a pesar de que existe más evidencia científica, se incrementan ligeramente las recomendaciones con un nivel de evidencia C (43%)1. Se mencionan 16 novedades que pueden resumirse en 7 cambios mayores, si bien no hay cambios muy radicales. Se intenta corregir el desacierto de las guías previas en la seriación de las troponinas de alta sensibilidad (TnI/TnT, 1 o 3 h)2, y actualmente se recomienda el algoritmo 0/1 h como primera opción. Probablemente, esta controversia en nuestro medio tiene poco sentido, puesto que la seriación es de un tiempo variable y depende de la presión del laboratorio. La tomografía computarizada (TC) de arterias coronarias en pacientes con bajo riesgo adquiere protagonismo en el diagnóstico. Sin embargo, los mayores cambios se producen en el tratamiento antitrombótico y la estrategia de revascularización, con novedades que pueden suscitar controversias.
DEFINICIÓN Y EPIDEMIOLOGÍANo se altera el diagnóstico de infarto de miocardio (IM) y se centra en la cuarta definición1. La generalización del uso de TnI/TnT ha producido un aumento absoluto del 4% en la detección del IM y una disminución de la incidencia de angina inestable. En nuestro medio, alrededor del 40% de los IM son sin elevación del segmento ST3.
Diagnóstico: síntomas, ECG, troponinas y técnicas de imagenLa guía relega la anamnesis y la exploración física al material adicional1, una preocupante señal en unos tiempos en los que se magnifica el valor de las pruebas complementarias en detrimento de la clínica. Al menos en ese material adicional sí se advierte de la gran frecuencia de síntomas atípicos, sobre todo en los ancianos y las mujeres, así como en los pacientes con diabetes, insuficiencia renal crónica o demencia. Además, se destaca que la capacidad diagnóstica de las características del dolor torácico es escasa, por lo que es esencial incluir en la valoración los antecedentes cardiovasculares y los factores de riesgo cardiovascular.
La estrella entre las pruebas complementarias sigue siendo el electrocardiograma (ECG), una prueba sencilla, barata y accesible. Se insiste no solo en la necesidad de realizarlo en los primeros 10min desde la llegada a urgencias o el contacto con el servicio de atención prehospitalaria, sino también en la necesidad de su interpretación inmediata por un médico cualificado que, en el caso de la atención prehospitalaria, puede realizarse a distancia. Respecto al trazado electrocardiográfico, es importante señalar que puede ser normal hasta en un tercio de los pacientes con síndrome coronario agudo sin elevación del ST (SCASEST). Por otra parte, se recuerda que la oclusión aguda de la arteria circunfleja no origina elevación del segmento ST en las derivaciones estándar del ECG2, y en ese caso se recomienda utilizar las derivaciones V7-V9, así como V3R y V4R para detectar IM del ventrículo derecho.
La recomendación para pacientes con bloqueo completo de la rama izquierda del haz de His (BRHHI) y alta sospecha de isquemia miocárdica sigue siendo tratarlos como IM con elevación del segmento ST, aunque se advierte que en más del 50% de los pacientes con dolor torácico y BRHHI, y también en los que presentan bloqueo de rama derecha, habrá un diagnóstico final diferente del IM. Además, esta recomendación incluye también a los pacientes con BRHHI previo.
Entre las pruebas analíticas, la determinación de TnI/TnT se ha impuesto por sus grandes sensibilidad y especificidad. En cualquier caso, hay que recordar que sus valores dependen de variables como la edad, el sexo, la insuficiencia renal y, por supuesto, el tiempo desde el inicio de los síntomas. Además, el daño miocárdico no siempre es por isquemia, por lo que otras situaciones (embolia pulmonar, traumatismos torácicos, miocarditis, insuficiencia cardiaca, etc.)3 pueden producir marcadas elevaciones de TnI/TnT. La determinación de TnI/TnT siguiendo los algoritmos de 0/1 h como primera opción y el de 0/2 h como segunda opción, incluidos los hallazgos clínicos y ECG, permite identificar a los pacientes candidatos a un alta precoz y tratamiento ambulatorio. En casos dudosos que necesitan observación, una tercera determinación a las 3 h y un ecocardiograma pueden ser de ayuda.
Para los pacientes sin cambios isquémicos en el ECG y valores normales de TnI/TnT, se recomienda realizar una técnica de imagen adicional, ya sea durante el ingreso o ambulatoria. Se recomienda la ecocardiografía de estrés sobre el ECG de ejercicio, por su mayor valor predictivo negativo (VPN), mientras que la resonancia magnética cardiaca (RMC) puede ayudar al diagnóstico diferencial entre IM, miocarditis y síndrome de tako-tsubo, gracias a las técnicas de caracterización tisular. Otras técnicas como la tomografía computarizada por emisión monofotónica (SPECT) pueden ser de utilidad en la estratificación del riesgo de estos pacientes. La TC permite la visualización de las arterias coronarias con un elevado VPN para excluir enfermedad coronaria, aunque resulta menos útil para excluir un SCASEST en pacientes con enfermedad coronaria previa, y tampoco se ha validado en pacientes con revascularización coronaria percutánea o quirúrgica. La RMC puede ser más útil que la TC para excluir otras causas de dolor torácico, como tromboembolia pulmonar o síndrome aórtico.
ESTRATIFICACIÓN DEL RIESGOLa estratificación del riesgo del paciente con SCASEST se basa en los indicadores electrocardiográficos, los valores de ciertos biomarcadores y el uso de escalas clínicas de riesgo isquémico y hemorrágico.
La guía actual, a diferencia de las anteriores, ilustra de forma muy elegante los distintos patrones electrocardiográficos de SCASEST que se han asociado con peor pronóstico o hallazgos angiográficos característicos. Se recomiendan 3 biomarcadores para estratificar el riesgo: a) el pico de TnI/TnT, que añade valor pronóstico en términos de mortalidad a corto y largo plazo: cuanto mayor sea, mayor riesgo de mortalidad; b) el filtrado glomerular, imprescindible para el cálculo de la escala GRACE, y c) los péptidos natriuréticos, que aportan información pronóstica adicional sobre el valor de TnI/TnT. La escala GRACE (IIa B) continúa siendo la escala de riesgo recomendada para la predicción de eventos clínicos tras un SCASEST. En numerosos estudios observacionales, esta escala se ha mostrado superior a la valoración subjetiva por parte del clínico tratante para predecir el riesgo de muerte o IM tras un SCA. La principal novedad en la evaluación del riesgo hemorrágico es la recomendación de utilizar el Academic Research Consortium for High Bleeding Risk (ARC-HBR)4 como alternativa a las escalas CRUSADE y ACUITY (IIb B). Sin embargo, no existe una validación de ARC-HBR mediante ensayos clínicos.
La guía muestra reticencia en otorgar valor al uso de escalas para optimizar la duración y la intensidad del tratamiento antiagregante plaquetario doble (TAPD) tras el intervención coronaria percutánea (ICP) (IIb B). Las escalas DAPT (al año) y PRECISE DAPT (al alta hospitalaria) añaden un discreto valor predictivo porque se basaron en estudios que no incluían prasugrel o ticagrelor y no incluyeron a pacientes que requerían anticoagulación a largo plazo y no se han realizado ensayos clínicos que muestren su evidencia.
TRATAMIENTO FARMACOLÓGICOElección del tratamiento antitrombóticoProbablemente, este es uno de los apartados más controvertidos, puesto que las recomendaciones están basadas en un nivel de evidencia bajo y muestran discrepancias con la guía de fibrilación auricular (FA)5. Sin embargo, se insiste en que la elección del tratamiento debe reflejar los riesgos isquémico y hemorrágico del paciente en función de las características de este, la presentación clínica, las comorbilidades, la comedicación (necesidad de anticoagulantes orales) y los aspectos del procedimiento.
Se recomienda el clopidogrel únicamente en caso de que el prasugrel y el ticagrelor estén contraindicados o el riesgo hemorrágico sea inaceptablemente alto (I C). Como novedad, se considera como tratamiento de elección el prasugrel. Esta decisión se tomó a partir de los resultados del estudio ISAR-REACT-5 que, en pacientes con SCA con y sin elevación del ST con un abordaje invasivo, demostró que el prasugrel sin pretratamiento era superior al ticagrelor en reducir significativamente el riesgo isquémico sin un incremento de las complicaciones hemorrágicas6. No obstante, este estudio no ha estado exento de controversia debido a ciertas limitaciones: la ausencia de doble enmascaramiento, el seguimiento predominantemente telefónico y que su beneficio fue fundamentalmente a expensas de la disminución de la incidencia de IM periprocedimiento6.
PretratamientoUna novedad muy importante que influye directamente en nuestra práctica cotidiana, actualmente objeto de debate y controversia en la comunidad científica, es que, para los pacientes que van a someterse a una estrategia invasiva precoz, se aconseja no agregar un segundo antiagregante plaquetario hasta no conocer la anatomía coronaria, independientemente del fármaco empleado (III A). El cambio en la indicación del pretratamiento se basa en la falta de ensayos clínicos que sustenten los beneficios del pretratamiento en el SCASEST, ya sea con clopidogrel, ticagrelor o prasugrel, y por la inhibición potente y rápida que se alcanza al administrar estos 2 últimos en la sala de hemodinámica. Algunos estudios han demostrado falta de beneficio isquémico, pero mayor riesgo hemorrágico en los pacientes que recibieron pretratamiento. Por otra parte, la administración de pretratamiento podría retrasar la cirugía de los pacientes que la tengan indicada o tener un efecto perjudicial en pacientes con un diagnóstico final distinto de SCASEST. Para los pacientes a los que no se puede ofrecer un tratamiento invasivo precoz, puede considerarse el pretratamiento con un inhibidor del P2Y12 (iP2Y12), dependiendo del riesgo hemorrágico (IIb C).
Una novedad en la anticoagulación periintervencionismo es el reconocimiento de la heparina no fraccionada como el fármaco de elección (I A) por su eficacia, su seguridad y su bajo coste. La bivalirudina y la enoxaparina bajan en el grado de recomendación, según la evidencia actual. Por último, el uso de fondaparinux (I B) se aconseja únicamente en casos de tratamiento médico o imposibilidad de traslado a tiempo del paciente a un centro con capacidad de angioplastia, y debe complementarse con un bolo adicional de heparina no fraccionada en el momento de la ICP. No hay novedades sobre los inhibidores de la glucoproteina (GP) IIb/IIIa y el cangrelor respecto a la guía previa.
Mantenimiento del tratamiento antitrombóticoSe recomiendan 12 meses de TAPD, independientemente del tipo de stent empleado. Sin embargo, hay escenarios específicos en los que los riesgos hemorrágico e isquémico son los que determinan la duración del tratamiento. Por primera vez se define a los pacientes con alto riesgo hemorrágico: sangrado en el último mes o que se someterán a cirugía planificada no demorable. Se recomienda TAPD (ácido acetilsalicílico [AAS] más clopidogrel) durante 1 mes, seguido de monoterapia con clopidogel. Se consideran pautas con AAS y un iP2Y12 (IIa B) durante 3-6 meses (IIa A) y pautas prolongadas> 12 meses (que eleva su recomendación de IIb A a IIa A), atendiendo a los riesgos hemorrágico e isquémico del paciente. La guía incluye un esquema claro de valoración de alto riesgo isquémico, donde se consideran además los datos de la anatomía coronaria y el tipo de ICP. A partir de los resultados del ensayo TWILIGHT7, que incluyó a pacientes con riesgo isquémico bajo-intermedio y bajo riesgo hemorrágico, se recomienda considerar para estos pacientes la combinación de TAPD durante 3 meses, para continuar con AAS hasta completar 12 meses.
Por primera vez, se contempla una desescalada de iP2Y12 como prasugrel o ticagrelor a clopidogrel (IIb A), como alternativa a los 12 meses, para los pacientes valorados como inadecuados para su implementación, aunque este grupo de pacientes no queda definido. Otra opción que se considera es la combinación de rivaroxabán a dosis de 2,5mg/12 h con AAS y clopidogrel (IIb B) para los pacientes con alto riesgo trombótico y sin mayor riesgo de hemorragia grave o potencialmente mortal, así como pacientes con riesgo trombótico moderadamente elevado. Sin embargo, no hay evidencia científica de la superioridad de esta estrategia sobre la combinación de AAS con ticagrelor o prasugrel (estudio COMPASS)8.
Tratamiento antitrombótico para pacientes con anticoagulación oralLamentablemente, la tabla que resume el tratamiento de los pacientes con FA (puntuación CHAD2DS2-VASc ≥ 1 los varones y ≥ 2 las mujeres) incluye numerosas alternativas y recomendaciones posibles, así como alguna discrepancia con la guía de FA, lo cual desvirtúa la intención inicial de clarificar y simplificar. Estas discrepancias ponen de manifiesto la falta de metanálisis y ensayos clínicos sobre estos paradigmas y que las recomendaciones se basan en el consenso de expertos con diferentes opiniones al respecto. Por otra parte, la nomenclatura utilizada de «nuevos anticoagulantes» es obsoleta, y es preferible cambiarla por «anticoagulantes orales de acción directa» (ACOD).
La principal novedad en estos pacientes sometidos a ICP o en tratamiento médico es el cambio significativo en la duración del tratamiento triple (anticoagulante oral más AAS más clopidogrel) con respecto a la guía previa1. Además, se establece la preferencia por los ACOD a la dosis recomendada para la prevención del ictus (aunque en PIONEER-FA9 se utilizó a dosis más bajas), sobre los antagonistas de la vitamina K (AVK). La estrategia de elección es durante 1 semana, seguido de tratamiento doble, preferiblemente con clopidogrel y un ACOD durante 1 año (I A). Sin embargo, la guía ESC 2020 sobre el tratamiento de la FA5 considera, con mucho acierto, esta recomendación como clase I B ante la ausencia de metanálisis o ensayos clínicos que demuestren su eficacia y su seguridad. Posteriormente, se recomienda continuar solo con un anticoagulante a partir del año (clase I B). En pacientes con alto riesgo hemorrágico, se considera acortar el tratamiento doble 6 meses y para los pacientes con alto riesgo isquémico, el tratamiento triple se prolongaría 1 mes (IIa C). También como novedad, a diferencia de la guía de FA5, se incluye la opción de tratamiento doble con ACOD y prasugrel o ticagrelor como alternativa al tratamiento triple cuando el riesgo de trombosis del stent sea moderado o alto, independientemente del stent empleado (IIb C).
Otro punto controvertido es que no se establece ninguna excepción a la suspensión de la antiagregación plaquetaria al año para pacientes con alto riesgo isquémico por características clínicas, anatómicas o por una intervención compleja. En los pacientes que precisan anticoagulación con AVK, la pauta es la misma que para los tratados con ACOD; para los pacientes en tratamiento médico, continúa la recomendación de tratamiento doble con anticoagulante más un antiagregante plaquetario, preferiblemente clopidogrel, durante al menos 6 meses (IIa C).
El tratamiento básico del sangrado para los pacientes en tratamiento antitrombótico no se modifica, pero para los pacientes con hemorragias graves en tratamiento con dabigatrán o rivaroxabán, por primera vez se recomienda emplear sus antídotos específicos: idarucizumab o andexanet a***lfa respectivamente (IIa B); mientras que para los pacientes tratados con AVK, se recomienda la rápida reversión de la anticoagulación mediante complejo protrombínico junto con vitamina K (IIa C).
Tratamiento farmacológico de la isquemiaSe mantienen las indicaciones clásicas del tratamiento farmacológico de la isquemia. Para los pacientes cuya función ventricular no se conozca, se desaconseja la administración muy precoz de bloqueadores beta, así como cuando haya espasmo coronario o consumo de cocaína, como ya se hizo en guías anteriores.
ESTRATIFICACIÓN DEL RIESGO PARA UNA ESTRATEGIA INVASIVASe aportan grandes novedades en la selección del momento en que debe realizarse la revascularización, que se basa en la estratificación de riesgo de los pacientes. La guía recomienda un tratamiento invasivo precoz en las primeras 24h de ingreso por un SCASEST basado en cambios dinámicos del ST, cifras de TnI/TnT y una escala GRACE> 140 puntos para mejorar los eventos adversos y la supervivencia (véase la figura 1 de la guía). Los pacientes muy inestables requieren un tratamiento invasivo inmediato (< 2 h). Este abordaje es similar al del infarto con elevación del segmento ST, por lo que los centros sin ICP deberían trasladar a los pacientes a su centro de referencia. Esta recomendación, aunque fundamentada, es de difícil aplicación sistemática en nuestro medio, dado el reducido número de servicios de hemodinámica disponibles las 24 h. La opción más eficiente para implementar esta recomendación sería incluir a estos enfermos en las redes de atención al SCACEST.
En esta guía, a diferencia de la previa, desaparece la opción de «estrategia invasiva» como realización de coronariografía/revascularización en menos de 72 h. Para los pacientes con bajo riesgo, el tratamiento invasivo debe ser selectivo y se recomienda usar un test no invasivo de estrés para la isquemia inducible (preferiblemente de imagen) antes de decidir una estrategia invasiva2,10. La guía enfatiza la necesidad de una valoración individualizada del paciente antes de descartar la coronariografía, pues la edad avanzada o los problemas logísticos no son razones suficientes. Dado que el grupo con alto riesgo tiene gran probabilidad de sufrir eventos isquémicos recurrentes y mortalidad cardiovascular, la restricción de la coronariografía debe limitarse únicamente en los casos en que el riesgo de la revascularización supera claramente al beneficio. Si se opta por la opción conservadora, se debe ser muy estricto con el tratamiento prescrito y las medidas de prevención secundaria. En casos de angina inestable, la guía reconoce el escaso beneficio de la ICP en las primeras 72 h.
Los principales aspectos técnicos de la ICP en pacientes con SCASEST no difieren de la evaluación invasiva y las estrategias de revascularización para otras manifestaciones de la cardiopatía isquémica. El acceso radial es el recomendado (I A), y los stents farmacoactivos se consideran ya el tratamiento estándar en la ICP (I A). Dado que el SCASEST suele implicar una enfermedad multivaso y no hay estudios sólidos al respecto, en pacientes que no estén en shock, la decisión de tratar solo el vaso culpable o llevar a cabo una revascularización completa (ICP o CABG, según la puntuación SYNTAX, etc.), y si esta debe hacerse en un tiempo o por etapas, debe basarse en la relevancia funcional de todas las estenosis, la edad del paciente, las comorbilidades, el estado clínico general y la función del ventrículo izquierdo (I B).
Para los pacientes que requieran revascularización quirúrgica, el momento del procedimiento debe individualizarse. El riesgo de sufrir un evento isquémico derivado de un tratamiento antiagretante plaquetario subóptimo es muy bajo, comparado con el riesgo hemorrágico del paciente tratado con fármacos antiagregantes.
A diferencia de la guía previa2, y como resultado del estudio COACT11, se considera razonable retrasar la coronariografía de los pacientes recuperados de una parada cardiaca extrahospitalaria. Sin embargo, la evidencia es escasa y los estudios futuros y en marcha aportarán información para establecer el tiempo correcto de la intervención.
INFARTO DE MIOCARDIO SIN OBSTRUCCIÓN DE ARTERIAS CORONARIAS Y DIAGNÓSTICOS ALTERNATIVOSSe introduce un apartado sobre el IM sin obstrucción de arterias coronarias (MINOCA), en el que la última definición de la ESC12 se actualiza por la de la American Heart Association13, que excluye de este síndrome la miocarditis y el tako-tsubo. Se recomienda seguir un algoritmo para el diagnóstico diferencial (I C): la RMC cobra protagonismo al identificar la causa subyacente en el 85% de los casos (I B); el test con acetilcolina o ergonovina se recomienda cuando haya sospecha de vasoespasmo, y la ecografía intravascular o la tomografía de coherencia óptica se consideran para el estudio de trombo, placa rota o disección coronaria espontánea. En esta última entidad, se trata un aspecto novedoso: el algoritmo de actuación que analiza las diversas opciones terapéuticas: tratamiento médico y estrategias de revascularización, ninguna de ellas avalada por ensayos clínicos (IIb C).
POBLACIONES ESPECIALESLa presentación de un SCASEST como insuficiencia cardiaca o shock cardiogénico es un reto diagnóstico. La coronariografía y la ecocardiografía emergentes son fundamentales para su diagnóstico. En caso de hallar una lesión culpable, el tratamiento, percutáneo (I B) o quirúrgico si la anatomía coronaria no es favorable (I B), debe ser emergente. El 80% de los pacientes presenta enfermedad multivaso, pero se desaconseja la ICP de las lesiones no culpables tras los resultados del CULPRIT-SHOCK14 (III B). Se sigue desaconsejando el balón de contrapulsación intraaórtico a no ser que haya una complicación mecánica (III B). No se ha demostrado hasta el momento que otros dispositivos de asistencia circulatoria a corto plazo sean superiores en supervivencia frente al balón de contrapulsación; el Impella incluso ha mostrado mayor mortalidad. Sin embargo, se mantienen con una clase IIb C a la espera de los resultados de los ensayos aleatorizados en marcha.
Se dedica menos espacio a poblaciones con gran impacto en la práctica clínica habitual, como mujeres, ancianos y pacientes con insuficiencia renal crónica. Se apunta que la valoración de la fragilidad y el balance riesgo-beneficio deben condicionar las decisiones terapéuticas. Sin embargo, no se comenta el tratamiento de los pacientes con cáncer que merecen una atención especial.
MUJERES Y SCASESTSorprendentemente, las mujeres siguen formando parte de las «poblaciones especiales». Los datos de registros3,15 demuestran desigualdades respecto al acceso a tratamientos basados en la evidencia y continúan infrarrepresentadas en los ensayos clínicos. Se aconseja seguir las mismas recomendaciones que para la población general en el acceso a la coronariografía y ajustar la dosificación de fármacos según peso y filtrado glomerular.
TRATAMIENTO A LARGO PLAZO DEL SCASESTEl tratamiento multidisciplinario cobra gran importancia en el tratamiento de esta entidad para reducir la morbimortalidad y mejorar la calidad de vida. Los factores psicosociales, los trastornos del estado de ánimo, el estrés y la ansiedad cobran relevancia al asociarse con una peor adherencia terapéutica y a estilos de vida saludables. Se señala que las intervenciones cognitivo-conductuales (I A) son necesarias para adquirir hábitos de vida saludables y un tratamiento farmacológico óptimo. En este sentido, el policomprimido y los regímenes terapéuticos simplificados pueden incrementar la adherencia terapéutica. Se ha demostrado que los programas multidisciplinarios de rehabilitación cardiaca disminuyen la mortalidad y las hospitalizaciones y mejoran la calidad de vida en los síndromes coronarios crónicos, pero tras SCASEST se remite a los pacientes a rehabilitación cardiaca mucho menos que tras SCACEST. La guía insiste en la necesidad de incrementar la tasa de derivación a dichos programas (eleva su recomendación a I A), y con equidad de género, que sigue siendo insuficiente en nuestro medio. El papel de enfermería adquiere protagonismo en la mejoría de la comunicación, coste-efectividad y adherencia terapéutica a todas las recomendaciones1. En nuestro medio, es imprescindible la creación de nuevas unidades de rehabilitación cardiaca y el uso de telemedicina para contribuir a implementar las recomendaciones en la prevención secundaria de los SCA.
Otro aspecto novedoso es la referencia al riesgo cardiovascular asociado con la contaminación ambiental no solo del aire, sino también acústica. Finalmente, la vacunación anual de la gripe está indicada (I B), sobre todo en los ancianos.
Las novedades más destacadas en el tratamiento farmacológico a largo plazo se centran en el hipolipemiante. En línea con la guía sobre el tratamiento de las dislipemias, se incrementa la exigencia en los objetivos terapéuticos de colesterol unido a lipoproteínas de baja densidad (cLDL): reducción del 50% (cifras basales entre 70 y 135mg/dl) y cLDL <55mg/dl16,17. Por otro lado, se incide en que estos objetivos han de lograrse lo más pronto posible (4-6 semanas); si no se lograsen con dosis máximas toleradas de estatinas, debe añadirse ezetimiba (I B), y si no se alcanzan con dosis máximas toleradas de ambos, se recomienda añadir un inhibidor de la PCSK9 (iPCSK9) (I B). Es evidente que los iPSCK9 reducen los eventos cardiovasculares con buena tolerancia, pero su implementación en la práctica clínica se ve limitada por su elevado coste. En caso de recurrencia de eventos, antes de los 2 años en tratamiento con estatinas, podría considerarse un objetivo más agresivo (cLDL <40mg/dl) (IIb B).
El tratamiento a largo plazo con bloqueadores beta no se modifica y se mantienen las indicaciones de la guía previa1. Los autores puntualizan que, a la espera obtener resultados de estudios actualmente en marcha, hay falta de evidencia en ensayos clínicos para establecer la necesidad y la duración del tratamiento bloqueador beta en pacientes sin disfunción sistólica18.
En los inhibidores de la enzima de conversión de la angiotensina o los antagonistas del receptor de la angiotensina II (IECA/ARA-II), reaparece la indicación en insuficiencia renal (excepto contraindicación por insuficiencia renal grave o hiperpotasemia). Los antagonistas del receptor de mineralocorticoides se indican a pacientes con insuficiencia cardiaca y fracción de eyección <40% (el 35% en guías previas). Como novedad, se introduce la indicación de sacubitrilo-valsartán sustituyendo los IECA/ARA-II para pacientes con insuficiencia cardiaca y fracción de eyección ≤ 35% sintomáticos a pesar del tratamiento optimizado.
INDICADORES DE CALIDADEsta guía define los indicadores de calidad de manera más exhaustiva y elaborada que en la guía anterior. Se señalan indicadores para cada uno de los siguientes aspectos: organización del centro, estrategia invasiva, evaluación del riesgo hospitalario, tratamiento antitrombótico durante la hospitalización, tratamientos de prevención secundaria, satisfacción del paciente y frecuencia de mortalidad a los 30 días. Aplicado a nuestro medio, los indicadores de más difícil consecución podrían ser: a) organización del centro: implementación del algoritmo 0-1 h/0-2 h de TnI/TnT; pocos servicios de urgencias tienen un nivel de organización que permita hacer 2 determinaciones de troponina y obtener resultados en 1 h;b) estrategia invasiva en 24 h en el SCASEST con alguna característica de alto riesgo; este indicador requiere unidades de hemodinámica bien dotadas y una correcta evaluación del paciente para distinguir el SCASEST tipo 1 de alto riesgo del SCASEST tipo 2 o daño miocárdico no isquémico, y no realizar indicaciones innecesarias de cateterismo precoz; esta recomendación puede ser de muy difícil aplicabilidad en nuestro medio, puesto que en muchos casos supone transferir al paciente a otro centro con servicio de hemodinámica, y c) evaluación de la satisfacción del paciente y análisis de la mortalidad a los 30 días: en nuestro medio, pocos centros realizan este tipo de mediciones.
ESTRATEGIA DE TRATAMIENTOQué hacer y qué noEste es uno de los apartados más importantes de la guía, ya que se resumen en tablas las recomendaciones de clase I (está recomendado) y III (no está recomendado). Es importante destacar que, de un total de 78 recomendaciones en las que en teoría está claro qué hacer (70) y qué no (8), solo el 32% tiene nivel de evidencia A, frente al 38,6 y el 29,4% con niveles B y C. Este hecho pone de manifiesto las lagunas en la evidencia pendientes de resolver en múltiples aspectos en el tratamiento del SCASEST.
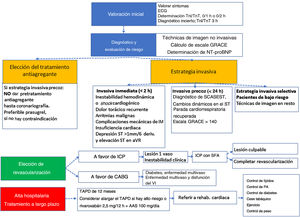
Mensajes claveEl apartado de mensajes clave ofrece un excelente resumen de las principales aportaciones de la guía. Incluye 15 mensajes clave, de los cuales 4 se centran en la TnI/TnT y 3 en el tratamiento antitrombótico. No se destaca ningún mensaje clave sobre estrategias de prevención secundaria o indicadores de calidad. La figura 1 esquematiza el tratamiento integral del paciente con SCASEST de acuerdo con estos mensajes.
Novedades en el tratamiento integral del síndrome coronario agudo sin elevación del segmento ST. AAS: ácido acetisalicílico; BNP: péptido natriurético cerebral; CABG: cirugía de revascularización coronaria; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IM: infarto de miocardio; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; PA: presión arterial; SCASEST: síndrome coronario agudo sin elevación del segmento ST; SFA: stents farmacoativos; TAPD: tratamiento antiagregante plaquetario doble.
En esta guía se reconocen multitud de lagunas pendientes de resolver mediante nuevos ensayos clínicos. Entre ellas, cabe destacar que desde hace décadas se recomienda estratificar el riesgo de los pacientes, de manera que se asume que a mayor riesgo, más agresivo debe de ser el tratamiento. Sin embargo, esto nunca se ha confirmado. El tratamiento farmacológico para los pacientes con FA sometidos a ICP requiere que las recomendaciones de expertos estén basadas en la evidencia científica actual, así como un acuerdo entre las diferentes asociaciones implicadas en su redacción. Otro aspecto de especial interés económico y para los pacientes es conocer hasta cuándo debe mantenerse el tratamiento con bloquedores beta o inhibidores del sistema-renina-angiotensina-aldosterona en los casos que tienen función ventricular normal sin otras indicaciones para estos tratamientos.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto relacionado con el presente trabajo.
Grupo de Trabajo de la SEC para la guía ESC 2020 sobre el tratamiento del síndrome coronario agudo sin elevación del segmento ST: Antonia Sambola (coordinadora), Pablo Avanzas (coordinador), Rut Andrea, Albert Ariza, Gemma Berga, Belén Cid, Esteban López de Sa, Manuel Martínez-Sellés, Raúl Moreno, Soledad Ojeda y Juan Sanchis.
Revisores expertos para la guía ESC 2020 sobre el tratamiento del síndrome coronario agudo sin elevación del segmento ST: Ana Huelmos, Pilar Jiménez Quevedo, Mirian Juárez, Roberto Martín Asenjo, Mila Pedreira, Oriol Rodríguez Leor, Inmaculada Roldán, Rafael Romaguera y Ana Viana Tejedor.
Comité de Guías de la SEC: Pablo Avanzas, Gemma Berga Congost, Araceli Boraita, Héctor Bueno, David Calvo, Raquel Campuzano, Victoria Delgado, Laura Dos, Ignacio Ferreira-González, Juan José Gómez Doblas, Domingo Pascual Figal, Antonia Sambola, Ana Viana Tejedor, José Luis Ferreiro (copresidente) y Fernando Alfonso (copresidente).