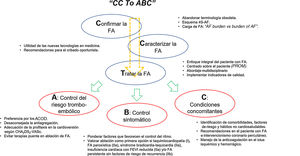
Ve la luz una nueva edición de la guía de tratamiento de la fibrilación auricular (FA) con una variedad de novedades relevantes. Calan con profundidad la aproximación organizada a la FA según el esquema CC: confirm and characterise AF y la atención integral y multidisciplinaria. Se propone centrar la atención mediante el ABC pathway, que recoge las 3 áreas principales del abordaje de la FA, que son: A, anticoagulation/avoid stroke; B: better symptom management, y C: cardiovascular and comorbidity optimization. Se enfatiza que este eje de actuación (figura 1) tendría consecuencia directa en la reducción del riesgo de eventos cardiovasculares y se demanda una participación más activa de diversos profesionales y del paciente en la toma de decisiones terapéuticas y de su cuidado1. En líneas generales, estos son mensajes que planean sobre cada uno de los apartados del nuevo documento y que se comentan de manera individualizada.
DEFINICIÓN, DIAGNÓSTICO Y CRIBADOEl diagnóstico de la FA clínica sigue consolidado en torno a su documentación electrocardiográfica, pero irrumpe con fuerza el uso de dispositivos portátiles (teléfonos o relojes inteligentes) que infieren el ritmo cardiaco mediante el análisis de la señal fotopletismográfica, el registro directo de la señal electrocardiográfica o una combinación de ambas técnicas. Estos permitirían el diagnóstico de la FA subclínica, con una capacidad predictiva variable entre técnicas y dispositivos. Su potencial de uso es muy extenso, pero igualmente supone un campo de incertidumbre por cuanto los episodios de FA subclínica detectados no necesariamente se corresponden con los niveles de riesgo ya conocidos de los pacientes con FA clínica. Además, la especificidad puede ser limitada, lo que podría incrementar innecesariamente la demanda asistencial. Sin duda es un área controvertida, y aún es necesario establecer parámetros que permitan validar y regular el tratamiento de la información registrada por estos dispositivos, aunque se reconoce que pudieran tener un papel relevante en el cribado de FA realizado por el propio paciente. Los estudios Apple Heart y Huawei revelaron un valor predictivo positivo del 34 y el 87% respectivamente, lo que enfatiza su utilidad, pero también la necesidad de confirmación por profesionales sanitarios entrenados1. Se consolidan, sin embargo, métodos clínicos convencionales para el cribado de FA (por ejemplo, la palpación del pulso, con varios metanálisis recientes que confirman su utilidad). Se recomienda el cribado oportunista de pacientes mayores de 65 años (I) y el cribado sistemático de los mayores de 75 años o con alto riesgo de ictus (IIa), considerando que siempre la efectividad es mayor con un cribado repetido.
EPIDEMIOLOGÍA Y PRESENTACIÓN CLÍNICASe recogen nuevos datos que sitúan la prevalencia de FA en el 2-4% de la población y la mantienen como la arritmia sostenida más común en adultos. Además, se espera que la prevalencia se duplique debido a la mayor longevidad de la población (confirma la edad como el factor de riesgo más potente), la intensificación de la búsqueda y la incorporación de la FA subclínica al panorama clínico. La ya clásica forma de clasificación temporal de la FA se mantiene sin cambios respecto a ediciones previas (primer diagnóstico, paroxística, persistente, persistente de larga evolución y permanente), pero se recomienda explícitamente abandonar los términos FA aislada, valvular frente a no valvular y crónica por la confusión que introducen y no tener claro respaldo fisiopatológico. Además, se promueve un cambio de la clasificación a la caracterización estructurada de la FA (IIa) mediante el innovador esquema 4S-AF, que aborda 4 aspectos clave con implicaciones terapéuticas y pronósticas como son: el riesgo embólico (stroke), la gravedad de los síntomas (symptoms; se enfatiza el valor de la escala EHRA), la carga de FA (severity of AF burden) y el sustrato (substrate). Este esquema agilizaría la evaluación en cualquier nivel asistencial, lo que facilitaría la comunicación entre profesionales sanitarios, la toma de decisiones y el tratamiento óptimo de los pacientes, y debería convertirse en un estándar en nuestro sistema sanitario. Se profundiza en el término carga de FA (AF burden) como el tiempo que el paciente sufre episodios de FA (clínica o subclínica). Y, algo original, se diferencia de la carga o impacto que para el paciente supone las manifestaciones clínicas de su FA (burden of AF). Cómo se puede emplear estos dos conceptos en la toma de decisiones clínicas está por definir, aunque supondrían un elemento de juicio desde la perspectiva del paciente.
ABORDAJE INTEGRALLa guía recomienda el tratamiento integral individualizado y centrado en el paciente (I). Este enfoque holístico requiere un equipo interdisciplinario coordinado (cardiología, atención primaria, enfermería y farmacia), así como el empoderamiento del paciente respecto a la educación, el estilo de vida y la toma de decisiones, de lo que depende gran parte del éxito del tratamiento2. Se debe tener en cuenta la capacidad, la oportunidad y la motivación de los profesionales, y es importante priorizar un enfoque multidisciplinario cohesionado en la transmisión de la información y la resolución de dudas. Uno de los puntos que la guía enfatiza es la clara comunicación entre cardiología y atención primaria. Como novedad importante, se incluye al personal de enfermería especialista en FA como parte fundamental del equipo. Las consultas de enfermería de FA, de reciente implementación en nuestro medio, contribuyen a mejorar la formación, el control de los factores de riesgo y la adherencia farmacológica y a estilos de vida saludables3. Y se nos emplaza al uso de indicadores de calidad, como la calidad de vida relacionada con la salud o los resultados referidos por el paciente (patient reported outcome measures [PROM]) que, medidos en el seguimiento, deben ayudar en la estrategia terapéutica, la determinación de resultados y la mejora de la atención (I). El objetivo es equilibrar resultados e indicadores para conseguir una intensidad de tratamiento que sea aceptada por el paciente y le proporcione el mejor nivel de calidad de vida y salud4. Además, permitirían evaluar un tratamiento estructurado acorde al esquema ABC propuesto (anticoagulation/avoid stroke; better symptom management; CV and comorbidities optimization).
ANTICOAGULACIÓN Y PREVENCIÓN DEL ICTUSLas escalas recomendadas para la evaluación del riesgo son CHA2DS2-VASc y HAS-BLED, prestando atención al valor específico de cada variable. El ictus hemorrágico incrementa el riesgo de nuevo ictus isquémico y debe considerarse en la escala. El antecedente de miocardiopatía hipertrófica debe puntuar y el sexo femenino es un modulador más que un factor de riesgo. Se destaca que los biomarcadores (elevación de troponinas o péptidos natriuréticos) podrían ayudar a la toma de decisiones en casos dudosos con un solo factor de riesgo y la importancia de la valoración dinámica (revaluación periódica de personas con bajo riesgo). El riesgo hemorrágico debe utilizarse para identificar los factores modificables y tratar de corregirlos, en ningún caso para establecer la contraindicación de anticoagulación, que solo se considera en casos de sangrado activo, trombocitopenia (< 50.000 plaquetas), anemia grave en estudio o una hemorragia intracraneal reciente.
Sobre qué anticoagulante utilizar, se da clara preferencia a los anticoagulantes de acción directa (ACOD) por su mejor perfil de eficacia y seguridad. Este es un aspecto de importancia en nuestro medio, ya que el Informe de Posicionamiento Terapéutico (IPT) restringe mediante un visado la financiación de los ACOD en España a situaciones especiales. Además, considera un tiempo en rango terapéutico (TRT) <60-65% (según metodología) para acceder a la financiación, mientras que la guía considera un TRT <70% con independencia de la metodología. Más del 50% de los pacientes que toman antagonistas de la vitamina K (AVK) en España tienen un control deficiente5, lo que ha llevado a sociedades científicas y profesionales a alertar sobre los riesgos del actual IPT6. Se advierte sobre la frecuente reducción inapropiada de dosis, que resta eficacia pero no complicaciones. Además, en nuestro entorno existen diferencias normativas importantes entre comunidades autónomas que llevan a una inequidad manifiesta en el acceso a los ACOD como tratamiento de primera línea. El tratamiento antiagregante plaquetario como profilaxis de enfermedad tromboembólica en FA está desaconsejado (III).
Sobre el cierre de orejuela, la guía da escasas indicaciones (contraindicación absoluta para anticoagulación oral (IIb), y resalta la ausencia de un régimen antitrombótico claramente estudiado para estos pacientes. Un reciente documento de la EHRA7 le otorga otras indicaciones (como mala adherencia o rechazo de los anticoagulantes e ictus pese a una correcta anticoagulación) que esta nueva guía no considera, por la ausencia de ensayos clínicos o la falta de comparaciones frente a los ACOD.
CONTROL SINTOMÁTICOControl de la frecuenciaApartado sin grandes cambios respecto a las recomendaciones previas (FC <110 lpm a menos que se requiera un control más estricto por síntomas, deterioro de la función ventricular o necesidad de asegurar una estimulación biventricular continua). Los bloqueadores beta, junto con el verapamilo y el diltiazem, son fármacos de primera línea que suponen una buena alternativa en presencia de fracción de eyección del ventrículo izquierdo (FEVI) conservada. La combinación con digoxina se plantea como segunda línea si no se alcanza un control óptimo. Los resultados del estudio RATE-AF8, presentado simultáneamente con esta guía en el congreso ESC 2020, probablemente maticen esta indicación en futuras ediciones, dados los beneficios que la digoxina parece aportar respecto a los bloqueadores beta para el control de frecuencia en pacientes de edad avanzada. Se desaconseja administrar antiarrítmicos con el mero objeto de alcanzar un buen control de FC, si bien la amiodarona puede ser útil en pacientes que no son candidatos a control no farmacológico y con necesidad de tratamiento farmacológico combinado. La ablación del nódulo AV se recomienda cuando falla el tratamiento farmacológico. Las nuevas formas de estimulación se recogen ya como una alternativa. En el paciente con cardiopatía estructural o disfunción ventricular, la resincronización mediante estimulación biventricular es un tratamiento de primera línea, y se considera la estimulación hisiana como una alternativa plausible9.
Control del ritmoTiene por objetivo mejorar los síntomas y la calidad de vida (I). La presentación de esta guía coincidió con la publicación de los resultados del EAST-AFNET 410, un estudio que comparó una estrategia de control del ritmo basada en cardioversión, fármacos antiarrítmicos y ablación con catéter (el 20% a 2 años) frente a la práctica clínica habitual (fundamentalmente control de la frecuencia) en FA de reciente comienzo (menos de 1 año). La estrategia de control del ritmo se asoció con una reducción significativa del 21% en el objetivo primario (incluida muerte cardiovascular, entre otros), sin un incremento de los efectos adversos. La frecuencia de mantenimiento del ritmo sinusal a 2 años de seguimiento fue significativamente mayor en el grupo de control de ritmo (el 82 frente al 62%). Por lo tanto, y matizando las recomendaciones de la guía, este estudio ofrece datos que permiten sospechar que, en pacientes con FA de reciente diagnóstico, la recuperación y la conservación tempranas del ritmo sinusal se traducen en un beneficio para el pronóstico. Como aspecto novedoso, se recoge que una estrategia de «esperar y ver» durante 48 h (cardioversión únicamente si no cediera) en pacientes con FA reciente (< 48 h) parece ser tan eficaz como la cardioversión inmediata en el mantenimiento del ritmo sinusal a 4 semanas (aunque precisaría de la infraestructura adecuada, como por ejemplo unidades de corta estancia)1.
La indicación de ablación debe individualizarse. En general, la guía aboga por la ablación con catéter11 cuando ha fracasado al menos 1 fármaco antiarrítmico (I). Pero si la opinión del paciente es favorable, podría ser la primera línea de tratamiento en casos de taquimiocardiopatía (I), FA paroxística (IIa), síndrome bradicardia-taquicardia (IIa), insuficiencia cardiaca con FEVI reducida (IIa) y FA persistente sin factores de riesgo de recurrencia (IIb). Recientemente se han comunicado los resultados del estudio STOP AF FIRST12, que apoyan la ablación como primera línea de tratamiento en la FA paroxística. Es el primer ensayo clínico aleatorizado en el que se demuestra la mayor eficacia de la crioablación con balón de venas pulmonares frente a los fármacos antiarrítmicos en el tratamiento inicial de la FA paroxística. Se mantiene la indicación (I) de abordar las venas pulmonares en el primer procedimiento de ablación, independientemente de la técnica utilizada (crioablación o radiofrecuencia punto a punto). La recomendación de abordar otros sustratos alcanza un nivel de recomendación más bajo (IIb), por lo que debería restringirse a casos individualizados. Un aspecto controvertido es el papel de la ablación en el paciente seleccionado con FA e insuficiencia cardiaca con FEVI reducida. Aunque la guía para esta situación da una indicación IIa, no ofrece información práctica que facilite la selección de los pacientes y obvia los interesantes datos derivados del estudio CAMERA-MRI13, en el que la cuantificación de la fibrosis del VI permitía identificar a los pacientes que más se beneficiarían de la ablación.
Se reconoce la eficacia de la cirugía de la FA para mantener el ritmo sinusal, pero hay dudas sobre el beneficio clínico que aporta. Las recomendaciones se mueven en un entorno de relativa indefinición, dado que incluyen información heterogénea. Por un lado, se sustentan en gran parte en registros; por otro, hay diferencias entre estudios en el tipo de pacientes incluidos y el tipo de FA, aunque mayoritariamente se reserve este tratamiento a la FA persistente de larga duración. Otra variable heterogénea es la técnica de intervención para el sustrato, tanto en el diseño de las líneas como en la energía y las herramientas empleadas. La indicación más frecuente es combinada con cirugía por otra causa (IIa). En los casos en los que no se asocia con otra cirugía, la intervención toracoscópica se reserva esencialmente a casos en los que previamente ha fallado la ablación percutánea (IIa), si bien hay que asumir un mayor número de complicaciones. En la FA persistente de larga duración, el reciente estudio CASA-AF14, que aleatorizó a abordaje percutáneo o toracoscópico, no muestra ventaja alguna a favor del abordaje quirúrgico. La terapia híbrida ofrece una tasa de eficacia mayor que el procedimiento solo percutáneo, pero también de complicaciones. El apartado de tratamiento antiarrítmico a largo plazo no presenta grandes novedades. Un nuevo algoritmo resume la elección de fármacos y de ablación con catéter en las diferentes situaciones clínicas.
Anticoagulación en cardioversión/ablaciónEl documento recoge el impacto de la incorporación de los ACOD a la práctica clínica, y contribuye a un contexto de seguridad, eficacia y eficiencia (por ejemplo, en el mejor control de tiempos de espera hasta el procedimiento). Un aspecto que se aborda con especial énfasis y diversas novedades es el del riesgo tromboembólico en relación con la cardioversión. Manteniendo una indicación IIa para realizar cardioversión precoz en pacientes no anticoagulados previamente con FA de duración <48 h, la guía apunta a individualizar según el contexto clínico. Se recuerda que los datos disponibles indican un buen perfil de seguridad en pacientes con FA reconocida de menos de 12 h y CHA2DS2-VASc 0 los varones o 1 las mujeres. Sin embargo, la evidencia en otros perfiles de pacientes, como aquellos con FA de entre 12 y 48 h y CHA2DS2-VASc más alto, no es tan sólida y su riesgo podría ser mayor. Estos pacientes se muestran como candidatos para ser derivados a una estrategia de cardioversión diferida incluso si su FA presenta una duración menor de 48 h. En cualquier caso, la guía refuerza el concepto de primar la seguridad y reconoce el papel del ecocardiograma transesofágico en diferentes situaciones. A diferencia de las guías anteriores, para los pacientes con CHA2DS2-VASc 1 las mujeres o 0 los varones, se indica anticoagulación oral durante 4 semanas tras la cardioversión de una FA de duración >24 h (en la guía anterior se establecía en> 48 h). Si la duración de la FA es «definitivamente» <24 h, se matiza que la indicación es opcional. Respecto a la ablación de FA, queda clara la preferencia por esquemas de tratamiento ininterrumpido (frente a las terapias puente) y por los ACOD. En este sentido, las recomendaciones listadas son pocas, pero con un nivel de recomendación alto. De nuevo, se recomienda mantener la anticoagulación a largo plazo basándose en el perfil de riesgo del paciente y no en el éxito de la intervención.
FACTORES DE RIESGO, COMORBILIDADES Y CONDICIONES ESPECIALESDentro del abordaje integral, se destaca la importancia de identificar comorbilidades, factores de riesgo y hábitos no cardiosaludables. El adecuado control de estos factores ayuda a limitar su progresión y sus síntomas y reducir el riesgo de ictus, lo que influye claramente en el pronóstico y mejora la calidad de vida y la tasa de recurrencias tras ablación. En conjunto, la promoción de hábitos cardiosaludables y tratamiento adecuado de los factores y condiciones asociados a la arritmia tiene una recomendación de clase I. Pero, de forma algo sorprendente, se ha reducido la recomendación sobre el tratamiento optimizado de los pacientes con apnea obstructiva y el ejercicio físico regular (I B). A este respecto se advierte cierta discrepancia con la guía sobre ejercicio físico para pacientes con enfermedad cardiovascular, publicada simultáneamente15. Esta última indica una recomendación I A de ejercicio físico para los pacientes con FA con el objeto de prevenirla. Aunque la redacción de la recomendación específica de cada guía es distinta (la de FA matiza de forma conjunta la situación especial de los deportes de alta intensidad), esto no debería afectar al nivel de recomendación, que se fundamenta en la calidad y el tipo de los estudios disponibles.
Las recomendaciones de tratamiento antitrombótico para el paciente con FA sometido a intervención coronaria percutánea recogen novedades. Tras un adecuado balance entre los riesgos isquémico y hemorrágico, se recomienda: a) administrar un ACOD más clopidogrel durante 12 meses en el síndrome coronario agudo y 6 meses en el crónico; b) el tratamiento doble con ACOD se prefiere a los AVK; c) el tratamiento triple debe limitarse a la primera semana, con posibilidad de prolongarlo a 1 mes cuando hay elevado riesgo isquémico o de trombosis del stent (IIa). Es de resaltar que la guía no considera las diferencias entre síndrome coronario agudo y crónico, sabiendo que el riesgo trombótico difiere entre ambas entidades. Además, a la hora de tomar las decisiones clínicas individualizadas, habría que tener en cuenta que solo en uno de los ensayos se evaluó la retirada precoz del ácido acetilsalicílico y la escasa potencia de los ensayos practicados para la detección de eventos trombóticos. La guía desaconseja el uso de prasugrel o ticaglelor. Sin embargo, estos fármacos son una opción como parte de una estrategia de tratamiento doble (un solo antiagregante más anticoagulación) para pacientes con riesgo trombótico moderado-alto según la guía sobre el síndrome coronario agudo sin elevación del segmento ST, publicada simultáneamente16. Este es un punto de discrepancia entre ambos documentos que habrá de aclarar en el futuro. En pacientes con FA tratados con revascularización quirúrgica, se debe reanudar la anticoagulación tan pronto como se controle la hemorragia, posiblemente en combinación con clopidogrel y evitando el tratamiento triple. Respecto a los pacientes con FA e ictus, la toma previa de anticoagulación contraindica la trombolisis debido al riesgo de hemorragia, salvo que la última dosis del ACOD se hubiera administrado 48 h antes y la función renal fuera normal. En el resto de los casos, los pacientes deben someterse a tratamiento endovascular. Algunos pacientes tratados con dabigatrán podrían recibir fibrinolisis si el antídoto idarucizumab estuviera disponible. Se enfatiza que el inicio de la anticoagulación antes de 48 h (tras el ictus isquémico) se relaciona con transformación hemorrágica y mayor mortalidad, y no está recomendado (III). Además, la administración de ACOD en prevención secundaria está recomendada por encima de los AVK (I A) para los pacientes con ictus.
Hay pocas novedades en el ictus criptogénico o embólico por causas indeterminadas. La evidencia actual no recomienda prescribir sistemáticamente anticoagulantes orales (ACO) y se recomienda la monitorización durante las primeras 72 h (I). La monitorización adicional a largo plazo puede considerarse (clase IIa) para aumentar la posibilidad de detección. Algunas cuestiones sin resolver son el tiempo de detección necesario para iniciar la ACO o su coste-beneficio. No hay evidencia sobre cribado con dispositivos móviles, como se ha descrito previamente. En caso de hemorragia intracraneal, parece razonable retrasar el reinicio de la anticoagulación más allá de la fase aguda (4 semanas), y en pacientes con riesgo muy alto de recurrencia, valorar el cierre de la orejuela (IIb), pero considerando las limitaciones existentes en cuanto al régimen de tratamiento antitrombótico necesario.
Para los pacientes con cardiopatía valvular con estenosis mitral moderada-grave o prótesis mecánica, los ACOD están contraindicados. Es importante recordar que no es así en el resto de valvulopatías, incluidas la estenosis/insuficiencia aórtica, la insuficiencia mitral y los pacientes con bioprótesis o reparación valvular, para los que no hay evidencia de que se deba modificar la elección del anticoagulante. Respecto al paciente anciano, obtiene un mayor beneficio clínico neto del tratamiento anticoagulante, aunque desafortunadamente un porcentaje alto no recibe anticoagulación y sí antiagregación. En los adultos con cardiopatías congénitas y FA, se reconoce el alto riesgo embólico de las formas complejas (IIa de anticoagulación). En otros tipos, se mantiene la recomendación si existen factores de riesgo embólico. También hay una recomendación IIa sobre el tratamiento quirúrgico de la FA en caso de someterse a otro tipo de intervención, si presentan episodios sintomáticos. En el embarazo se recomiendan preferentemente el control de ritmo, indicar tratamiento anticoagulante según CHA2DS2-VASc y adaptar el fármaco según el trimestre del embarazo, como recogen las guías específicas, y recordando que los ACOD están contraindicados. Los atletas profesionales incrementan por 5 su riesgo de sufrir FA.
La anticoagulación debe guiarse por la escala CHA2DS2-VASc y se suele optar por control del ritmo mediante ablación (ante la intolerancia a los fármacos o la recomendación de no realizar ejercicio tras la toma de flecainida). Respecto a la FA posoperatoria, la evidencia a favor de la anticoagulación a largo plazo no está basada en datos de ensayos clínicos, sino en datos observacionales. A pesar de ello, la guía recomienda anticoagulación crónica para los pacientes con riesgo elevado tras cirugía no cardiaca (IIa) y con menos peso tras cirugía cardiaca (IIb). Hay en marcha 2 estudios aleatorizados que proporcionarán información en el futuro. Un aspecto no tratado en la presente guía es la relación entre la FA y los pacientes con tumores sólidos, de interés por la elevada prevalencia de la FA en el momento del diagnóstico de la enfermedad neoplásica y el incremento del riesgo arrítmico que conllevan las distintas terapias antineoplásicas (dirigidas, quimioterapia, inmunoterapia, etc.).
FIBRILACIÓN AURICULAR EN LA MUJERLa guía analiza el contexto particular de la FA en la mujer, clásicamente infrarrepresentadas en los ensayos clínicos. Estas, por norma general, se diagnostican a edad más avanzada, lo que puede explicar el papel modulador del sexo en cuanto a su asociación con una mayor incidencia de accidente cerebrovascular y una mayor gravedad de este; también su mayor prevalencia de hipertensión arterial, enfermedad vascular e insuficiencia cardiaca con FEVI conservada justifican una relación circunstancial, más que causal, entre sexo femenino y FA. La guía desaconseja la diferenciación por sexo en cuanto a las opciones diagnósticas y terapéuticas relacionadas con la FA.
IMPLEMENTACIÓN E INDICADORES DE CALIDADUno de los aspectos que se resaltan repetidamente a lo largo del documento es que el objetivo final de la guía es la mejora de resultados centrados en el paciente. La adherencia a los tratamientos recomendados por la guía se asocia con mejores resultados en salud. Sin embargo, múltiples registros internacionales de FA muestran que hay margen de mejora y una variabilidad geográfica significativa. La nueva guía recomienda la recogida de indicadores de calidad para identificar oportunidades de mejora (IIa) y aconsejan utilizar medidas estandarizadas recogidas en un documento dedicado a indicadores de calidad publicado simultáneamente, resultado de la colaboración entre las asociaciones internacionales de arritmias así como de pacientes4. Es la primera vez que en las guías se realiza el esfuerzo simultáneo de definir indicadores de calidad para cuantificar su implementación y su impacto en los resultados en FA centrados en el paciente. El uso de los indicadores recomendados deberá validarse (implementación) para confirmar su utilidad en la práctica clínica habitual, una actitud que desde la Sociedad Española de Cardiología se promueve dentro del marco SEC-Excelente y el proceso FA.
EPISODIOS DE FRECUENCIA AURICULAR ALTA O FIBRILACIÓN AURICULAR SUBCLÍNICALa detección de episodios de alta frecuencia o de FA subclínica es un área de interés creciente. La línea de pensamiento al respecto se resume en: a) se detectan mayoritariamente en portadores de dispositivos terapéuticos, con una incidencia presumiblemente superior a la de la población general; b) confieren un riesgo incrementado de FA clínica y eventos tromboembólicos modulado por su duración (irrelevante en los muy breves), aunque menor que el de la FA clínica; c) variabilidad temporal y disociación temporal con los eventos tromboembólicos, lo que indica su papel de marcador más que de agente causal, y d) la indicación de anticoagulación se encuentra en estudio en ensayos aleatorizados (NOAH-AFNET 6 y ARTESiA); actualmente se puede plantear ante episodios prolongados (más de 24 h) en pacientes con CHA2DS2-VASc elevado. La decisión terapéutica se recomienda con base en una valoración completa de la situación clínica, el riesgo tromboembólico y la carga arrítmica.
CONCLUSIONESEsta nueva guía de tratamiento de la FA destaca por su clave de interpretación fundamentalmente clínica, atendiendo a aspectos que proporcionan valor en la atención del paciente con FA y promoviendo un enfoque integral donde la perspectiva del paciente cobra particular relevancia. Es de destacar la alineación que se advierte con respecto al marco de trabajo propuesto por los procesos SEC-Excelente que abordan la FA, y deja claros los beneficios derivados de una aproximación estructurada y medible con base en indicadores de calidad apropiados. Su aplicación práctica en nuestro medio parece, a todas luces, plausible y necesaria. Dentro de una estrategia de proporcionar valor, los ACOD adquieren un papel relevante y son un aspecto pendiente en nuestro sistema sanitario que habrá que valorar en el marco apropiado. Por último, y haciendo referencia a los comentarios realizados en anteriores ediciones17, la FA continúa siendo un ámbito con múltiples incertidumbres. Aunque el número de recomendaciones con nivel de evidencia A ha pasado del 15 al 17%, el margen para la investigación de los aspectos que tienen que ver con la FA y el cuidado de los pacientes continúa siendo muy amplio.
CONFLICTO DE INTERESESLos siguientes autores declaran relaciones no relativas al presente trabajo: E. Arbelo, honorarios por conferencias de Biosense Webster; F. Arribas, honorarios por consultoría, asesoría o conferencias de Daiichi Sankyo, Impulse Dynamics, Medtronic, Boston Scientific, Bayer, Bristol Myers Squibb, Abbott, y becas o ayudas a su institución de Novartis, Janssen-Cilag, Medtronic, Boston Scientific, Daiichi Sankyo, Bayer, Biosensors, Edwards Lifesciences; F. Atienza, patentes licenciadas a la Universitat Politécnica de Valencia y es miembro de los comités de asesores de Medtronic y Microport; V. Barrios, honorarios de Bayer, Boehringer Ingelheim, BMS/Pfizer y Daiichi Sankyo; D. Calvo, honorarios por consultoría, asesoría o conferencias de Daiichi Sankyo, Bayer, Pfizer, Boehringer Ingelheim y Novartis, y contratos de investigación con Biosense-Webster y Medtronic; J. Cosin-Sales, becas de investigación de BMS/Pfizer y honorarios por consultoría y conferencias de Bayer, BMS/Pfizer, Daiichi-Sankyo, Boehringuer -Ingelheim y Cardiome; J. M. Gámez, honorarios por conferencias de Daiichii-Sankyo y Pfizer; F. Marín, honorarios de Boehringer Ingelheim y AstraZeneca, y ayuda no pecuniaria de Esteve. Los demás autores declaran no tener ningún conflicto de intereses.
Grupo de Trabajo para la guía ESC 2020 sobre el diagnóstico y tratamiento de la fibrilación auricular: David Calvo (coordinador), Elena Arbelo (coordinadora), Fernando Arribas, Juan Cosín, José María Gámez, Javier Jiménez Candil, Miriam Juárez, Francisco Marín, Silvia Pérez Ortega y Pablo Jorge Pérez.
Revisores expertos para la guía ESC 2020 sobre el diagnóstico y tratamiento de la fibrilación auricular: Concepción Alonso, Albert Ariza, Felipe Atienza, Vivencio Barrios, Begoña Benito, Vicente Bertomeu, Carlos Escobar, Esteban López de Sá, Ana Martin, Roberto Martín Asenjo, Marta Pachón y Marta Pombo.
Comité de Guías de la SEC: Pablo Avanzas, Gemma Berga Congost, Araceli Boraita, Héctor Bueno, David Calvo, Raquel Campuzano, Victoria Delgado, Laura Dos, Ignacio Ferreira-González, Juan José Gómez Doblas, Domingo Pascual Figal, Antonia Sambola, Ana Viana Tejedor, José Luis Ferreiro (copresidente) y Fernando Alfonso (copresidente).