Las guías de la Sociedad Europea de Cardiología (ESC) están respaldadas por la Sociedad Española de Cardiología (SEC) y se traducen para su publicación en REVISTA ESPAÑOLA DE CARDIOLOGÍA. Cada nueva guía se acompaña de un artículo que la comenta, siguiendo los objetivos y la metodología recomendados en el artículo del Comité de Guías de la SEC1–3. En el presente artículo se comenta la nueva guía de la ESC sobre la valoración de los pacientes en la cirugía no cardiaca4. El Comité de Guías encargó a un grupo de expertos el comentario a esta guía. Posteriormente, las secciones de Cardiología Clínica, Cardiología Geriátrica, Cardiopatía Isquémica y Cuidados Agudos Cardiológicos, e Insuficiencia Cardiaca han nombrado a otros expertos que han hecho importantes aportaciones al documento aquí presentado.
Es interesante mencionar la pertinencia de que aparezca una nueva guía sobre este tema, no tanto por las nuevas evidencias al respecto, sino sobre todo porque se ha tenido que revisar en profundidad la indicación de los bloqueadores beta en este contexto, debido a la exclusión de los resultados de la familia de estudios DECREASE, en la que se basaba la evidencia de esta indicación, por haber surgido dudas razonables sobre su falta de veracidad5.
Otro aspecto interesante es que, en las guías previas6, la Sociedad Europea de Anestesiología se limitaba a respaldar o apoyar el contenido, mientras que ahora ha participado activamente en el diseño de las guías actuales. En esta guía se enfatiza el papel central del anestesiólogo, que debe coordinar el proceso de evaluación de los pacientes antes de la cirugía no cardiaca.
Si en otras guías la evidencia está basada sobre todo en la opinión de expertos, esto es especialmente así en la guía que comentamos. El 57% de las recomendaciones tienen un nivel de evidencia C. Además, tienen otra particularidad en este sentido: de las nueve recomendaciones con nivel de evidencia A, ocho se basan en estudios clínicos realizados en un contexto clínico diferente de la cirugía no cardiaca.
Así ocurre con 11 de las 43 recomendaciones con nivel de evidencia B. Por lo tanto, muchas recomendaciones se han extrapolado de otras situaciones clínicas y nunca se han estudiado en los pacientes de los que se ocupa esta guía. De todas maneras, no se espera que se realicen estudios aleatorizados que respalden la evidencia.
A continuación se comenta cada uno de los apartados valorados por la nueva guía y se pone énfasis en las novedades aportadas, los aspectos positivos y conflictivos y las implicaciones para nuestra práctica clínica.
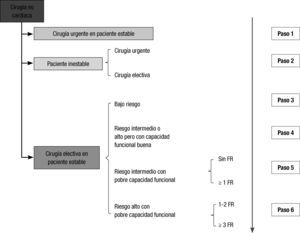
EVALUACIÓN PREOPERATORIALa nueva guía clarifica el papel central del anestesiólogo y propone que sea un equipo multidisciplinario el que lleve la valoración cardiovascular de pacientes cuya cardiopatía sea fuente potencial de complicaciones durante una cirugía no cardiaca. Y especifican muy acertadamente cuáles son: a) pacientes con cardiopatía conocida o sospechada que conlleve riesgo potencial perioperatorio; b) pacientes a los optimizar el tratamiento podría reducir el riesgo perioperatorio durante una cirugía de riesgo bajo o intermedio, y c) pacientes con cardiopatía conocida o alto riesgo de padecerla que van a someterse a cirugía de alto riesgo. Se echa de menos, sin embargo, algún comentario sobre la importancia de la exploración física en cualquier evaluación preoperatoria (Figura 1).
Evaluación preoperatoria antes de cirugía no cardiaca. Paciente inestable es el que tiene angina inestable o infarto reciente con isquemia residual o insuficiencia cardiaca aguda o arritmias significativas o enfermedad valvular sintomática. Paciente estable es el que no tiene ninguna de estas condiciones. FR: factores de riesgo (cardiopatía isquémica, insuficiencia cardiaca, accidente cerebrovascular, disfunción renal con creatinina > 2 mg/dl y diabetes mellitus insulinodependiente). Paso 1: proceder a la cirugía, manteniendo bloqueadores beta y estatinas si el paciente ya los recibe. Paso 2: en cirugía urgente, podría estar indicada una revascularización urgente si está clínicamente indicada (II aC); si la cirugía es electiva, se aconseja ECG (I C), ecocardiograma (I C) y revascularización coronaria si está clínicamente indicado (I A). Paso 3: si el paciente no tiene factores de riesgo, se procede con la cirugía; si tiene uno o más factores de riesgo, es razonable hacer un ECG (IIb C) y en pacientes coronarios se podría iniciar previamente estatinas (IIa B) y más dudosamente bloqueadores beta (IIb B). Paso 4: se procede a la cirugía; en pacientes coronarios, se podría iniciar previamente estatinas (IIaB) y más dudosamente bloqueadores beta (IIbB). Paso 5: si el paciente no tiene factores de riesgo, se procede a la cirugía; es razonable hacer un ECG (IIb C), y si el paciente es coronario, se podría iniciar previamente estatinas (IIa B) y más dudosamente bloqueadores beta (IIb B); si el paciente tiene uno o más factores de riesgo, hay que hacer un ECG (I C), y si el paciente es coronario, se podría iniciar previamente estatinas (IIa B) y más dudosamente bloqueadores beta (IIb B); la realización de un test de isquemia es cuestionable (IIb C). Paso 6: si el paciente tiene uno o dos factores de riesgo, hay que hacer un ECG (I C), y es cuestionable hacer un ecocardiograma (IIb C) o un test de isquemia con imagen (IIb B); si el paciente tiene más de dos factores de riesgo, hay que hacer un ECG (I C) y un test de isquemia con imagen (I C) y es cuestionable hacer un ecocardiograma (IIb C); en pacientes coronarios se podría iniciar previamente estatinas (IIa B) y más dudosamente bloqueadores beta (IIb B); es cuestionable que se deba realizar cirugía de revascularización coronaria previa a la cirugía (IIb B).
En la nueva clasificación basada en el riesgo de la cirugía, se ha aumentado el número de procedimientos de alto riesgo. Así, no solo la cirugía vascular se considera de alto riesgo (ya lo era en la previa), sino también el trasplante hepático y pulmonar, la neumonectomía y varios procedimientos digestivos y urológicos, entre otros.
Respecto a la decisión del tipo de cirugía, la guía insiste en una elección individualizada, teniendo en cuenta que en determinados casos optar por una técnica menos invasiva como la endovascular puede disminuir el riesgo quirúrgico inmediato pero asociarse a una mayor probabilidad de recidiva en el futuro. Como aspectos novedosos, la guía comenta específicamente el papel de las técnicas endovasculares en la enfermedad de la aorta abdominal. Concretamente, da una recomendación I A para el tratamiento tanto endovascular como quirúrgico del aneurisma aórtico abdominal > 55mm si es anatómicamente apropiado para la terapia percutánea y el riesgo quirúrgico es aceptable.
Un comentario interesante hace referencia a la cirugía laparoscópica que, si bien tiene ciertas ventajas iniciales, no ha mostrado diferencias con la cirugía abierta en los estudios disponibles, probablemente por el neumoperitoneo asociado a la laparoscopia.
La estratificación del riesgo del paciente se basa en dos aspectos:
a) la capacidad funcional, como ya se dejaba claro en guías previas, si es alta, el pronóstico es excelente, aunque el paciente tenga enfermedad coronaria o muchos factores de riesgo, y b) los índices de riesgo, de los que la guía ofrece dos, el índice de Lee —ya propuesto en guías previas, basado en cinco variables clínicas (cardiopatía isquémica, insuficiencia cardiaca, enfermedad cerebrovascular, insuficiencia renal y diabetes mellitus) y en el tipo de cirugía— y un nuevo índice, el NSQIP MICA, menos intuitivo, pero que puede medirse con una calculadora disponible en la red. Este índice incluye las siguientes variables: el tipo de cirugía, el estado funcional del paciente, la creatinina plasmática, la clase ASA (clasificación en cinco categorías de la Sociedad Americana de Anestesistas) y la edad del paciente. Dispone de una calculadora interactiva7 que proporciona una estimación basada en modelos de la probabilidad para cada paciente individual y muestra los resultados en porcentaje de riesgo y percentiles. Ambos índices tienen limitaciones. El índice de Lee se obtuvo de una cohorte en la que predominaban pacientes sometidos a cirugía ortopédica. Así, el modelo NSQIP para el cálculo del riesgo obtiene mejores resultados que el índice de Lee, en general y especialmente en pacientes de alto riesgo8. Nos quedan dudas, por lo tanto, sobre cuál debemos utilizar y si el uso de los dos mejoraría la valoración pronóstica de ambos por separado. Además, otros factores no incluidos en las escalas de riego, como la fragilidad, los valores muy bajos o muy altos de índice de masa corporal, la anemia y el estado inmunológico, entre otros, no podrían interactuar con la enfermedad cardiovascular de base de los pacientes y los factores de riesgo cardiovascular, lo que favorecería la aparición de complicaciones cardiovasculares tras la cirugía no cardiaca.
Con respecto al uso de pruebas no invasivas y de la coronariografía, es positivo comprobar la cautela de la nueva guía en este sentido, dada la falta de evidencia. Las indicaciones del ECG han disminuido en número y en nivel de evidencia respecto a guías previas. No está indicado sistemáticamente y solo se aconseja para pacientes con factores de riesgo que van a someterse a cirugía de riesgo intermedio o alto (nivel de evidencia C). La ecocardiografía no es especialmente útil en este contexto, aunque podría valorarse para pacientes que van a someterse a cirugía de alto riesgo (recomendación clase IIb). La guía recomienda hacer pruebas de valoración de isquemia solo a los pacientes que tienen baja capacidad funcional (menos de 4 MET, es decir, ser capaz de subir dos pisos de escaleras o correr una distancia corta), más de dos factores de riesgo (los referidos en el párrafo anterior) y que van a someterse a cirugía de alto riesgo. Para pacientes estables, la coronariografía podría considerarse solo para quienes van a someterse a endarterectomía (recomendación clase IIb). En definitiva, la nueva guía enfatiza la estratificación clínica sencilla, basada en la capacidad funcional y en la presencia de variables clínicas, por delante de biomarcadores y pruebas diagnósticas y pronósticas.
La aplicación correcta de esta guía debería suponer un alivio para los sobrecargados servicios de cardiología de nuestro país. Por una parte, se reconoce el papel central del anestesiólogo en la valoración preoperatoria, que en cualquier caso debe coordinar la actuación de un equipo multidisciplinario, de los pacientes de alto riesgo. Además, se acotan las indicaciones de ECG y ecocardiografía, técnicas tradicionalmente sobreutilizadas en este contexto.
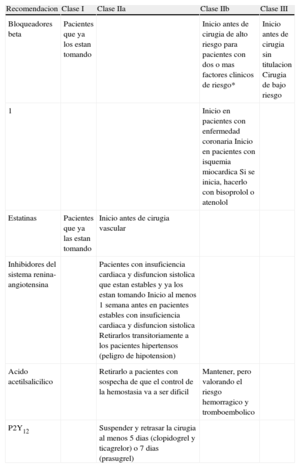
ESTRATEGIAS PARA LA REDUCCIÓN DEL RIESGOLas estrategias para la reducción del riesgo incluyen la utilización de fármacos (Tabla 1), el manejo perioperatorio de los pacientes en tratamiento antiagregante o anticoagulante y la revascularización.
Recomendaciones y clases de recomendacion de la nueva guia sobre uso de farmacos para reducir el riesgo perioperatorio
| Recomendacion | Clase I | Clase IIa | Clase IIb | Clase III |
| Bloqueadores beta | Pacientes que ya los estan tomando | Inicio antes de cirugia de alto riesgo para pacientes con dos o mas factores clinicos de riesgo* | Inicio antes de cirugia sin titulacion Cirugia de bajo riesgo | |
| 1 | Inicio en pacientes con enfermedad coronaria Inicio en pacientes con isquemia miocardica Si se inicia, hacerlo con bisoprolol o atenolol | |||
| Estatinas | Pacientes que ya las estan tomando | Inicio antes de cirugia vascular | ||
| Inhibidores del sistema renina-angiotensina | Pacientes con insuficiencia cardiaca y disfuncion sistolica que estan estables y ya los estan tomando Inicio al menos 1 semana antes en pacientes estables con insuficiencia cardiaca y disfuncion sistolica Retirarlos transitoriamente a los pacientes hipertensos (peligro de hipotension) | |||
| Acido acetilsalicilico | Retirarlo a pacientes con sospecha de que el control de la hemostasia va a ser dificil | Mantener, pero valorando el riesgo hemorragico y tromboembolico | ||
| P2Y12 | Suspender y retrasar la cirugia al menos 5 dias (clopidogrel y ticagrelor) o 7 dias (prasugrel) |
*Cardiopatia isquemica, insuficiencia cardiaca, enfermedad cerebrovascular, insuficiencia renal y diabetes mellitus.
Como ya se ha comentado, esta guía incorpora numerosas e importantes novedades en este apartado, pues responde a la polémica suscitada por las dudas sobre la veracidad de los resultados de algunos estudios de la familia DECREASE, liderados por el coordinador de las guías anteriores, debido a procedimientos metodológicos cuestionables. Dichos estudios habían contribuido notablemente a la evidencia sobre el efecto de los bloqueadores beta en el resultado de la cirugía no cardiaca, al ser los únicos en los que se observó una reducción de la mortalidad cardiovascular y tendencia a una reducción de la mortalidad total asociada al uso de bloqueadores beta9. Otro aspecto positivo es que se recogen recomendaciones no incluidas en las guías previas sobre el manejo de pacientes que reciben doble antiagregación tras el implante de un stent coronario y sobre los nuevos anticoagulantes orales.
Se modifican sustancialmente las recomendaciones sobre el uso de fármacos, en particular los bloqueadores beta. Así, la única indicación inequívoca (recomendación clase I) de bloqueadores beta es la continuación en el perioperatorio si el tratamiento ya está en curso. El inicio preoperatorio para pacientes con cardiopatía isquémica conocida o evidencia de isquemia en una prueba de estrés preoperatoria y la administración sistemática a pacientes citados para cirugía de alto riesgo, que en las guías previas se consideraron recomendaciones de clase I, pasan a considerarse de clase IIb. Además, el inicio del tratamiento antes de una intervención de alto riesgo podría considerarse para pacientes con dos o más factores de riesgo clínico. En estos casos se recomienda atenolol o bisoprolol. En cualquier caso, el inicio debería ser a dosis bajas y aumentarlas progresivamente.
Respecto al uso de inhibidores de la enzima de conversión de la angiotensina y antagonistas del receptor de la angiotensina II, se baja la clase de recomendación a IIa tanto para la continuación como para el inicio del tratamiento en pacientes estables con insuficiencia cardiaca y disfunción sistólica.
Las recomendaciones sobre el uso de estatinas también se han modificado ligeramente. La única indicación de clase I es la continuación perioperatoria del tratamiento, preferentemente con estatinas de larga vida media o fórmulas de liberación prolongada. El inicio preoperatorio de estatinas, que en guías anteriores se consideró de clase I entre 30 días y 1 semana antes de una intervención de alto riesgo, en la actual se restringe a la cirugía vascular e idealmente al menos 2 semanas antes, y en cualquier caso se lo considera indicación de clase IIa.
Las guías anteriores consideraban como indicación de clase IIb el uso de agonistas de los receptores alfa 2 para la reducción de complicaciones perioperatorias en pacientes de cirugía vascular. Los resultados desfavorables del ensayo POISE-2 con clonidina han sido definitivos para desaconsejar su uso en la guía actual.
Se añaden nuevas recomendaciones sobre el manejo perioperatorio en pacientes con tratamiento antiagregante, con consideraciones específicas para pacientes que reciben doble antiagregación. Se añade con clase I la recomendación de no interrumpir el tratamiento con ácido acetilsalicílico durante la cirugía en las 4 semanas siguientes al implante de stent convencional y en los 3-12 meses siguientes en caso de stent liberador de fármacos según el tipo, a menos que el riesgo de hemorragia quirúrgica con riesgo vital sea inaceptablemente alto.
Se confirma la recomendación de suprimir el tratamiento con ácido acetilsalicílico cuando se prevé que durante la cirugía será difícil controlar la hemostasia. En caso contrario, la decisión de mantener el ácido acetilsalicílico durante el periodo perioperatorio, que en la guía previa se consideraba indicación de clase IIa, pasa a ser indicación de clase IIb y solo individualizada sopesando los riesgos de complicaciones trombóticas y hemorrágicas. La supresión de clopidogrel y ticagrelor se hará al menos 5 días antes de la cirugía y la del prasugrel, al menos 7 días antes.
La guía actual incorpora información novedosa respecto al manejo perioperatorio de pacientes con anticoagulantes, en particular con anticoagulantes orales que no sean antivitamina K. Destaca que en la mayoría de los casos no es necesaria la terapia puente con heparina debido a la corta vida media biológica de estos anticoagulante orales, a lo que probablemente habría que añadir que no están indicados en muchas de las situaciones asociadas a alto riesgo tromboembólico (como las prótesis mecánicas o la trombofilia).
Hay pocos cambios en las recomendaciones sobre la revascularización. En general se mantienen las recomendaciones sobre el momento de la cirugía no cardiaca para pacientes con revascularización previa. Aunque menos categórico (de clase I se pasa a IIa), se mantienen las recomendaciones sobre el momento ideal de la cirugía no cardiaca tras procedimientos de revascularización percutánea (3 meses tras el implante de stent convencional y 12 meses en el caso de stent liberador de fármacos), y se reduce a 4 semanas (de 6 en la guía previa) el tiempo mínimo tras stent convencional y a 6 meses para pacientes con stent liberador de fármacos de última generación.
La guía actual subraya la ausencia de beneficio de la revascularización miocárdica profiláctica sistemática para pacientes asintomáticos con enfermedad coronaria estable, aunque (como en la guía anterior) se deja abierta la posibilidad de revascularización profiláctica antes de la cirugía de alto riesgo para los pacientes con isquemia extensa en un estudio de perfusión miocárdica de estrés (indicación de clase IIb). Respecto al tipo de revascularización miocárdica, el texto plantea la posibilidad de extender el uso de stents liberadores de fármacos de última generación, que precisan un periodo de doble antiagregación sustancialmente menor, si se confirman los resultados de estudios preliminares, tanto en pacientes con cardiopatía isquémica estable como con síndrome coronario agudo sin elevación del ST. En estos, en caso de necesidad de cirugía no cardiaca por enfermedad grave y revascularización miocárdica, un equipo de expertos debería discutir la prioridad de la cirugía (en la guía anterior se daba prioridad a la cirugía).
Un tema que no queda aclarado definitivamente es la conveniencia de iniciar o mantener el tratamiento con ácido acetilsalicílico en situaciones para las que está inequívocamente indicada, como la cardiopatía isquémica crónica estable, fuera de los periodos de seguridad tras el implante de stent coronario. La guía recomienda la difícil tarea de sopesar el riesgo de complicaciones hemorrágicas y trombóticas para adoptar una decisión individualizada, a pesar de que no existen herramientas objetivas para medir dichos riesgos en este contexto.
El mensaje principal es la recomendación de continuar durante el periodo perioperatorio la administración de los fármacos con protección cardiovascular demostrada (bloqueadores beta, inhibidores del sistema renina/angiotensina, estatinas) a los pacientes que los toman adecuada y crónicamente y permanecen estables. Iniciar el tratamiento, en particular con bloqueadores beta, poco antes de la intervención podría ser perjudicial, ya que sus potenciales efectos beneficiosos se pueden ver contrarrestados por los adversos. En caso de tener que hacerlo, debería realizarse con precaución y con la antelación suficiente (estatinas al menos 14 días antes, inhibidores del sistema renina-angiotensina al menos 7 días antes y bloqueadores beta al menos 2 días antes), de modo que sea posible la adecuada monitorización del tratamiento.
ENFERMEDADES ESPECÍFICASLa guía dedica amplia información a realidades asistenciales cada vez más frecuentes, como la insuficiencia cardiaca, la estenosis valvular aórtica o la enfermedad renal crónica, aunque se echa de menos algún comentario en enfermedades específicas cardiacas, como la miocardiopatía hipertrófica. Lamentablemente, hay poca evidencia al respecto, por lo que muchas recomendaciones se basan en la opinión de expertos y, por lo tanto, están abiertas a cierta controversia.
Respecto a la insuficiencia cardiaca, se considera de clase IA la recomendación de evaluar la función ventricular izquierda con eco-cardiograma o péptidos natriuréticos, salvo que se haya efectuado recientemente, en pacientes con insuficiencia cardiaca establecida o sospechada pendientes de cirugía de riesgo intermedio o alto. La indicación de ecocardiograma para pacientes con sospecha clínica de insuficiencia cardiaca sin evaluación previa de la función ventricular y ante el empeoramiento de pacientes con diagnóstico establecido es poco discutible, pero no tanto para pacientes estables con insuficiencia cardiaca conocida y tratamiento óptimo. También debería admitirse con reservas la recomendación sobre el uso de los péptidos natriuréticos, por la falta de evidencia definitiva sobre su utilidad en el manejo de estos pacientes. Las nuevas recomendaciones de clase I sobre el tratamiento farmacológico de la insuficiencia cardiaca redundan en las establecidas en el apartado anterior: optimización previa a la cirugía del tratamiento farmacológico con bloqueadores beta, inhibidores del sistema renina-angiotensina, antagonistas de la aldosterona y diuréticos; si es posible, debe retrasarse la cirugía de riesgo intermedio o alto en pacientes con nuevo diagnóstico de insuficiencia cardiaca al menos 3 meses desde el inicio del tratamiento, y debe valorarse suspender los inhibidores del sistema renina-angiotensina el día de la cirugía si lo aconseja la presión arterial del paciente.
Las recomendaciones sobre valvulopatías se centran en la estenosis aórtica. Se recomienda el reemplazo valvular quirúrgico antes de la cirugía no cardiaca en pacientes con estenosis aórtica grave sintomática cuando la cirugía valvular no es de alto riesgo (clase I). En caso de alto riesgo de la cirugía valvular, se recomienda considerar implante percutáneo de válvula aórtica (TAVI) o valvuloplastia aórtica con balón (clase IIa). Es sorprendente que esta indicación no esté en consonancia con la dada en la guía de la ESC sobre valvulopatías publicada en 201210, en las que se aconseja proceder a la cirugía no cardiaca con estricta monitorización en pacientes con estenosis aórtica grave sintomática y alto riesgo de la cirugía valvular. Finalmente, en pacientes con estenosis aórtica grave asintomática a los que se va a realizar cirugía no cardiaca de alto riesgo, también se recomienda el reemplazo valvular quirúrgico en ausencia de alto riesgo de la cirugía valvular (clase IIa). Esta recomendación también es controvertida, y puede ser razonable efectuar la cirugía no cardiaca sin reemplazo valvular previo en estos pacientes.
Existen pocas novedades sobre pacientes con estenosis mitral e insuficiencias valvulares. Aunque la nueva guía incorpora un párrafo dedicado a la insuficiencia mitral secundaria, no ofrece recomendaciones específicas al respecto. Se recomienda con clase IIa la posibilidad de llevar a cabo la intervención no cardiaca en pacientes con insuficiencia valvular grave en ausencia de síntomas o disfunción del ventrículo izquierdo y proceder a una valvuloplastia mitral percutánea en pacientes con estenosis mitral grave sintomática o asintomática que tengan una presión sistólica de la arteria pulmonar superior a 50mmHg antes de hacer una cirugía no cardiaca de moderado o alto riesgo.
La nueva guía incorpora novedades sobre medidas destinadas a reducir el riesgo de lesión renal inducida por contraste. Se hacen recomendaciones detalladas sobre el manejo de pacientes con nefropatía inducida por contraste (clase I) para el uso de hidratación con suero salino antes de la administración de contraste, el uso de contrastes isoosmolares o de baja osmolaridad y reducir el volumen de contraste. Llama la atención que se haya incluido entre las recomendaciones específicas para la protección renal contra la lesión por contraste el tratamiento a corto plazo con altas dosis de estatinas (clase IIa) sobre la base de un único ensayo clínico con pocos pacientes, en un contexto clínico específico y con un diseño discutible.
También se ha completado el apartado sobre enfermedad pulmonar con nuevas recomendaciones, sobre todo relacionadas con el tratamiento de la hipertensión arterial pulmonar (seis recomendaciones de clase I) y la recomendación de abandonar el tabaquismo al menos 2 meses antes de la cirugía no cardiaca para todos los pacientes fumadores (clase I).
MONITORIZACIÓN PERIOPERATORIAEn este apartado, la guía realiza escasas aportaciones respecto a las previas, todas con bajo nivel de evidencia (una con nivel A, tres con nivel B y ocho con nivel C). En cuanto a la monitorización por ECG para la detección de arritmias e isquemia miocárdica, sigue siendo preceptiva durante cualquier tipo de cirugía que requiera anestesia, ya sea general o regional. La monitorización de la contractilidad segmentaria con ecocardiografía transesofágica (ETE) en pacientes sometidos a cirugía no cardiaca no está indicada sistemáticamente debido a la baja frecuencia de aparición de alteraciones de la contractilidad segmentaria en estos pacientes, así como la poca implicación pronóstica en la fase posoperatoria. Donde la guía sí marca una indicación de clase I es en el uso de la ETE como forma de monitorización intraoperatoria en casos de aparición de inestabilidad hemodinámica; una indicación de clase IIa para los pacientes que sufren cambios intraoperatorios en la monitorización por ECG, y finalmente una indicación IIb para pacientes sometidos a cirugía no cardiaca de alto riesgo que además presentan alto riesgo de sufrir alteraciones isquémicas o hemodinámicas o lesiones valvulares graves. Al igual que en la guía previa, no se recomienda el uso sistemático de catéteres pulmonares para la monitorización intraoperatoria en cirugía no cardiaca. De manera novedosa, se recomienda la monitorización del gasto cardiaco y estimar la resucitación con fluidos mediante sondas Doppler transesofágicas como método de monitorización intraoperatoria.
Los péptidos natriuréticos y la troponina de alta sensibilidad se están utilizando sistemáticamente en muchas instituciones tras la cirugía no cardiaca. Basándose en metanálisis y estudios prospectivos, la guía recomienda que puede valorarse el uso de péptidos natriuréticos y troponina de alta sensibilidad tras la cirugía en pacientes de alto riesgo para mejorar la estratificación (indicación IIb B). Los pacientes que más se podrían beneficiar de la determinación de estos biomarcadores son los pacientes de riesgo definidos por una capacidad funcional < 4 MET y un índice cardiaco revisado o de Lee > 1 (para cirugía vascular) y > 2 (para cirugía no vascular). Se puede considerar estas recomendaciones como un paso inicial para protocolizar su uso en el posoperatorio de la cirugía no cardiaca.
Un aspecto importante de la guía hace referencia a la monitorización de la glucemia durante la cirugía. La guía hace varias recomendaciones en este apartado, dada la suma importancia de la diabetes mellitus y las alteraciones en el metabolismo de la glucosa como predictores de morbimortalidad durante la cirugía no cardiaca y el posoperatorio. No queda aclarado el papel del control estricto de la glucemia de pacientes no diabéticos sometidos a cirugía no cardiaca. Respecto al control estricto de la glucemia (81-108 mg/dl), la guía se hace eco de lo controvertido de trasladar los resultados derivados de los estudios iniciales con pacientes críticos no quirúrgicos a los pacientes sometidos a cirugía no cardiaca. Estos resultados derivados de estudios antiguos han sido refutados por los resultados de revisiones recientes que asocian un mejor pronóstico al control menos estricto de la glucemia (140-180 mg/dl)11. Por eso la guía ofrece una recomendación de clase IB al manejo intensivo de la hiperglucemia en el posoperatorio (con insulina en perfusión), estableciendo un límite por debajo de los 180 mg/dl pero sin bajar de los 110 mg/dl, debido al potencial riesgo de hipoglucemias asociado a las estrategias de control estricto de la glucemia. Este último aspecto ha sido un punto novedoso respecto a las recomendaciones previas, en las que solo se insistía en evitar la hipoglucemia pero sin establecer un dintel inferior de seguridad12. Una novedad relevante es la inclusión en los protocolos preoperatorios del cribado de glucohemoglobina (HBA1c) elevada antes de cirugía mayor de alto riesgo, aunque se basa en una recomendación de expertos (IIaC). La introducción de la HBA1c en el perfil analítico perioperatorio no debe de suponer un gran incremento del gasto, dado que las cirugías de alto riesgo son un porcentaje pequeño del total de cirugías que se realizan en España13.
Finalmente, con respecto a la anemia, aunque se introduce de forma novedosa este apartado en la guía y se enfatiza la contribución de la anemia en la aparición de isquemia en pacientes con cardiopatía isquémica preexistente, no se da ninguna recomendación específica, y únicamente se incide en mantener una política de transfusiones guiadas por la clínica, aspecto que contrasta un poco con las indicaciones más precisas de las guías estadounidenses14.
ANESTESIAEsta nueva guía profundiza un poco más en el aspecto anestésico del paciente sometido a cirugía no cardiaca, aunque sin dar una recomendación específica respecto al tipo de agente anestésico que se debe utilizar (inhalados o parenterales), puntualizando que la evidencia que favorece a los inhalados como el sevoflurano se deriva de estudios en pacientes sometidos a cirugía cardiaca.
Se realiza una importante observación en cuanto a los valores seguros de presión arterial durante la inducción y el mantenimiento anestésico, para evitar las complicaciones posoperatorias, incidiendo en prevenir tanto la hipotensión (media < 60 mmHg) como la sedación profunda definida por valores de Biespectral Index Scale < 45 más allá de 30min.
La nueva guía subraya que se puede considerar la anestesia neuraxial para reducir la mortalidad y la morbilidad perioperatorias respecto a la anestesia general (indicación IIb B). Al ser una forma de anestesia regional, los beneficios respecto a la anestesia general son muy debatidos. Sin embargo, según la guía, se podría tenerla en cuenta para sujetos de alto riesgo quirúrgico (con factores de riesgo cardiovascular o con enfermedad cardiovascular establecida) sin contraindicaciones, para evitar complicaciones peroperatorias y posoperatorias.
La terapia guiada de reanimación con fluidos es otro punto novedoso, derivado del desarrollo de técnicas avanzadas de monitorización cardiaca intraoperatoria, así como de algoritmos que simplifican la estimación de la volemia y la respuesta a la terapia con fluidos para remontar situaciones de inestabilidad hemodinámica durante la cirugía. El uso de técnicas cada vez menos invasivas como la dilución transpulmonar y las técnicas derivadas del análisis de la onda de pulso arterial han permitido que este tipo de aproximación terapéutica se haya impuesto a las previas, basadas principalmente en los catéteres pulmonares y la estimación de variables por termodilución. Por ello, la guía hace una recomendación de clase IIa B sobre el uso de estas estrategias de terapia guiada con fluidos en pacientes de alto riesgo quirúrgico o de alto riesgo cardiaco (miocardiopatías, valvulopatías, etc.).
El dolor posoperatorio conlleva un incremento de las complicaciones, un aumento del tono simpático, una recuperación más lenta y sufrimiento para el paciente. Se dispone de una gama de opciones para controlarlo, como la analgesia neuraxial, la anestesia local, los opioides y los antiinflamatorios no esteroideos. Respecto a las guías previas, la actual concreta más los aspectos relacionados con la analgesia. Se señala que se puede considerar el uso de la analgesia neuraxial de manera muy cauta y teniendo en cuenta el riesgo-beneficio en cada caso, y que no dar antiinflamatorios no esteroideos a pacientes de riesgo se puede considerar (previamente la contraindicación era absoluta).
CONFLICTO DE INTERESESNinguno.
ANEXOGrupo de Trabajo de la SEC para la guía de práctica clínica de la ESC/ESA 2014 sobre cirugía no cardiaca: evaluación y manejo cardiovascular: José Alberto San Román (coordinador), Alfredo Bardají (coordinador), Manuel Almendro, Teresa Blasco, Vicente Bodí, Juan Antonio Castillo, Juan José Gómez Doblas y Carlos González Juanatey.
Revisores expertos para la guía de práctica clínica de la ESC/ESA 2014 sobre cirugía no cardiaca: evaluación y manejo cardiovascular: Pilar Carrillo, Manuel Martínez-Sellés, Rosa González Davia, Javier López Díaz, Alessandro Sionis Green, Rosa María Lidón Corbi, Javier Segovia Cubero, Antonio Fernández Ortiz, Ramón Bover, Domingo Marzal, Juan Cosín Sales y Lorenzo Fácila.
Comité de Guías de la SEC: Manuel Anguita Sánchez (Presidente), Ángel Cequier Fillat (Secretario), Lina Badimón Maestro, José Antonio Barrabés Riu, Josep Comín Colet, Ignacio Fernández Lozano, José Juan Gómez de Diego, Manuel Pan Alvarez-Osorio, Luis Rodríguez Padial, José Alberto San Román Calvar y Pedro Luis Sánchez Fernández.