Las válvulas SAPIEN 3 (S3) y Medtronic Evolut R (EVR) son prótesis transcatéter de segunda generación, diseñadas para reducir el grado de insuficiencia aórtica (IAo) paravalvular. El objetivo es comparar la hemodinámica valvular en un estudio de casos emparejados con análisis ecocardiográfico independiente.
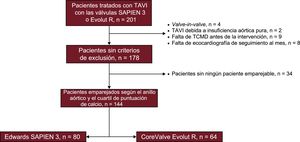
MétodosDe una población de 201 pacientes tratados con implante percutáneo de válvula aórtica, se emparejó a un total de 144 (S3, n=80; EVR, n=64) en función del diámetro del anillo y de la puntuación de calcio aórtico medidos por tomografía computarizada. Los ecocardiogramas de seguimiento basal, al mes y a los 6 meses se analizaron de manera independiente y centralizada.
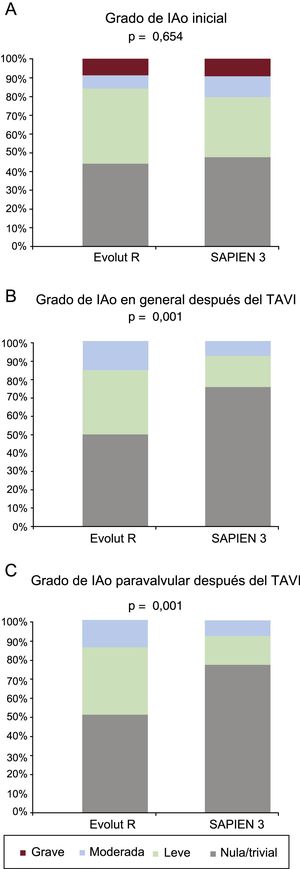
ResultadosNo se observaron diferencias respecto a las características basales clínicas y ecocardiográficas. La prótesis EVR mostró un mejor perfil hemodinámico evaluado mediante gradiente aórtico máximo (EVR frente a S3, 13±7 frente a 20±10; p<0,001), gradiente aórtico medio (7±3 frente a 11±6; p<0,001) e índice de velocidad Doppler (0,65±0,15 frente a 0,51±0,16; p<0,001). Por otro lado, la tasa de IAo paravalvular moderada-grave o de cualquier grado de IAo paravalvular (≥leve) fue mayor en el grupo de EVR (el 11 y el 50%) que en el de S3 (el 2,5 y el 21%; p<0,05), con mayor número de chorros regurgitantes (p<0,001).
ConclusionesEn una cohorte de casos emparejados tratados con implante percutáneo de válvula aórtica de segunda generación, la S3 se asoció con una menor tasa de IAo paravalvular y mayor gradiente transprotésico residual que con la EVR.
Palabras clave
El implante percutáneo de válvula aórtica (TAVI) está recomendado para los pacientes con una estenosis aórtica grave considerados inoperables o con alto riesgo quirúrgico y es una alternativa al tratamiento quirúrgico para los pacientes con riesgo intermedio1. La presencia de una fuga paravalvular causante de insuficiencia aórtica (IAo) moderada-grave es una de las principales limitaciones de las válvulas de nueva generación, ya que se asocia con un aumento de la mortalidad tardía2–4 y mayor incidencia que la que se da con las válvulas quirúrgicas5,6. Las válvulas de nueva generación, es decir, la válvula expandible con balón Edwards SAPIEN 3 (S3) (Edwards Lifesciences; Irvine, California, Estados Unidos) y la válvula autoexpandible Medtronic CoreValve Evolut R (EVR) (Medtronic; Minneapolis, Minnesota, Estados Unidos) son modificaciones basadas en sus predecesoras que tienen la finalidad de reducir en mayor medida la frecuencia y la gravedad de la fuga paravalvular, aumentar los éxitos de los dispositivos y reducir la tasa de complicaciones relacionadas con la intervención. La válvula S3 incorpora un manguito de sellado externo en la parte baja de la estructura del stent para reducir la incidencia de la IAo paravalvular7; mientras que la EVR incorpora un faldón de sellado en la cara de flujo interno de la válvula, así como un sistema reposicionable desarrollado para optimizar la colocación de la válvula8,9. Sin embargo, no hay comparaciones directas de estas 2 válvulas de nueva generación. Así pues, el objetivo de este estudio es comparar los resultados hemodinámicos en los pacientes sometidos a TAVI con la válvula S3 en comparación con la EVR en una población de casos emparejados, según un análisis independiente.
MÉTODOSSe consideró aptos para el estudio a un total de 201 pacientes sintomáticos consecutivos tratados con TAVI en 2 centros. El Equipo Cardiaco de cada centro valoró que los pacientes fueran aptos e idóneos para TAVI. Ambos centros tenían experiencia en estas 2 válvulas percutáneas de nueva generación e incluyeron a pacientes tratados con S3 y con EVR. Se trató preferiblemente con la EVR a los pacientes con válvula mitral o aórtica previa, alto riesgo de oclusión coronaria o rotura de anillo, y se prefirió la S3 para los pacientes con anomalías de la conducción intraventricular (especialmente el bloqueo de rama derecha) o con una aorta muy tortuosa u horizontal. Se excluyó a los pacientes con una IAo pura, reemplazo previo de válvula aórtica (intervenciones de valve-in-valve), falta de ecocardiografía o tomografía computarizada cardiaca previa a la intervención o falta de ecocardiografía en los 30 días siguientes a la intervención. Se obtuvo el consentimiento informado de cada uno de los pacientes antes de la intervención. Se emparejó a los pacientes aptos para el estudio en función de los siguientes parámetros: a) diámetro del anillo aórtico basado en el perímetro (menos de 0,5 mm de diferencia), y b) cuartil de puntuación de calcio de la válvula aórtica determinada mediante tomografía computarizada con multidetectores (TCMD). Se permitió el empleo de un número variable de controles (entre 1 y 3), con lo que formaron la muestra final 144 pacientes (S3, n= 80; EVR, n = 64) (figura 1). La TCMD se llevó a cabo con exploraciones de TC helicoidal con detectores de 64 filas y sincronización electrocardiográfica durante la infusión de un contraste yodado no iónico. Se utilizó una adquisición retrospectiva con cortes de 0,625 mm y un solapamiento del 50% según la planificación del TAVI. Las exploraciones de TCMD se realizaron y se interpretaron según la guía de la Society of Cardiovascular Computed Tomography10 utilizando el programa informático IntelliSpace V. 4.0 (Philips Medical Systems; Andover, Massachusetts, Estados Unidos). Como parte del protocolo, se calcularon los siguientes parámetros: anillo aórtico (diámetros mínimo y máximo, perímetro y área), diámetros estimados a partir del perímetro y del área, y distancia del anillo aórtico a las arterias coronarias. La calcificación de la válvula aórtica se valoró cuantitativamente mediante la puntuación de calcio de la válvula aórtica según un método descrito con anterioridad11. De manera resumida, se establecía una región de interés para la cuantificación del calcio, desde el plano anular basal hasta las puntas de las valvas, excluyendo el calcio coronario, con un umbral para la detección del calcio fijado en 130 UH. El tamaño de la prótesis valvular a utilizar se determinó en función de las mediciones del anillo aórtico utilizando las orientaciones proporcionadas al respecto por el fabricante (). El objetivo era obtener un sobredimensionamiento del área de la prótesis de un 1-15% respecto al área del anillo aórtico en todos los pacientes. Se calcularon también el índice de excentricidad —definido como 100 × [1 – (diámetro mínimo/diámetro máximo del anillo aórtico)]—, el índice de tamaño —definido por el diámetro o el área nominal de la válvula percutánea/diámetro o área del anillo aórtico— y el índice de cobertura —definido como 100 × (diámetro nominal de válvula percutánea – diámetro de TCMD)/ diámetro nominal de la válvula percutánea—.
A todos los pacientes incluidos se les realizó una exploración completa mediante ecocardiografía transtorácica, siguiendo lo establecido en la guía de la American Society of Echocardiography12, antes de la intervención y al mes de seguimiento. Todas las exploraciones se registraron en formato digital y las analizó de manera centralizada un cardiólogo experimentado independiente que no conocía los datos clínicos, utilizando el Xcelera Cardiology Information System (Philips Medical Systems). Se realizaron determinaciones de los siguientes parámetros: diámetro del anillo aórtico, diámetro del tracto de salida del ventrículo izquierdo, fracción de eyección del ventrículo izquierdo evaluada con el método de biplano de Simpson, valor medio y máximo del gradiente transvalvular estimados con la fórmula de Bernouilli modificada, área efectiva del orificio valvular calculada con la ecuación de continuidad e índice de velocidad Doppler, que se calculó como el cociente velocidad en el tracto de salida del ventrículo izquierdo/velocidad transvalvular. El área efectiva del orificio valvular se indexó respecto al área de superficie corporal, y el desajuste entre prótesis y paciente se definió como un área efectiva del orificio valvular indexada ≤ 0,85 cm2/m2 (moderado, 0,65-0,85 cm2/m2; grave, ≤ 0,65 cm2/m2) si el índice de masa corporal era ≤ 30 y el área efectiva del orificio valvular indexada ≤ 0,70 cm2/m2 (moderada, 0,60-0,70 cm2/m2; grave, ≤ 0,60 cm2/m2) si el índice de masa corporal era > 30. Se evaluó la presencia, el grado y el tipo (transvalvular, paravalvular y total) de IAo mediante un método multiparamétrico y se clasificó según las recomendaciones del Valve Academic Research Consortium 213. Si había una IAo paravalvular, se determinaba también el número de chorros. Después del alta hospitalaria, se programaron visitas de seguimiento a los 30 días y a los 6-12 meses, que incluyeron una entrevista y exploración física con un cardiólogo y una ecocardiografía transtorácica. Se registraron prospectivamente en una base de datos dedicada los datos de la intervención, el éxito del dispositivo y los eventos hospitalarios, y se definieron según los criterios del Valve Academic Research Consortium 2. El protocolo del estudio se atuvo a lo establecido en las directrices éticas de la Declaración de Helsinki de 1975 que se reflejaban en la autorización obtenida a priori por los comités de investigación humana de ambos centros.
Análisis estadísticoLas variables discretas se presentan en forma de frecuencias y las comparaciones de los grupos se realizaron con la prueba de la χ2 o la prueba exacta de Fisher. Las variables continuas se presentan como media ± desviación estándar o mediana [intervalo intercuartílico] y se analizó su distribución normal mediante la prueba de Shapiro-Wilk. Las comparaciones se efectuaron con la prueba de la t de Student o la prueba de la U de Mann-Whitney, en función de la distribución de valores de la variable. Se consideraron estadísticamente significativas las diferencias con un valor de p < 0,05. Todos los análisis se realizaron con el programa informático estadístico SPSS (SPSS, Inc.; Chicago, Illinois, Estados Unidos), versión 20.0 para Windows.
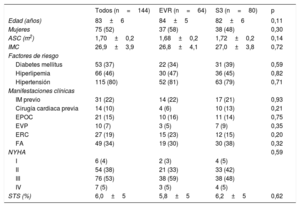
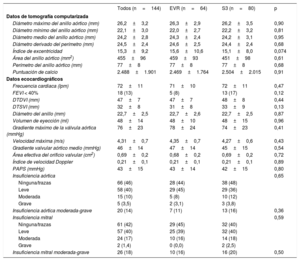
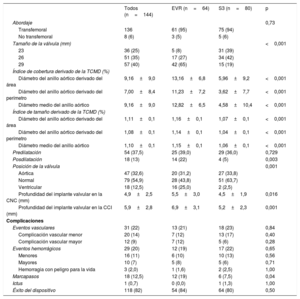
RESULTADOSLa media de edad de la población era 83 ± 6 años y un 52% de los pacientes eran mujeres. No hubo diferencias entre los grupos emparejados en cuanto a las características clínicas iniciales (tabla 1). Las características principales de la ecocardiografía y la TCMD iniciales, según el tipo de válvula, se muestran en la tabla 2. Las variables del emparejamiento evaluadas en la TCMD estuvieron bien equilibradas en los 2 grupos (puntuación de calcio: EVR, 2.469±1.764 frente a S3, 2.504±2.015; p = 0,91; diámetro del anillo aórtico: EVR, 24,6±2,5 frente a S3, 24,4±2,4 mm; p = 0,68). Tampoco hubo diferencias por lo que respecta a la disfunción ventricular izquierda, el volumen de eyección, la gravedad de la estenosis aórtica o la tasa y la gravedad de la IAo.
Características iniciales, generales y según el tipo de válvula percutánea utilizada
| Todos (n=144) | EVR (n=64) | S3 (n=80) | p | |
|---|---|---|---|---|
| Edad (años) | 83±6 | 84±5 | 82±6 | 0,11 |
| Mujeres | 75 (52) | 37 (58) | 38 (48) | 0,30 |
| ASC (m2) | 1,70±0,2 | 1,68±0,2 | 1,72±0,2 | 0,14 |
| IMC | 26,9±3,9 | 26,8±4,1 | 27,0±3,8 | 0,72 |
| Factores de riesgo | ||||
| Diabetes mellitus | 53 (37) | 22 (34) | 31 (39) | 0,59 |
| Hiperlipemia | 66 (46) | 30 (47) | 36 (45) | 0,82 |
| Hipertensión | 115 (80) | 52 (81) | 63 (79) | 0,71 |
| Manifestaciones clínicas | ||||
| IM previo | 31 (22) | 14 (22) | 17 (21) | 0,93 |
| Cirugía cardiaca previa | 14 (10) | 4 (6) | 10 (13) | 0,21 |
| EPOC | 21 (15) | 10 (16) | 11 (14) | 0,75 |
| EVP | 10 (7) | 3 (5) | 7 (9) | 0,35 |
| ERC | 27 (19) | 15 (23) | 12 (15) | 0,20 |
| FA | 49 (34) | 19 (30) | 30 (38) | 0,32 |
| NYHA | 0,59 | |||
| I | 6 (4) | 2 (3) | 4 (5) | |
| II | 54 (38) | 21 (33) | 33 (42) | |
| III | 76 (53) | 38 (59) | 38 (48) | |
| IV | 7 (5) | 3 (5) | 4 (5) | |
| STS (%) | 6,0±5 | 5,8±5 | 6,2±5 | 0,62 |
ASC: área de superficie corporal; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; EVP: enfermedad vascular periférica; EVR: Evolut R; FA: fibrilación auricular; IM: infarto de miocardio; IMC: índice de masa corporal; NYHA: New York Heart Association; S3: SAPIEN 3; STS: puntuación de la Society of Thoracic Surgeons.
Los valores expresan media±desviación estándar o n (%).
Datos de la ecocardiografía y la tomografía computarizada basales, generales y según el tipo de válvula
| Todos (n=144) | EVR (n=64) | S3 (n=80) | p | |
|---|---|---|---|---|
| Datos de tomografía computarizada | ||||
| Diámetro máximo del anillo aórtico (mm) | 26,2±3,2 | 26,3±2,9 | 26,2±3,5 | 0,90 |
| Diámetro mínimo del anillo aórtico (mm) | 22,1±3,0 | 22,0±2,7 | 22,2±3,2 | 0,81 |
| Diámetro medio del anillo aórtico (mm) | 24,2±2,8 | 24,3±2,4 | 24,2±3,1 | 0,95 |
| Diámetro derivado del perímetro (mm) | 24,5±2,4 | 24,6±2,5 | 24,4±2,4 | 0,68 |
| Índice de excentricidad | 15,3±9,2 | 15,6±10,6 | 15,1±8,0 | 0,074 |
| Área del anillo aórtico (mm2) | 455±96 | 459±93 | 451±98 | 0,61 |
| Perímetro del anillo aórtico (mm) | 77±8 | 77±8 | 77±8 | 0,68 |
| Puntuación de calcio | 2.488±1.901 | 2.469±1.764 | 2.504±2.015 | 0,91 |
| Datos ecocardiográficos | ||||
| Frecuencia cardiaca (lpm) | 72±11 | 71±10 | 72±11 | 0,47 |
| FEVI < 40% | 18 (13) | 5 (8) | 13 (17) | 0,12 |
| DTDVI (mm) | 47±7 | 47±7 | 48±8 | 0,44 |
| DTSVI (mm) | 32±8 | 31±8 | 33±9 | 0,13 |
| Diámetro del anillo (mm) | 22,7±2,5 | 22,7±2,6 | 22,7±2,5 | 0,87 |
| Volumen de eyección (ml) | 48±14 | 48±10 | 48±15 | 0,96 |
| Gradiente máximo de la válvula aórtica (mmHg) | 76±23 | 78±24 | 74±23 | 0,41 |
| Velocidad máxima (m/s) | 4,31±0,7 | 4,35±0,7 | 4,27±0,6 | 0,43 |
| Gradiente valvular aórtico medio (mmHg) | 46±14 | 47±14 | 45±15 | 0,54 |
| Área efectiva del orificio valvular (cm2) | 0,69±0,2 | 0,68±0,2 | 0,69±0,2 | 0,72 |
| Índice de velocidad Doppler | 0,21±0,1 | 0,21±0,1 | 0,21±0,1 | 0,89 |
| PAPS (mmHg) | 43±15 | 43±14 | 42±15 | 0,80 |
| Insuficiencia aórtica | 0,65 | |||
| Ninguna/trazas | 66 (46) | 28 (44) | 38 (48) | |
| Leve | 58 (40) | 29 (45) | 29 (36) | |
| Moderada | 15 (10) | 5 (8) | 10 (12) | |
| Grave | 5 (3,5) | 2 (3,1) | 3 (3,8) | |
| Insuficiencia aórtica moderada-grave | 20 (14) | 7 (11) | 13 (16) | 0,36 |
| Insuficiencia mitral | 0,59 | |||
| Ninguna/trazas | 61 (42) | 29 (45) | 32 (40) | |
| Leve | 57 (40) | 25 (39) | 32 (40) | |
| Moderada | 24 (17) | 10 (16) | 14 (18) | |
| Grave | 2 (1,4) | 0 (0,0) | 2 (2,5) | |
| Insuficiencia mitral moderada-grave | 26 (18) | 10 (16) | 16 (20) | 0,50 |
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; EVR: Evolut R; FEVI: fracción de eyección del ventrículo izquierdo; PAPS: presión arterial pulmonar sistólica; S3: SAPIEN 3.
Los valores expresan media±desviación estándar o n (%).
En la tabla 3 se enumeran los principales eventos aparecidos durante la intervención y la hospitalización después del TAVI. A similares dimensiones del anillo, el tamaño de la válvula percutánea fue mayor en el caso de la EVR y, por consiguiente, el grado de exceso de tamaño evaluado con el índice de cobertura y el índice de tamaño fue también mayor en el grupo de EVR (p = 0,001). Se intentó con éxito el reposicionamiento mediante nueva introducción de la vaina de la prótesis en 13 (20,3%) casos del grupo de EVR. La altura de implante final en la cúspide no coronaria fue más profunda en el grupo de EVR que en el de S3 (5,5±3,0 frente a 4,5±1,9; p = 0,016) (tabla 3). La tasa de posdilatación con balón tras el implante de la válvula fue mayor en el grupo de EVR (23%) que en el de S3 (5%; p = 0,002). No hubo otras diferencias entre los grupos por lo que respecta a los eventos periintervención y hospitalarios, excepto por la mayor incidencia de implante de nuevos marcapasos en el grupo de EVR (el 18,8 frente al 7,5%; p = 0,04).
Características principales de la intervención y resultados a los 30 días, en general y según el tipo de válvula percutánea
| Todos (n=144) | EVR (n=64) | S3 (n=80) | p | |
|---|---|---|---|---|
| Abordaje | 0,73 | |||
| Transfemoral | 136 | 61 (95) | 75 (94) | |
| No transfemoral | 8 (6) | 3 (5) | 5 (6) | |
| Tamaño de la válvula (mm) | <0,001 | |||
| 23 | 36 (25) | 5 (8) | 31 (39) | |
| 26 | 51 (35) | 17 (27) | 34 (42) | |
| 29 | 57 (40) | 42 (65) | 15 (19) | |
| Índice de cobertura derivado de la TCMD (%) | ||||
| Diámetro del anillo aórtico derivado del área | 9,16±9,0 | 13,16±6,8 | 5,96±9,2 | <0,001 |
| Diámetro del anillo aórtico derivado del perímetro | 7,00±8,4 | 11,23±7,2 | 3,62±7,7 | <0,001 |
| Diámetro medio del anillo aórtico | 9,16±9,0 | 12,82±6,5 | 4,58±10,4 | <0,001 |
| Índice de tamaño derivado de la TCMD (%) | ||||
| Diámetro del anillo aórtico derivado del área | 1,11±0,1 | 1,16±0,1 | 1,07±0,1 | <0,001 |
| Diámetro del anillo aórtico derivado del perímetro | 1,08±0,1 | 1,14±0,1 | 1,04±0,1 | <0,001 |
| Diámetro medio del anillo aórtico | 1,10±0,1 | 1,15±0,1 | 1,06±0,1 | <0,001 |
| Predilatación | 54 (37,5) | 25 (39,0) | 29 (36,0) | 0,729 |
| Posdilatación | 18 (13) | 14 (22) | 4 (5) | 0,003 |
| Posición de la válvula | 0,001 | |||
| Aórtica | 47 (32,6) | 20 (31,2) | 27 (33,8) | |
| Normal | 79 (54,9) | 28 (43,8) | 51 (63,7) | |
| Ventricular | 18 (12,5) | 16 (25,0) | 2 (2,5) | |
| Profundidad del implante valvular en la CNC (mm) | 4,9±2,5 | 5,5±3,0 | 4,5±1,9 | 0,016 |
| Profundidad del implante valvular en la CCI (mm) | 5,9±2,8 | 6,9±3,1 | 5,2±2,3 | 0,001 |
| Complicaciones | ||||
| Eventos vasculares | 31 (22) | 13 (21) | 18 (23) | 0,84 |
| Complicación vascular menor | 20 (14) | 7 (12) | 13 (17) | 0,40 |
| Complicación vascular mayor | 12 (9) | 7 (12) | 5 (6) | 0,28 |
| Eventos hemorrágicos | 29 (20) | 12 (19) | 17 (22) | 0,65 |
| Menores | 16 (11) | 6 (10) | 10 (13) | 0,56 |
| Mayores | 10 (7) | 5 (8) | 5 (6) | 0,71 |
| Hemorragia con peligro para la vida | 3 (2,0) | 1 (1,6) | 2 (2,5) | 1,00 |
| Marcapasos | 18 (12,5) | 12 (19) | 6 (7,5) | 0,04 |
| Ictus | 1 (0,7) | 0 (0,0) | 1 (1,3) | 1,00 |
| Éxito del dispositivo | 118 (82) | 54 (84) | 64 (80) | 0,50 |
CCI: cúspide coronaria izquierda; CNC: cúspide no coronaria; EVR: Evolut R; S3: SAPIEN 3; TCMD: tomografía computarizada con multidetectores.
Salvo otra indicación, los valores expresan media±desviación estándar o n (%).
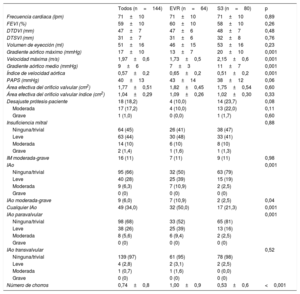
Los datos ecocardiográficos a los 30 días del TAVI, generales y según el tipo de válvula, se presentan en la tabla 4 y la figura 2. El gradiente transprotésico medio general se redujo de 46±14 a 9±6mmHg (p < 0,001) y la media del área efectiva del orificio valvular aumentó de 0,69±0,2 a 1,77±0,51 cm2 (p < 0,001) después del TAVI. El grupo de EVR presentó un gradiente aórtico máximo inferior (EVR frente a S3, 13±7 frente a 20±10 mmHg; p < 0,001), un gradiente aórtico medio inferior (7±3 frente a 11±7 mmHg; p < 0,001) y un índice de velocidad Doppler superior (0,65±0,15 frente a 0,51±0,16; p < 0,001). La incidencia del desajuste entre prótesis y paciente tendió a ser mayor en el grupo de S3 (el 23,7 frente al 10,0%; p = 0,082), con tan solo 1 caso de desajuste grave de la prótesis en el grupo de S3. La tasa de IAo moderada-grave fue mayor en el grupo de EVR (11%) que en el de S3 (2,5%; p = 0,04) (figura 2). Además, la tasa de IAo paravalvular de cualquier tipo (≥ leve) fue mayor en el grupo de EVR (50%) que en el de S3 (21%; p < 0,001), con un número superior de chorros paravalvulares (1,0±0,9 frente a 0,5±0,6; p < 0,001). El porcentaje final de éxitos del dispositivo, según los criterios del Valve Academic Research Consortium 2, fue similar en ambos grupos (el 84 frente al 80%; p = 0,50) (). Estos resultados hemodinámicos a 1 mes se mantuvieron en valores similares en las exploraciones de imagen realizadas en el seguimiento a los 6 meses (). La tasa de reingresos a los 12 meses por insuficiencia cardiaca (el 3,1 frente al 5,0%; p = 0,576) y la clase funcional de la New York Heart Association fueron similares en los 2 grupos, aunque la situación más frecuente fue la de clases I-II (el 96,8 frente al 96,1%; p = 0,374).
Datos ecocardiográficos Doppler en el seguimiento 1 mes después del implante percutáneo de válvula aórtica según el tipo de válvula
| Todos (n=144) | EVR (n=64) | S3 (n=80) | p | |
|---|---|---|---|---|
| Frecuencia cardiaca (lpm) | 71±10 | 71±10 | 71±10 | 0,89 |
| FEVI (%) | 59±10 | 60±10 | 58±10 | 0,26 |
| DTDVI (mm) | 47±7 | 47±6 | 48±7 | 0,48 |
| DTSVI (mm) | 31±7 | 31±6 | 32±8 | 0,76 |
| Volumen de eyección (ml) | 51±16 | 46±15 | 53±16 | 0,23 |
| Gradiente aórtico máximo (mmHg) | 17±10 | 13±7 | 20±10 | 0,001 |
| Velocidad máxima (m/s) | 1,97±0,6 | 1,73±0,5 | 2,15±0,6 | 0,001 |
| Gradiente aórtico medio (mmHg) | 9±6 | 7±3 | 11±7 | 0,001 |
| Índice de velocidad aórtica | 0,57±0,2 | 0,65±0,2 | 0,51±0,2 | 0,001 |
| PAPS (mmHg) | 40±13 | 43±14 | 38±12 | 0,06 |
| Área efectiva del orificio valvular (cm2) | 1,77±0,51 | 1,82±0,45 | 1,75±0,54 | 0,60 |
| Área efectiva del orificio valvular índice (cm2) | 1,04±0,29 | 1,09±0,26 | 1,02±0,30 | 0,33 |
| Desajuste prótesis-paciente | 18 (18,2) | 4 (10,0) | 14 (23,7) | 0,08 |
| Moderada | 17 (17,2) | 4 (10,0) | 13 (22,0) | 0,11 |
| Grave | 1 (1,0) | 0 (0,0) | 1 (1,7) | 0,60 |
| Insuficiencia mitral | 0,88 | |||
| Ninguna/trivial | 64 (45) | 26 (41) | 38 (47) | |
| Leve | 63 (44) | 30 (48) | 33 (41) | |
| Moderada | 14 (10) | 6 (10) | 8 (10) | |
| Grave | 2 (1,4) | 1 (1,6) | 1 (1,3) | |
| IM moderada-grave | 16 (11) | 7 (11) | 9 (11) | 0,98 |
| IAo | 0,001 | |||
| Ninguna/trivial | 95 (66) | 32 (50) | 63 (79) | |
| Leve | 40 (28) | 25 (39) | 15 (19) | |
| Moderada | 9 (6,3) | 7 (10,9) | 2 (2,5) | |
| Grave | 0 (0) | 0 (0) | 0 (0) | |
| IAo moderada-grave | 9 (6,0) | 7 (10,9) | 2 (2,5) | 0,04 |
| Cualquier IAo | 49 (34,0) | 32 (50,0) | 17 (21,3) | 0,001 |
| IAo paravalvular | 0,001 | |||
| Ninguna/trivial | 98 (68) | 33 (52) | 65 (81) | |
| Leve | 38 (26) | 25 (39) | 13 (16) | |
| Moderada | 8 (5,6) | 6 (9,4) | 2 (2,5) | |
| Grave | 0 (0) | 0 (0) | 0 (0) | |
| IAo transvalvular | 0,52 | |||
| Ninguna/trivial | 139 (97) | 61 (95) | 78 (98) | |
| Leve | 4 (2,8) | 2 (3,1) | 2 (2,5) | |
| Moderada | 1 (0,7) | 1 (1,6) | 0 (0,0) | |
| Grave | 0 (0) | 0 (0) | 0 (0) | |
| Número de chorros | 0,74±0,8 | 1,00±0,9 | 0,53±0,6 | <0,001 |
DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; EVR: Evolut R; FEVI: fracción de eyección del ventrículo izquierdo; IAo: insuficiencia aórtica; IM: insuficiencia mitral; PAPS: presión arterial pulmonar sistólica; S3: SAPIEN 3.
Los valores expresan media ± desviación estándar o n (%).
El objetivo de presente estudio es evaluar el perfil hemodinámico de 2 válvulas cardiacas percutáneas de nueva generación, Edwards S3 y Medtronic EVR, en una población de casos emparejados. Los principales resultados de este análisis fueron los siguientes: a) en comparación con la válvula S3, la EVR mostró un mejor perfil hemodinámico según lo determinado por el valor inferior de los gradientes transprótesicos máximo y medio en los seguimientos realizados al mes y a los 6 meses; b) la tasa de IAo moderada fue < 12% en ambos grupos, sin que hubiera ningún caso de IAo grave, y c) la tasa de posdilatación con balón y las tasas finales de cualquier fuga paravalvular y de fugas paravalvulares ≥ moderadas fueron mayores en el grupo de EVR que en el de S3.
Por lo que respecta al perfil hemodinámico de las 2 válvulas, se observaron unos gradientes máximo y medio inferiores y un índice de velocidad Doppler superior con la válvula EVR que con la S3. Esta observación concuerda con las de otras comparaciones previas en las que la válvula autoexpandible CoreValve más antigua mostró también unos gradientes inferiores a los de la válvula SAPIEN XT14,15. Es probable que esto estuviera relacionado con la posición supraanular de las valvas en el caso del dispositivo autoexpandible, lo cual permite una menor resistencia al flujo de salida del ventrículo izquierdo y los gradientes. El hecho de que el tamaño de la válvula fuera mayor en el grupo de EVR, y por consiguiente que el grado de exceso de tamaño fuera mayor, puede ser otra razón de esta diferencia en los gradientes. Sin embargo, el tamaño del anillo nativo medido en la TCMD fue similar en ambos grupos y el grado de exceso de tamaño se correspondía a lo establecido en las recomendaciones actuales. Así pues, en la práctica clínica real, el tamaño de las válvulas expandibles con balón suele ser inferior al de las válvulas autoexpandibles a iguales dimensiones del anillo, por lo que el grado de exceso de tamaño es menor. De hecho, un mayor tamaño del anillo con las válvulas expandibles con balón podría traducirse en complicaciones aórticas graves. Habrá que explorar en un seguimiento a largo plazo el beneficio clínico a largo plazo de esta diferencia absoluta de 4 mmHg en el gradiente medio y la tendencia a una tasa superior de desajuste del tamaño de la prótesis respecto al paciente con la S3. A pesar de esta diferencia en los gradientes, el resultado hemodinámico general de las 2 válvulas fue excelente y similar al de estudios previos con estas válvulas de nueva generación7-9,16,17. Dado el bajo perfil del marco del stent, las válvulas percutáneas son una interesante opción para los pacientes con un anillo pequeño que reduce el riesgo de desajuste de tamaño entre prótesis y paciente, en comparación con las válvulas quirúrgicas18.
La reducción de la fuga paravalvular es uno de los principales retos que plantea el TAVI, debido a su asociación con un peor resultado, una mayor incidencia en comparación con la cirugía y la tendencia a utilizar estos dispositivos en poblaciones con menos riesgo2–6. Inicialmente, en algunos registros nacionales de TAVI19,20 y estudios multicéntricos14 se observó una tendencia a mayor incidencia de fugas significativas con las válvulas autoexpandibles de primera generación en comparación con las válvulas expandibles con balón de la primera. En un metanálisis de estudios observacionales, la tasa de IAo ≥ moderada con las válvulas percutáneas de primera generación osciló entre 0 y el 47%, con tasas más altas con las válvulas autoexpandibles (el 16 frente al 9,1%; p = 0,005) que con las expandibles con balón2. Posteriormente, en el ensayo aleatorizado CHOICE15, de comparación directa de las válvulas de la anterior generación CoreValve y SAPIEN XT, se observó mayor tasa de éxitos del dispositivo en el grupo de SAPIEN XT, principalmente por la menor tasa de IAo moderada-grave evaluada con la angiografía (el 4,1 frente al 18,3%; p < 0,001), que persistió en el seguimiento realizado al año21. Con las válvulas de segunda generación, la tasa descrita de IAo ≥ moderada mejoró en comparación con las generaciones previas22,23, con una incidencia < 5%, pero aun así superior a la de la cirugía5,6. En el estudio de emparejamiento de casos, con un análisis ecocardiográfico independiente, se observó una tasa del 2,5% de IAo moderada-grave con la válvula S3, similar a la tasa de ∼3,5% descrita en registros previos de toda Europa y Norteamérica5,16,24,25. Asumimos que esta baja tasa de IAo probablemente se deba a un mejor ajuste al tamaño del anillo, la presencia de un manguito de sellado externo que reduce la tasa de fuga paravalvular y la adición de una plataforma de aplicación estable que optimiza la correcta colocación de la válvula. Con la válvula EVR, la información existente sobre la tasa de IAo se limita a cohortes más pequeñas. En el estudio fundamental de registro de la EVR realizado en 60 pacientes para quienes que se consideró que la cirugía implicaba un riesgo extremo8, se registró una tasa del 3,4% de IAo moderada-grave; el registro de EVR de Reino Unido e Irlanda (n = 264), el registro de EVR de Estados Unidos (n = 241) y el estudio de pacientes no seleccionados (all comers) de Perrin et al. (n = 83) mostraron unas tasas de IAo moderada-grave del 7,7, el 5,3 y el 1,6% respectivamente9,17,26. En el presente estudio se observó una tasa ligeramente superior de IAo moderada (∼10%), pero que continuaba siendo inferior a la de la generación anterior de CoreValve27. El nuevo diseño de la válvula, además de que el sistema sea reposicionable-recuperable, puede contribuir a una adecuada y mejor colocación final de la válvula.
En el único estudio publicado hasta la fecha de comparación directa de las válvulas S3 y EVR, no se observaron diferencias respecto a la tasa de IAo moderada-grave (el 2,5% frente a 0; p = 0,251) y las tasas de IAo fueron muy bajas en ambos grupos28. Este estudio es de 1 solo centro, con grupos poco equilibrados, un diámetro del anillo mayor en el grupo de S3 (con un uso preferente de la válvula S3 para los pacientes con anillo > 26 mm) y sin ajuste respecto al calcio, que es un conocido factor predictivo de IAo paravalvular y necesidad de posdilatación con balón29–31. En el estudio de cohortes con emparejamiento, con un tamaño valvular basado en el análisis de la TCMD y un grado de calcificación valvular similar en los 2 grupos, la EVR se asoció con mayor grado de IAo paravalvular de cualquier tipo y de gravedad ≥ moderada. La mayor fuerza radial y la adaptabilidad de la S3 al anillo aórtico pueden estar relacionadas con esta menor tasa de IAo paravalvular. Continúa habiendo controversia respecto a si la IAo leve aumenta la mortalidad a largo plazo o no, pero la IAo ≥ moderada es un factor bien conocido que se asocia con peor resultado3,4, y esta diferencia absoluta del 8% en la IAo moderada podría tener influencia en los resultados clínicos a largo plazo, sobre todo en los pacientes de menos edad y en estado menos grave. En el presente análisis, estas diferencias en la tasa de IAo persistieron en los seguimientos a los 6 y los 12 meses. Así pues, en futuros estudios con un seguimiento más largo deberá confirmarse si se produce una mayor reducción de la gravedad de la fuga paravalvular con el paso del tiempo al utilizar sistemas autoexpandibles. Es importante señalar que la tasa de IAo paravalvular significativa fue baja en ambos grupos, sin que hubiera ningún caso de IAo grave, lo cual indica que los cambios recientes de la tecnología y el tamaño adecuado de la válvula reducirán en mayor medida la tasa de IAo paravalvular, con objeto de alcanzar un buen resultado quirúrgico.
Aunque este estudio no disponía de la potencia estadística necesaria para detectar diferencias en los eventos clínicos, no se observaron diferencias significativas entre los 2 grupos en cuanto a los eventos hospitalarios, excepto por lo que respecta a la tasa de implantes de marcapasos. Además, la baja tasa de complicaciones vasculares y de hemorragias mayores reflejaba el beneficio de una reducción significativa del diámetro de la vaina con estos 2 nuevos sistemas.
LimitacionesLas principales limitaciones de este estudio son su pequeño tamaño muestral y el carácter observacional. No se aleatorizó a los pacientes, pero esto se compensó con un muy cuidadoso proceso de emparejamiento de los grupos teniendo en cuenta el tamaño del anillo y la calcificación de la válvula aórtica, que son factores de demostrada buena correlación con la hemodinámica valvular y la presencia de IAo paravalvular. La evaluación de la gravedad de la IAo puede resultar difícil, en especial en el grupo de EVR, con mayor número de chorros paravalvulares y mayor protrusión del marco del stent en el tracto de salida del ventrículo izquierdo; no obstante, un abordaje ecocardiográfico multiparamétrico asegura la exactitud de los resultados con ambos dispositivos. Además, un mismo ecocardiografista experimentado que no conocía los datos clínicos evaluó todas las exploraciones ecocardiográficas, lo cual garantiza un análisis uniforme. Sin embargo, no puede descartarse la presencia de otros posibles factores de confusión; en consecuencia, estos resultados deberán confirmarse en futuros ensayos clínicos aleatorizados de comparación directa entre las 2 válvulas percutáneas.
CONCLUSIONESEn este estudio de casos emparejados, los pacientes sometidos a TAVI con la válvula S3 presentaron menores tasas de IAo paravalvular en general y de IAo paravalvular moderada, pero los gradientes residuales fueron superiores a los de los pacientes tratados con el sistema EVR en el seguimiento al mes y a los 6 meses. Será necesario un seguimiento a largo plazo y una experiencia multicéntrica a mayor escala para evaluar los posibles efectos de estas observaciones en los resultados clínicos a largo plazo. Mientras tanto, estos datos indican que, en los centros que disponen de ambas válvulas, la S3 puede ser la preferida para los pacientes con mayor riesgo de fuga paravalvular, mientras que la EVR puede ser una mejor opción para los pacientes cuya hemodinámica pueda peligrar.
CONFLICTO DE INTERESESI.J. Amat-Santos es proctor de Boston Scientific. L. Nombela-Franco es proctor de Abbott y ha recibido honorarios por conferencias de Edwards Lifesciences Inc.
- –
El TAVI está recomendado para los pacientes con estenosis aórtica sintomática grave considerados inoperables o con riesgo quirúrgico intermedio o alto. La fuga paravalvular causante de una IAo moderada-grave es una de las principales preocupaciones que las válvulas percutáneas de la anterior generación generaban, a causa de su asociación con una mayor mortalidad a largo plazo. Las válvulas de nueva generación S3 expandible con balón y EVR autoexpandible se desarrollaron modificando las precedentes con objeto de reducir en mayor medida la tasa y el grado de fuga paravalvular, aumentar el éxito del dispositivo y reducir la tasa de complicaciones relacionadas con la intervención.
- –
Este estudio de casos emparejados compara los resultados hemodinámicos de 2 centros con la válvula de nueva generación S3 expandible con balón y la EVR autoexpandible mediante un análisis ecocardiográfico independiente. El TAVI con el dispositivo S3 mostró una tasa inferior de IAo paravalvular de cualquier tipo y de IAo paravalvular moderada, pero con un gradiente residual superior, en comparación con los pacientes tratados con el sistema EVR. Los resultados hospitalarios y a los 30 días fueron similares en los 2 grupos, excepto por una mayor incidencia de implantes de nuevos marcapasos en el grupo de EVR.