SEC 2023 - El Congreso de la Salud Cardiovascular
Introducción
Dr. Juan José Gómez Doblas
Presidente del Comité Científico del Congreso
Vicepresidente de la SEC
Comités ejecutivo, organizador y científico
Comité de evaluadores
Listado de sesiones
Índice de autores
31. IAM y sus complicaciones: del shock a la parada cardiaca. Síndrome de tako-tsubo
6. EFICACIA Y SEGURIDAD DEL LEVOSIMENDÁN INTRAVENOSO, EN LAS PRIMERAS 24 HORAS TRAS LA ANGIOPLASTIA PRIMARIA, EN PACIENTES CON IAMCEST: ESTUDIO LEVOCEST
1Cardiología. Complejo Hospitalario Universitario de Canarias, San Cristóbal de La Laguna (Santa Cruz de Tenerife), España y 2Complejo Hospitalario Universitario de Canarias, San Cristóbal de La Laguna (Santa Cruz de Tenerife), España.
Introducción y objetivos: Dado que existen evidencias de que el levosimendán mediante varias dianas terapéuticas podría ejercer cardioprotección en pacientes con IAMCEST, nos planteamos la pregunta de si este fármaco administrado tras la angioplastia primaria reduce el tamaño del infarto. Surge así el ensayo clínico LEVOCEST, puesto en marcha en nuestro centro a finales de noviembre de 2018 y notificado su cierre a la AEMPS en octubre de 2022.
Métodos: El estudio LEVOCEST es un ensayo clínico aleatorizado, prospectivo, en fase III, unicéntrico, doble ciego y controlado con placebo, cuyo objetivo es evaluar la eficacia y seguridad del levosimendán IV en las primeras 24 horas tras la angioplastia primaria en pacientes con IAMCEST. Se incluyó a un total de 187 pacientes, y se los aleatorizó para recibir una infusión de levosimendán o placebo durante 24 horas, tras la angioplastia primaria. El objetivo principal del estudio fue evaluar si el miocardio contundido, puede recuperarse total o parcialmente después de la infusión de levosimendán, midiendo el tamaño del infarto mediante RMN a los 30 días y a los 6 meses del evento (figura).
Resultados: Se incluyó a un total de 187 pacientes, cuyas características basales están descritas en la tabla. De todos los pacientes incluidos, se pudo analizar la variable principal en 78 pacientes del grupo placebo y 79 en el grupo levosimendán. Al cuantificar el tamaño del infarto mediante RMN, se encontró que sí hubo diferencias estadísticamente significativas, con una reducción del porcentaje de miocardio infartado mayor en pacientes tratados con levosimendán (13,19 ± 9,50 vs 11,79 ± 9, p = 0,041), comparado con los que fueron aleatorizados a placebo (13,43 ± 7,80 vs 13,35 ± 7,11). A la hora de analizar otras variables como los VTD y VTS del VI y la FEVI, no se encontraron diferencias estadísticamente significativas entre ambos grupos de tratamiento. Con respecto a la seguridad del fármaco, no hubo diferencias estadísticamente significativas con respecto a los eventos adversos graves.
|
Características basales |
Grupo placebo n = 78 |
Grupo levosimendán n = 79 |
p |
|
Edad, años (media ± DE) |
57 ± 9 |
59 ± 12 |
0,35 |
|
Sexo varón, n (%) |
65 (83,3) |
66 (83,54) |
0,97 |
|
Hipertensión arterial, n (%) |
40 (51,3) |
43 (54,4) |
0,7 |
|
Diabetes mellitus, n (%) |
13 (16,7) |
13 (16,5) |
0,97 |
|
Dislipemia, n (%) |
45 (57,7) |
49 (62) |
0,58 |
|
Obesidad, n (%) |
24 (30,8) |
21 (26,6) |
0,56 |
|
Fumador, n (%) |
51 (65) |
48 (60,8) |
0,55 |
|
Alcoholismo, n (%) |
4 (5,1) |
4 (5,1) |
0,98 |
|
Arteria culpable |
0,01 |
||
|
CD n (%) |
44 (56,4) |
30 (38) |
|
|
DA n (%) |
21 (26,9) |
39(49,4) |
|
|
CX n (%) |
12(15,4) |
6(7,6) |
|
|
OM n (%) |
0 (0) |
3 (3,8) |
|
|
TCCI n (%) |
0 (0) |
1 (1,3) |
|
|
DX n (%) |
1(1,3) |
0 (0) |
|
|
Número de vasos afectos: |
0,71 |
||
|
1 n (%) |
65 (72,2) |
60(67,4) |
|
|
2 n (%) |
17(18,9) |
20 (22,4) |
|
|
3 n (%) |
8 (8,9) |
9 (10,1) |
|
|
Horas hasta la apertura de la arteria, n (%) |
3,7 ± 1,6 |
3,9 ± 1,8 |
0,6 |
|
Troponina T pico ng/L, (mediana; min-máx) |
58 (0-80) |
55 (0-80) |
0,84 |
|
Troponina I pico ng/L, (mediana;min-máx) |
4.214 (44-21.275) |
4.671 (72-18.659) |
0,9 |
|
Creatinina mg/dl, (media ± DE) |
0,9 ± 0,2 |
0,9 ± 0,2 |
1 |
|
NT-proBNP pg/ml, (media ± DE) |
292 ± 514 |
330 ± 635 |
0,9 |
|
FEVI % por ventriculografía, (media ± DE) |
59 ± 9 |
58 ± 9 |
0,6 |
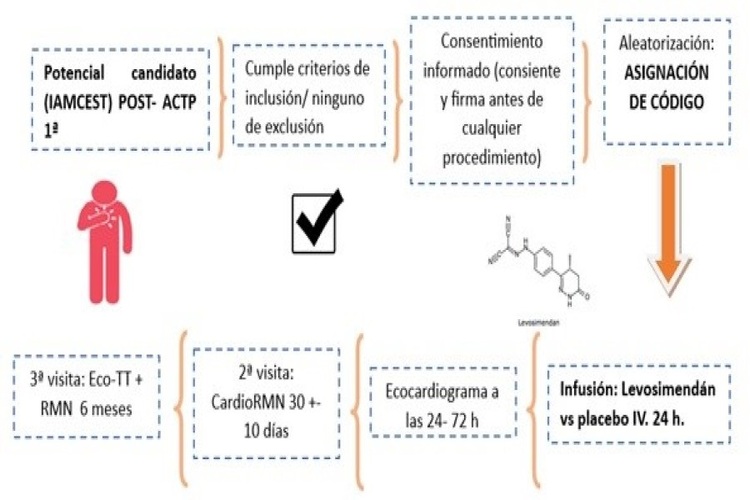
Esquema del protocolo de tratamiento y visitas de los pacientes del ensayo clínico LEVOCEST.
Conclusiones: Los resultados de este estudio demuestran que el levosimendán es un fármaco seguro en pacientes con IAMCEST que se someten a angioplastia primaria independientemente de la FEVI. Se demuestra que ejerce efecto cardioprotector, al reducir el tamaño del infarto. No se encontraron diferencias estadísticamente significativas con respecto a la FEVI y el remodelado ventricular adverso a los 6 meses del tratamiento.
Comunicaciones disponibles de "IAM y sus complicaciones: del <i>shock</i> a la parada cardiaca. Síndrome de <i>tako-tsubo</i>"
- 1. MODERA
- Nuria Ribas Barquet, Barcelona
- 2. EXPERIENCIA EN LA ATENCIÓN A LA PARADA CARDIACA EXTRAHOSPITALARIA REFRACTARIA CON ECMO-VA
- María Vidal Burdeus, Eduard Argudo Serra, Andrea Camblor Blasco, María Martínez Martínez, Laia Milà Pascual, Pau Torrella Llauger, Carlota Vigil-Escalera López, Remedios Ríos Barrera, Jordi Riera del Brio, José A. Barrabés Riu, Ignacio Ferreira González y Aitor Uribarri González
Hospital Universitari Vall d’Hebron, Barcelona, España.
- 3. IMPACTO PRONÓSTICO DEL TIEMPO DE RECUPERACIÓN DE LA FUNCIÓN DEL VENTRÍCULO IZQUIERDO EN EL SÍNDROME DE TAKO-TSUBO
- Luis López Flores1, Paula Marín Andreu1, Margarita Montero Parrilla1, Antonio Pablo Rivas García1, Mireia Andrés2, Alberto Pérez Castellanos3, Aitor Uribarri González4, Iván Núñez Gil5, Juan Carlos García Rubira1 y Manuel Almendro Delia1
1Hospital Universitario Virgen Macarena, Sevilla, España, 2Hospital Universitari Vall d’Hebron, Barcelona, España, 3Hospital Son Espases, Palma de Mallorca (Illes Balears), España, 4Hospital Clínico Universitario de Valladolid, Valladolid, España y 5Hospital Clínico San Carlos, Madrid, España.
- 4. TIEMPOS DE CATETERISMO Y USO DE PRETRATAMIENTO ANTIPLAQUETARIO EN PACIENTES CON SÍNDROME CORONARIO AGUDO SIN ELEVACIÓN DEL SEGMENTO ST EN ESPAÑA
- Felipe Díez-Delhoyo1, María Thiscal López Lluva2, María Fernández-González3, Martín Negreira Caamaño4, Paula Mendoza Cuartero5, David Aritza-Conty6, Jessica Vaquero-Luna7, Alicia Prieto Lobato8, Eduardo Luján Valencia9, Clara Fernández-Cordón10, Alfonso Jurado-Román11, Jessika González D' Gregorio12, Antonio Martínez-Guisado13, Ander Arteagoitia Bolumburu14, Anna Gálvez-García15, Jesús Diz-Díaz16, José Carreras Mora17, Ricardo Rivera18, Fernando Torres-Mezcua19, Lucía Matute-Blanco20, Lucía Pérez-Cebey21 y Pablo Diez-Villanueva22
1Hospital Universitario 12 de Octubre. CIBERCV, Madrid, España, 2Cardiología. Complejo Asistencial Universitario de León, León, España, 3Complejo Asistencial Universitario de León, León, España, 4Cardiología. Hospital General Universitario de Ciudad Real, Ciudad Real, España, 5Cardiología. Hospital Universitario de Basurto, Bilbao (Vizcaya), España, 6Cardiología. Hospital Universitario Navarra, Pamplona/Iruña (Navarra), España, 7Cardiología. Hospital Universitario Araba-Txagorritxu, Vitoria-Gasteiz (álava), España, 8Cardiología. Complejo Hospitalario Universitario, Albacete, España, 9Cardiología. Hospital Universitario Marqués de Valdecilla, Santander (Cantabria), España, 10Cardiología. Hospital General Universitario Gregorio Marañón, Madrid, España, 11Cardiología. Hospital Universitario La Paz, Madrid, España, 12Cardiología. Fundación de Investigación del Hospital Clínico de Valencia-INCLIVA, Valencia, España, 13Cardiología. Hospital Clínic, CNIC, Barcelona, España, 14Cardiología. Hospital Universitario Ramón y Cajal, Madrid, España, 15Cardiología.Hospital Universitari de Bellvitge, L’Hospitalet de Llobregat (Barcelona), España, 16Cardiología. Hospital Clínico San Carlos, Madrid, España, 17Cardiología. Hospital del Mar, Barcelona, España, 18Cardiología. Hospital Universitario Virgen de las Nieves, Granada, España, 19Cardiología. Hospital General Universitario de Alicante, Alicante, España, 20Cardiología. Hospital Universitari de Lleida, Lleida, España, 21Cardiología. Hospital Universitario de A Coruña A Coruña, España y 22Hospital Universitario de La Princesa, Madrid, España.
- 5. CÓDIGO ECMO: EXPERIENCIA RETROSPECTIVA NACIONAL Y MULTICÉNTRICA DE TRASLADO PRIMARIO DE PACIENTES CON SHOCK REFRACTARIO BAJO SOPORTE CON ECMO VENOARTERIAL
- Alexander Stepanenko1, Javier Tobar Ruíz2, María Plaza Martín2, Aitor Uribarri González3, María Vidal Burdeus4, Manuel García Delgado5, Violeta Chica Sáez5, Marta Alonso Fernández de Gatta6, Francisco José Hernández Pérez7, Ignacio J. Amat Santos8 y José Alberto San Román Calvar1
1Servicio de Cardiología, CIBERCV. Hospital Clínico Universitario de Valladolid, Valladolid, España, 2Servicio de Cardiología. Hospital Clínico Universitario de Valladolid, Valladolid, España, 3Unidad de Cuidados Agudos Cardiovasculares, Unidad de Insuficiencia Cardiaca Avanzada. Hospital Universitario Vall d’Hebron, Barcelona, España, 4Unidad de Cuidados Agudos Cardiovasculares, Unidad de Insuficiencia Cardiaca Avanzada. Hospital Universitari Vall d’Hebron, Barcelona, España, 5Servicio de Medicina Intensiva. Hospital Universitario Virgen de las Nieves, Granada, España, 6Servicio de Cardiología, Instituto de Investigación Biomédica de Salamanca IBSAL. Complejo Asistencial Universitario de Salamanca, Salamanca, España, 7Unidad de Insuficiencia Cardiaca y Trasplante. Hospital Universitario Puerta de Hierro Majadahonda (Madrid), Madrid, España y 8Servicio de Cardiología, Cardiología intervencionista. Hospital Clínico Universitario de Valladolid, Valladolid, España.
- 6. EFICACIA Y SEGURIDAD DEL LEVOSIMENDÁN INTRAVENOSO, EN LAS PRIMERAS 24 HORAS TRAS LA ANGIOPLASTIA PRIMARIA, EN PACIENTES CON IAMCEST: ESTUDIO LEVOCEST
- Manuel Alejandro Rivero García1, Francisco Bosa Ojeda2, Corabel Méndez Vargas1, Geoffrey Yanes Bowden1, Alejandro Sánchez-Grande Flecha1, Julio Miranda Bacallado1, Consuelo Rodríguez Jiménez2, Martín J. García González2, Juan Lacalzada Almeida2, Mª Manuela Izquierdo Gómez2, Marta M. Martín Cabeza2, Pablo Jorge Pérez2 y Patricia Rodríguez Fortúnez2
1Cardiología. Complejo Hospitalario Universitario de Canarias, San Cristóbal de La Laguna (Santa Cruz de Tenerife), España y 2Complejo Hospitalario Universitario de Canarias, San Cristóbal de La Laguna (Santa Cruz de Tenerife), España.
- 7. EPIDEMIOLOGÍA Y PERFIL CLÍNICO DE 7.696 HOSPITALIZACIONES CON SÍNDROME DE TAKO-TSUBO POR SEXO: MENOR COMORBILIDAD Y MORTALIDAD EN MUJERES
- Isabel López Alacid1, Nicolás Rosillo Ramírez2, Guillermo Moreno Muñoz2, Jorge Vélez García2, Martín Romo Pardo1, Sara Nieto Becerro1, Héctor Bueno Zamora2 y Lourdes Vicent Alaminos2
1Servicio de Cardiología. Hospital Universitario 12 de Octubre, Madrid, España y 2Servicio de Cardiología. Hospital Universitario 12 de Octubre. CIBERCV, Madrid, España.
- 8. RESULTADOS DE LA ESTRATEGIA DE "NO PRETRATAMIENTO" EN EL SÍNDROME CORONARIO AGUDO SIN ELEVACIÓN DEL ST
- Luis López Flores, Alejandro Gómez González, Rocío Martínez Núñez, Carlos Barea González, Carmen López Flores y Juan Carlos García Rubira
Hospital Universitario Virgen Macarena, Sevilla, España.
- 9. REANIMACIÓN CARDIOPULMONAR CON ECMO-VA: UNA NUEVA OPORTUNIDAD PARA LOS PACIENTES CON PARADA CARDIACA REFRACTARIA
- María Vidal Burdeus, Pau Torrella Llauger, Laia Milà Pascual, Eduard Argudo Serra, Remedios Ríos Barrera, María Martínez Martínez, Carlota Vigil-Escalera López, Irene Buera Surribas, Jordi Riera del Brio, Ignacio Ferreira González y Aitor Uribarri González
Hospital Universitari Vall d’Hebron, Barcelona, España.
- 10. CARACTERÍSTICAS CLÍNICAS Y PRONÓSTICO ASOCIADOS A LA ENFERMEDAD MULTIVASO EN PACIENTES TRAS UN INFARTO AGUDO DE MIOCARDIO CON ELEVACIÓN DEL SEGMENTO ST
- Diego Iraola Viana1, Víctor Marcos Garcés1, Héctor Merenciano González1, Nerea Pérez2, José Gavara Doñate2, César Ríos Navarro2, Elena de Dios Lluch3, Carlos Bertolín Boronat1, Silvia Mínguez Díaz de Alda1, Paolo Racugno1, Joaquim Cànoves Femenia1, Cristina Albiach Montañana1, Francisco López Fornas1, Francisco Javier Chorro Gascó1 y Vicente Bodí Peris1
1Cardiología. Hospital Clínico Universitario de Valencia, Valencia, España, 2Cardiología. Fundación de Investigación del Hospital Clínico de Valencia-INCLIVA, Valencia, España y 3Cardiología. Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares CIBER-CV, Madrid, España.
- 11. PERFIL CLÍNICO, MANEJO Y PRONÓSTICO DEL PACIENTE CON SHOCK CARDIOGÉNICO SOMETIDO A TRASLADO INTERHOSPITALARIO EN ESPAÑA
- Marisa Barrionuevo Sánchez1, Albert Ariza Solé1, Ana Viana Tejedor2, Náyade del Prado3, Nicolás Rosillo Ramírez3, José Carlos Sánchez Salado1, Joan Isaac Llaó Ferrando1, Oriol Alegre Canals1, José Luis Bernal Sobrino3, Cristina Fernández Pérez3, Victoria Lorente Tordera1, Remedios Sánchez Prieto1, Marta Marcos Mangas1, Julia Pascual Mayans4 y Francisco Javier Elola Somoza3
1Hospital Universitari Bellvitge, L´Hospitalet de Llobregat Barcelona, España, 2Hospital Clínico San Carlos, Madrid, España, 3Fundación IMAS, Madrid, España y 4Hospital Universitario Dr. Josep Trueta, Girona, España.
- 12. CARACTERÍSTICAS CLÍNICAS, MANEJO Y PRONÓSTICO DE LOS PACIENTES CON SHOCK CARDIOGÉNICO DE ETIOLOGÍA NO ISQUÉMICA
- Sara Lozano Jiménez1, Mercedes Rivas Lasarte1, Cristina Daniela Mitroi1, Manuel Gómez Bueno1, Reyes Iranzo1, Juan Manuel Escudier Villa1, José María Viéitez Flórez1, Susana Villar García2, Ramón Garrido González1, Juan Francisco Oteo Domínguez1, Javier Segovia Cubero1 y Francisco Hernández Pérez1
1Cardiología. Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España y 2Cirugía Cardiaca. Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España.
- 13. PRONÓSTICO A 10 AÑOS DE LA FIBRILACIÓN AURICULAR COMO COMPLICACIÓN EN FASE AGUDA DEL INFARTO AGUDO DE MIOCARDIO CON ELEVACIÓN DEL SEGMENTO ST
- María José Martínez Membrive1, Isaac Subirana Cachinero2, Edgar Fadeuilhe Grau3, Ferran Rueda Sobella3, José Carreras Mora1, Teresa Oliveras Vilà3, Diana Mojón Álvarez1, Carlos Labata Salvador3, Marc Ferrer Massot3, Nabil El Ouaddi Azzaytouni3, Santiago R. Montero Aradas3, Roberto Elosua Llanos2, Nuria Ribas Barquet1, Antoni Bayés Genís3 y Cosme García García3
1Hospital del Mar, Barcelona, España, 2Institut Municipal d'Investigació Mèdica IMIM, Barcelona, España y 3Hospital Universitari Germans Trias i Pujol, Badalona (Barcelona), España.
Más comunicaciones de los autores
-
Bosa Ojeda, Francisco
- 7 - PREDICTORES ELECTROCARDIOGRÁFICOS DE NECESIDAD DE ESTIMULACIÓN ENDOCAVITARIA DEFINITIVA TRAS EL ALTA HOSPITALARIA EN PACIENTES SOMETIDOS A IMPLANTE DE PRÓTESIS AÓRTICA TRANSCATÉTER CON VÁLVULA BALÓN-EXPANSIBLE
- 9 - DESCRIPCIÓN RETROSPECTIVA DEL CATÉTER DE ARTERIA PULMONAR EN UNA POBLACIÓN EN SHOCK CARDIOGÉNICO
- 6 - EFICACIA Y SEGURIDAD DEL LEVOSIMENDÁN INTRAVENOSO, EN LAS PRIMERAS 24 HORAS TRAS LA ANGIOPLASTIA PRIMARIA, EN PACIENTES CON IAMCEST: ESTUDIO LEVOCEST
- 7 - LA DISTRIBUCIÓN DEL CALCIO EN LA VÁLVULA AÓRTICA Y AORTA ASCENDENTE COMO PREDICTOR DE DESARROLLO DE BLOQUEO AURICULOVENTRICULAR AVANZADO TRAS IMPLANTE DE PRÓTESIS AÓRTICA TRANSCATÉTER
- García González, Martín J.
- Izquierdo Gómez, M. Manuela
-
Jorge Pérez, Pablo
- 10 - IMPACTO DE LA INERCIA TERAPÉUTICA EN EL TRATAMIENTO CON HIPOLIPEMIANTES EN PACIENTES CON MUY ALTO RIESGO CARDIOVASCULAR
- 9 - DESCRIPCIÓN RETROSPECTIVA DEL CATÉTER DE ARTERIA PULMONAR EN UNA POBLACIÓN EN SHOCK CARDIOGÉNICO
- 6 - EFICACIA Y SEGURIDAD DEL LEVOSIMENDÁN INTRAVENOSO, EN LAS PRIMERAS 24 HORAS TRAS LA ANGIOPLASTIA PRIMARIA, EN PACIENTES CON IAMCEST: ESTUDIO LEVOCEST
- Lacalzada Almeida, Juan
- Martín Cabeza, Marta María
- Méndez Vargas, Corabel
- Miranda Bacallado, Julio
- Rodríguez Fortúnez, Patricia
- Rodríguez Jiménez, Consuelo
- Sánchez-Grande Flecha, Alejandro
-
Yanes Bowden, Geoffrey
- 7 - PREDICTORES ELECTROCARDIOGRÁFICOS DE NECESIDAD DE ESTIMULACIÓN ENDOCAVITARIA DEFINITIVA TRAS EL ALTA HOSPITALARIA EN PACIENTES SOMETIDOS A IMPLANTE DE PRÓTESIS AÓRTICA TRANSCATÉTER CON VÁLVULA BALÓN-EXPANSIBLE
- 6 - EFICACIA Y SEGURIDAD DEL LEVOSIMENDÁN INTRAVENOSO, EN LAS PRIMERAS 24 HORAS TRAS LA ANGIOPLASTIA PRIMARIA, EN PACIENTES CON IAMCEST: ESTUDIO LEVOCEST
- 7 - LA DISTRIBUCIÓN DEL CALCIO EN LA VÁLVULA AÓRTICA Y AORTA ASCENDENTE COMO PREDICTOR DE DESARROLLO DE BLOQUEO AURICULOVENTRICULAR AVANZADO TRAS IMPLANTE DE PRÓTESIS AÓRTICA TRANSCATÉTER
