SEC 2024 - El Congreso de la Salud Cardiovascular
Introducción
Dr. José María de la Torre Hernández
Presidente del Comité Científico del Congreso. Vicepresidente de la SEC
Comités ejecutivo, organizador y científico
Comité de evaluadores
Listado completo de comunicaciones
Índice de autores
4022. Comunicaciones en amiloidosis y muerte súbita
4022-2. Cambios electrocardiográficos en portadores asintomáticos de ATTRv que desarrollan amiloidosis cardiaca por transtirretina
1Unidad de Cardiopatías Familiares, Servicio de Cardiología. Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España y 2National Amyloidosis Centre, Division of Medicine. University College London, London (Reino Unido).
Introducción y objetivos: Los portadores asintomáticos de variantes patogénicas en el gen de la transtirretina (TTR) representan un grupo de pacientes en riesgo de desarrollar amiloidosis cardiaca. La identificación temprana de la afectación cardiaca es clave para guiar el inicio oportuno de las terapias modificadoras de la enfermedad. El objetivo del estudio fue identificar cambios electrocardiográficos asociados al desarrollo de amiloidosis cardiaca en portadores de mutaciones en el gen TTR.
Métodos: Estudio retrospectivo bicéntrico de 40 portadores de mutaciones patogénicas en el gen TTR (58% mujeres, 51 ± 10 años, 35% con Val50Met) sin amiloidosis cardiaca en la evaluación inicial y que hubieran sido sometidos a > 2 estudios por gammagrafía cardiaca con 3,3-difosfonato-1,2-propanodicarboxílico (DPD) durante el seguimiento. Se compararon los cambios en los parámetros electrocardiográficos entre aquellos sujetos que desarrollaron algún grado de captación de DPD (Perugini 1-3) y aquellos que no lo hicieron (Perugini 0 al final del seguimiento).
Resultados: Después de un seguimiento mediano de 2,6 años (RIC 2-4,7), 6 individuos (4 hombres, edad 49 ± 11 años, 1 Val50Met) mostraron algún grado de captación en la gammagrafía de seguimiento (cuatro grado 1 de Perugini; uno grado 2 y uno grado 3). No se observaron diferencias en la variación del intervalo PR [-0,5 (-8 a 4) vs 2 (-11 a 9) ms; (p = 0,547)], de la duración del QRS [1 (-2 a 6) vs 0 (-3 a 7) ms (p = 0,846)] o de los voltajes del QRS de las derivaciones de miembros (tabla) entre los pacientes que desarrollaron captación gammagráfica y los que no. Sin embargo, se observó una reducción significativa en el voltaje medio del QRS en V3 [-2,5 (-8 a -1) vs 0 (-2 a 2) mVx10-1; p = 0,025] y en la suma de todas las derivaciones precordiales [-11 (-20 a 0) vs 1 (-8 a 3) mVx10-1; p = 0,047] en los pacientes que desarrollaron captación gammagráfica durante el seguimiento en comparación con aquellos que no lo hicieron (figura).
|
Cambios electrocardiográficos asociados al desarrollo de captación gammagráfica en portadores de variantes patogénicas de amiloidosis hereditaria |
||||
|
Cohorte (N = 40) |
Sin captación (N = 34) |
Captación grado 1-3 (N = 6) |
p |
|
|
Δ intervalo PR (ms) |
-0,5 [-8,5 a 5] |
-0,5 [-8 a 4] |
2 [-11 a 9] |
0,547 |
|
Δ duración complejo QRS (ms) |
1 [-2 a 6] |
1 [-2 a 6] |
0 [-3 a 7] |
0,846 |
|
Δ voltaje del QRS en I (mVx10-1) |
-1 [-1 a 1] |
-1 [-1 a 1] |
-1 [-3 a 1] |
0,582 |
|
Δ voltaje del QRS en II (mVx10-1) |
0 [-1 a 2] |
0,5 [-1 a 2] |
-1 [-1 a 6] |
0,928 |
|
Δ voltaje del QRS en III (mVx10-1) |
-0,5 [-2 a 2] |
-1 [-2 a 2] |
2 [-3 a 5] |
0,373 |
|
Δ voltaje del QRS en aVR (mVx10-1) |
0 [-1 a 1] |
0 [0 a 1] |
-0,5 [-1 a 2] |
0,595 |
|
Δ voltaje del QRS en aVL (mVx10-1) |
0 [-1 a 1] |
0 [-1 a 1] |
-1 [-0,5 a 1] |
0,706 |
|
Δ voltaje del QRS en aVF (mVx10-1) |
0 [-1 a 1] |
0 [-1 a 1] |
0 [0 a 5] |
0,689 |
|
Δ voltaje del QRS en V1 (mVx10-1) |
0 [-2 a 1] |
0 [-2 a 1] |
-0,5 [-2 a 0] |
0,792 |
|
Δ voltaje del QRS en V2 (mVx10-1) |
-1 [-3 a 1,5] |
-1 [-3 a 2] |
-1,5 [-3 a -1] |
0,514 |
|
Δ voltaje del QRS en V3 (mVx10-1) |
0 [-3,5 a 1] |
0 [-2 a 2] |
-2,5 [-8 a -1] |
0,025 |
|
Δ voltaje del QRS en V4 (mVx10-1) |
0 [-1,5 a 1,5] |
0 [-2 a 2] |
-1 [-1 a -1] |
0,216 |
|
Δ voltaje del QRS en V5 (mVx10-1) |
0 [-1 a 1,5] |
0,5[-1 a 2] |
-1 [-3 a 0] |
0,08 |
|
Δ voltaje del QRS en V6 (mVx10-1) |
0,5 [-2 a 2] |
0,5 [-1 a 2] |
0,5 [-4 a 1] |
0,334 |
|
Δ suma de los voltajes del QRS de las derivaciones de miembros (mVx10-1) |
-2,5 [-4 a 5,5] |
-2,5 [-4 a 5] |
0 [-8 a 15] |
0,098 |
|
Δ suma de los voltajes del QRS de las derivaciones precordiales (mVx10-1) |
-0,5 [-9 a 3] |
1 [-8 a 3] |
-11 [-20 a 0] |
0,047 |
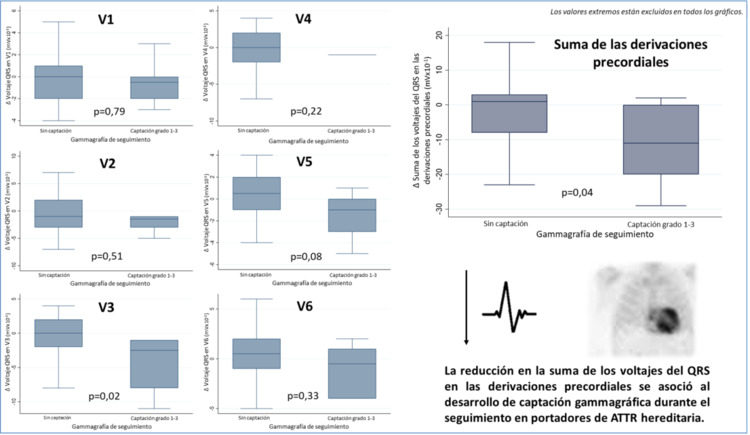
Variación del voltaje del QRS en las derivaciones precordiales en función del desarrollo de captación gammagráfica.
Conclusiones: La disminución en la suma de los voltajes del QRS de las derivaciones precordiales en el electrocardiograma podría constituir un potencial indicador temprano del desarrollo de amiloidosis cardiaca en portadores asintomáticos de mutaciones en el gen TTR. Serán necesarios estudios a mayor escala para confirmar estos hallazgos y validar su utilidad clínica.
Comunicaciones disponibles de "4022. Comunicaciones en amiloidosis y muerte súbita"
- 4022-1. Modera
- Rebeca Lorca Gutiérrez, Hospital Universitario Central de Asturias, Oviedo
- 4022-2. Cambios electrocardiográficos en portadores asintomáticos de ATTRv que desarrollan amiloidosis cardiaca por transtirretina
- Belén Peiró Aventín1, Aldostefano Porcari2, Nerea Mora Ayestarán1, Daniel de Castro Campos1, Fernando Domínguez Rodríguez1, Marianna Fontana2, Esther González López1, Julian D. Gillmore2 y Pablo García Pavía1
1Unidad de Cardiopatías Familiares, Servicio de Cardiología. Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España y 2National Amyloidosis Centre, Division of Medicine. University College London, London (Reino Unido).
- 4022-3. Cambios morfofuncionales, tisulares y de captación cardiaca mediante imagen de resonancia magnética y gammagrafía cardiaca en amiloidosis ATTR hereditaria tras un año de tratamiento con un silenciador génico
- José Ángel Urbano Moral1, Rocío Eiros Bachiller2, José López Aguilera3, Ainhoa Robles Mezcua4, Ana María González González5, Alberto de los Santos Moreno6, María Martín Istillarty1, Miguel Sánchez Torrente7, José Manuel García Pinilla4, Sara Martín Aguilar7, Lucía Couso Costas1 y Juan Carlos Fernández Guerrero1
1Servicio de Cardiología. Hospital Universitario de Jaén, Jaén, España, 2Servicio de Cardiología. Hospital Universitario de Salamanca, Salamanca, España, 3Servicio de Cardiología. Hospital Universitario Reina Sofía, Córdoba, España, 4Servicio de Cardiología. Hospital Clínico Universitario Virgen de la Victoria, Málaga, España, 5Servicio de Cardiología. Hospital Regional Universitario de Málaga, Málaga, España, 6Servicio de Medicina Interna. Hospital Universitario Puerta del Mar, Cádiz, España y 7Servicio de Medicina Nuclear. Hospital Universitario de Jaén, Jaén, España.
- 4022-4. Nuevos biomarcadores séricos para la evaluación del pronóstico de los pacientes con amiloidosis cardiaca por transtirretina
- Belén Peiró Aventín1, Elena Revuelta-López2, Dimitros Bampatsias3, Sergio Teruya3, Rosa María Carmona Canorea4, Manuel Alejandro Fernández Rojo4, Ana Royuela5, Ahmad Masri6, Mathew S. Maurer3, Julio Núñez Villota7, Antoni Bayés Genís2 y Pablo García Pavía1
1Unidad de Cardiopatías Familiares, Servicio de Cardiología. Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España, 2Unidad de Insuficiencia Cardiaca, Servicio de Cardiología. Hospital Universitari Germans Trias i Pujol, Badalona (Barcelona), España, 3Clinical Cardiovascular Research Laboratory for the Elderly (CCRLE). New York-Presbyterian/Columbia University Irving Medical Center, New York (Estados Unidos), 4Centro Nacional de Investigaciones Cardiovasculares (CNIC), Madrid, España, 5Bioestadística Clínica, Instituto de Investigación Sanitaria Puerta de Hierro (IDIPHISA). Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), España, 6Hypertrophic Cardiomyopathy Center, Knight Cardiovascular Institute. Oregon Health and Science University, Portland (Estados Unidos) y 7Servicio de Cardiología. Hospital Clínico Universitario de Valencia, Valencia, España.
Más comunicaciones de los autores
-
de Castro Campos, Daniel
- 5002-9 - Impacto clínico del estudio y consejo genético en familiares de pacientes con amiloidosis TTR hereditaria
- 6113-13 - Impacto del upgrade a terapia de resincronización cardiaca o estimulación de rama izquierda en pacientes con amiloidosis cardiaca por transtirretina
- 6072-459 - Prevalencia e impacto pronóstico de la concentración urinaria de sodio y cloro en pacientes con insuficiencia cardiaca aguda
- 5017-5 - Prevalencia e impacto pronóstico de la hipocloremia en pacientes con insuficiencia cardiaca aguda
- 4022-2 - Cambios electrocardiográficos en portadores asintomáticos de ATTRv que desarrollan amiloidosis cardiaca por transtirretina
- 6011-70 - Prevalencia e impacto pronóstico de la obstrucción ventricular en amiloidosis cardiaca por transtirretina
-
Domínguez Rodríguez, Fernando
- 5002-7 - Genotipos de alto riesgo en miocardiopatía dilatada: más allá de las arritmias
- 5023-9 - Pauta corta de corticoide sistémico en la pericarditis aguda: una alternativa en casos refractarios
- 4008-7 - Cohorte nacional de sospecha de miocarditis Pre-MYO: manejo asistencial en los 100 primeros casos
- 6113-13 - Impacto del upgrade a terapia de resincronización cardiaca o estimulación de rama izquierda en pacientes con amiloidosis cardiaca por transtirretina
- 6019-114 - Cohorte nacional de sospecha de miocarditis Pre-MYO: características basales de los 100 primeros casos
- 4022-2 - Cambios electrocardiográficos en portadores asintomáticos de ATTRv que desarrollan amiloidosis cardiaca por transtirretina
- 6113-16 - Diseño y justificación de la creación de una plataforma nacional multicéntrica para el estudio de la enfermedad inflamatoria del miocardio: cohorte Pre-MYO
- 5002-9 - Impacto clínico del estudio y consejo genético en familiares de pacientes con amiloidosis TTR hereditaria
- 6011-70 - Prevalencia e impacto pronóstico de la obstrucción ventricular en amiloidosis cardiaca por transtirretina
- Fontana, Marianna
-
García Pavía, Pablo
- 6113-13 - Impacto del upgrade a terapia de resincronización cardiaca o estimulación de rama izquierda en pacientes con amiloidosis cardiaca por transtirretina
- 5002-9 - Impacto clínico del estudio y consejo genético en familiares de pacientes con amiloidosis TTR hereditaria
- 5023-9 - Pauta corta de corticoide sistémico en la pericarditis aguda: una alternativa en casos refractarios
- 5002-7 - Genotipos de alto riesgo en miocardiopatía dilatada: más allá de las arritmias
- 6072-459 - Prevalencia e impacto pronóstico de la concentración urinaria de sodio y cloro en pacientes con insuficiencia cardiaca aguda
- 4022-4 - Nuevos biomarcadores séricos para la evaluación del pronóstico de los pacientes con amiloidosis cardiaca por transtirretina
- 5017-5 - Prevalencia e impacto pronóstico de la hipocloremia en pacientes con insuficiencia cardiaca aguda
- 4022-2 - Cambios electrocardiográficos en portadores asintomáticos de ATTRv que desarrollan amiloidosis cardiaca por transtirretina
- 6011-70 - Prevalencia e impacto pronóstico de la obstrucción ventricular en amiloidosis cardiaca por transtirretina
- Gillmore, Julian D.
-
González López, Esther
- 5002-9 - Impacto clínico del estudio y consejo genético en familiares de pacientes con amiloidosis TTR hereditaria
- 6113-13 - Impacto del upgrade a terapia de resincronización cardiaca o estimulación de rama izquierda en pacientes con amiloidosis cardiaca por transtirretina
- 6011-67 - ¿Podemos mejorar la detección precoz de arritmias en amiloidosis cardiaca por transtirretina?
- 6011-70 - Prevalencia e impacto pronóstico de la obstrucción ventricular en amiloidosis cardiaca por transtirretina
- 4022-2 - Cambios electrocardiográficos en portadores asintomáticos de ATTRv que desarrollan amiloidosis cardiaca por transtirretina
-
Mora Ayestarán, Nerea
- 5002-9 - Impacto clínico del estudio y consejo genético en familiares de pacientes con amiloidosis TTR hereditaria
- 6113-13 - Impacto del upgrade a terapia de resincronización cardiaca o estimulación de rama izquierda en pacientes con amiloidosis cardiaca por transtirretina
- 5002-7 - Genotipos de alto riesgo en miocardiopatía dilatada: más allá de las arritmias
- 4022-2 - Cambios electrocardiográficos en portadores asintomáticos de ATTRv que desarrollan amiloidosis cardiaca por transtirretina
- 6011-67 - ¿Podemos mejorar la detección precoz de arritmias en amiloidosis cardiaca por transtirretina?
- 6011-70 - Prevalencia e impacto pronóstico de la obstrucción ventricular en amiloidosis cardiaca por transtirretina
-
Peiró Aventín, Belén
- 6113-13 - Impacto del upgrade a terapia de resincronización cardiaca o estimulación de rama izquierda en pacientes con amiloidosis cardiaca por transtirretina
- 4022-4 - Nuevos biomarcadores séricos para la evaluación del pronóstico de los pacientes con amiloidosis cardiaca por transtirretina
- 5002-9 - Impacto clínico del estudio y consejo genético en familiares de pacientes con amiloidosis TTR hereditaria
- 6011-70 - Prevalencia e impacto pronóstico de la obstrucción ventricular en amiloidosis cardiaca por transtirretina
- 6018-92 - Fiebre o febrícula pos-TAVI, seguimiento a largo plazo
- 4022-2 - Cambios electrocardiográficos en portadores asintomáticos de ATTRv que desarrollan amiloidosis cardiaca por transtirretina
- Porcari, Aldostefano
