SEC 2024 - El Congreso de la Salud Cardiovascular
Introducción
Dr. José María de la Torre Hernández
Presidente del Comité Científico del Congreso. Vicepresidente de la SEC
Comités ejecutivo, organizador y científico
Comité de evaluadores
Listado completo de comunicaciones
Índice de autores
6043. Dispositivos de asistencia circulatoria de corta duración
6043-289. ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
Hospital Clínico Universitario de Valladolid, Valladolid, España.
Introducción y objetivos: El soporte con membrana de oxigenación extracorpórea venoarterial (ECMO-VA) es una terapia utilizada en estadios avanzados de shock cardiogénico, entre ellos en la parada cardiorrespiratoria (EPCR) refractaria. El objetivo del presente estudio es analizar si existen características diferenciales de este subgrupo en cuanto a presentación clínica y evolución.
Métodos: Estudio descriptivo, retrospectivo y unicéntrico que incluye de forma consecutiva todos los pacientes que precisaron soporte con ECMO-VA entre 2021 y 2023 en nuestro centro, excluyendo los pacientes con shock poscardiotomía.
Resultados: Se incluyeron 78 pacientes, el 35,9% (N = 28) fueron EPCR (mayoritariamente intrahospitalaria). Las características basales se muestran en la tabla. La etiología más frecuente fue el síndrome coronario agudo (42,9 vs 48,0%, p = 0,662), mientras que la insuficiencia cardiaca agudizada fue más frecuente en no-EPCR (16,0 vs 0%, p = 0,045). El acceso mayoritario fue el femoral (superior al 90% en ambos), aunque se utilizó el acceso axilar en el 6,1% de los pacientes no-EPCR y en ninguno de los EPCR. A pesar de ello, la línea de perfusión distal (LPD) fue numéricamente más frecuente en no-EPCR (78,0 vs 63,0%, p = 0,157) aunque no se alcanzó la significación estadística. Además, la LPD se implantó de forma diferida solo en el 28,6% de los no-EPCR frente a un 45,0% en EPCR (p = 0,201). Los dispositivos de descarga ventricular fueron más frecuentes en EPCR (60,7 vs 48,9%, p = 0,321), siendo mayoritariamente balón de contrapulsación. La incidencia de complicaciones durante el soporte fue similar (69,2 vs 63,3%, p = 0,605), sin diferencias tampoco según el tipo de complicación (figura A). La tasa de recuperación de la función ventricular fue significativamente superior en no-EPCR (53,1 vs 25,0%, p = 0,017). Las tasas de destete y necesidad de otros soportes o terapia de reemplazo cardiaco se muestran en la tabla. La mortalidad intrahospitalaria fue significativamente mayor en EPCR (75,0 vs 44,9%, p = 0,011). La figura B muestra las causas del fallecimiento en ambos grupos.
|
Análisis comparativo de los dos grupos a estudio |
||||
|
Global (n = 78) |
EPCR (n = 28) |
No-ECPR (n = 50) |
p |
|
|
Edad (años) |
59,6 |
61,60 |
58,48 |
0,167 |
|
Sexo masculino |
62 (79,5%) |
25 (89,3%) |
37 (74%) |
0,109 |
|
Causa de shock: SCA |
36 (46,2%) |
12 (42,9%) |
24 (48,0%) |
0,662 |
|
Causa de shock: IC crónica reagudizada |
8 (10,3%) |
0 (0,0%) |
8 (16,0%) |
0,045* |
|
Canulación femoral |
73 (94,8%) |
27 (96,4%) |
46 (93,9%) |
|
|
LPD |
56 (72,7%) |
17 (63,0%) |
39 (78,0%) |
0,157 |
|
Implante LPD diferida |
21 (33,9%) |
9 (45,0%) |
12 (28,6%) |
0,201 |
|
Complicación durante el soporte |
49 (65,3%) |
18 (69,2%) |
31 (63,3%) |
0,605 |
|
Complicación vascular grave |
18 (24,0%) |
6 (23,1%) |
12 (24,5%) |
0,892 |
|
Politransfusión |
33 (44,0%) |
13 (50,0%) |
20 (40,8%) |
0,446 |
|
Complicación neurológica |
24 (32,0%) |
9 (34,6%) |
15 (30,6%) |
0,724 |
|
Recuperación cardiaca |
33 (42,9%) |
7 (25%) |
26 (53,1%) |
0,017* |
|
Destete |
49 (69,0%) |
16 (66,7%) |
33 (70,2%) |
0,760 |
|
Puente a otra asistencia |
7 (10,1%) |
3 (12,5%) |
4 (8,9%) |
0,687 |
|
Puente a trasplante |
6 (8,7%) |
3 (12,5%) |
3 (6,7%) |
0,412 |
|
Dispositivo de descarga ventricular |
41 (53,2%) |
17 (60,7%) |
24 (49%) |
0,321 |
|
Mortalidad intrahospitalaria |
43 (55,8%) |
21 (75%) |
49 (44,9%) |
0,011* |
|
EPCR: implante de ECMO en parada cardiorrespiratoria. SCA: síndrome coronario agudo. IC: insuficiencia cardiaca. LPD: línea de perfusión periférica. |
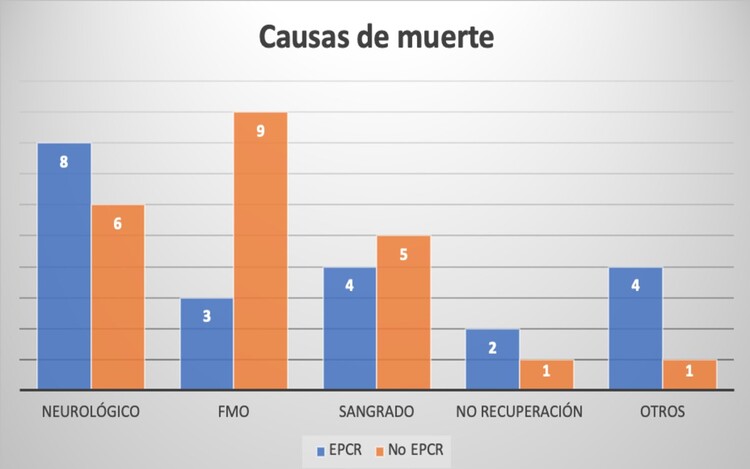
Se observan los valores absolutos de causas de mortalidad de cada grupo. FMO: fracaso multiorgánico. EPCR: implante de ECMO en parada cardiorrespiratoria.
Conclusiones: En nuestra cohorte, los pacientes con EPCR no tuvieron más tasa de complicaciones relacionadas con el soporte incluyendo las vasculares (23,1 vs 24,5%, p = 0,892) o el sangrado que requiriese politransfusión (40,8 vs 50,0%, p = 0,446), pero sí mayor mortalidad condicionada fundamentalmente por el daño neurológico.
Comunicaciones disponibles de "6043. Dispositivos de asistencia circulatoria de corta duración"
- 6043-282. Función renal y pronóstico a 6 y 12 meses en pacientes ingresados por shock cardiogénico con necesidad de soporte circulatorio mecánico de corta duración
- Álvaro Luis Gamarra Lobato, Jorge Salamanca Viloria, Pablo Díez Villanueva, Río Jorge Aguilar Torres, Jorge Vázquez López-Ibor, Sofía Cuenca Parra, Fernando Rivero Crespo, Teresa Bastante Valiente, Javier Cuesta Cuesta, David del Val Martín, Juan Perich Krsnik y Fernando Alfonso Manterola
Servicio de Cardiología. Hospital Universitario de la Princesa, Madrid, España.
- 6043-283. Desarrollo de un programa de soporte circulatorio en un hospital terciario no trasplantador: experiencia inicial
- Mireia Llevadot Sesmilo, Elena Collado Lledó, Santiago Montero Aradas, Nabil El Ouaddi Azzaytouni, Ferrán Rueda Sobella, Daniel Casquete Sánchez, Carlos Labata Salvador, Marc Ferrer Massot, Teresa Oliveras Vilà, Antoni Bayés Genís y Cosme García García
Cardiología. Hospital Universitari Germans Trias i Pujol, Badalona (Barcelona), España.
- 6043-284. Experiencia de soporte circulatorio con Impella en intervencionismo percutáneo de alto riesgo y shock cardiogénico
- Angie Tatiana Ariza Mosquera1, Fernando Sabatel-Pérez1, Ana Guerra-Librero2, Teresa Gil-Jiménez1, Manuel López-Pérez1, Gerardo Moreno-Terribas1 y Juan Caballero-Borrego1
1Cardiología. Hospital Clínico San Cecilio, Granada, España y 2Fundación para la Investigación Biosanitaria en Andalucía Oriental (FIBAO), Granada, España.
- 6043-285. Papel de la ecocardiografía transesofágica durante el destete de la membrana de oxigenación extracorpórea venoarterial: resultados de nuestro protocolo tras más de 10 años de experiencia
- Joffrey Eduardo Luján Valencia, José M. Cuesta Cosgaya, Marta Ruiz Lera y Virginia Burgos Palacios
Hospital Universitario Marqués de Valdecilla, Santander (Cantabria), España.
- 6043-286. Papel de la espectrofotometría cercana al infrarrojo en la detección de complicaciones vasculares en extremidades tras implante de soporte de oxigenación extracorpórea venoarterial tras shock cardiogénico: resultados de nuestro protocolo de actuación
- Joffrey Eduardo Luján Valencia, José Aurelio Sarralde Aguayo, J. Francisco Nistal Herrera y Ángela Canteli Álvarez
Hospital Universitario Marqués de Valdecilla, Santander (Cantabria), España.
- 6043-287. Complicaciones infecciosas en pacientes con ECMO-VA periférico de canulación percutánea: ¿ventaja o desventaja?
- Joaquín Vila García1, Emilio Arbas Redondo1, Alejandro Lara García1, Sandra Rosillo Rodríguez1, Lucía Canales Muñoz1, Juan Caro Codón1, Clara Ugueto Rodrigo1, Jesús Saldaña García1, Ricardo Martínez González1, Ana Torremocha López1, Pablo Merás Colunga1, Carlos Merino Argos1, Belén Loeches Yagüe2, Eduardo R. Armada Romero1 y José Raúl Moreno Gómez1
1Servicio de Cardiología y 2Unidad de Enfermedades Infecciosas. Hospital Universitario La Paz, Madrid, España.
- 6043-288. ECMO venoarterial en shock poscardiotomía y parada refractaria. ¿De mal en peor?
- Andrea Oña Orive, Sara Martín Paniagua, Mario García Fernández, Julio Ruiz Ruiz, Javier Tobar Ruíz, Alexander Stepanenko, Gonzalo Cabezón Villalba, Raquel Ramos Martínez, Gemma Pastor Báez, Alfredo García Cabello, J. Alberto San Román y María Plaza Martín
Servicio de Cardiología. Hospital Clínico Universitario de Valladolid, Valladolid, España.
- 6043-289. ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- María Plaza Martín, Andrea Oña Orive, Sara Martín Paniagua, David Carnicero Martínez, Ana Alicia Alañón Hernández, Javier Tobar Ruíz, Alexander Stepanenko, Gonzalo Cabezón Villalba, Raquel Ramos Martínez, Gemma Pastor Báez, Alfredo García Cabello y J. Alberto San Román
Hospital Clínico Universitario de Valladolid, Valladolid, España.
Más comunicaciones de los autores
-
Alañón Hernández, Ana Alicia
- 5010-3 - ¿Existen diferencias en función del sexo en los pacientes que precisan soporte con ECMO venoarterial?
- 6061-392 - ¿Debemos incluir el análisis del calcio valvular aórtico en los pacientes estudiados por dolor torácico mediante tomografía cardiaca computarizada?
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 6105-6 - Coronariografía urgente y asistencia circulatoria: comparación entre Impella, ECMO-VA y balón de contrapulsación (BCIAo)
-
Cabezón Villalba, Gonzalo
- 6043-288 - ECMO venoarterial en shock poscardiotomía y parada refractaria. ¿De mal en peor?
- 6069-438 - ¿Es la escala SOFA un predictor de mortalidad en el postrasplante inmediato de los pacientes con dispositivo de asistencia circulatoria de corta-media duración?
- 6105-6 - Coronariografía urgente y asistencia circulatoria: comparación entre Impella, ECMO-VA y balón de contrapulsación (BCIAo)
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 5010-3 - ¿Existen diferencias en función del sexo en los pacientes que precisan soporte con ECMO venoarterial?
- 6012-79 - Endocarditis infecciosa sobre válvula izquierda nativa. Predictores de insuficiencia cardiaca en pacientes con insuficiencia valvular grave y su pronóstico
- 5010-4 - Resultados a 5 años de un programa ECMO móvil interprovincial
- 5010-10 - Estrategia de Impella de alto flujo (5,0 y 5,5) como puente a trasplante
-
Carnicero Martínez, David
- 6061-392 - ¿Debemos incluir el análisis del calcio valvular aórtico en los pacientes estudiados por dolor torácico mediante tomografía cardiaca computarizada?
- 6069-438 - ¿Es la escala SOFA un predictor de mortalidad en el postrasplante inmediato de los pacientes con dispositivo de asistencia circulatoria de corta-media duración?
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 5010-4 - Resultados a 5 años de un programa ECMO móvil interprovincial
- 6105-6 - Coronariografía urgente y asistencia circulatoria: comparación entre Impella, ECMO-VA y balón de contrapulsación (BCIAo)
- 5010-5 - Efecto hemodinámico del soporte circulatorio durante el traslado primario con ECMO-VA. Experiencia unicéntrica del programa "ECMO-móvil"
- 5010-3 - ¿Existen diferencias en función del sexo en los pacientes que precisan soporte con ECMO venoarterial?
- 5010-10 - Estrategia de Impella de alto flujo (5,0 y 5,5) como puente a trasplante
- 5006-8 - Resultados a corto plazo y análisis del leak residual tras implante de dispositivo OMEGA en el cierre de orejuela de aurícula izquierda
- 5009-5 - Fisiología de la arteria donante antes y después de CTO-PCI: QFR versus FFR
-
García Cabello, Alfredo
- 5010-10 - Estrategia de Impella de alto flujo (5,0 y 5,5) como puente a trasplante
- 6043-288 - ECMO venoarterial en shock poscardiotomía y parada refractaria. ¿De mal en peor?
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 5010-5 - Efecto hemodinámico del soporte circulatorio durante el traslado primario con ECMO-VA. Experiencia unicéntrica del programa "ECMO-móvil"
-
Martín Paniagua, Sara
- 5010-10 - Estrategia de Impella de alto flujo (5,0 y 5,5) como puente a trasplante
- 5010-3 - ¿Existen diferencias en función del sexo en los pacientes que precisan soporte con ECMO venoarterial?
- 6105-6 - Coronariografía urgente y asistencia circulatoria: comparación entre Impella, ECMO-VA y balón de contrapulsación (BCIAo)
- 5010-4 - Resultados a 5 años de un programa ECMO móvil interprovincial
- 6043-288 - ECMO venoarterial en shock poscardiotomía y parada refractaria. ¿De mal en peor?
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 6069-438 - ¿Es la escala SOFA un predictor de mortalidad en el postrasplante inmediato de los pacientes con dispositivo de asistencia circulatoria de corta-media duración?
- 6122-8 - Insuficiencia cardiaca aguda: más allá de los ensayos un análisis de supervivencia en la vida real
- 6061-392 - ¿Debemos incluir el análisis del calcio valvular aórtico en los pacientes estudiados por dolor torácico mediante tomografía cardiaca computarizada?
- 6007-40 - Características de los pacientes ingresados por insuficiencia cardiaca en los servicios de cardiología de hospitales de Castilla y León de acuerdo con su nivel de comorbilidad/complejidad y cómo influye este en la supervivencia libre de eventos
-
Oña Orive, Andrea
- 6111-11 - Análisis retrospectivo del papel de la cirugía en la endocarditis protésica precoz
- 6111-8 - Evolución temporal del perfil clínico y pronóstico de los pacientes con endocarditis infecciosa y hemocultivos persistentemente positivos en los últimos 25 años: la importancia de la cirugía precoz
- 5010-3 - ¿Existen diferencias en función del sexo en los pacientes que precisan soporte con ECMO venoarterial?
- 6105-6 - Coronariografía urgente y asistencia circulatoria: comparación entre Impella, ECMO-VA y balón de contrapulsación (BCIAo)
- 6043-288 - ECMO venoarterial en shock poscardiotomía y parada refractaria. ¿De mal en peor?
- 5023-2 - La escala CHA2DS2-VASc como predictora de mortalidad hospitalaria y eventos embólicos en la endocarditis infecciosa definitiva izquierda
- 6012-79 - Endocarditis infecciosa sobre válvula izquierda nativa. Predictores de insuficiencia cardiaca en pacientes con insuficiencia valvular grave y su pronóstico
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 6061-392 - ¿Debemos incluir el análisis del calcio valvular aórtico en los pacientes estudiados por dolor torácico mediante tomografía cardiaca computarizada?
- 6111-7 - Factores predictivos e impacto pronóstico del fracaso renal agudo en la endocarditis infecciosa: un estudio comparativo
-
Pastor Báez, Gemma
- 5015-1 - Modera
- 6043-288 - ECMO venoarterial en shock poscardiotomía y parada refractaria. ¿De mal en peor?
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 5010-5 - Efecto hemodinámico del soporte circulatorio durante el traslado primario con ECMO-VA. Experiencia unicéntrica del programa "ECMO-móvil"
- 5010-3 - ¿Existen diferencias en función del sexo en los pacientes que precisan soporte con ECMO venoarterial?
- 5010-10 - Estrategia de Impella de alto flujo (5,0 y 5,5) como puente a trasplante
-
Plaza Martín, María
- 6043-288 - ECMO venoarterial en shock poscardiotomía y parada refractaria. ¿De mal en peor?
- 6105-6 - Coronariografía urgente y asistencia circulatoria: comparación entre Impella, ECMO-VA y balón de contrapulsación (BCIAo)
- 5010-5 - Efecto hemodinámico del soporte circulatorio durante el traslado primario con ECMO-VA. Experiencia unicéntrica del programa "ECMO-móvil"
- 6069-438 - ¿Es la escala SOFA un predictor de mortalidad en el postrasplante inmediato de los pacientes con dispositivo de asistencia circulatoria de corta-media duración?
- 5010-3 - ¿Existen diferencias en función del sexo en los pacientes que precisan soporte con ECMO venoarterial?
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 5010-4 - Resultados a 5 años de un programa ECMO móvil interprovincial
- 5010-10 - Estrategia de Impella de alto flujo (5,0 y 5,5) como puente a trasplante
-
Ramos Martínez, Raquel
- 5010-10 - Estrategia de Impella de alto flujo (5,0 y 5,5) como puente a trasplante
- 5010-3 - ¿Existen diferencias en función del sexo en los pacientes que precisan soporte con ECMO venoarterial?
- 5010-5 - Efecto hemodinámico del soporte circulatorio durante el traslado primario con ECMO-VA. Experiencia unicéntrica del programa "ECMO-móvil"
- 6043-288 - ECMO venoarterial en shock poscardiotomía y parada refractaria. ¿De mal en peor?
- 5010-4 - Resultados a 5 años de un programa ECMO móvil interprovincial
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 6069-438 - ¿Es la escala SOFA un predictor de mortalidad en el postrasplante inmediato de los pacientes con dispositivo de asistencia circulatoria de corta-media duración?
- 6105-6 - Coronariografía urgente y asistencia circulatoria: comparación entre Impella, ECMO-VA y balón de contrapulsación (BCIAo)
-
San Román Calvar, José Alberto
- 5016-9 - Remodelado del ventrículo derecho con o sin disfunción sistólica asociada en pacientes con insuficiencia tricuspídea grave. Impacto pronóstico
- 4003- 6 - ¿Importa el grado de insuficiencia tricuspídea dentro de los pacientes con IT grave?
- 5006-8 - Resultados a corto plazo y análisis del leak residual tras implante de dispositivo OMEGA en el cierre de orejuela de aurícula izquierda
- 5010-10 - Estrategia de Impella de alto flujo (5,0 y 5,5) como puente a trasplante
- 6111-11 - Análisis retrospectivo del papel de la cirugía en la endocarditis protésica precoz
- 5014-8 - Valor pronóstico del acoplamiento ventrículo-arterial en la insuficiencia tricuspídea funcional grave. IT atriogénica vs IT ventricular
- 6111-8 - Evolución temporal del perfil clínico y pronóstico de los pacientes con endocarditis infecciosa y hemocultivos persistentemente positivos en los últimos 25 años: la importancia de la cirugía precoz
- 5010-3 - ¿Existen diferencias en función del sexo en los pacientes que precisan soporte con ECMO venoarterial?
- 5010-5 - Efecto hemodinámico del soporte circulatorio durante el traslado primario con ECMO-VA. Experiencia unicéntrica del programa "ECMO-móvil"
- 6105-6 - Coronariografía urgente y asistencia circulatoria: comparación entre Impella, ECMO-VA y balón de contrapulsación (BCIAo)
- 4001-2 - ¿Está relacionada la etiología de la insuficiencia tricuspídea grave con el pronóstico?
- 4014-7 - Valor pronóstico del tiempo de tránsito pulmonar y sistémico medido por resonancia cardiaca en pacientes con disfunción ventricular
- 6111-7 - Factores predictivos e impacto pronóstico del fracaso renal agudo en la endocarditis infecciosa: un estudio comparativo
- 5009-5 - Fisiología de la arteria donante antes y después de CTO-PCI: QFR versus FFR
- 5009-9 - Valor pronóstico del volumen global de placa en pacientes sin enfermedad coronaria significativa
- 5010-4 - Resultados a 5 años de un programa ECMO móvil interprovincial
- 6111-2 - Un nuevo sistema de clasificación de la insuficiencia cardiaca derecha en pacientes con insuficiencia tricuspídea grave. Implicaciones pronósticas
- 6111-9 - Análisis de la infección no controlada en la endocarditis infecciosa. Prevalencia, importancia pronóstica y papel de la cirugía cardiaca
- 4003-2 - Registro multicéntrico español de pacientes con insuficiencia tricuspídea grave. Resultados a 1 año
- 4001-5 - Tratamiento quirúrgico versus percutáneo en pacientes con enfermedad coronaria y estenosis aórtica grave concomitantes: registro nacional
- 4003-3 - Insuficiencia tricuspídea atriogénica. Resultados en el seguimiento a un año e impacto pronóstico
- 5023-2 - La escala CHA2DS2-VASc como predictora de mortalidad hospitalaria y eventos embólicos en la endocarditis infecciosa definitiva izquierda
- 6012-79 - Endocarditis infecciosa sobre válvula izquierda nativa. Predictores de insuficiencia cardiaca en pacientes con insuficiencia valvular grave y su pronóstico
- 6030-192 - Perfil clínico de pacientes con insuficiencia tricuspídea grave sometidos a intervenciones sobre la válvula tricuspídea
- 5018-6 - Impacto pronóstico de la insuficiencia cardiaca como indicación de intervención en la estenosis aórtica grave
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 6012-81 - Resultados a largo plazo de la insuficiencia tricuspídea grave en una población sometida a manejo médico. Revisión de una cohorte histórica
- 6085-513 - Impacto clínico y pronóstico de la fibrilación auricular en la estenosis aórtica grave aislada intervenida
- 6061-392 - ¿Debemos incluir el análisis del calcio valvular aórtico en los pacientes estudiados por dolor torácico mediante tomografía cardiaca computarizada?
- 5018-7 - La insuficiencia cardiaca tras el recambio valvular en la estenosis aórtica grave es un predictor de mal pronóstico
- 6043-288 - ECMO venoarterial en shock poscardiotomía y parada refractaria. ¿De mal en peor?
-
Stepanenko, Alexander
- 5010-4 - Resultados a 5 años de un programa ECMO móvil interprovincial
- 6043-288 - ECMO venoarterial en shock poscardiotomía y parada refractaria. ¿De mal en peor?
- 5010-3 - ¿Existen diferencias en función del sexo en los pacientes que precisan soporte con ECMO venoarterial?
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 5010-10 - Estrategia de Impella de alto flujo (5,0 y 5,5) como puente a trasplante
- 5010-5 - Efecto hemodinámico del soporte circulatorio durante el traslado primario con ECMO-VA. Experiencia unicéntrica del programa "ECMO-móvil"
-
Tobar Ruíz, Javier
- 6069-438 - ¿Es la escala SOFA un predictor de mortalidad en el postrasplante inmediato de los pacientes con dispositivo de asistencia circulatoria de corta-media duración?
- 6122-8 - Insuficiencia cardiaca aguda: más allá de los ensayos un análisis de supervivencia en la vida real
- 6043-288 - ECMO venoarterial en shock poscardiotomía y parada refractaria. ¿De mal en peor?
- 6043-289 - ECMO venoarterial en parada refractaria, ¿cuáles son las diferencias?
- 6007-40 - Características de los pacientes ingresados por insuficiencia cardiaca en los servicios de cardiología de hospitales de Castilla y León de acuerdo con su nivel de comorbilidad/complejidad y cómo influye este en la supervivencia libre de eventos
- 6105-6 - Coronariografía urgente y asistencia circulatoria: comparación entre Impella, ECMO-VA y balón de contrapulsación (BCIAo)
- 5010-5 - Efecto hemodinámico del soporte circulatorio durante el traslado primario con ECMO-VA. Experiencia unicéntrica del programa "ECMO-móvil"
- 5010-3 - ¿Existen diferencias en función del sexo en los pacientes que precisan soporte con ECMO venoarterial?
- 5010-10 - Estrategia de Impella de alto flujo (5,0 y 5,5) como puente a trasplante
- 5010-4 - Resultados a 5 años de un programa ECMO móvil interprovincial
