El riesgo residual cardiovascular supone un reto clínico. Aunque queda mucho por descubrir en esto campo, cada vez tenemos más medios que nos permiten estimar la probabilidad de nuevos eventos cardiovasculares y abordarlo correctamente.
La medición general de parámetros lipídicos, inflamatorios, metabólicos y antropométricos, la consideración de todos los factores de riesgo y el abordaje integral de los pacientes con los tratamientos adecuados podrían ayudar a reducir el riesgo residual cardiovascular.
Palabras clave
El riesgo residual es aquel que permanece tras haber realizado todos los esfuerzos por eliminarlo, pero el riesgo residual cardiovascular se refiere a cuando los pacientes, después de alcanzar los valores óptimos de lipoproteínas de baja densidad (LDL), siguen teniendo la probabilidad, en mayor o menor medida, de tener otro evento cardiovascular1.
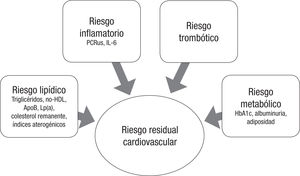
Este riesgo está determinado por diversos factores: los principales son los riesgos lipídico, inflamatorio, trombótico y metabólico. Por lo tanto, para abordar el riesgo residual del paciente, en primer lugar se debe estimar la posibilidad de que pueda sufrir otro evento isquémico y después cuáles son las estrategias terapéuticas que se puede utilizar para reducirlo.
ESTIMACIÓN DEL RIESGO RESIDUAL CARDIOVASCULARMedir el riesgo residual de cada paciente es un reto e incluso es utópico saber la «probabilidad real» de que en un paciente pueda producirse un nuevo evento cardiovascular, pero sí hay datos que ayudan a estimarlo.
El riesgo residual que muestran los estudiosLa reducción del LDL con diferentes tratamientos hipolipemiantes ha supuesto una reducción de los eventos cardiovasculares en todos perfiles de riesgo cardiovascular2, pero incluso en estudios recientes con tratamientos hipolipemiantes intensivos que combinan estatinas más inhibidores de la proproteína convertasa subtilisina/kexina 9 (iPCSK9)3,4 y/o ezetimiba3–5, en los cuales se han alcanzado cifras de LDL < 30 mg/dl con una reducción de los eventos cardiovasculares asociados, se mantiene un riesgo de nuevos eventos cardiovasculares.
Por lo tanto, existe un riesgo independientemente del LDL, pero no se puede olvidar que las condiciones de los estudios aleatorizados y observacionales no son la realidad de la práctica clínica. Los últimos registros de vida real demuestran que el control real del LDL en los pacientes con enfermedad cardiovascular no supera el 18%6, hecho que se debe abordar para reducir el riesgo cardiovascular global.
Los avances recientes en genética humana, junto con una gran cantidad de resultados de ensayos clínicos, preclínicos y epidemiológicos, brindan un fuerte respaldo para confirmar una asociación causal de los triglicéridos (TG) y las lipoproteínas ricas en TG con un mayor riesgo de eventos cardiovasculares. Por ello, estos datos también indican que pueden contribuir significativamente al riesgo cardiovascular residual en pacientes con terapia optimizada para reducir las LDL7.
En estudios contemporáneos como es el estudio poblacional de Copenhague8, con mas de 110.000 pacientes, se observó un aumento del riesgo cardiovascular asociado a las concentraciones plasmáticas de TG 4 veces mayor en los pacientes con TG > 440 mg/dl. En el Estudio PESA9, diseñado para evaluar la progresión ateroesclerótica precoz, se documentó que en el 73% de los pacientes con TG plasmáticos > 150 mg/dl presentaron enfermedad ateroesclerótica subclínica. En cuanto a las lipoproteínas ricas en TG, como es el colesterol remanente, se ha visto en diversos estudios que pueden aumentar el riesgo cardiovascular independientemente de la concentración de LDL10.
Desde el Framingham Heart Study sabemos que existe una relación inversa entre las cifras de lipoproteínas de alta densidad (HDL) y el aumento de la enfermedad coronaria11, incluso en personas con LDL < 100 mg/dl12. Pero los estudios que han probado tratamientos farmacológicos para aumentar las HDL no han sido exitosos. Quizá tiene más sentido entender la reducción del HDL como parte de la disfunción metabólica que se produce en la resistencia a la insulina y la obesidad, que da lugar a una dislipemia que se caracteriza por un aumento de los TG con valores de HDL bajos y LDL pequeñas y densas. Esto se produce por un aumento hepático de los TG que deben ser internalizados en las lipoproteínas, lo que da lugar a VLDL grandes que acabarán convirtiéndose en lipoproteínas más pequeñas y más densas que puedan albergar todos los TG. Además, el HDL se reduce porque se vuelve disfuncionante y es eliminado por el riñón13.
La lipoproteína (a) es otro factor lipídico que tener en cuenta, porque se ha demostrado que aumenta el riesgo cardiovascular independientemente del LDL14, así como el resto de factores de riesgo cardiovascular15, pues produce una disfunción metabólica similar a la dislipemia aterogénica16.
Existen diversos estudios que aportan datos suficientes para afirmar que la inflamación tiene un papel fundamental en toda la historia de la enfermedad ateroesclerótica, tanto en la patogénesis como en la progresión. Además, la inflamación residual está también muy relacionada con el riesgo residual lipídico; sabemos por los estudios que los TG elevados se asocian con inflamación de bajo grado que aumenta el riesgo cardiovascular, y se observa17 un aumento de proteína C reactiva en los pacientes con TG plasmáticos elevados. Es bien conocido que las enfermedades sistémicas, como la artritis reumatoide18 o la psoriasis19, producen estados inflamatorios que aumentan el riesgo cardiovascular y condicionan un peor pronóstico, como las infecciones u otros agentes como la contaminación ambiental20.
Se sabe por el estudio REACH21 que hay un riesgo residual isquémico en pacientes que han sufrido un evento cardiovascular agudo que llega a ser del 15% al cuarto año del evento e incluso más frecuentemente en las lesiones no culpables22, de ahí la importancia de valorar en conjunto todos los factores que influyen en el riesgo residual del paciente, incluidos los lipídicos, inflamatorios, trombóticos y metabólicos.
Instrumentos para medir o estimar el riesgo residualLos diferentes medios que pueden ayudar a medir el riesgo residual cardiovascular son fundamentalmente de tipo bioquímico y antropométrico o también con técnicas de imagen para evaluar la ateroesclerosis subclínica (figura 1).
Parámetros lipídicos: cuando se mide la concentración plasmática de LDL, esta se ciñe a la masa de LDL sin tener en cuenta diversos factores que pueden influir en la valoración del riesgo lipídico residual, además del perfil lipídico convencional (colesterol total, LDL, TG y HDL). La European Atheroesclerosis Society (EAS) y la European Federation of Clinical Chemistry and Laboratoy Medicine (EFLM) recomiendan las siguientes determinaciones23:
- •
El colesterol no-HDL (colesterol total – cHDL) estima la concentración plasmática de lipoproteínas aterogénicas; tal es así que en la última guía de práctica clínica de la Sociedad Europea de Cardiología sobre prevención cardiovascular se posiciona como variable lipídica que tener en cuenta en la estratificación del riesgo cardiovascular (SCORE2/SCORE2OP)24 y es objetivo de control secundario en valores < 85 mg/dl para los pacientes con muy alto riesgo cardiovascular.
- •
Apolipoproteína B (ApoB): su determinación ayuda a cuantificar la cantidad de lipoproteínas aterogénicas, por estar presente en todas ellas. Existen estudios en los que se demuestra que su elevación se relaciona con eventos cardiovasculares incluso con cLDL bajo25. En la última guía de prevención cardiovascular se propone como objetivo de control secundario en valores < 65 mg/dl para pacientes con muy alto riesgo cardiovascular24.
- •
Colesterol remanente: se puede determinar mediante cálculos estimados (colesterol total – cLDL-cHDL) o por método directo automatizado. Existen estudios que se lo han relacionado con un aumento del riesgo cardiovascular independientemente del LDL26.
- •
Lipoproteína (a): se recomienda su determinación alguna vez en la vida y su elevación se asocia con mayor probabilidad de eventos27.
- •
Índices aterogénicos: son cocientes que ayudan a estimar la presencia de lipoproteínas pequeñas y densas, útiles fundamentalmente para la evaluación de la dislipemia aterogénica28. Cuando el cociente TG/cHDL > 2 o el cLDL/ApoB es < 1,3, indica la presencia de estas partículas.
Parámetros inflamatorios: la determinación de marcadores inflamatorios está menos extendida en la práctica clínica habitual, aunque hay evidencia suficiente que muestra la relación entre la proteína C reactiva ultrasensible (PCRus) y los eventos cardiovasculares en pacientes con enfermedad cardiovascular establecida1. En el estudio FOURIER con evolocumab en pacientes con valores de LDL bajos, aquellos con PCRus elevadas tenían más riesgo cardiovascular29. La interleucina 6 es el precursor para la liberación de PCRus, se encuentra aumentada en procesos inflamatorios e infecciosos y también se le ha relacionado con el pronóstico cardiovascular1.
Otros parámetros bioquímicos: para hacer una estimación global del riesgo residual del paciente, no hay que olvidar una evaluación metabólica del paciente con la medición de la glucohemoglobina30, la posible afección renal con la presencia de albuminuria24 u otros parámetros más controvertidos o menos utilizados como son la homocisteína o la insulinemia.
Marcadores antropométricosLa adiposidad es un factor fundamental que tener en cuenta y muy relacionado con el riesgo residual global. El índice de masa corporal clasifica la obesidad, pero con muchas limitaciones. Sin embargo, el perímetro abdominal estima de modo más fiable la grasa visceral, que es la que se relaciona con el estado proinflamatorio que da lugar a la disfunción metabólica asociada31. Se necesitan más estudios para determinar el papel de la adiposidad medida con bioimpedancia y la relación con la enfermedad cardiovascular.
Técnicas de imagenEn la última guía de prevención cardiovascular de la ESC24, se recomienda la realización sistemática de técnicas de imagen para la clasificación del riesgo cardiovascular. Pero ¿cuál podría ser su papel en la evaluación del riesgo residual?
Actualmente no hay respuesta para esto y solo existen pequeños estudios con resultados esperanzadores32 con instrumentos de imagen útiles que pudieran posicionarse en este sentido, aunando la anatomía con funcionalidad, buscando inflamación y que demostraran predecir eventos cardiovasculares.
ESTRATEGIAS TERAPÉUTICAS PARA REDUCIR EL RIESGO RESIDUAL CARDIOVASCULARLas estrategias terapéuticas para reducir el riesgo residual cardiovascular deben incluir el tratamiento farmacológico y los cambios en le estilo de vida con intervenciones en la dieta y la actividad física (tabla 1).
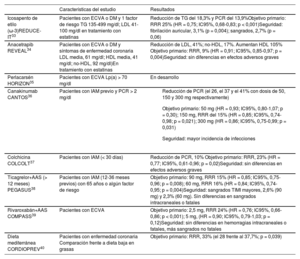
Tratamientos para reducir el riesgo residual cardiovascular
| Características del estudio | Resultados | |
|---|---|---|
| Icosapento de etilo (ω-3)REDUCE-IT33 | Pacientes con ECVA o DM y 1 factor de riesgo TG 135-499 mg/dl; LDL 41-100 mg/dl en tratamiento con estatinas | Reducción de TG del 18,3% y PCR del 13,9%Objetivo primario: RRR 25% (HR = 0,75; IC95%, 0,68-0,83; p < 0,001)Seguridad: fibrilación auricular, 3,1% (p = 0,004); sangrados, 2,7% (p = 0,06) |
| Anacetrapib REVEAL34 | Pacientes con ECVA o DM y síntomas de enfermedad coronaria LDL media, 61 mg/dl; HDL media, 41 mg/dl; no-HDL, 92 mg/dl)En tratamiento con estatinas | Reducción de LDL, 41%; no-HDL, 17%. Aumentan HDL 105% Objetivo primario: RRR, 9% (HR = 0,91; IC95%, 0,85-0,97; p = 0,004)Seguridad: sin diferencias en efectos adversos graves |
| Perlacarsén HORIZON35 | Pacientes con ECVA Lp(a) > 70 mg/dl | En desarrollo |
| Canakinumab CANTOS36 | Pacientes con IAM previo y PCR > 2 mg/dl |
|
| Colchicina COLCOLT37 | Pacientes con IAM (< 30 días) | Reducción de PCR, 10% Objetivo primario: RRR, 23% (HR = 0,77; IC95%, 0,61-0,96; p = 0,02)Seguridad: sin diferencias en efectos adversos graves |
| Ticagrelor+AAS (> 12 meses) PEGASUS38 | Pacientes con IAM (12-36 meses previos) con 65 años o algún factor de riesgo | Objetivo primario: 90 mg, RRR 15% (HR = 0,85; IC95%, 0,75-0,96; p = 0,008); 60 mg, RRR 16% (HR = 0,84; IC95%, 0,74-0,95; p = 0,004)Seguridad: sangrados TIMI mayores, 2,6% (90 mg) y 2,3% (60 mg). Sin diferencias en sangrados intracraneales o fatales |
| Rivaroxabán+AAS COMPASS39 | Pacientes con ECVA | Objetivo primario: 2,5 mg, RRR 24% (HR = 0,76; IC95%, 0,66-0,86; p < 0,001); 5 mg, (HR = 0,90; IC95%, 0,79-1,03; p = 0,12)Seguridad: sin diferencias en hemorragias intracraneales o fatales, más sangrados no fatales |
| Dieta mediterránea CORDIOPREV40 | Pacientes con enfermedad coronaria Comparación frente a dieta baja en grasas | Objetivo primario: RRR, 33% (el 28 frente al 37,7%; p = 0,039) |
AAS: ácido acetilsalicílico; DM: diabetes mellitus; ECVA: enfermedad cardiovascular establecida; HDL: lipoproteínas alta densidad; HR: hazard ratio; IAM: infarto agudo de miocardio; IC95%: intervalo de confianza del 95%; LDL: lipoproteínas de baja densidad; Lp(a): lipoproteína (a); PCR: proteína C reactiva; RRR: reducción del riesgo relativo; TG: triglicéridos.
Se ha demostrado que los fármacos que tienen como diana terapéutica reducir la concentración de LDL reducen la probabilidad de nuevos eventos cardiovasculares, pero manteniendo un riesgo residual. El tratamiento hipolipemiante combinado intensivo puede ayudar a reducir el riesgo residual. En un análisis del estudio en práctica clínica real LIPID-REAL41 mostró el beneficio del tratamiento con iPCSK9 en el cociente TG/HDL además de otros componentes del denominado riesgo residual lipídico, como el colesterol remanente, el cociente TG/glucosa o el colesterol total/cHDL.
En cuanto a los tratamientos dirigidos a reducir los TG, como los fibratos, los resultados en reducción del riesgo residual cardiovascular son bastante controvertidos. En varios metanálisis se documentó que pueden tener efecto beneficioso en pacientes con TG muy elevados y dislipemia aterogénica, pero no en aquellos con valores menos elevados42-43. El último estudio esperanzador con un fibrato, el PROMINENT44 con pemafibrato, intentó dar respuesta a si este fibrato podría reducir los eventos cardiovasculares en los pacientes diabéticos al reducir los TG, pero se detuvo precozmente porque en un análisis intermedio se documentó que era poco probable que se alcanzara el objetivo primario.
Los ácidos omega-3 o derivados, en un metanálisis de la Cochrane con más 100.000 pacientes y 79 estudios, no mostró reducción en la mortalidad ni en los eventos cardiovasculares, salvo una tendencia en la mejoría de la enfermedad coronaria45. Sin embargo, el estudio REDUCE-IT33 con 4 g de icosapento de etilo al día demostró, en pacientes con enfermedad cardiovascular establecida o diabetes mellitus y al menos un factor de riesgo, una reducción del 25% de los eventos cardiovasculares tras reducir en un 18,3% los TG y un 13,9% la PCRus. Los autores atribuyen este beneficio a la reducción global del riesgo residual abordando los riesgos lipídico, inflamatorio y trombótico.
Existen otras vías farmacológicas en desarrollo para la reducción de los TG por medio de tratamiento con ARN silenciadores dirigidos a la apolipoproteína C-III, como el volanorsén, con el que se ha demostrado que se reducen hasta en un 80%46, o los dirigidos a la ANGPTL3, pero aún no hay estudios que muestran su papel en la reducción del riesgo residual cardiovascular.
Los intentos farmacológicos de aumentar el HDL no han tenido éxito; la niacina y el laropiprant no han mostrado beneficio cardiovascular y, sin embargo, sí aumentaron la frecuencia de efectos adversos47,48. Los inhibidores de la CEPT tampoco han mostrado beneficios aumentando el HDL, incluso los estudios existentes aumentan la mortalidad, salvo el estudio REVEAL34 con anacetrapib, cuyo beneficio se atribuye a la reducción del LDL.
Los tratamientos farmacológicos que tienen como diana terapéutica la lipoproteína (a) están desarrollo35. El estudio HORIZON (fase III) con pelacarsén, un oligonucleótido antisentido, arrojará datos sobre el papel de esta molécula en la reducción del riesgo residual cardiovascular reduciendo la lipoproteína (a).
Tratamientos para reducir la inflamaciónLos tratamientos para reducir la inflamación no se utilizan habitualmente en la práctica clínica, pero existe evidencia de su impacto en el pronóstico cardiovascular y, por lo tanto, de su posible papel en la reducción del riesgo residual.
El canakinumab es un anticuerpo que bloquea la interleucina 1β, con indicación aprobada por la FDA para unos síndromes inflamatorios de origen reumático concretos. Pero en el estudio CANTOS36 se vio una reducción del 15% de los eventos cardiovasculares independientemente de las cifras lipídicas.
Otro fármaco que ha mostrado que reduce la inflamación residual cardiovascular es la colchicina. En el estudio COLCOT37, se observó que los pacientes con infarto agudo de miocardio reciente que recibían 0,5 mg de colchicina tenían una reducción del 23% del riesgo relativo de tener un nuevo evento cardiovascular.
Tratamientos antitrombóticosEl abordaje del riesgo trombótico tiene una variable más que tener en cuenta, el riesgo hemorrágico asociado con el tratamiento. Aunque existe evidencia que los sangrados se asocian con mayor mortalidad, esto se produce en el primer año tras un síndrome coronario agudo y, sin embargo, los infartos que mayor mortalidad producen son los que ocurren a partir del primer año49.
Existen varias estrategias terapéuticas con antitrombóticos con demostrada reducción del riesgo residual cardiovascular en pacientes con evento previo, como son la doble antiagregación plaquetaria prolongada más allá del primer año con ácido acetilsalicílico más ticagrelor en el estudio PEGASUS38 y la anticoagulación a dosis bajas con rivaroxabán en el estudio COMPASS39.
Tratamientos metabólicosEl abordaje de la diabetes mellitus, la obesidad y la resistencia a la insulina ha supuesto una revolución en los últimos años. El abordaje cardio-nefro-protector de los pacientes ha supuesto una reducción del riesgo residual cardiovascular y también de la insuficiencia cardiaca.
Centrándonos en la reducción del riesgo residual ateroesclerótico, los fármacos que han demostrado que reducen los eventos cardiovasculares son los análogos de la GLP1 liraglutida50, semaglutida52 y dulaglutida52, con un efecto beneficioso en la reducción del peso y la dislipemia53, aunque todos los estudios se diseñaron para demostrar seguridad cardiovascular y no para la valoración de la reducción del riesgo residual.
Un nuevo análogo de la GLP1 que también bloquea el GIP intestinal, la tirzetapida, se ha demostrado incluso más eficaz que la semaglutida en la reducción del peso, en pacientes con y sin diabetes mellitus54,55, mejorando también la dislipemia aterogénica, pero aún no hay resultados de prevención de eventos cardiovasculares.
Dieta y estilos de vidaLos estilos de vida son clave en el abordaje del riesgo residual cardiovascular, y en los demás factores influyen en cierta medida la dieta y la actividad física.
Pero en cuanto a la evidencia de los tipos de dieta que pueden mejorar el riesgo residual de los pacientes, recientemente se ha publicado el estudio CORDIOPREV40, en el que se analizó la influencia de la dieta mediterránea en pacientes con enfermedad cardiovascular establecida. Con un total de algo más de 1.000 pacientes aleatorizados a dieta mediterránea o dieta baja en grasas, la primera fue superior significativamente, con una reducción del 33% de eventos cardiovasculares.
CONTRIBUCIÓN DE LOS AUTORESLos autores han participado en la redacción del manuscrito y la revisión de forma proporcional y aceptan su publicación.
INFORMACIÓN SOBRE EL SUPLEMENTOEste artículo forma parte del suplemento titulado “Riesgo cardiovascular residual: nuevos enfoques”, el cual ha sido financiado por la sección de Riesgo Vascular y Rehabilitación Cardiaca de la Sociedad Española de Cardiología.