En la situación actual de pandemia por enfermedad coronavírica de 2019 (COVID-19), en la que España registra la mortalidad por millón de habitantes más alta del mundo, empiezan a cobrar relevancia manifestaciones más variadas que el grave síndrome respiratorio que produce. Entre ellas destacan y preocupan las cardiovasculares1, como el daño miocárdico agudo, las miocarditis, las arritmias y los numerosos casos de enfermedad pulmonar tromboembólica. Sin embargo, hay pocos casos publicados de complicaciones arteriales trombóticas, a pesar del estado procoagulante asociado con el coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2)2,3, posiblemente por la novedad y escaso conocimiento de esta emergencia sanitaria.
Los síndromes coronarios agudos (SCA) pueden desencadenarse por infecciones respiratorias. Kwong et al.4 encontraron una incidencia de SCA 6 veces superior en la semana posterior al diagnóstico de gripe que durante un intervalo de control definido como 1 año antes y 1 año después de la infección. Es presumible que exista también un aumento del riesgo de SCA a corto plazo con la infección por COVID-19.
Se presenta el caso de un médico de 59 años que trabaja en urgencias extrahospitalarias tomando muestras nasofaríngeas para reacción en cadena de la polimerasa (PCR) a pacientes con sospecha clínica de COVID-19, que ingresó por un SCA con elevación del segmento ST de localización inferior de 3,5 h de evolución. Es hipertenso, diabético tipo 2 mal controlado (glucohemoglobina, 12,2%) y no tiene hábitos tóxicos. En el ECG realizado a su llegada, se apreciaba elevación del segmento ST inferolateral con descenso especular en las precordiales derechas. Sus constantes al ingreso eran: presión arterial, 150/100mmHg; frecuencia cardiaca, 82 lpm; peso, 107 kg; talla, 183 cm, e índice de masa corporal, 31,94. La saturación basal era del 92%, y su peor presión parcial de oxígeno arterial/fracción inspirada de oxígeno (PaO2/FiO2) estimada fue de 257, que corresponde con un síndrome de dificultad respiratoria aguda leve.
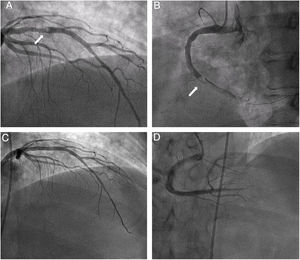
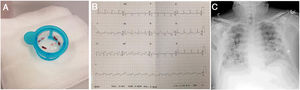
En la angioplastia primaria se documentó una lesión grave, con gran contenido trombótico, en la arteria coronaria derecha (CD) y oclusión de la descendente posterior (DP), así como la descendente anterior (DA) con lesión moderada proximal con defecto de contraste compatible con trombo. Se tromboaspiró el material trombótico de la CD y se implantó un stent farmacoactivo directo, con lo que quedó ocluida la DP distal. Después se revascularizó la DA proximal con otro stent directo (figura 1A-D, figura 2A, y ). Se usó tirofibán por la alta carga trombótica y por la embolización en DP distal. El tiempo puerta-balón fue de aproximadamente 60 min. En la figura 2B se presenta el ECG realizado al día siguiente, con elevación persistente del segmento ST de 1,5mm en derivaciones inferiores, V 4-6, así como onda Q de necrosis inferior y bloqueo auriculoventricular de primer grado.
Después de la angioplastia primaria y tras una anamnesis más dirigida, describía síntomas compatibles con COVID-19 de al menos 3 días de evolución (tos seca, febrícula, cefalea y astenia). La radiografía de tórax mostró opacidades alveolares coalescentes bilaterales de predominio subpleural, con aumento de densidad con patrón intersticial en las regiones parahiliares (figura 2C). Las pruebas de laboratorio mostraron linfocitopenia (0,73×103/μl), valores elevados de proteína C reactiva (135,6mg/l), dímero D (1.513 ng/ml), ferritina (1.239 ng/ml) e interleucina 6 (41,3 pg/ml). La puntuación de la escala de coagulación intravascular diseminada (CID) según la escala de la International Society on Thrombosis and Haemostasis (ISTH) fue de 3 (CID dudosa). En el contexto actual de pandemia por COVID-19, se realizó PCR específica y fue positiva para SARS-CoV-2.
El paciente recibió el tratamiento habitual del SCA (tratamiento antitrombótico con ácido acetilsalicílico, prasugrel y enoxaparina a dosis anticoagulante durante el ingreso y 1 semana adicional por la alta carga trombótica y la sospecha de estado procoagulante), soporte de oxígeno de alto flujo, hidroxicloroquina y antibióticos (ceftriaxona/azitromicina).
La evolución respiratoria fue satisfactoria y se le dio el alta a los 10 días (ingreso el 1 de abril y alta el 10 de abril de 2020). El 17 de abril se realizó nueva PCR de SARS-CoV-2, que continúa siendo positiva. Actualmente se encuentra asintomático.
Lamentablemente, no fue posible caracterizar la presencia de placas ateroescleróticas activas mediante un estudio de imagen intracoronario con tomografía de coherencia óptica o ecografía intracoronaria, debido a las limitaciones de recursos materiales en el brote actual de COVID-19 para evitar contagios a profesionales y pacientes. Sin embargo, la presencia de lesiones coronarias obstructivas, los factores de riesgo cardiovascular (especialmente la diabetes mellitus con muy mal control metabólico), la ausencia de posibles focos embolígenos (ritmo sinusal en la telemetría durante los 10 días de ingreso, ecocardiograma transtorácico con acinesia inferior con fracción de eyección del ventrículo izquierdo normal, inexistencia de trombos intraventriculares, válvulas morfológicamente normales y falta de alteraciones en la aorta ascendente proximal) y la ausencia de trombocitosis (plaquetas al ingreso, 387×103/μl) y de hábitos tóxicos hacen que la rotura o erosión de placas ateroescleróticas sea la causa más probable del evento.
Carece asimismo de factores asociados con la presencia de una trombofilia hereditaria (edad mayor de 50 años, ausencia personal y familiar de tromboembolia venosa previa, nula existencia de trombosis de repetición en localizaciones inusuales, como venas esplénicas o del sistema nervioso central)5. De todas formas, no se realizó estudio completo de trombofilia por el riesgo de falsos positivos en el momento agudo, especialmente en un contexto de inflamación e infección activa, y se optó finalmente por demorarlo 2 meses.
Este caso clínico resalta que el estado inflamatorio/protrombótico asociado con la infección por SARS-CoV-2 no solo está relacionado con el territorio microvascular o la enfermedad tromboembólica, también puede conferir un mayor riesgo de rotura de la placa ateroesclerótica en el sistema arterial, como ya se ha documentado con otros virus respiratorios, pero no con el SARS-CoV-2.