La hipertensión arterial (HTA) es una de las enfermedades que más contribuyen a la morbimortalidad cardiovascular en el mundo. Por este motivo, desde hace muchas décadas, nos hemos centrado en intentar prevenirla y tratarla. A pesar de numerosas pautas farmacológicas o de la modificación de los estilos de vida, sigue habiendo numerosos pacientes que no logran reducir su presión arterial (PA) hasta los valores recomendados. Otros lo consiguen tomando múltiples fármacos antihipertensivos, lo que supone un gran gasto farmacéutico y una mayor exposición a efectos secundarios, muchos de ellos graves.
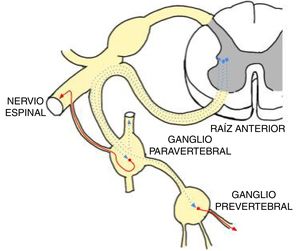
El sistema nervioso simpático (SNS), junto con el parasimpático, forma parte del sistema nervioso autónomo1. Este se encarga de la regulación de las funciones involuntarias del organismo, entre ellas la PA, y el SNS tiene el papel crucial en su regulación. El SNS actúa a través de 2 neuronas unidas en serie. El cuerpo de la primera neurona (neurona preganglionar) se localiza en los segmentos torácico y lumbar de la médula espinal (de T1 a L2), concretamente en el cuerno intermedio-lateral. El cuerpo de la segunda neurona simpática (neurona ganglionar) se localiza fuera del sistema nervioso central, bien a nivel paravertebral bilateral en pequeños ganglios autónomos interconectados entre sí (formando la cadena simpática paravertebral), bien en grandes ganglios simpáticos abdominales distales, denominados ganglios prevertebrales o preaórticos (fundamentalmente el ganglio celiaco, el mesentérico superior y el mesentérico inferior). Estas neuronas ganglionares se conectan con el órgano diana a través de sus axones posgangliónicos para hacer su función (figura 1). Cada neurona preganglionar hace sinapsis con múltiples neuronas ganglionares distribuidas a varios niveles, lo que explica la respuesta difusa en todo el organismo de una única estimulación simpática.
Esquema de las conexiones del sistema nervioso simpático. Dos neuronas conectadas en serie. En azul punteado, la neurona preganglionar localizada en el cuerno intermedio-lateral de la médula. En rojo, la neurona ganglionar localizada en la cadena simpática paravertebral o en los grandes ganglios distales prevertebrales. Las neuronas ganglionares se conectan con el órgano diana donde actúan. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En el SNS, el neurotransmisor fundamental de las neuronas preganglionares es la acetilcolina (neuronas colinérgicas) y el de las neuronas ganglionares, la noradrenalina (neuronas adrenérgicas), salvo en la médula suprarrenal, que secretan fundamentalmente adrenalina. Estos neurotransmisores posganglionares interaccionan con los receptores simpáticos (alfa y beta) en los diferentes órganos donde producen su respuesta biológica. Las células yuxtaglomerulares renales son ricas en receptores B1 que estimulan la secreción de renina.
La activación del SNS es primordial en la patogenia de la HTA2, particularmente en personas jóvenes y de mediana edad. Una hiperestimulación del SNS favorece la aparición de HTA en jóvenes sanos y también contribuye al mantenimiento de la HTA y que se produzca y progrese el daño en el órgano diana. De hecho, se ha demostrado que la simpatectomía quirúrgica no selectiva (esplacnicectomía) disminuye la PA, pero a costa de efectos secundarios incapacitantes, como hipotensión ortostática, síncope o disfunción sexual3.
Dentro del conjunto del SNS, los nervios simpáticos renales son clave en la HTA. Intervienen en el procesamiento tubular del sodio (que retienen sodio y agua) y la secreción de renina y aumentan la resistencia vascular renal (disminuyendo el flujo sanguíneo renal y la tasa de filtrado glomerular)4. Se forman, como se ha indicado, a partir de las neuronas ganglionares de la cadena simpática paravertebral y/o de los ganglios prevertebrales anteriores de la aorta. A partir de estos ganglios, se desarrolla la inervación específica renal. Clásicamente se ha descrito que estos nervios destinados al riñón (SNS renal), al llegar a la arteria renal (AR), forman una red, denominada plexo renal. Esta red rodearía la AR principal a nivel adventicial y entrarían en el riñón para inervarlo a través del hilio. Hay mayor cantidad de nervios periarteriales en los segmentos proximales y medios, y la región ventral tiene más nervios que la dorsal. El 75% de estos nervios se encontrarían a una distancia desde la luz de la AR de 4,28mm (intervalo, de <1 hasta> 10 mm)5. Esta distribución del SNS renal periadventicial, muy próxima a la luz de la AR, junto con el papel de estos nervios en la HTA y los buenos resultados de la simpatectomía quirúrgica no selectiva, sentaron las bases para el desarrollo de la simpatectomía endovascular renal selectiva desde un catéter situado en la luz arterial para tratar la HTA.
Con este principio se desarrollaron numerosos catéteres para la denervación renal (DR) endovascular. La mayoría de ellos consisten en un catéter con 1 o varios electrodos conectados a un generador de radiofrecuencia. Controlando la temperatura y la impedancia con los algoritmos específicos de cada compañía, se lograba aplicar la energía adecuada para dañar el nervio sobre el punto de contacto. Después de los resultados excelentes de numerosos estudios de DR, el SYMPLICITY HTN-3 era el gran estudio esperado (aleatorizado, con control con sham y objetivo primario basado en un Holter de PA de 24 h)6. En el grupo de DR se utilizaba un catéter monopolar (Symplicity, Medtronic; Minneapolis, Minnesota, Estados Unidos) con el que se realizaban de 4 a 6 ablaciones en ambas AR principales (derecha e izquierda). Se comenzaba en el extremo distal de la AR y se iba denervando punto a punto hacia proximal siguiendo un patrón helicoidal. Con esta espiral, teóricamente se aseguraba la ablación circunferencial del plexo renal. También, al no ser una quemadura circular (en anillo), teóricamente se reducía también la incidencia de estenosis renal. Este ensayo no demostró que la DR fuera superior al tratamiento médico, con lo que la DR sufrió un gran revés, y hoy prácticamente sigue en el olvido. La pregunta es: ¿qué pudo haber fallado?
Se han estudiado e identificado muchas causas de por qué este estudio, con todos los antecedentes que tenía, falló. Entre otras, una selección errónea de la población, una falta de adherencia al tratamiento de los pacientes y, muy importante, un desconocimiento general de la neuroanatomía macroscópica y microscópica renal. Nosotros trabajamos en el estudio anatómico del SNS renal7,8, y actualmente estamos centrados en analizar las causas que podrían explicar el fracaso de la técnica y en cómo optimizar el procedimiento desde un punto de vista anatómico.
Gran parte del conocimiento que existe de la neuroanatomía renal y que se utilizó para crear los protocolos de DR se basa en pequeños estudios anatómicos de principios y mediados del siglo xx, y el estudio más amplio (que nosotros sepamos) tenía 9 cadáveres adultos9. El motivo más que probable de esta escasez de disecciones del SNS renal en los trabajos previos es que se necesitan más de 40 h de trabajo para exponer el plexo renal de manera apropiada partiendo de un bloque renal. Esta falta de información anatómica hizo que se creara un protocolo de DR (desde nuestro punto de vista) erróneo, basado en un modelo demasiado simple, por lo que se dio poca importancia al protocolo de denervación. Se creó, en definitiva, la falsa expectativa de que la DR iba a ser efectiva se hiciera lo que se hiciese y donde se hiciera. Un «todo vale».
Son varias las causas anatómicas potenciales de que el procedimiento de DR, tal y como se entendió en el pasado, fallara.
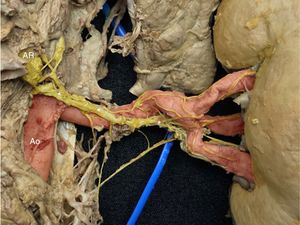
En primer lugar, el plexo renal no es un plexo, entendido como pequeños nervios todos de igual tamaño que rodean a modo de red la adventicia de la AR. Por el contrario, el SNS renal está formado por haces de nervios gruesos agrupados, procedentes de los axones de las neuronas ganglionares simpáticas y suelen ir por AR superiores, inferiores, ventrales o dorsales. En muchas ocasiones estos haces de nervios siguen un trayecto espiroideo, con lo que cambiarían de cuadrante a lo largo de la AR (figura 2). Esto significa que, si se quiere conseguir una DR eficaz (ablación circunferencial en los 4 cuadrantes), hay 2 estrategias.
Riñón derecho, visión posterior. Imagen en la que se observa un gran nervio originado en la parte superior en el ganglio aórtico renal (AR) posterior derecho. Se puede observar cómo cambia de localización a lo largo del trayecto de la arteria renal principal: pasa de superior a posterior y luego a inferior (*). En rojo, aorta (Ao) y arterias renales principal y segmentarias. En amarillo, el simpático renal. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En la primera de ellas, utilizando un catéter unipolar (que suele producir daños arteriales en 90° de la circunferencia arterial), se debería asegurar que se hace la ablación espiroidea completa, y es obligado denervar todos los puntos de la espiral, sin dejar ninguno aislado. Además es necesario realizarlo a lo largo de un segmento corto de la arteria, ya que, si no es así y debido a los trayectos espiroideos nerviosos, sería posible que el nervio cruce a otro cuadrante en el espacio entre punto y punto de denervación, con lo que podría no denervarse. Parece lógico pensar también que, por azar, cuantos más puntos de ablación se consigan, mayor probabilidad habrá de denervar adecuadamente el riñón.
La segunda estrategia de DR consiste en realizar, en un segmento de la AR concreto, una única DR circunferencial en anillo (no espiroidea), con lo que se evitarían los problemas anteriores de la DR espiral. Esto, que teóricamente aumentaría la eficacia de la técnica, podría aumentar la incidencia de estenosis renal a largo plazo, ya que el daño arterial se produce a lo largo de 360° en un punto concreto de la arteria.
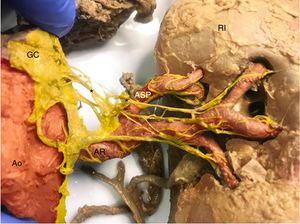
Además de lo anterior, en un gran porcentaje de riñones, la AR principal no es la que llega al hilio renal. Antes de llegar al hilio, se suele ramificar en 2 subramas, la arteria segmentaria anterior (es anterior a la pelvis renal y el uréter) y la segmentaria posterior (posterior a la pelvis renal y el uréter). Cuando estas divisiones prehiliares existen, es frecuente que haya nervios que pasen desde los ganglios preaórtios a una o ambas subramas (por lo tanto, saltarían la AR principal). Este fenómeno es muy importante, ya que implica que, además de denervar la AR principal (que es lo que se recomendaba hasta ahora con la radiofrecuencia), hay que realizar denervaciones también a las subramas renales si se quiere alcanzar los nervios con llegada distal. Una segunda posibilidad sería realizar la DR en la AR principal aplicando una mayor cantidad de energía en la RF o utilizando otras fuentes de energía (como ultrasonidos), con objeto de acceder a estos nervios renales, que a esta altura no se encuentran tan cerca de la AR principal (figura 3). Esta última posibilidad, al tener que penetrar más, teóricamente tendría la contrapartida de producir daños no deseados en estructuras adyacentes.
Riñón izquierdo (RI), visión anterior. Se observa un gran nervio (*) originado en el ganglio celiaco (GC). Se puede observar que hay haces de nervios que se unen a la arteria segmentaria posterior izquierda (ASP). En rojo, aorta (Ao) y arterias renales (AR), segmentarias y subsegmentarias. En amarillo, el simpático renal. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
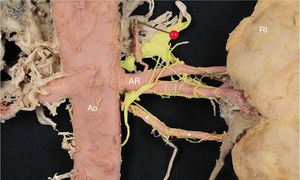
Por otro lado, la vascularización renal se caracteriza por un gran número de variaciones. Desde AR únicas hasta AR múltiples. Desde las arterias que llegan al hilio (arterias hiliares) o las que penetran el riñón fuera del hilio (extrahiliares) y que habitualmente lo hacen por los polos (arterias polares). Las arterias renales múltiples se suelen encontrar con relativa frecuencia (del orden de un 30% como media en los estudios). Dentro de las arterias renales múltiples, a la de mayor diámetro se la denomina AR principal y a las de menor diámetro, accesorias o supernumerarias. En estos casos de arterias renales múltiples, nosotros hemos podido documentar que la inervación simpática no solo la lleva la AR principal, sino que, la inmensa mayoría de las veces, las arterias accesorias llevan también nervios a lo largo de su pared, y esto es independiente de su tamaño (figura 4). Parece lógico pensar que, si se quiere realizar una DR lo más completa posible, es necesario identificar minuciosamente estos casos de arterias renales múltiples y denervar no solo la de mayor diámetro, sino todas.
Riñón izquierdo (RI), visión anterior. Se observa una arteria accesoria (*) polar inferior izquierda. La arteria accesoria lleva abundantes nervios a lo largo de su pared. En rojo, aorta (Ao) y arterias renales (AR), segmentarias y subsegmentarias. En amarillo, el simpático renal. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
La pregunta más importante es, pues: ¿cómo se debería haber enfocado una DR para haberla realizado con éxito? Además de tener en cuenta los tres puntos previos mencionados, y debido a la variabilidad anatómica, es importante realizar antes del procedimiento un estudio de la vasculatura renal y planificarlo estratégicamente en función de los hallazgos. En la DR actual ya no sirve pensar que «cualquier cosa que se haga vale».
De modo idéntico a lo que el cardiólogo intervencionista conoce de la anatomía de las arterias coronarias, la persona responsable de realizar un procedimiento de DR debe tener un conocimiento profundo de la vasculatura renal, sus variantes y las ramas de la aorta que se encuentran alrededor de las AR. Esto es necesario para planificar cuáles van a ser los segmentos diana, las proyecciones radiológicas adecuadas, en qué punto está el catéter en cada momento, qué ramas o subramas ya se han denervado y cuáles quedarían por denervar, y qué proyecciones hay que utilizar para acceder a ellas.
ESTUDIOS DE DENERVACIÓN RENAL VARIANDO LA TÉCNICATras el revés del Symplicity HTN-3, se han diseñado nuevos estudios piloto como «prueba de concepto», controlado al máximo las variables de confusión y con el objetivo real de ver si la DR endovascular es eficaz.
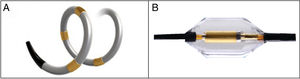
Desde el punto de vista del procedimiento y la técnica de ablación, tras el HTN-3 se han utilizado 2 tipos de catéteres. El primero, un catéter de radiofrecuencia espiral en el que van montados 4 electrodos secuenciales con el objeto de asegurar una ablación circular en espiral (Spyral, Medtronic; Minneapolis, Minnesota, Estados Unidos). El segundo es un catéter de ultrasonidos que realiza una ablación en anillo en el mismo segmento (Paradise, ReCor Medical; California, Estados Unidos) (figura 5). Además, se ha modificado la técnica de ablación. En la DR con radiofrecuencia en espiral, se tratan las ramas segmentarias además de la AR principal y las ramas accesorias. En la DR en anillo con catéter de ultrasonido, solo se denerva la AR principal y las accesorias. Solo operadores con gran experiencia en DR realizan el procedimiento.
Con estos 2 dispositivos e intentando controlar todas las variables de confusión, hay información de 3 estudios prospectivos aleatorizados, a simple ciego y controlados con sham. Dos han utilizado la DR con radiofrecuencia en espiral y el catéter Spyral (estudios piloto SPYRAL HTN-OFF MED10 y SPYRAL HTN-ON MED11) y otro (RADIANCE-SOLO12) realiza una DR en anillo con el catéter balón de ultrasonidos Paradise.
Como novedad importante, y una vez demostrada la seguridad de la DR en los ensayos clínicos previos, ya no se aleatoriza solo a pacientes con HTA resistente. Se incluye a pacientes con HTA esencial leve o moderada pese a estar en tratamiento antihipertensivo (no más de 3 fármacos en el SPYRAL HTN-ON MED) o pacientes con HTA leve-moderada que no toman fármacos antihipertensivos (estudios SPYRAL HTN-OFF MED y RADIANCE-SOLO).
Y los resultados de los 3 estudios son muy positivos. En primer lugar, hay que destacar un aspecto muy importante. Los 3 estudios no han reportado ningún evento adverso serio ni complicaciones relevantes derivadas de la técnica. Esto implica que la técnica es segura, funcione en algunos pacientes o no. En lo que habrá que trabajar a partir de ahora es en identificar previamente a los pacientes respondedores a la DR. En cuanto a eficacia, estos 3 estudios han demostrado de forma significativa que la DR reduce la presión arterial de manera duradera (figura 6).
CONCLUSIÓN Y PERSPECTIVAS FUTURASEn definitiva, el conocimiento profundo de la vasculatura y la neuroanatomía renales es esencial para diseñar y aplicar un procedimiento apropiado para esta simpatectomía renal selectiva. Después de superar numerosos problemas, con una drástica caída en las expectativas de la DR hasta casi cero, y tras un control estricto de las variables de confusión, los estudios SPYRAL ON MED, OFF MED y el RADIANCE-HTN SOLO son la primera evidencia de que la DR es verdaderamente eficaz y además muy segura. Ahora sí se puede decir que la DR, cuando se aplica correctamente, es una terapia efectiva que abre definitivamente un nuevo campo para ayudar, de manera alternativa, al control de la PA.
A pesar de ello, muchas preguntas quedan aún sin responder: ¿cuánto hay que denervar para conseguir un efecto?, ¿hay algún marcador de pueda confirmar el éxito de la DR durante el procedimiento?, ¿qué pacientes son los respondedores y no respondedores a la técnica?, ¿qué grupos de población podrían beneficiarse?, ¿cuál es el beneficio clínico neto de la técnica?, ¿cuál es la seguridad a muy largo plazo?, ¿cuánto duran los efectos de la denervación?, etc.
Los estudios de DR actualmente en marcha (estudio pivotal SPYRAL OFF-MED [NCT02439749] y la extensión de los estudios piloto SPYRAL ON-MED [NCT02439775], RADIANCE-HTN TRIO y SOLO [NCT02649426] y RADIANCE-II [NCT03614260], etc.) continuarán aportando más información para responder a todas estas preguntas y esperemos que a muchas más.
CONFLICTO DE INTERESESA. García-Touchard es consultor de Medtronic y Metavention Inc. y ha recibido becas de Medtronic para estudio del plexo renal.