Palabras clave
INTRODUCCION
La miocardiopatía hipertrófica (MH) es una enfermedad progresiva que se caracteriza por una hipertrofia miocárdica inapropiada y, microscópicamente, por fibrosis miocárdica focal, tejido cicatrizal, desorganización miofibrilar (disarray) y enfermedad de pequeño vaso, dando como resultado un perfil clínico y patológico heterogéneo1. En estudios necrópsicos, la severidad de la MH se ha relacionado con la presencia y la cantidad de fibrosis miocárdica2-5. Sin embargo, el valor pronóstico de la fibrosis miocárdica ha sido difícil de determinar debido a la falta de métodos diagnósticos capaces de detectar su presencia in vivo.
Hasta ahora, la cardiorresonancia magnética (CRM), por medio del método de realce tardío (RT) tras la administración de un agente de contraste, es la única técnica que permite la detección in vivo de la cicatriz miocárdica debida a necrosis6, así como la fibrosis miocárdica focal de origen no isquémico7,8. Recientemente, algunos autores9 han demostrado el potencial valor de esta técnica en la valoración clínica de pacientes con MH. Sin embargo, por el momento son todavía escasos los estudios dirigidos a demostrar el valor clínico del RT en la MH. Nuestro objetivo fue, por tanto, describir la presencia y la distribución de la fibrosis miocárdica en una serie de pacientes con MH, y establecer si hay una relación entre la extensión de la fibrosis miocárdica y la severidad de la enfermedad.
MÉTODOS
Pacientes
Se incluyó a 43 pacientes, de forma consecutiva (30 varones; edad media, 47 ± 18 años) diagnosticados de MH por ecocardiografía: grosor parietal ventricular izquierdo ≥ 15 mm en ausencia de una causa de hipertrofia ventricular conocida. El único criterio de exclusión fue una contraindicación para el estudio de CRM. El perfil de riesgo clínico fue valorado con los criterios ya establecidos10: historia familiar de muerte súbita, síncope inexplicable, taquicardia ventricular documentada e hipertrofia ventricular izquierda severa ≥ 30 mm.
Estudios de cardiorresonancia magnética
En todos los pacientes se realizó una CRM con contraste con un sistema Philips Intera 1.5T scanner. Después de la obtención de los planos localizadores habituales, se obtuvieron imágenes de cine-RM con una secuencia Steady-State Free-Precession en cortes orientados sobre el eje longitudinal del ventrículo izquierdo, así como múltiples cortes de 10 mm de grosor orientados en el eje transversal que cubrían desde la base hasta el ápex del ventrículo izquierdo. Se adquirieron un mínimo de 16 fases del ciclo cardiaco para cada corte y se reprodujeron en forma de asa continua.
Se inyectaron 0,1 mmol/kg de gadoterilol intravenoso (Gadovist®, Schering AG, Berlín, Alemania) y se adquirió, a los 10 min de la inyección de contraste, una secuencia eco-gradiente 3D inversión-recuperación11 para analizar el RT. El tiempo de inversión se ajustó para anular la señal del miocardio normal (200-300 ms). Esta secuencia se programó en múltiples cortes sobre el eje transversal del ventrículo izquierdo, utilizando la misma orientación que para las imágenes de cine-RM.
Análisis de las imágenes
Las imágenes de cine-RM y de RT fueron analizadas en un segundo tiempo con un software dedicado (Mass, MEDIS, Leiden, Países Bajos). Los bordes intracardiacos y epicárdicos del ventrículo izquierdo fueron trazados manualmente en las imágenes de cine-RM sistólica y diastólica para cada nivel de corte del eje transversal. Se calcularon la masa (MVI), el volumen telediastólico y el volumen telesistólico ventrículo izquierdo para cada paciente.
Se analizó visualmente la presencia de RT en el ventrículo izquierdo, así como su patrón de distribución y localización. En las imágenes obtenidas sobre el eje transversal del ventrículo izquierdo se planimetraron manualmente las áreas que mostraban RT para calcular la masa total de fibrosis miocárdica, identificada por el método de RT.
Análisis estadístico
Las variables cuantitativas continuas se expresan como media ± desviación estándar y se compararon utilizando la prueba de la t de Student para muestras independientes. Se utilizó el test de Mann-Whitney en las variables que no cumplían una distribución normal. Se consideraron como estadísticamente significativos los valores de p < 0,05.
RESULTADOS
Las características clínicas del grupo de pacientes estudiado están resumidas en la tabla 1. La CRM mostró una hipertrofia ventricular izquierda con un grosor parietal máximo que oscilaba en 14-39 mm (media, 21 ± 6 mm), y una MVI entre 67 y 358 g (media, 169 ± 61 g). Todos los pacientes excepto 2 mostraron valores de fracción de eyección del ventrículo izquierdo por CRM ≥ 50% (media, 71 ± 13%).
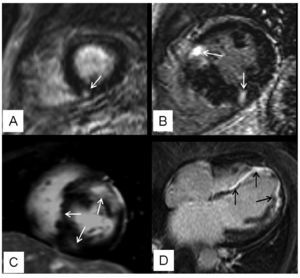
Se observó RT en el 63% (27/43) de los pacientes, siguiendo los siguientes patrones de distribución: a) unifocal, con afección de distintas regiones del miocardio ventricular izquierdo (4 pacientes; 15%); b) bifocal, con afección de las zonas de unión de los ventrículos izquierdo y derecho (10 pacientes; 37%); c) multifocal (10 pacientes; 37%), y d) difuso (3 pacientes; 11%) (fig. 1). La masa total de fibrosis miocárdica calculada osciló entre 1 y 59 g (media, 17 g).
Fig. 1.Patrones de distribución de la fibrosis miocárdica focal detectada por el realce tardío (RT). A: patrón unifocal que, en este caso, afecta al septo inferior (flecha). B: característico patrón bifocal que afecta a la unión de ambos ventrículos (flechas). C: patrón multifocal que engloba diferentes segmentos del ventrículo izquierdo (flechas). D: ilustra un ejemplo de un patrón difuso con una larga extensión de RT (flechas).
Se observó una buena correlación entre la cantidad de fibrosis miocárdica y el grado de hipertrofia en términos de grosor parietal máximo (r = 0,58; p = 0,002), así como con la MVI (r = 0,60; p = 0,001) (fig. 2). Considerando el grupo de pacientes con y sin RT, encontramos diferencias significativas en el grosor parietal máximo (23 ± 7 frente a 18 ± 4 mm, respectivamente; p = 0,045). No había diferencias significativas, por otra parte, en la MVI (176 ± 71 frente a 158 ± 38 g; p = 0,55), el volumen telediastólico (133 ± 46 frente a 116 ± 27 ml; p = 0,38) y el volumen telesistólico (43 ± 35 frente a 30 ± 10 ml; p = 0,22).
Fig. 2.Gráficos que muestran la correlación entre la fibrosis miocárdica, detectada por el realce tardío (RT), con la masa ventricular izquierda (MVI) (izquierda) y con el grosor parietal máximo (derecha).
En el grupo con fibrosis miocárdica se encontró una mayor prevalencia de casos familiares que en el grupo sin fibrosis miocárdica (el 48 frente al 13%, respectivamente; p = 0,08). Asimismo, se encontraron también diferencias al comparar entre ambos grupos la presencia de factores de riesgo convencionales: 13 pacientes (48%) con fibrosis miocárdica demostrada por el método de RT presentaban al menos un factor de riesgo, mientras que sólo 2 (13%) pacientes sin fibrosis miocárdica presentaban uno de estos factores de riesgo (p = 0,04) (fig. 3).
Fig. 3.Comparación del número de factores de riesgo clínico entre el grupo con y el grupo sin realce tadío (RT). Se observa que la mayor parte de los pacientes sin RT no presentaba ningún factor de riesgo clínico, mientras que casi la mitad de los pacientes con RT presentaban al menos un factor de riesgo clínico.
DISCUSION
Este estudio demuestra que la mayoría de pacientes con MH presentan RT en la CRM indicativo de fibrosis miocárdica focal. De acuerdo con lo publicado recientemente en la literatura científica9,12, en este estudio se observa que hay una correlación entre la cantidad de fibrosis miocárdica y el grado de hipertrofia por CRM. No obstante, a pesar de la relación entre extensión de RT y MVI o grosor parietal máximo, cabe destacar la posible ausencia de fibrosis miocárdica incluso en casos con aumento manifiesto de MVI.
Varnava et al2 demostraron en un estudio histológico en pacientes con MH, que murieron o que recibieron un trasplante cardiaco, que la presencia de fibrosis miocárdica en la MH se relacionaba con el grado de hipertrofia. Aunque estas observaciones se basan en un grupo de pacientes con un grado de enfermedad mucho más avanzado, los hallazgos de nuestro estudio demuestran que, en una población no seleccionada de pacientes con MH, también se observa la presencia de fibrosis miocárdica, tal y como se ha observado en otros estudios9,12. Además, la fibrosis miocárdica está presente en los segmentos que muestran una mayor hipertrofia.
La importancia de la detección de la fibrosis miocárdica en pacientes no seleccionados con MH deriva de la potencial implicación pronóstica de este hallazgo. Actualmente se utiliza la combinación de los distintos factores de riesgo clínico para estratificar el riesgo de los pacientes con MH. Sin embargo, hasta ahora, la identificación de los pacientes con MH y perfil de alto riesgo continúa siendo un desafío. Moon et al9 observaron que la extensión del RT ayudó a identificar a los pacientes con un perfil de riesgo alto. Asimismo, en los pacientes con dilatación y disfunción ventricular izquierda progresiva observaron una mayor extensión del RT. En nuestro estudio, la inclusión consecutiva de pacientes resultó en una población con un perfil relativamente benigno, ya que todos los pacientes excepto uno tenían ninguno o un único factor de riesgo para muerte súbita. Al comparar estos dos grupos observamos que la ausencia de RT se detecta con más frecuencia en pacientes sin factores de riesgo que en los que tienen uno. Este hallazgo es particularmente interesante, sobre todo teniendo en cuenta que todavía hay cierta controversia en prevención primaria acerca de la indicación del desfibrilador automático implantable en el grupo de pacientes con un único factor de riesgo13. No obstante, es cierto que, según lo publicado en la literatura científica hasta el momento, el significado pronóstico del RT en este grupo de pacientes todavía está por determinar. Se requieren estudios con seguimientos a largo plazo y con amplias poblaciones de pacientes para establecer si el hallazgo de RT en pacientes con un único factor de riesgo de muerte súbita cambiará la estrategia terapéutica en el ámbito de la prevención primaria.
Por otro lado, es importante señalar que los 2 pacientes de nuestra serie que mostraron una MH progresiva con disfunción ventricular izquierda severa presentaban una mayor cantidad de fibrosis miocárdica (fig. 1D). En estos 2 pacientes, la masa total de fibrosis miocárdica fue de 58 y 59 g, mientras que en el resto de pacientes osciló entre 1 y 48 g. Esta observación se correlaciona también con los hallazgos de estudios anatomopatológicos, en los que se ha demostrado que los pacientes con MH que evolucionan rápidamente a una insuficiencia cardiaca progresiva presentan, en el momento del trasplante cardiaco o la autopsia, una extensa cicatriz miocárdica del ventrículo izquierdo14.
En este estudio, el patrón de distribución de RT más frecuente fue el bifocal, con afección de las zonas de unión de ambos ventrículos, y el multifocal. El patrón bifocal ha sido previamente relacionado con un perfil benigno9,12. Sin embargo, el tamaño de nuestra muestra no es suficiente para poder extraer conclusiones sobre las potenciales implicaciones pronósticas de los diferentes patrones de distribución del RT.
Este estudio está limitado por su diseño transversal, que impide establecer una relación entre la fibrosis miocárdica y el pronóstico de la MH. Se necesitan estudios con un seguimiento a largo plazo para poder extraer conclusiones en este sentido, así como para valorar el valor pronóstico potencial de los distintos patrones de distribución de la fibrosis miocárdica.
CONCLUSIONES
En definitiva, este estudio demuestra que la fibrosis miocárdica focal, identificada por el RT en la CRM, es un hallazgo común en los pacientes con MH. Aunque la fibrosis miocárdica no se observa necesariamente en todos los pacientes con los ventrículos más hipertrofiados, cuando está presente hay una correlación entre la cantidad de fibrosis miocárdica y el grado de hipertrofia. Además, la presencia de RT en la MH tiende a ser más prevalente entre los casos familiares, así como entre los pacientes con un perfil de riesgo potencialmente más alto. La confirmación de este hecho en futuros estudios podrá confirmar el valor del RT como factor de riesgo en la MH.
Correspondencia: Dra. S. Pujadas.
Vía Augusta, 17-19, sobreático 3.a. 08006 Barcelona. España.
Correo electrónico: spujadas@santpau.es
Recibido el 12 de abril de 2006.
Aceptado para su publicación el 13 de julio de 2006.