Palabras clave
INTRODUCCION
La miocardiopatía hipertrófica (MCH) es una enfermedad cardiaca de origen genético con una penetrancia variable y una expresión clínica heterogénea1,2. Aunque varios factores de riesgo han demostrado asociarse con un incremento del riesgo de muerte súbita, la capacidad predictiva de cada uno de estos marcadores clínicos adversos es generalmente baja. Los mecanismos implicados en la muerte súbita y en la progresión a disfunción sistólica no están totalmente aclarados, pero la desorganización miofibrilar y la fibrosis miocárdica se consideran el sustrato anatómico para las arritmias ventriculares y el remodelado ventricular izquierdo3-11. El realce tardío de gadolinio (RT) en la resonancia magnética cardiaca (RM) identifica regiones con fibrosis miocárdica y nos permite valorar de forma directa el tejido miocárdico anormal12-15. Estudios previos, limitados por el tamaño muestral, mostraron una relación entre la extensión del realce tardío y menor fracción de eyección (FE), dilatación ventricular progresiva y mayor número de factores de riesgo de muerte súbita16,17.
Con la intención de determinar el significado clínico del RT en la MCH, analizamos la relación entre la extensión del RT y la morfología y función ventricular izquierda (VI), los síntomas, la capacidad funcional y los factores de riesgo de muerte súbita en una cohorte de pacientes con MCH.
MÉTODOS
Población de estudio
Se realizaron estudios de RM en 104 pacientes de nuestra cohorte de más de 360 en forma consecutiva durante un período de 26 meses. Solicitamos sistemáticamente estudios de RM en nuestros pacientes con MCH y excluimos a los que tenían desfibrilador automático implantable (DAI), marcapasos o fibrilación auricular debido a dificultades para realizar la RM. También excluimos para este estudio a los pacientes que fueron intervenidos por miectomía, ablación septal con alcohol o reemplazo valvular previo a la realización de la RM, y aquellos en los cuales se conocía o sospechaba enfermedad coronaria. La MCH se diagnosticó por la presencia de un ventrículo izquierdo hipertrófico y no dilatado (espesor parietal máximo é 15 mm en adultos o ≥ 13 mm en familiares adultos de un paciente con MCH) en ausencia de otra enfermedad cardiaca o sistémica (p. ej., hipertensión o estenosis aórtica) capaz de producir una hipertrofia de la magnitud observada11,18,19.
Evaluación clínica
La evaluación clínica incluyó: historia clínica y examen físico, electrocardiograma (ECG) de 12 derivaciones, ecocardiograma, ECG-Holter de 24 h y prueba de esfuerzo convencional o ecocardiografía de ejercicio con valoración de la presión arterial y la presencia de respuesta isquémica. Nuestros pacientes con MCH son valorados clínicamente de forma anual para estratificar el riesgo y seguir la evolución de sus síntomas, por lo que el tiempo transcurrido entre la realización de la RM y el resto de los estudios, en general, no suele ser mayor de 1 año.
Se utilizaron 5 factores clínicos de riesgo de muerte súbita para estratificar a los pacientes: historia familiar de muerte súbita cardiaca prematura, síncope de causa desconocida, taquicardia ventricular no sostenida (una o más salvas ≥ 3 extrasístoles ventriculares consecutivas ≥ 120 lat/min y con una duración menor de 30 s), una respuesta anormal de la presión arterial durante la prueba de esfuerzo en sujetos menores de 40 años (falta de incremento de la presión arterial sistólica en más de 25 mmHg desde los valores basales o un descenso de más de 10 mmHg de la presión arterial máxima durante el ejercicio) y la presencia de hipertrofia ventricular izquierda severa (espesor parietal ≥ 30 mm).
De los 104 pacientes estudiados con RM, todos presentaban ecocardiografía bidimensional y Doppler, 96 (92%) ECG-Holter de 24 h y 93 (90%), valoración de la presión arterial con el esfuerzo, 73 pacientes con ecocardiografía de ejercicio y 20 pacientes con prueba de esfuerzo convencional.
Resonancia magnética
Adquisición de las imágenes
Todos los estudios se realizaron en un equipo de 1,5-T (Gyroscan NT; Philips Medical Systems, Best, Países Bajos) con una antena acoplada en fase con 4 elementos y sincronización electrocardiográfica.
Se obtuvieron inicialmente imágenes en 3 planos (coronal, sagital y transversal) para conocer la posición exacta del ventrículo izquierdo. A continuación se adquirieron secuencias funcionales de cine-RM turbo eco de gradiente (tiempo de repetición [TR] de 11 ms, tiempo de eco [TE] de 4 ms, ángulo de inclinación de 20º, campo de visión de 400 mm, matriz de 147 × 256, grosor de corte de 10 mm e intervalo entre cortes de 1 mm) durante la apnea espiratoria en planos de eje corto desde la base hasta el ápex del ventrículo izquierdo, eje largo horizontal y 2 cámaras en la aurícula izquierda-ventrículo izquierdo.
Tras las imágenes funcionales de cine-RM, se adquirieron imágenes de marcado miocárdico (tagging) mediante secuencias eco de gradiente eco-planar (TR de 750 ms, TE de 16 ms, ángulo de inclinación de 13º factor planar 13, campo de visión de 400 mm, matriz de 102 × 256, grosor de corte de 10 mm, rejilla ortogonal de 10 mm) en la apnea espiratoria y en el plano eje corto (basal, tercio medio y apical).
Diez minutos después de la inyección de una dosis de 0,2 mmol/kg del contraste paramagnético gadopentetate dimeglumine (Dotarem, Guerbet, Francia)20, se obtuvieron imágenes de inversión-recuperación potenciadas en T1 (TR de 8 ms, TE de 4,5 ms, ángulo de inclinación de 15º, campo de visión de 400 mm, matriz de 144 × 256 y grosor de 10 mm) en planos del eje corto (basal, tercio medio y apical), el eje largo horizontal y el eje largo vertical. El tiempo de inversión se ajustó manualmente en cada paciente entre 200 y 400 ms21,22 hasta anular la señal del miocardio normal y conseguir imágenes de miocardio negro. Los estudios de RM se completaron en todos los casos sin complicaciones.
Análisis de las imágenes
Los estudios fueron analizados de forma conjunta por dos observadores con experiencia en RM cardiaca (RS, 14 años; ER, 11 años) con un software específico (EasyVision, versión 4.0; Philips Medical Systems), sin conocer el resultado del resto de las exploraciones ni el curso clínico de los pacientes.
Se dividió el ventrículo izquierdo según el modelo de 17 segmentos23 y se analizaron el grosor del miocardio, la función contráctil y las áreas de realce tardío en cada segmento.
Se utilizaron las imágenes funcionales de cine-RM en plano eje corto para calcular la masa del miocardio del ventrículo izquierdo y medir el volumen diastólico, el volumen sistólico, el volumen/latido, la fracción de eyección y el gasto cardiaco del ventrículo izquierdo.
Las imágenes de marcado miocárdico (tagging) en el plano eje corto fueron analizadas visualizando en modo cine la incurvación radial de las líneas de marcado hacia el centro del ventrículo izquierdo en el tabique y las paredes anterior, lateral e inferior de la base, el tercio medio y el ápex. El acortamiento radial se clasificó como normal, hipocinético o discinético en cada segmento del miocardio.
Se consideró que había realce tardío cuando la intensidad de señal de un área del miocardio era muy hiperintensa y persistía en el mismo corte después de cambiar la codificación de la fase para excluir la presencia de artefactos.
Los patrones de hipertrofia se definieron como asimétrico cuando la relación entre el tabique y la pared posterior era ≥ 1,3 y apical cuando el espesor parietal apical era ≥ 15 mm y la relación entre el espesor máximo apical y basal en el eje corto era ≥ 1,324.
Ecocardiografía de ejercicio
Se recogieron imágenes de ecocardiografía bidimensional en situación basal, de ejercicio máximo e inmediatamente después de finalizarlo25,26. Se definió como ejercicio máximo cuando aparecieron signos de agotamiento, depresión del segmento ST > 2 mm en ausencia de dolor precordial, arritmia significativa, hipertensión severa (presión arterial sistólica > 240 mmHg o diastólica > 110 mmHg), respuesta hipotensiva severa (descenso > 20 mmHg desde la máxima presión) o síntomas limitantes. Se consideró que había una respuesta isquémica cuando apareció un nuevo trastorno regional de motilidad o cuando una región con hipocinesia empeoró a acinesia, así como también cuando el descenso de la fracción de eyección era > 5% al final del ejercicio27,28. Las diferencias de fracción de eyección y gradiente subaórtico entre la situación basal y de máximo ejercicio se correlacionaron con el número de segmentos con RT. La ecocardiografía de ejercicio fue valorada por un único investigador (JP), quien no conocía los datos clínicos.
Análisis estadístico
Los datos se analizaron utilizando el programa estadístico SPSS (versión 12.0). Los pacientes fueron clasificados en 4 grupos de acuerdo con el número de segmentos con RT: 0, 1, 2 o ≥ 3. Se empleó el test de la χ² de tendencia en la comparación entre estos grupos y cada variable dicotómica. Las variables cuantitativas se expresaron como media ± desviación estándar (DE) y se valoraron mediante un análisis de regresión lineal. Se consideraron estadísticamente significativos los valores de p < 0,05.
RESULTADOS
Características de la población
Hubo 67 (65%) varones y 37 (35%) mujeres. La edad media en el momento del diagnóstico fue de 43 años (intervalo, 12-76) y en el momento de realizar la RM fue de 51 años (intervalo, 16-78). La mayoría de los pacientes estaba en clase funcional de la New York Heart Association (NYHA) I (50%) o II (48%); 19 (18%) tenían dolor precordial con el esfuerzo y 8 (8%), síncope previo. El grosor máximo en el ecocardiograma fue de 21 ± 6 mm (≥ 30 mm en 13 pacientes) y 36 (35%) pacientes presentaban un gradiente subaórtico ≥ 30 mmHg. Había historia familiar de muerte súbita en 12 pacientes (11%), taquicardia ventricular no sostenida en 19 (18%) y respuesta anormal de la presión arterial durante la prueba de esfuerzo en 31 (30%). De los 104 pacientes, 44 no tenían factores de riesgo de muerte súbita (42%), 42 (41%) tenían uno, 14 (13%) 2, 3 (3%) 3 y un paciente (1%) tenía 4 factores de riesgo. El tratamiento médico durante el seguimiento incluyó: bloqueadores beta (el 65% de los pacientes), antagonistas del calcio (28%), disopiramida (3%), amiodarona (19%), acenocumarol (12%), inhibidores de la enzima de conversión de la angiotensina (13%) y pequeñas dosis de diuréticos (20%). Durante el seguimiento, 4 pacientes recibieron un desfibrilador automático implantable (DAI) (los datos clínicos se exponen en la tabla 1), 4 ablación septal con alcohol, y uno fue intervenido por una miectomía septal.
Resonancia magnética
El grosor medio de la pared del ventrículo izquierdo fue de 14 ± 3 mm y el máximo de 23 mm (intervalo, 14-42 mm). El número de segmentos hipertróficos por paciente osciló de 1 a 15 (promedio, 6 ± 3). La hipertrofia fue asimétrica en 67 pacientes (65%), simétrica en 25 (24%) y apical en 12 (11%). La hipertrofia se observó con mayor frecuencia en la región anterior o posterior del tabique basal o medio.
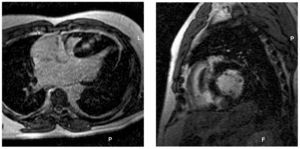
La presencia de RT se observó en 50 pacientes (48%), o en 131 (8%) de los 1.768 segmentos analizados (de 1 a 11 segmentos por paciente). El RT fue más frecuente en los segmentos hipertróficos del tabique interventricular. Los patrones de RT identificados fueron: realce difuso o focos de realce parcheado confluente (70%), realce subendocárdico (10%), realce puntiforme (14%) y realce subepicárdico (6%) (fig. 1)29. Si bien la mayoría de los segmentos hipocinéticos presentaba RT, de los 111 segmentos sólo 75 tenían RT.
Fig. 1. Varón de 44 años de edad con miocardiopatía hipertrófica no obstructiva, 2 factores de riesgo para muerte súbita (taquicardia ventricular no sostenida y grosor máximo del ventrículo izquierdo de 35 mm), fracción de eyección del ventrículo izquierdo del 65%, masa ventricular izquierda de 400 g y 5 segmentos con realce tardío e hipocinesia en el tabique interventricular. A: imágenes de realce tardío de gadolinio con resonancia magnética cardiaca en eje largo horizontal. B: eje corto que muestra una señal confluente de alta intensidad en el tabique interventricular hipertrofiado.
Relación entre la extensión del realce tardío de contraste y los datos clínicos
En la tabla 2 se resume la relación entre RT y la edad, los síntomas, los parámetros de la prueba de esfuerzo y los factores de riesgo de muerte súbita. No hubo relación entre la extensión del RT y la edad de los pacientes en el momento de realizarse la RM (p = 0,3), pero el número de segmentos con RT se correlacionó inversamente con la edad en el momento del diagnóstico (r = -0,20; p = 0,04). En lo que se refiere al perfil de los factores de riesgo de muerte súbita, hubo una mayor proporción de pacientes con grosor máximo ≥ 30 mm y taquicardia ventricular no sostenida (TVNS) al aumentar el número de segmentos con RT (p < 0,001 y p = 0,04, respectivamente). Se observó una tendencia no significativa hacia una mayor proporción de pacientes con 2 o más factores de riesgo de muerte súbita al aumentar el número de segmentos con RT (p = 0,09). No se encontraron diferencias significativas con respecto al tratamiento utilizado o a los factores de riesgo para enfermedad coronaria entre los diferentes grupos con RT.
Dos pacientes presentaron una fracción de eyección del ventrículo izquierdo (FEVI) < 50%, con un ventrículo izquierdo no dilatado, uno con 2 y el otro con 3 segmentos con RT. El aumento del gradiente subaórtico durante el ecocardiograma de ejercicio se correlacionó inversamente con el número de segmentos con RT (r = -0,26; p = 0,023). Se observó respuesta isquémica en la prueba de ecocardiografía de esfuerzo en 5 pacientes, 4 de los cuales tenían ≥ 3 segmentos con RT (p = 0,003). De los 5 pacientes con una respuesta isquémica, 3 tenían arterias coronarias angiográficamente normales y los otros 2 no presentaban angina u otro síntoma indicativo de enfermedad coronaria, y rechazaron realizarse una coronariografía (uno con un patrón de RT parcheado difuso septal y el otro subepicárdico).
La tabla 3 muestra la relación entre RT y otros parámetros de la RM. La extensión del RT se correlacionó positivamente con el grosor máximo (r = 0,53; p < 0,001), la masa (r = 0,41; p < 0,001) y el número de segmentos hipocinéticos (r = 0,51; p < 0,001), e inversamente con la FEVI (r = -0,32; p = 0,001) (fig. 2).
Fig. 2. Relación entre el número de segmentos con realce tardío y (A) el grosor máximo, (B) la masa y (C) la fracción de eyección del ventrículo izquierdo. VI: ventrículo izquierdo.
DISCUSION
La fibrosis miocárdica ha sido vinculada con la patogenia de la muerte súbita cardiaca y la disfunción sistólica de la MCH por su hallazgo en estudios necrópsicos, pero su papel en el desarrollo de la enfermedad no ha sido establecido debido a la falta de una técnica de cuantificación in vivo11-14,30,31. El RT permite detectar la fibrosis miocárdica y aporta una nueva herramienta para caracterizar mejor el fenotipo de esta enfermedad. Este estudio, con el tamaño muestral más grande de pacientes con MCH estudiados con RM hasta la fecha, apoya la perspectiva clínica de que la fibrosis miocárdica, detectada como RT, podría desempeñar un papel importante en la expresión de esta enfermedad.
Realce tardío y factores de riesgo de muerte súbita
La necesidad de estratificar el riesgo de forma precisa en la MCH es fundamental, teniendo en cuenta que se encuentra disponible una terapia preventiva efectiva (DAI) y que los pacientes con MCH a los que se les implanta un DAI son más jóvenes que los pacientes con enfermedad coronaria, y es probable que el riesgo de complicaciones relacionadas con el dispositivo sea alto debido a la larga expectativa de vida de éstos. El RT podría potencialmente identificar el sustrato a través del cual se generan las arritmias ventriculares que llevan a la muerte súbita cardiaca. En relación con este aspecto, un estudio previo demostró que una mayor extensión de RT se asocia con 2 o más marcadores clínicos de riesgo de muerte súbita17. Nosotros identificamos que, entre esos factores de riesgo, la extensión del RT se relaciona no sólo con la hipertrofia severa (> 30 mm), sino también con la presencia de episodios de TVNS en el Holter. La fibrosis miocárdica podría ser el enlace por el que estos conocidos factores de riesgo se relacionan con arritmias ventriculares malignas9,32. El hecho de que la mayoría de los pacientes con hipertrofia severa o TVNS no mueran súbitamente y que muchas muerte súbitas ocurran en pacientes con grosores máximos < 30 mm o sin TVNS en el Holter refleja la necesidad de estratificar mejor a estos pacientes y, en este sentido, la extensión del RT podría desempeñar un papel importante. Sin embargo, es importante remarcar que, si bien la extensión del RT podría vincularse al desarrollo de arritmias, su mera presencia no implicaría necesariamente un mal pronóstico, ya que el RT es un hallazgo común en la MCH (el 50% en nuestro estudio) y el riesgo de muerte súbita en nuestra población es bajo (< 1%). Además, la ausencia de RT probablemente no tenga un alto valor predictivo negativo. Por ejemplo, un paciente con múltiples salvas de TVNS al cual se le implantó un DAI para prevención primaria no presentaba RT en la RM (tabla 1). Una posible explicación a esto sería que la imagen de RT se crea mediante la anulación de la señal de miocardio normal, por lo que un compromiso miocárdico difuso puede no ser detectado21,22. Por otra parte, la expresión de este sustrato anormal depende de factores tales como el tono autónomo y/o la isquemia miocárdica9,33. En nuestro estudio no fue habitual una respuesta isquémica durante la ecocardiografía de ejercicio, a diferencia de un estudio previo realizado con ecocardiografía de estrés con dobutamina28, pero su presencia estuvo vinculada con una mayor extensión de RT, lo que indica otro marcador clínico adverso en este grupo de pacientes.
Aunque no encontramos asociación entre la extensión del RT y la edad de los pacientes en el momento de la prueba, la extensión de RT se asoció con un diagnóstico más precoz de la enfermedad. Esto implicaría que, en algunos pacientes, una fibrosis miocárdica extensa se desarrolla precozmente y puede presentarse a una edad temprana. La velocidad con la que se desarrolla el RT podría ser importante y una fibrosis extensa en un paciente joven podría tener un mayor valor pronóstico que un grado similar en un paciente de mayor edad.
Realce tardío y disfunción sistólica
En estudios previos se ha mostrado que la extensión del RT se asocia con una menor FE y con una dilatación ventricular progresiva16,17. En este aspecto, nuestro estudio aporta datos adicionales acerca de la relación entre la extensión del RT y un deterioro de la función sistólica del ventrículo izquierdo (mayor número de segmentos hipocinéticos y menor FE y capacidad de aumentar el gradiente subaórtico durante la ecocardiografía de ejercicio). El curso clínico de la disfunción sistólica en la MCH suele ser variable, impredecible y generalmente desfavorable34,35. Los marcadores clínicos capaces de anticipar de forma fiable su evolución son difíciles de identificar en una enfermedad tan heterogénea como ésta. Sin embargo, la extensión del RT, junto con otras características clínicas (edad joven en el momento del diagnóstico, mayor grosor parietal, etc.)34,35, podría ayudarnos a identificar a un subgrupo de pacientes en el que podría estar justificado realizar un seguimiento cercano.
CONCLUSIONES
El RT con gadolinio ofrece una nueva perspectiva en la valoración de los pacientes con MCH. La extensión del RT refleja una mayor expresión de esta enfermedad. Se asocia con un daño miocárdico más severo (menor FE y mayor número de segmentos hipocinéticos) y con parámetros clínicos adversos (edad más joven en el momento del diagnóstico, hipertrofia severa, TVNS y respuesta isquémica al ejercicio), lo que indica que podría vincularse al pronóstico. El seguimiento de esta población nos ayudará a determinar el valor predictivo de esta técnica, tanto para la muerte súbita cardiaca como para el desarrollo de disfunción sistólica.
Limitaciones
En primer lugar, nosotros evaluamos la extensión del RT de una manera semicuantitativa si la comparamos con la medición del volumen de las lesiones con RT realizada en estudios previos16,17. Esta metodología podría explicar la diferencia entre nuestro estudio y los previos en lo que se refiere a la fuerza de las asociaciones observadas entre la extensión del RT y los marcadores clínicos de riesgo. Sin embargo, esta diferencia y la menor incidencia de RT en nuestro estudio con respecto a estudios previos podrían también explicarse por un diferente criterio de selección y un distinto tamaño muestral. Choudhury et al16 estudiaron sólo a 21 pacientes con MCH y Moon et al17 seleccionaron a priori a pacientes con alto o bajo riesgo de muerte súbita en vez de incluir a una población consecutiva como la nuestra. Nuestro estudio confirma que la cuantificación del RT de gadolinio mediante el modelo de segmentación miocárdico estandarizado para imágenes tomográficas del corazón es clínicamente relevante y de fácil disponibilidad para su aplicación clínica36,37.
En segundo lugar, aunque todos los pacientes con enfermedad coronaria fueron excluidos de este estudio, sólo los pacientes con dolor precordial típico o síntomas indicativos de enfermedad coronaria fueron evaluados mediante coronariografía, por lo que es posible que se haya incluido a algunos pacientes con enfermedad coronaria. Sin embargo, ninguno de los pacientes con respuesta isquémica en la ecocardiografía de ejercicio presentó un patrón de RT indicativo de enfermedad coronaria.
El Dr. Dumont ha recibido una beca de investigación de la Fundación BBVA-Carolina. Los Dres. Monserrat, Peteiro y Castro-Beiras están financiados por la Red Cardiovascular RECAVA-Instituto de Salud Carlos III. El Dr. Monserrat recibe ayuda financiera de la Fundación Sanofi-Aventis.
Correspondencia: Dr. L. Monserrat.
Servicio de Cardiología. Hospital Juan Canalejo.
Xubias de Arriba, 84. 15006 A Coruña. España.
Correo electrónico: Lorenzo_Monserrat@canalejo.org
Recibido el 17 de marzo de 2006.
Aceptado para su publicación el 16 de octubre de 2006.