La determinación aislada de sodio urinario (UNa+) ha surgido como una medio útil para monitorizar la respuesta diurética en pacientes con insuficiencia cardiaca aguda (ICA). Sin embargo, la evidencia en pacientes ambulatorios es escasa. Nuestro objetivo fue examinar si el UNa+ se asocia con el riesgo de muerte y descompensación de insuficiencia cardiaca (IC) en pacientes con IC crónica.
MétodosEste estudio observacional y ambispectivo incluyó a 1.145 pacientes ambulatorios con IC crónica seguidos en una unidad de IC especializada de un único centro. La evaluación de UNa+ se realizó 1-5 días antes de la visita. Los criterios de validación fueron la asociación entre UNa+ y el riesgo de: a) muerte a largo plazo, y b) hospitalización por ICA y total de eventos descompensación de la IC (hospitalización, atención en urgencias o administración parenteral de diuréticos en la unidad de IC), evaluados mediante regresión multivariante de Cox.
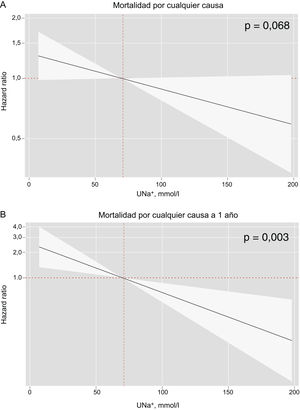
ResultadosLa media de edad±desviación estándar fue de 73±11 años, 670 (58,5%) eran varones, 902 (78,8%) estaban en clase funcional II de la NYHA y 595 (52%) tenían una FEVI ≥ 50%. La mediana [intervalo intercuartílico] de UNa+ fue 72 [51-94] mmol/l. Tras una mediana de seguimiento de 2,63 [1,70-3,36] años, se registraron 293 muertes (25,6%) y 382 descompensaciones de IC (244 ingresos por ICA) en 233 pacientes (20,3%). Tras el ajuste multivariante, el UNa+ basal se asoció de forma lineal e inversa con el riesgo de descompensación de IC (IRR=1,07; IC95%, 1,02-1,12; p=0,007) y de ingreso por ICA (IRR=1,08; IC95%, 1,02-1,14; p=0,012) y marginalmente con la mortalidad por cualquier causa (HR=1,04; IC95%, 0,99-1,09; p=0,068).
ConclusionesEn pacientes ambulatorios con IC, un UNa+ más bajo se asocia con un mayor riesgo de eventos recurrentes de descompensación de IC.
Palabras clave
La congestión es fundamental en la fisiopatología de la insuficiencia cardiaca (IC)1, de tal manera que aproximadamente un 80% de las descompensaciones de la IC se atribuyen a la aparición o el agravamiento de la congestión2,3. La sobrecarga de volumen es principalmente pasiva y secundaria a la retención de sodio4,5. En consecuencia, la determinación del sodio urinario (UNa+) ha pasado a ser útil para evaluar la respuesta al tratamiento diurético e identificar a los pacientes con resistencia a este6,7. El UNa+ de 24 h es el método estándar para cuantificar la natriuresis8. Sin embargo, su uso en la práctica clínica resulta laborioso, sobre todo durante el seguimiento8.
En los últimos años, la determinación aislada del UNa+ ha surgido como alternativa válida para predecir y dar seguimiento de la respuesta diurética en los pacientes con IC aguda (ICA) y es un biomarcador pronóstico fiable8. Sin embargo, la evidencia al respecto en un contexto ambulatorio es escasa, y no hay estudios previos en los que se haya evaluado la utilidad clínica de la estratificación del riesgo para predecir los resultados a largo plazo, en especial la carga de morbilidad de IC en la IC crónica9,10.
El objetivo de este trabajo es evaluar la asociación entre la determinación aislada del UNa+ y el riesgo de mortalidad a largo plazo y de eventos de descompensación de la IC en pacientes ambulatorios con IC crónica.
MÉTODOSPoblación del estudioSe trata de un estudio observacional, unicéntrico y ambispectivo, en el que se incluyó a un total de 1.145 pacientes ambulatorios con IC ambulatoria crónica en estadio C. Se incluyó a pacientes de todo el espectro de clases funcionales. Se excluyó a los pacientes con una hospitalización en los 30 días previos. Todos los pacientes de la muestra fueron seguidos en la consulta ambulatoria especializada en IC de un único centro de España entre octubre de 2016 y octubre de 2021. El diagnóstico de IC se estableció según la guía vigente por la presencia de signos o síntomas y una fracción de eyección del ventrículo izquierdo (FEVI) <50% o evidencia de anomalías cardiacas estructurales o funcionales11,12. Se utilizaron cuestionarios electrónicos prestablecidos para registrar toda la información relativa a datos demográficos, antecedentes patológicos completos, constantes vitales, exploración física, electrocardiograma de 12 derivaciones, ecocardiografía, análisis de laboratorio y tratamientos farmacológicos en cada visita médica.
El estudio se diseñó conforme a los principios establecidos en la Declaración de Helsinki y fue aprobado por el Comité Ético de Investigación Clínica del Hospital Clínico Universitario de Valencia.
Obtención, conservación y análisis de las muestras de orinaSe indicó a los pacientes que obtuvieran una muestra de orina de primera micción. A los pacientes que estaban en tratamiento crónico con diuréticos orales se les indicó que tomaran el diurético después de obtener la muestra. La orina se recogió en un recipiente desechable. A continuación, se aspiró una muestra aislada del recipiente de recogida cerrado herméticamente, utilizando para ello el puerto de aspiración, y la muestra en el tubo de vacío etiquetado se colocó de inmediato en el congelador. Todas las muestras de orina se obtuvieron entre 1 y 5 días antes de cada visita programada, y la determinación del UNa+ se llevó a cabo mediante potenciometría indirecta. Durante el periodo de estudio, no se realizó ninguna recomendación terapéutica específica basada en los resultados de UNa+.
Al mismo tiempo, se obtuvo una muestra de sangre y se determinaron los parámetros de la función renal y las concentraciones plasmáticas de sodio, potasio, hemoglobina, NT-proBNP y CA125 con métodos de análisis comercializados (tests de NT-proBNP Elecsys y de CA125 II Elecsys Roche Diagnostics, Alemania).
Objetivos y seguimientoLos objetivos de interés fueron la mortalidad por cualquier causa a largo plazo y el número de episodios de descompensación de la IC (incluidas las hospitalizaciones por ICA, las visitas de urgencia al servicio de urgencias y la administración parenteral de diurético del asa en la unidad de IC). Se exploró también la mortalidad cardiovascular, definida como la muerte debida a enfermedades del corazón o los vasos sanguíneos (principalmente insuficiencia cardiaca, enfermedad coronaria, muerte súbita cardiaca o ictus). La evaluación de los resultados se llevó a cabo verificando la supervivencia del paciente o la existencia de reingresos mediante una revisión de las historias clínicas electrónicas del sistema de salud pública regional. En esta evaluación se usaron los datos obtenidos de las bases de datos electrónicas SIA-GAIA y Orion Clinic, que registran de manera completa todas las interacciones médicas que se producen con el sistema de salud pública de la Comunidad Valenciana.
La mediana del número de visitas de seguimiento en la unidad de IC al año fue de 3 [2-4], y se dispuso de la información relativa a la supervivencia a los 6 meses, 1 año y 2 años en el 98,1, el 94,3 y el 75,0% de los pacientes de la muestra.
Análisis estadísticoLas variables continuas se expresan en forma de media ± desviación estándar o mediana [intervalo intercuartílico] según proceda y las variables discretas, mediante porcentajes. El UNa+ inicial se evaluó como variable continua y se estratificó en cuartiles para el análisis.
Las comparaciones de las distintas categorías de cuartiles de UNa+ se realizaron mediante la prueba de χ2 para las variables discretas y con un análisis de la varianza (ANOVA) de 1 vía o la prueba de Kruskal-Wallis, según correspondiera, para las variables continuas. Se estimó la probabilidad acumulada de mortalidad por cualquier causa en los distintos cuartiles de UNa+ con el método de Kaplan-Meier, y las diferencias se compararon mediante log-rank test. La asociación entre la exposición y la mortalidad se evaluó con un modelo de regresión de riesgos proporcionales de Cox multivariante. Las estimaciones del riesgo se presentaron en forma de hazard ratio (HR). Por lo que respecta a la mortalidad de causa cardiovascular, se utilizó un análisis de regresión de Cox adaptado para la mortalidad de causa no cardiovascular como evento competitivo. Para la asociación entre el UNa+ y el total de eventos de descompensación de la IC y hospitalizaciones por ICA durante el seguimiento, se elaboró un modelo de regresión binomial negativa multivariante que modeliza simultáneamente el número de eventos de descompensación de la IC (como recuentos) u hospitalizaciones por ICA y la mortalidad por cualquier causa (como evento terminal). Las estimaciones de regresión para ambos objetivos se ajustaron mutuamente con el empleo de shared frailty (fragilidad compartida, que tiene en cuenta la correlación positiva entre los 2 objetivos)13. Las estimaciones del riesgo de descompensación de la IC y de hospitalizaciones por ICA se expresaron mediante la razón de tasas de incidencia (RTI).
Simultáneamente se evaluó el supuesto de linealidad para todas las variables continuas, y se transformaron las variables, si así procedía, mediante polinomios fraccionales. Las covariables incluidas en los modelos multivariantes finales para todos los objetivos evaluados se basaron en la plausibilidad biológica y fueron las siguientes: edad, sexo, ingreso previo por ICA, antecedentes de hipertensión, antecedentes de cardiopatía isquémica, clase funcional evaluada mediante la escala NYHA, índice de comorbilidad de Charlson, frecuencia cardiaca, presión arterial sistólica, filtrado glomerular determinado mediante la ecuación CKD-EPI, cociente de nitrógeno de urea en sangre/creatinina, sodio sérico, NT-proBNP, CA125, dosis equivalente de furosemida y tratamiento con inhibidores del sistema renina-angiotensina-aldosterona y bloqueadores beta.
El umbral de significación utilizado en todos los análisis fue un valor de p bilateral <0,05. El análisis se llevó a cabo con el paquete informático Merlin en el programa STATA 18.1 (Stata Corp., Estados Unidos).
RESULTADOSLa media de edad fue 73±11 años, 670 pacientes (58,5%) eran varones, 902 (78,8%) se encontraban estables en la clase II de la NYHA y 595 (52%) tenían una FEVI ≥ 50%. La mediana del UNa+ en la primera visita fue de 72 [51-94] mmol/l.
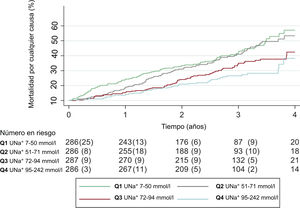
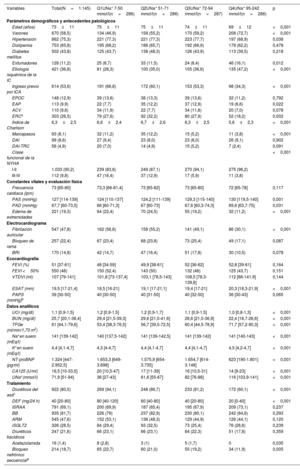
En la tabla 1 se muestran las características basales de la cohorte total, por cuartiles de UNa+ (Q1, 7-50 mmol/l; Q2, 51-71 mmol/l; Q3, 72-94 mmol/l; Q4, 92-242 mmol/l). Los pacientes del cuartil más bajo de UNa+ tenían un perfil de riesgo basal más desfavorable; eran de mayor edad y tenían una mayor carga de comorbilidad (índice de Charlson superior), con más ingresos previos por ICA, peor clase funcional de la NYHA, presión arterial más baja y mayor tasa de edema periférico. Estos pacientes presentaban también un filtrado glomerular inferior y valores más altos de NT-proBNP y CA125 y estaban tratados más frecuentemente con diuréticos del asa y dosis equivalentes de furosemida superiores, así como con un bloqueo secuencial de la nefrona (tabla 1). Por lo que respecta a los parámetros ecocardiográficos, no se observaron diferencias significativas en la FEVI. Sin embargo, los pacientes con un UNa+ inferior presentaban una menor extrusión sistólica del anillo tricuspídeo.
Características basales por cuartiles de UNa+
| Variables | Total(N=1.145) | Q1UNa+ 7-50 mmol/l(n=286) | Q2UNa+ 51-71 mmol/l(n=286) | Q3UNa+ 72-94 mmol/l(n=287) | Q4UNa+ 95-242 mmol/l(n=286) | p |
|---|---|---|---|---|---|---|
| Parámetros demográficos y antecedentes patológicos | ||||||
| Edad (años) | 73±11 | 75±11 | 75±11 | 74±11 | 69±12 | <0,001 |
| Varones | 670 (58,5) | 134 (46,9) | 158 (55,2) | 170 (59,2) | 208 (72,7) | <0,001 |
| Hipertensión | 862 (75,3) | 221 (77,3) | 221 (77,3) | 223 (77,7) | 197 (68,9) | 0,038 |
| Dislipemia | 753 (65,8) | 195 (68,2) | 188 (65,7) | 192 (66,9) | 178 (62,2) | 0,478 |
| Diabetes mellitus | 502 (43,8) | 125 (43,7) | 138 (48,3) | 126 (43,9) | 113 (39,5) | 0,218 |
| Exfumadores | 128 (11,2) | 25 (8,7) | 33 (11,5) | 24 (8,4) | 46 (16,1) | 0,012 |
| Etiología isquémica de la IC | 421 (36,8) | 81 (28,3) | 100 (35,0) | 105 (36,6) | 135 (47,2) | <0,001 |
| Ingreso previo por ICA | 614 (53,6) | 191 (66,8) | 172 (60,1) | 153 (53,3) | 98 (34,3) | <0,001 |
| EPOC | 148 (12,9) | 39 (13,6) | 38 (13,3) | 39 (13,6) | 32 (11,2) | 0,792 |
| EAP | 113 (9,9) | 22 (7,7) | 35 (12,2) | 37 (12,9) | 19 (6,6) | 0,022 |
| ACV | 110 (9,6) | 34 (11,9) | 22 (7,7) | 34 (11,8) | 20 (7,0) | 0,078 |
| ERCa | 303 (26,5) | 79 (27,6) | 92 (32,2) | 80 (27,9) | 52 (18,2) | 0,002 |
| Índice de Charlson | 6,3±2,5 | 6,6±2,4 | 6,7±2,6 | 6,3±2,5 | 5,6±2,3 | <0,001 |
| Marcapasos | 93 (8,1) | 32 (11,2) | 35 (12,2) | 15 (5,2) | 11 (3,8) | <0,001 |
| DAI | 99 (8,6) | 27 (9,4) | 23 (8,0) | 23 (8,0) | 26 (9,1) | 0,902 |
| DAI-TRC | 56 (4,9) | 20 (7,0) | 14 (4,9) | 15 (5,2) | 7 (2,4) | 0,091 |
| Clase funcional de la NYHA | <0,001 | |||||
| I-II | 1.033 (90,2) | 239 (83,6) | 249 (87,1) | 270 (94,1) | 275 (96,2) | |
| III-IV | 112 (9,8) | 47 (16,4) | 37 (12,9) | 17 (5,9) | 11 (3,8) | |
| Constantes vitales y evaluación física | ||||||
| Frecuencia cardiaca (lpm) | 73 [65-80] | 73,3 [66-81,4] | 73 [65-82] | 73 [65-80] | 72 [65-78] | 0,117 |
| PAS (mmHg) | 127 [114-139] | 124 [110-137] | 124,2 [111-139] | 129,3 [115-140] | 130 [119,5-140] | 0,001 |
| PAD (mmHg) | 67,7 [60-73,5] | 66 [60-71,3] | 67 [60-73] | 67,6 [60,3-74,3] | 69,6 [63,7-75] | 0,031 |
| Edema de extremidades | 221 (19,3) | 64 (22,4) | 70 (24,5) | 55 (19,2) | 32 (11,2) | <0,001 |
| Electrocardiograma | ||||||
| Fibrilación auricular | 547 (47,8) | 162 (56,6) | 158 (55,2) | 141 (49,1) | 86 (30,1) | <0,001 |
| Bloqueo de rama | 257 (22,4) | 67 (23,4) | 68 (23,8) | 73 (25,4) | 49 (17,1) | 0,087 |
| BRI | 170 (14,8) | 42 (14,7) | 47 (16,4) | 51 (17,8) | 30 (10,5) | 0,078 |
| Ecocardiografía | ||||||
| FEVI (%) | 51 [37-61] | 48 [34-59] | 49,9 [38-61] | 52 [36-62] | 52,8 [39-61] | 0,164 |
| FEVI <50% | 550 (48) | 150 (52,4) | 143 (50) | 132 (46) | 125 (43,7) | 0,151 |
| VTDVI (ml) | 107 [79-141] | 101,8 [73-137,4] | 103,1 [78,5-143] | 108,5 [78,3-139,8] | 112 [88-141,9] | 0,144 |
| ESAT (mm) | 19,5 [17-21,4] | 18,5 [16-21] | 19,1 [17-21,1] | 19,4 [17-21] | 20,3 [18,3-21,9] | <0,001 |
| PAPS (mmHg)b | 39 [30-50] | 40 [30-50] | 40 [31-50] | 40 [32-50] | 36 [30-43] | 0,065 |
| Datos analíticos | ||||||
| UCr (mg/dl) | 1,1 [0,9-1,5] | 1,2 [0,9-1,5] | 1,2 [0,9-1,7] | 1,1 [0,9-1,5] | 1,0 [0,8-1,3] | <0,001 |
| BUN (mg/dl) | 25,7 [20,1-36,4] | 29,4 [21,5-39,3] | 29,6 [21,0-41,6] | 26,6 [21,0-36,9] | 22,4 [18,7-26,6] | <0,001 |
| TFGe (ml/min/1,73 m2) | 61 [44,1-79,6] | 53,4 [38,3-76,5] | 56,7 [39,5-72,5] | 60,4 [44,5-78,9] | 71,7 [57,2-90,3] | <0,001 |
| Na+en suero (mEq/l) | 141 [139-142] | 140 [137,5-142] | 141 [139-142,5] | 141 [139-142] | 141 [140-143] | <0,001 |
| K+en suero (mEq/l) | 4,4 [4,1-4,7] | 4,3 [4-4,7] | 4,4 [4,1-4,7] | 4,4 [4,1-4,7] | 4,5 [4,2-4,7] | <0,001 |
| NT-proBNP (pg/ml) | 1.324 [447-2.952,5] | 1.653,3 [649-3.698] | 1.575,9 [654-3.735] | 1.654,7 [614-3.148] | 623 [190-1.801] | <0,001 |
| CA125 (U/ml) | 16,5 [10-33,5] | 20 [10,5-47] | 17 [11-39] | 16 [10,5-31] | 14 [9-23] | <0,001 |
| UNa+(mmol/l) | 71,9 [51-94] | 36 [27-43] | 61,6 [55-67] | 82 [76-88] | 116 [103,9-141] | <0,001 |
| Tratamiento | ||||||
| Diuréticos del asac | 922 (80,5) | 269 (94,1) | 248 (86,7) | 233 (81,2) | 172 (60,1) | <0,001 |
| DEF (mg/24 h) | 40 [20-80] | 80 [40-120] | 60 [40-80] | 40 [20-80] | 20 [0-40] | <0,001 |
| ISRAA | 791 (69,1) | 200 (69,9) | 187 (65,4) | 195 (67,9) | 209 (73,1) | 0,237 |
| BB | 935 (81,7) | 226 (79) | 237 (82,9) | 230 (80,1) | 242 (84,6) | 0,293 |
| ARM | 545 (47,6) | 152 (53,1) | 138 (48,3) | 129 (44,9) | 126 (44,1) | 0,120 |
| iSGLT2 | 326 (28,5) | 84 (29,4) | 93 (32,5) | 73 (25,4) | 76 (26,6) | 0,239 |
| Diuréticos tiacídicos | 247 (21,6) | 66 (23,1) | 66 (23,1) | 64 (22,3) | 51 (17,8) | 0,359 |
| Acetazolamida | 16 (1,4) | 8 (2,8) | 3 (1) | 5 (1,7) | 0 | 0,035 |
| Bloqueo nefrónico secuenciald | 214 (18,7) | 65 (22,7) | 60 (21,0) | 55 (19,2) | 34 (11,9) | 0,005 |
ACV: accidente cerebrovascular; ARM: antagonistas del receptor de mineralocorticoides; BRI: bloqueo de rama izquierda; CA125: antígeno carbohidrato 125; DAI: desfibrilador automático implantable; DEF: dosis equivalente de furosemida; DSAT: desplazamiento sistólico del anillo tricuspídeo; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; ICA: insuficiencia cardiaca aguda; iSGLT2: inhibidores del cotransportador 2 de sodio-glucosa; iSRAA: inhibidores del sistema renina-angiotensina-aldosterona; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PAD: presión arterial diastólica; PAPS: presión arterial pulmonar sistólica; PAS: presión arterial sistólica; TFGe: tasa de filtrado glomerular estimada mediante la ecuación CKD-EPI; TRC: terapia de resincronización cardiaca; UCl+: cloro urinario; UCr: creatinina urinaria; UK+: potasio urinario; UNa+: sodio urinario; VTDVI: volumen telediastólico del ventrículo izquierdo.
Tras una mediana de seguimiento de 2,63 [1,70-3,36] años, se registraron 293 (25,6%) muertes, 382 episodios de descompensación de la IC, que se produjeron en 233 pacientes (20,3%), y 244 ingresos por ICA en 170 pacientes (14,85%). Las causas de la muerte fueron cardiovasculares y no cardiovasculares en 147 (12,8%) y 146 (12,7%) casos respectivamente. La causa de muerte cardiovascular más frecuente fue la IC (61 pacientes, el 5,3% de la muestra). Hubo un número considerable de pacientes que presentaron eventos recurrentes de descompensación de la IC, con un total de 62, 18, 8, 5 y 1 pacientes con 2, 3, 4, 5 y 8 eventos.
Sodio urinario basal y riesgo de mortalidadLos gráficos de Kaplan-Meier muestran un riesgo de mortalidad superior en los cuartiles inferiores del UNa+ (figura 1). Estas diferencias se observaron principalmente durante el primer año de seguimiento, con un posterior solapamiento entre el Q1 y el Q2 después de ese periodo (figura 1). Tras el ajuste multivariante, el UNa+ no mostró una asociación significativa con el riesgo de mortalidad a largo plazo; sin embargo, las diferencias están en el límite de la significación estadística (por cada 10 mmol/l de disminución del UNa+, HR=1,04; IC95%, 0,99-1,09; p=0,068) (figura 2A).
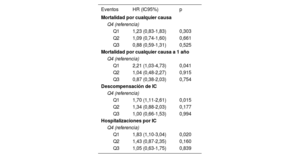
En un análisis de sensibilidad, en el que se limitó el seguimiento a 1 año, un UNa+ inferior mostró una asociación inversa significativa con el riesgo de mortalidad por cualquier causa a pesar del ajuste multivariante (por cada 10 mmol/l de disminución del UNa+, HR=1,14; IC95%, 1,05-1,25; p=0,003) (figura 2B). En comparación con el cuartil más alto, los pacientes del cuartil más bajo de UNa+ mostraron un aumento del riesgo a más del doble (HR=2,21; IC95%, 1,03-4,73; p=0,041) (tabla 2). Los pacientes de los cuartiles Q2 (HR=1,04; IC95%, 0,48-2,27; p=0,915) y Q3 (HR=0,87; IC95%, 0,38-2,03; p=0,754) no mostraron un aumento significativo del riesgo.
Estimaciones de los riesgos de mortalidad, hospitalización por insuficiencia cardiaca y descompensación de la insuficiencia cardiaca
| Eventos | HR (IC95%) | p |
|---|---|---|
| Mortalidad por cualquier causa | ||
| Q4 (referencia) | ||
| Q1 | 1,23 (0,83-1,83) | 0,303 |
| Q2 | 1,09 (0,74-1,60) | 0,661 |
| Q3 | 0,88 (0,59-1,31) | 0,525 |
| Mortalidad por cualquier causa a 1 año | ||
| Q4 (referencia) | ||
| Q1 | 2,21 (1,03-4,73) | 0,041 |
| Q2 | 1,04 (0,48-2,27) | 0,915 |
| Q3 | 0,87 (0,38-2,03) | 0,754 |
| Descompensación de IC | ||
| Q4 (referencia) | ||
| Q1 | 1,70 (1,11-2,61) | 0,015 |
| Q2 | 1,34 (0,88-2,03) | 0,177 |
| Q3 | 1,00 (0,66-1,53) | 0,994 |
| Hospitalizaciones por IC | ||
| Q4 (referencia) | ||
| Q1 | 1,83 (1,10-3,04) | 0,020 |
| Q2 | 1,43 (0,87-2,35) | 0,160 |
| Q3 | 1,05 (0,63-1,75) | 0,839 |
IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; RTI: razón de tasas de incidencia; UNa+: sodio urinario.
Por lo que respecta a la mortalidad de causa cardiovascular, tras el ajuste multivariante, el UNa+ tampoco mostró una asociación significativa con la mortalidad (por cada 10 mmol/l de disminución del UNa+, HR=1,05; IC95%, 0,99-1,11; p=0,085) (figura 1 del material adicional).
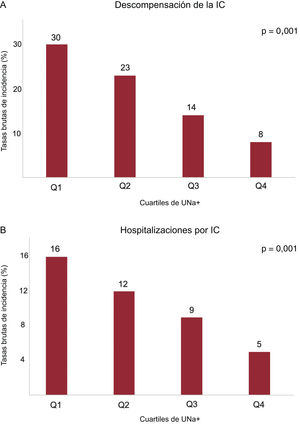
Sodio urinario basal y total de eventos de descompensación de la ICLas tasas de descompensación de la IC (cada 100 años-persona) aumentaron de manera significativa de los cuartiles de UNa+ superiores a los inferiores, como se muestra en la figura 3A. Lo mismo ocurrió al considerar solamente las hospitalizaciones por ICA (figura 3B).
Tasas brutas de incidencia (cada 100 años-persona) para la descompensación de la IC y las hospitalizaciones por insuficiencia cardiaca (IC) en los distintos cuartiles de sodio urinario (UNa+). A: tasas brutas de incidencia de descompensación de la IC. B: tasas brutas de incidencia de hospitalizaciones por IC.
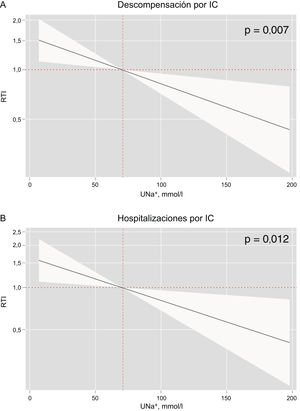
Tras el ajuste multivariante, el UNa+ continuó mostrando una asociación inversa significativa con el riesgo del total de episodios de descompensación de la IC, incluida la hospitalización por ICA (figura 4). Por cada 10 mmol/l de disminución del UNa+, el riesgo de descompensación de la IC y de hospitalizaciones por ICA aumentaba en 1,07 (IC95%, 1,02-1,12; p=0,007) y 1,08 (IC95%, 1,02-1,14; p=0,012) respectivamente (figura 3A,B). En comparación con los pacientes del cuartil superior, los pacientes del cuartil más bajo (≤ 50 mmo/l) tenían un riesgo significativamente superior de episodios de descompensación de la IC (RTI=1,70; IC95%, 1,11-2,61; p=0,015), y ello incluía también un mayor riesgo de reingreso por ICA (RTI=1,83; IC95%, 1,10-3,04; p=0,020) (tabla 2).
Hazard ratio de descompensación de la IC y de hospitalizaciones por insuficiencia cardiaca (IC) en todo el espectro de valores del sodio urinario (UNa+) en el modelo multivariable. A: UNa+ y descompensación de la IC. B: UNa+ y hospitalizaciones por IC. RTI: razón de tasas de incidencia.
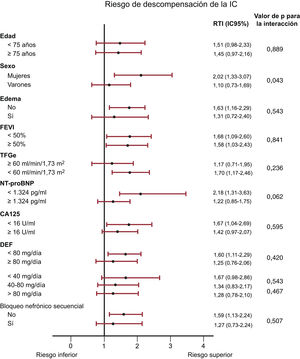
En general y la misma situación de análisis multivariante, no se observó evidencia de heterogeneidad entre el UNa+ ≤ 50 mmol/l y el riesgo de descompensación de la IC entre las características más relevantes de la población, incluidas las de edad <75 o ≥ 75 años, presencia o ausencia de edema, FEVI <50% o ≥ 50%, tasa de filtrado glomerular estimada <60 o ≥ 60ml/min/1,73 m2, NT-proBNP y CA125 por debajo o por encima de la mediana, dosis equivalente de furosemida o bloqueo secuencial de la nefrona (figura 5). Se observó un resultado indicativo de una mayor asociación del UNa+ ≤ 50 mmol/l en las mujeres que en los varones (p para la interacción=0,043) por lo que respecta a la predicción de la descompensación de la IC (figura 5).
Análisis por subgrupos según el sodio urinario (UNa+) ≤ 50 frente a >50 mmol/l, basado en el riesgo de eventos de descompensación de la insuficiencia cardiaca (IC). CA125: antígeno carbohidrato 125; DEF: dosis equivalente de furosemida; FEVI: fracción de eyección del ventrículo izquierdo; IC95%: intervalo de confianza del 95%; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; RTI: razón de tasas de incidencia; TFGe: tasa de filtrado glomerular estimada mediante la ecuación CKD-EPI.
Un análisis de sensibilidad en el que se exploró durante 1 año una posible asociación independiente entre el UNa+ y el tiempo transcurrido hasta la descompensación de la IC mostró que un UNa+ inferior se asociaba también con riesgo de este objetivo (por cada 10 mmol/l de disminución del UNa+, HR=1,13; IC95%, 1,03-1,24; p=0,010) (figuras 2 y 3 del material adicional). En la figura 6 se resumen los métodos y resultados principales del trabajo.
DISCUSIÓNEn este estudio observacional, en el que se incluye una cohorte de pacientes ambulatorios con IC crónica, un valor inferior en la determinación aislada del UNa+ permitió identificar un mayor riesgo de episodios de descompensación de la IC recurrentes a largo plazo. Concretamente, un valor aislado de UNa+ ≤ 50 mmol/l identificó a un subgrupo de pacientes con mayor riesgo de episodios de descompensación de la IC, incluidas las hospitalizaciones por ICA. La asociación entre un UNa+ inferior y el riesgo de mortalidad no fue significativa en el seguimiento a largo plazo. Este fenómeno podría ser consecuencia de haberse ampliado la duración del seguimiento del estudio, dado que el UNa+ muestra una considerable variabilidad y es posible que refleje con más exactitud el riesgo de mortalidad a corto plazo. Es de destacar que nuestra evaluación de su correlación con la mortalidad por cualquier causa en el plazo de 1 año reveló una elevación significativa del riesgo de muerte en los pacientes del cuartil más bajo.
Aunque gran parte de la literatura existente sobre el UNa+ se centra en su importancia en las descompensaciones agudas de la IC, planteamos que este biomarcador tiene también significación pronóstica en el contexto ambulatorio. Hasta donde sabemos, este estudio es el de mayor cohorte en la que se haya evaluado el uso de determinaciones aisladas del UNa+ en un amplio espectro de pacientes con IC ambulatoria. La asociación entre un menor UNa+ y la carga de morbilidad de la IC fue uniforme en los subgrupos más representativos.
Predecir la descompensación de la insuficiencia cardiaca: un reto pendienteLa predicción de las descompensaciones de la IC, incluidas tanto las hospitalizaciones por IC como la descompensación de la IC sin ingreso hospitalario, continúa siendo un verdadero reto clínico14. Aunque los factores asociados al riesgo de mortalidad están bien establecidos, y hay varios sistemas de puntuación ampliamente validados al respecto, la predicción de las hospitalizaciones por IC o los episodios de descompensación de la IC no se está abordando aún de manera adecuada15,16. De hecho, son pocas las escalas diseñadas específicamente para predecir las descompensaciones de la IC, y las que hay tienen una capacidad de discriminación baja17,18. Además, muchos de los modelos existentes se centran en la predicción del evento de IC inicial, no tienen en cuenta el hecho de que la mayoría de los pacientes presentan eventos recurrentes y tampoco aplican un ajuste por la mortalidad como evento terminal y competitivo19. En este contexto, los presentes resultados respaldan la utilidad de las determinaciones aisladas del sodio urinario para predecir la carga de descompensación de la IC.
Determinación aislada del sodio urinario para la estratificación del riesgo: estudios previosNumerosos estudios contemporáneos han explorado la utilidad pronóstica de las determinaciones aisladas del UNa+ en cuanto a los episodios de ICA20–30. Estos estudios son de pequeño tamaño, en su mayor parte observacionales y heterogéneos por lo que respecta a los valores umbral y el momento de obtención del análisis. No obstante, parecen coincidir en que un valor inferior de UNa+ se asocia con peor respuesta diurética y mayor riesgo de eventos adversos, tanto durante la descompensación como a largo plazo20–30. En consecuencia, actualmente las guías y las recomendaciones de expertos aconsejan incorporar la determinación del UNa+ a los protocolos de tratamiento diurético durante las primeras 24h de la descompensación de la IC12,31.
Los 2 estudios más grandes realizados hasta la fecha son el ENACT-HF32 recientemente publicado, en el que se incluyó a 401 pacientes, y el PUSH-AHF33, con un total de 310 pacientes; sin embargo, solamente el segundo fue un ensayo aleatorizado. Estos estudios de intervención, en los que se compararon pautas de tratamiento diurético guiadas por protocolos estandarizados basados en el UNa+ con las prácticas habituales, mostraron una mayor excreción de UNa+ en 24 h y un aumento de la natriuresis y la diuresis en los grupos de intervención que se atribuyeron a un ajuste de aumento de dosis de diuréticos del asa más agresivo y a un aumento del uso de diuréticos adyuvantes32,33.
Determinación aislada del sodio urinario en la insuficiencia cardiaca crónicaEscasea mucho más la evidencia sobre la IC ambulatoria. No se encontraron estudios previos sobre el uso de una sola determinación aislada del UNa+ como marcador del pronóstico a largo plazo. Sin embargo, hay estudios preliminares que hacen pensar en la utilidad del UNa+ también en los pacientes ambulatorios. Elias et al. llevaron a cabo un análisis combinado en 263 pacientes con una IC optimizada basándose en la concentración de UNa+ en una muestra de orina aislada (valor umbral, 80 mEq/l) y la dosis diaria de furosemida (valor umbral, 80mg/día). Observaron que los pacientes con un UNa+ <80 mEq/l y una dosis de furosemida >80mg/día tenían unas tasas superiores de mortalidad a 5 años34. Por otra parte, no se conoce el papel que pueda desempeñar el UNa+ en el seguimiento de la evolución de la enfermedad. Un estudio de gran interés es el de Martens et al., que ya proponía el uso del UNa+ como herramienta de telemedicina para el seguimiento de pacientes ambulatorios con IC. En ese ensayo observacional de un solo centro, se realizó un seguimiento prospectivo de 80 pacientes con la obtención de muestras de orina de la primera micción de la mañana 1 vez por semana durante 30 semanas consecutivas. Se observó una disminución de la concentración de sodio en orina en la semana previa a un evento, que volvía a los valores iniciales tras la descongestión35.
Los presentes resultados respaldan el empleo sistemático de determinaciones aisladas del UNa+ para la estratificación del riesgo en un contexto de IC ambulatoria. Tiene interés señalar que la asociación entre un UNa+ más bajo y la carga de descompensación de la IC fue homogénea en los subgrupos de mayor prevalencia, incluidos los de pacientes con FEVI conservada o con disfunción renal. De igual modo, y en consonancia con lo indicado por los estudios en la ICA, 50 mmol/l parece ser un valor de corte útil para el uso en la práctica clínica.
Consecuencias clínicas y perspectivas futurasEn primer lugar, y según lo indicado por los resultados del presente estudio, recomendamos la determinación del UNa+ para estimar la carga de descompensación de la IC en los pacientes ambulatorios con IC. Con los datos actuales no se puede esclarecer el mecanismo fisiopatológico exacto del valor bajo de UNa+; sin embargo, nuestra hipótesis es que un valor bajo de UNa+ identifica a un subgrupo de pacientes con una enfermedad más avanzada y una mayor activación neurohormonal, una mayor reabsorción tubular de sodio y una mayor resistencia a los diuréticos. Serán necesarios nuevos estudios para definir los factores determinantes clave del Una+ bajo y sus consecuencias clínicas en todo el espectro de pacientes con IC. No se conoce aún la evolución de los valores de Una+ ni si su determinación secuencial puede revelar cambios en el riesgo y podría usarse para el seguimiento o la guía de las estrategias de descongestión en un contexto ambulatorio.
Limitaciones del estudioSon varias las limitaciones del estudio. En primer lugar, se trata de un estudio observacional realizado en un solo centro, en el que pueden haber influido la obtención retrospectiva de los datos y diversos factores de confusión no medidos. En segundo lugar, el valor de UNa+ no estaba enmascarado al clínico a cargo del paciente. Pese a no haber ninguna recomendación clínica específica basada en la determinación aislada del UNa+ en el contexto ambulatorio, no se puede descartar que haya influido en algunos casos. En tercer lugar, no se realizó una evaluación longitudinal del UNa+ ni se evaluaron los cambios en el tratamiento. En cuarto lugar, con el diseño utilizado, no se puede discernir mejor la asociación entre el estado hemodinámico, el UNa+ y el pronóstico. En quinto lugar, no se evaluaron los resultados renales durante el seguimiento. En sexto lugar, no se puede esclarecer de qué forma el tiempo transcurrido desde la hospitalización previa o la administración intravenosa de diuréticos del asa y la determinación del UNa+ hasta la visita ambulatoria puedan haber influido en los resultados en este estudio. Por último, no se registraron los parámetros ecográficos de sobrecarga de líquidos.
CONCLUSIONESEn los pacientes con una IC crónica estable, un valor inferior en la determinación aislada inicial del UNa+ se asoció con aumento del riesgo de eventos de descompensación de la IC en el seguimiento a largo plazo, incluidas las hospitalizaciones por ICA.
- -
La determinación aislada del UNa+ es un biomarcador pronóstico útil en la ICA y puede superar a la determinación del sodio en orina de 24 h.
- -
Un tratamiento diurético guiado por el UNa+ parece aumentar la natriuresis y la diuresis a corto plazo tras una hospitalización por ICA.
- -
El UNa+ es un parámetro válido para identificar a los pacientes ambulatorios con IC crónica que tienen un mayor riesgo de episodios recurrentes de descompensación de la IC, incluidas las hospitalizaciones por IC.
- -
Un valor inferior en la determinación aislada del UNa+ se asoció con aumento del riesgo de mortalidad a 1 año y estuvo en el límite de la significación por lo que respecta al riesgo de mortalidad por cualquier causa a largo plazo.
- -
Un valor de UNa+ ≤ 50 mmol/l, en comparación con un valor más alto, implica una situación de aumento de riesgo de descompensación de la IC, con independencia de la edad, el filtrado glomerular, la FEVI, la pauta de tratamiento diurético y los péptidos natriuréticos.
Este trabajo fue financiado en parte por subvenciones del Instituto de Salud Carlos III (subvención FIS PI20/00392) y CIBER Cardiovascular [número de las subvenciones 16/11/00403 y 16/11/00420].
CONSIDERACIONES ÉTICASEl estudio se diseñó según los principios establecidos en la Declaración de Helsinki y fue aprobado por el comité de ética del Hospital Clínico Universitario La Fe de Valencia. Al tratarse de un estudio observacional con un análisis retrospectivo de eventos en el que un porcentaje de los pacientes había fallecido en el momento de la obtención de los datos, el comité de ética aceptó la ausencia de consentimiento informado en este estudio. Se siguieron las guías SAGER por lo que respecta a los posibles sesgos de sexo/género.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se hizo ningún uso de inteligencia artificial en la redacción de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORESM. Lorenzo participó en la obtención de los datos, la redacción de la versión inicial del manuscrito y la preparación de las tablas y figuras. R. de la Espriella, G. Miñana, E. Santas y S. Villar han participado en el seguimiento de los pacientes y han revisado el manuscrito. G. Núñez participó en el seguimiento de los pacientes y la obtención de los datos. A. Carratalá y E. Rodríguez han llevado a cabo las determinaciones en las muestras analíticas y han revisado la versión final del manuscrito. N. Valls ha participado en la obtención de los datos. V. Donoso ha ayudado a diseñar las figuras. A. Bayés-Genís y J. Sanchis han revisado la versión final del manuscrito. J. Núñez participó en el diseño del estudio, el seguimiento de los pacientes, el análisis estadístico y la revisión del manuscrito.
CONFLICTO DE INTERESESJ. Sanchis es editor jefe de Rev Esp Cardiol. Se ha seguido el procedimiento editorial establecido por la Revista para garantizar un tratamiento imparcial del manuscrito. J. Núñez declara haber recibido pagos personales o pertenecer a consejos asesores de Alleviant, AstraZeneca, Boehringer Ingelheim, Bayer, Novartis, NovoNordisk, Pfizer, Rovi y Vifor Pharma (sin relación con el trabajo presentado). Los demás autores no declaran ningún conflicto de intereses en relación con este estudio.