Aunque la enfermedad coronavírica de 2019 (COVID-19) es una infección vírica generalizada que lleva a síndromes respiratorios agudos, cada vez hay más evidencia que indica que la afectación miocárdica es frecuente y se asocia con una mayor mortalidad.1 Se ha observado que las alteraciones en el ventrículo izquierdo (VI) y el ventrículo derecho (VD) no son infrecuentes, y es motivo de preocupación que sean resultado de la inflamación sistémica.2 No obstante, hay pocos datos sobre la eficacia de la ecocardiografía transtorácica (ETT) para entender si la lesión miocárdica es un fenómeno pasivo o si contribuye a una lesión grave. El objetivo de este estudio es definir las alteraciones de la infección aguda por COVID-19 por análisis de ETT avanzada y determinar sus implicaciones en el tratamiento y el pronóstico.
Se trata de un estudio de cohortes realizado en 200 pacientes ingresados con COVID-19 a quienes se hizo una ETT a criterio del médico tratante entre el 1 de marzo y el 25 de mayo de 2020. Dada la falta de conocimientos con respecto a la COVID-19, las técnicas de diagnóstico por la imagen se limitaron a pacientes que pudiesen obtener un mayor beneficio.3 Los criterios de exclusión fueron: ausencia de SARS-CoV-2 confirmado, edad <18 años, estudios de ETT portátiles y falta de calidad del estudio de imagen. Se revisó la historia clínica de cada paciente tras la ETT para evaluar la repercusión en la atención del paciente: cambios en el tratamiento (antibióticos, diuréticos, anticoagulación), ajuste de la asistencia hemodinámica, facilitar decisiones relacionadas con el nivel de asistencia sanitaria de los pacientes y ausencia de cambios. Se realizó una ETT convencional, análisis de la deformación miocárdica por strain 2D y del trabajo miocárdico. El estudio fue aprobado por el comité de ética del centro. Todos los participantes en el estudio firmaron el consentimiento informado a su inicio.
En el análisis final, tras la exclusión de 134 pacientes (ETT portátiles, falta de calidad/resolución de la imagen), se incluyeron 66 exploraciones. No se observaron diferencias demográficas ni clínicas entre los pacientes incluidos en el análisis y los excluidos (p>0,05). La media de edad fue de 62 [intervalo intercuartílico, 55-70] años y el 59,1% de los pacientes eran varones (tabla 1). El tiempo transcurrido entre el ingreso hospitalario y la ETT fue una mediana de 14 [6-22] días. La indicación para hacer una ETT fue: en un 50%, sospecha de una enfermedad sistémica (endocarditis, embolia pulmonar); en el 30,3%, valoración de la situación hemodinámica (shock, insuficiencia cardiaca), y en el 19,7%, sospecha de afección cardiaca (elevación de biomarcadores, dolor torácico). Los pacientes con una ETT patológica eran de edad más avanzada y tenían peor perfil de riesgo cardiovascular que los pacientes con una ETT normal. En conjunto, el estudio mediante ETT fue patológico en 36 pacientes (54,5%) (tabla 2). La alteración más frecuente fue disfunción diastólica (definida según las guías ASE/EACVI de 2016) (33,3%), seguida de disfunción del VD (12,1%), disfunción del VI (6,1%) y una valvulopatía grave o endocarditis (3%). Se analizó la deformación por strain 2D solo en 33 pacientes y el trabajo miocárdico en 16, dada la calidad de imagen de alta resolución requerida. El strain longitudinal global (SLG) del VI estaba reducido en el 48,5% de los pacientes y el rendimiento del trabajo miocárdico estaba disminuido en todos los pacientes con una ETT patológica, aunque las diferencias no fueron significativas. Se observó disfunción del VD en el 12,1% de los pacientes y strain del VD reducido en el 17,7%. No hubo diferencias significativas entre una ETT normal o patológica y el aumento de los valores de troponina cardiaca I ultrasensible (TncI-us), la porción N-terminal del propéptido natriurético cerebral (NT-proBNP) o el dímero D (p>0,3 para todos los parámetros). Al evaluar el rendimiento del VI mediante SLG, se observó una asociación significativa con las cifras de TncI-us (r=–0,556; p=0,039), así como el índice de trabajo miocárdico global (ITG) (r=−0,900; p=0,037). La ETT patológica es uno de los factores que influyó en la toma de decisiones clínicas para 60 pacientes: en 28, cambios de tratamiento; en 22, el alta de la unidad de cuidados intensivos, y en 10, para tratamiento de la asistencia hemodinámica. La duración de la estancia hospitalaria fue una mediana de 34 [16-49] días y la muerte hospitalaria no fue significativamente diferente entre los pacientes con una ETT patológica o una normal.
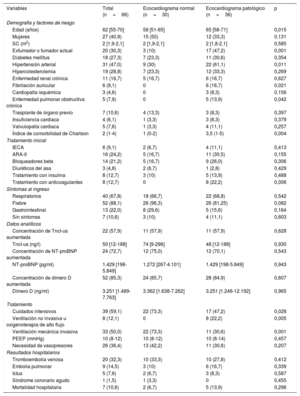
Características demográficas y clínicas de los pacientes con y sin un ecocardiograma normal
| Variables | Total (n=66) | Ecocardiograma normal (n=30) | Ecocardiograma patológico (n=36) | p |
|---|---|---|---|---|
| Demografía y factores de riesgo | ||||
| Edad (años) | 62 [55-70] | 58 [51-65] | 65 [58-71] | 0,015 |
| Mujeres | 27 (40,9) | 15 (50) | 12 (33,3) | 0,131 |
| SC (m2) | 2 [1,9-2,1] | 2 [1,9-2,1] | 2 [1,8-2,1] | 0,585 |
| Exfumador o fumador actual | 20 (30,3) | 3 (10) | 17 (47,2) | 0,001 |
| Diabetes mellitus | 18 (27,3) | 7 (23,3) | 11 (30,6) | 0,354 |
| Hipertensión arterial | 31 (47,0) | 9 (30) | 22 (61,1) | 0,011 |
| Hipercolesterolemia | 19 (28,8) | 7 (23,3) | 12 (33,3) | 0,269 |
| Enfermedad renal crónica | 11 (16,7) | 5 (16,7) | 6 (16,7) | 0,627 |
| Fibrilación auricular | 6 (9,1) | 0 | 6 (16,7) | 0,021 |
| Cardiopatía isquémica | 3 (4,6) | 0 | 3 (8,3) | 0,156 |
| Enfermedad pulmonar obstructiva crónica | 5 (7,9) | 0 | 5 (13,9) | 0,042 |
| Trasplante de órgano previo | 7 (10,6) | 4 (13,3) | 3 (8,3) | 0,397 |
| Insuficiencia cardiaca | 4 (6,1) | 1 (3,3) | 3 (8,3) | 0,379 |
| Valvulopatía cardiaca | 5 (7,6) | 1 (3,3) | 4 (11,1) | 0,257 |
| Índice de comorbilidad de Charlson | 2 (1-4) | 1 (0-2) | 3,5 (1-5) | 0,004 |
| Tratamiento inicial | ||||
| IECA | 6 (9,1) | 2 (6,7) | 4 (11,1) | 0,413 |
| ARA-II | 16 (24,2) | 5 (16,7) | 11 (30,5) | 0,155 |
| Bloqueadores beta | 14 (21,2) | 5 (16,7) | 9 (26,0) | 0,306 |
| Diuréticos del asa | 3 (4,8) | 2 (6,7) | 1 (2,8) | 0,429 |
| Tratamiento con insulina | 8 (12,7) | 3 (10) | 5 (13,9) | 0,488 |
| Tratamiento con anticoagulantes | 8 (12,7) | 0 | 8 (22,2) | 0,006 |
| Síntomas al ingreso | ||||
| Respiratorios | 40 (67,8) | 18 (66,7) | 22 (68,8) | 0,542 |
| Fiebre | 52 (88,1) | 26 (96,3) | 26 (81,25) | 0,082 |
| Gastrointestinal | 13 (22,0) | 8 (29,6) | 5 (15,6) | 0,164 |
| Sin síntomas | 7 (10,6) | 3 (10) | 4 (11,1) | 0,603 |
| Datos analíticos | ||||
| Concentración de TncI-us aumentada | 22 (57,9) | 11 (57,9) | 11 (57,9) | 0,628 |
| TncI-us (ng/l) | 50 [12-188] | 74 [9-296] | 48 [12-188] | 0,930 |
| Concentración de NT-proBNP aumentada | 24 (72,7) | 12 (75,0) | 12 (70,1) | 0,543 |
| NT-proBNP (pg/ml) | 1.429 [198-5.849] | 1.272 [267-4.101] | 1.429 [198-5.849] | 0,943 |
| Concentración de dímero D aumentada | 52 (85,3) | 24 (85,7) | 28 (84,9) | 0,607 |
| Dímero D (ng/ml) | 3.251 [1.489-7.763] | 3.362 [1.638-7.262] | 3.251 [1.246-12.192] | 0,965 |
| Tratamiento | ||||
| Cuidados intensivos | 39 (59,1) | 22 (73,3) | 17 (47,2) | 0,028 |
| Ventilación no invasiva u oxigenoterapia de alto flujo | 8 (12,1) | 0 | 8 (22,2) | 0,005 |
| Ventilación mecánica invasiva | 33 (50,0) | 22 (73,3) | 11 (30,6) | 0,001 |
| PEEP (mmHg) | 10 (8-12) | 10 (8-12) | 10 (8-14) | 0,457 |
| Necesidad de vasopresores | 26 (36,4) | 13 (42,2) | 11 (30,6) | 0,207 |
| Resultados hospitalarios | ||||
| Tromboembolia venosa | 20 (32,3) | 10 (33,3) | 10 (27,8) | 0,412 |
| Embolia pulmonar | 9 (14,5) | 3 (10) | 6 (16,7) | 0,339 |
| Ictus | 5 (7,6) | 2 (6,7) | 3 (8,3) | 0,587 |
| Síndrome coronario agudo | 1 (1,5) | 1 (3,3) | 0 | 0,455 |
| Mortalidad hospitalaria | 7 (10,6) | 2 (6,7) | 5 (13,9) | 0,296 |
ARA-II: antagonistas del receptor de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: porción N-terminal del propéptido natriurético cerebral; PEEP: presión positiva al final de la espiración; SC: superficie corporal; TncI-us: troponina cardiaca I ultrasensible.
Los valores categóricos expresan n (%) y los continuos, mediana [intervalo intercuartílico].
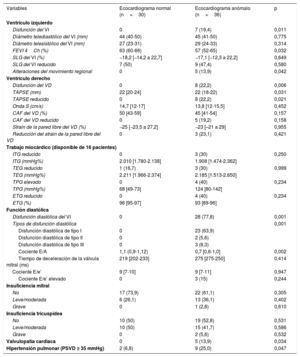
Resultados ecocardiográficos normal y patológico en pacientes con COVID-19
| Variables | Ecocardiograma normal (n=30) | Ecocardiograma anómalo (n=36) | p |
|---|---|---|---|
| Ventrículo izquierdo | |||
| Disfunción del VI | 0 | 7 (19,4) | 0,011 |
| Diámetro telediastólico del VI (mm) | 44 (40-50) | 45 (41-50) | 0,775 |
| Diámetro telesistólico del VI (mm) | 27 (23-31) | 29 (24-33) | 0,314 |
| FEVI 4Ch (%) | 63 (60-66) | 57 (52-65) | 0,032 |
| SLG del VI (%) | −18,2 [−14,2 a 22,7] | −17,1 [−12,3 a 22,2] | 0,649 |
| SLG del VI reducido | 7 (50) | 9 (47,4) | 0,580 |
| Alteraciones del movimiento regional | 0 | 5 (13,9) | 0,042 |
| Ventrículo derecho | |||
| Disfunción del VD | 0 | 8 (22,2) | 0,006 |
| TAPSE (mm) | 22 [20-24] | 22 (18-22) | 0,031 |
| TAPSE reducido | 0 | 8 (22,2) | 0,021 |
| Onda S (cm/s) | 14,7 [12-17] | 13,8 [12-15,5] | 0,452 |
| CAF del VD (%) | 50 [43-59] | 45 [41-54] | 0,157 |
| CAF del VD reducido | 0 | 5 (19,2) | 0,158 |
| Strain de la pared libre del VD (%) | −25 [−23,5 a 27,2] | −23 [–21 a 29] | 0,955 |
| Reducción del strain de la pared libre del VD | 0 | 3 (23,1) | 0,421 |
| Trabajo miocárdico (disponible de 16 pacientes) | |||
| ITG reducido | 0 | 3 (30) | 0,250 |
| ITG (mmHg%) | 2.010 [1.780-2.138] | 1.908 [1.474-2.362] | |
| TEG reducido | 1 (16,7) | 3 (30) | 0,999 |
| TEG (mmHg%) | 2.211 [1.966-2.374] | 2.185 [1.513-2.650] | |
| TPG elevado | 0 | 4 (40) | 0,234 |
| TPG (mmHg%) | 68 [49-73] | 124 [80-142] | |
| ETG reducido | 0 | 4 (40) | 0,234 |
| ETG (%) | 96 [95-97] | 93 [89-96] | |
| Función diastólica | |||
| Disfunción diastólica del VI | 0 | 28 (77,8) | 0,001 |
| Tipos de disfunción diastólica | 0,001 | ||
| Disfunción diastólica de tipo I | 0 | 23 (63,9) | |
| Disfunción diastólica de tipo II | 0 | 2 (5,6) | |
| Disfunción diastólica de tipo III | 0 | 3 (8,3) | |
| Cociente E/A | 1,1 (0,9-1,12) | 0,7 [0,6-1,0] | 0,002 |
| Tiempo de deceleración de la válvula mitral (ms) | 219 [202-233] | 275 [275-250] | 0,414 |
| Cociente E/e’ | 9 [7-10] | 9 [7-11] | 0,947 |
| Cociente E/e’ elevado | 0 | 3 (15) | 0,244 |
| Insuficiencia mitral | |||
| No | 17 (73,9) | 22 (61,1) | 0,305 |
| Leve/moderada | 6 (26,1) | 13 (36,1) | 0,402 |
| Grave | 0 | 1 (2,8) | 0,610 |
| Insuficiencia tricuspídea | |||
| No | 10 (50) | 19 (52,8) | 0,531 |
| Leve/moderada | 10 (50) | 15 (41,7) | 0,586 |
| Grave | 0 | 2 (5,6) | 0,532 |
| Valvulopatía cardiaca | 0 | 5 (13,9) | 0,034 |
| Hipertensión pulmonar (PSVD ≥ 35 mmHg) | 2 (6,8) | 9 (25,0) | 0,047 |
CAF: cambio de área fraccional; ETG: eficiencia del trabajo miocárdico global; FEVI: fracción de eyección del VI; ITG: índice de trabajo miocárdico global; PSVD: presión sistólica del ventrículo derecho; SLG: strain longitudinal global; TEG: trabajo miocárdico efectivo global; TPG: trabajo perdido global; VD: ventrículo derecho; VI: ventrículo izquierdo.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Este es el primer informe prospectivo sobre una cohorte de pacientes seleccionados con COVID-19 ingresados en un centro terciario de referencia a quienes se realizó una ETT a criterio médico. Los resultados principales son: a) en más de la mitad de los pacientes con COVID-19 la ETT fue patológica, la alteración predominante fue la disfunción diastólica y se evidenció disfunción del VD o el VI en menos del 12% de los pacientes; b) los pacientes cuya ETT fue patológica eran de edad más avanzada y tenían un peor perfil de riesgo cardiovascular que los pacientes con una ETT normal; c) no se observaron diferencias significativas entre el resultado de la ETT y los biomarcadores cardiacos, y d) la indicación más habitual para hacer una ETT fue la sospecha de una afección sistémica, y en la mayor parte de los casos el resultado de la ETT modificó directamente el tratamiento médico, pues es uno de los factores influyentes en la toma de decisiones terapéuticas.
Estudios recientes indican que la troponinas se asocian con aumento de las concentraciones de proteína C reactiva, citocinas y NT-proBNP observado en la infección por coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2), lo cual indica una relación entre la lesión miocárdica, la inflamación y la disfunción ventricular.1 No obstante, estos estudios carecen de hallazgos en técnicas de imagen. En nuestro estudio, la disfunción sistólica del VI y las alteraciones segmentarias de la contractilidad fueron infrecuentes, a pesar de la evidencia de lesión miocárdica, lo que indica que esta podría estar relacionada con el síndrome inflamatorio. Se ha observado que en pacientes con COVID-19 el SLG del VI está disminuido en el 52 y el 70% de ellos, lo cual emerge como un buen predictor de mortalidad.4 Según nuestros resultados, el análisis del trabajo miocárdico también se relacionó de manera significativa con la concentración de TncI-us. Los hallazgos más frecuentes fueron alteraciones miocárdicas subclínicas, lo que refuerza los resultados de otras cohortes de que la afección miocárdica abunda, pero principalmente es subclínica 5(SLG reducida e inflamación miocárdica persistente en estudios de resonancia magnética cardiaca). En nuestra cohorte, el análisis del strain y del trabajo miocárdico no fueron marcadores indirectos de disfunción del VI en los pacientes con COVID-19 con un ecocardiograma normal y no influyeron en la toma de decisiones. Sigue sin conocerse si las decisiones clínicas basadas en estos parámetros se traducen en un mejor resultado. Son necesarios registros a gran escala de técnicas de imagen multimodal y biomarcadores para entender la fisiopatología de la COVID-19. En estudios previos, un evento cardiovascular mayor fue la principal indicación para la realización de una ETT2; no obstante, en el presente estudio, el motivo más frecuente fue la sospecha de una afección sistémica, dado que la lesión miocárdica se interpretó minuciosamente integrando los síntomas, las alteraciones electrocardiográficas y la probabilidad de enfermedad coronaria. Según nuestros resultados y publicaciones anteriores6, un estudio ecocardiográfico debería limitarse a los pacientes en quienes se sospeche una afección sistémica o cuando se quiera descartar complicaciones asocias con una estancia prolongada en unidades de cuidados intensivos, se requiera una valoración de inestabilidad hemodinámica o se necesite facilitar la toma de decisiones sobre el nivel de asistencia del paciente y la graduación del tratamiento.
Este estudio tiene las limitaciones del sesgo de selección, dado que la ecocardiografía y las pruebas con biomarcadores se solicitaron a criterio del médico. En segundo lugar, se trata de una muestra pequeña y de un único centro, lo que puede llevar a errores de tipo II. Sin embargo, el estudio se llevó a cabo en un hospital terciario, referencia de una gran área suburbana, en el que ingresaron 2.025 pacientes con COVID-19 durante la primera ola de la pandemia. En tercer lugar, se desconoce si las alteraciones en las ETT (disfunción diastólica) ya existían anteriormente y, por lo tanto, no estaban relacionadas con la infección. Por último, los resultados de este estudio deberían interpretarse teniendo en cuenta la baja mortalidad de nuestra cohorte, por lo que la ausencia de un impacto pronóstico a corto plazo no permite concluir que no haya consecuencias a largo plazo.
En conclusión, las alteraciones ecocardiográficas graves son poco frecuentes en los pacientes hospitalizados con COVID-19, y en su mayoría muestran alteraciones miocárdicas subclínicas. No obstante, en estos pacientes el estudio ecocardiográfico es útil para orientar el tratamiento y el proceso de la toma de decisiones clínicas.
FINANCIACIÓNNingún autor ha recibido financiación para este artículo.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores tuvieron acceso a los datos y participaron en la preparación del artículo. Todos los autores han contribuido a la idea del estudio, la conservación de los datos, el análisis formal, la investigación, la metodología, la validación, la redacción y la revisión.
CONFLICTO DE INTERESESNinguno.