Palabras clave
INTRODUCCIÓN
El cierre percutáneo con catéter de los defectos del septo interauricular (SIA) se ha establecido como una alternativa eficaz y segura al tratamiento médico y la intervención quirúrgica1-4. Aunque el tratamiento quirúrgico se ha practicado durante más de 45 años y se ha considerado de elección en los pacientes con defectos tipo ostium secundum, ya en 1976 se describió el primer cierre no quirúrgico de una comunicación interauricular (CIA)5. La cirugía, aunque segura y efectiva, conlleva las complicaciones propias de una toracotomía, como hemorragias, arritmias y secuelas físicas y psicológicas en pacientes relativamente jóvenes6,7. El uso de dispositivos oclusores por vía percutánea, antes limitado por razones técnicas, es hoy una excelente alternativa de cierre anatómico en adultos8,9.
El ecocardiograma transesofágico (ETE) es la técnica de imagen habitualmente utilizada, durante los procedimientos de cierre percutáneo de los defectos del SIA, para valorar la posición y el tamaño del defecto y como guía para implantar adecuadamente los dispositivos intracardiacos2-4,10. Sin embargo, esta técnica en pacientes adultos implica sedación o anestesia general con intubación orotraqueal, lo que prolonga el procedimiento y aumenta su complejidad. El reciente desarrollo de la ecocardiografía intracardiaca (EIC) añade una nueva dimensión a las técnicas de imagen disponibles para el cardiólogo, y se la ha propuesto como otra opción para guiar las intervenciones de cierre percutáneo11. La posición del transductor en las cavidades derechas del corazón permite una excelente definición de la anatomía intracardiaca, y ha sido utilizada para guiar la punción transeptal con aguja y durante procedimientos de ablación por radiofrecuencia12,13. Diversos artículos refieren la utilidad y la seguridad de la EIC durante los procedimientos de cierre percutáneo de defectos del SIA, porque evita la necesidad del ETE y la anestesia general, acorta el tiempo de la intervención y permite al cardiólogo intervencionista controlar los aspectos de imagen sin necesidad de soporte ecocardiográfico adicional11,14-19.
En este artículo describimos nuestra experiencia y los resultados del implante de dispositivos oclusores en defectos del SIA en pacientes adultos, guiado exclusivamente por EIC para la medición del defecto, la selección del tamaño del dispositivo y la monitorización de su correcta posición.
MÉTODOS
Pacientes
Entre enero de 2002 y agosto de 2006 se ha intervenido de forma percutánea a 52 pacientes (37 mujeres y 15 varones; edad, media ± desviación estándar [intervalo], 39 ± 12 [22-74] años) para cierre percutáneo de un defecto del SIA. En 40 pacientes se trataba de una CIA ostium secundum y en 12, de un foramen oval permeable (FOP) con aneurisma del SIA. En todos los casos se había realizado previamente un ETE con sonda multiplano (Acuson Sequoia C-256, Siemens AG, Malvern, Pennsylvania, Estados Unidos) para confirmar el diagnóstico y definir el tamaño, la localización y el número de defectos en el SIA, así como descartar otras anomalías asociadas (drenaje venoso pulmonar anómalo).
EIC
Se realizó con el equipo de uso único 9F-9MHz Ultra ICE (EP Technologies, Boston Scientific Corp, Natick, Massachusetts, Estados Unidos) conectado a la consola Clearview Ultra (Boston Scientific Corp). Se trata de un catéter de 9 Fr, con un elemento rotante de ultrasonidos de 9 MHz montado en su extremo. Con él se obtienen imágenes a una frecuencia fija de 9 MHz, con un campo radial de vista de 4 cm de profundidad. Sus limitaciones son obtener imágenes en un solo plano (horizontal) y no disponer de Doppler20,21.
El catéter de EIC se introduce percutáneamente con anestesia local a través de la vena femoral izquierda, mediante un sistema con vaina precurvada de 55° y 60 cm de longitud (Convoy, Boston Scientific EP Technologies). El extremo de la vaina se sitúa en la aurícula derecha (AD), y el manejo del transductor se realiza manualmente con movimientos rotatorios y de avance y retroceso. Los planos estándar suelen ser: uno longitudinal en el que se visualizan las cuatro cámaras cardiacas, especialmente ambas aurículas y el SIA, y uno transversal a nivel del plano valvular aórtico22. En ambos planos se realiza la medición del diámetro máximo del defecto (en las CIA) y se confirma la correcta posición del dispositivo atrapando los bordes del defecto septal antes de su liberación definitiva (figs. 1 y 2). No se utilizó el balón de medición (stretching balloon) en ningún caso para decidir el tamaño del dispositivo a implantar.
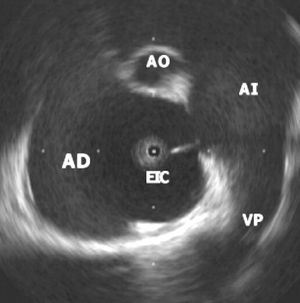
Fig. 1. Imagen de un defecto del tabique interauricular tipo ostium secundum. El extremo del catéter de ecocardiografía intracardiaca (EIC) está en la aurícula derecha (AD). Se observa también una vena pulmonar (VP) superior derecha y un corte tangencial de la aorta (AO) en el plano anterior.
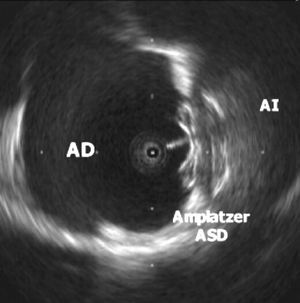
Fig. 2. Imagen del dispositivo Amplatzer ASD para comunicación interauricular implantado en el septo. Se aprecia claramente el mayor tamaño del disco que queda en la aurícula izquierda (AI) y el eco del cable que se une al disco de la aurícula derecha (AD).
Dispositivos
Se utilizaron los dispositivos Amplatzer Septal Occluder (ASO) en las CIA y Amplatzer Patent Foramen Ovale (PFO) Occluder en los FOP, ambos de AGA Medical, Golden Valley, Minnesota (Estados Unidos). Su diseño consiste en un doble disco de finos hilos de nitinol, con memoria térmica del material y capacidad de autocentrado. Ambos discos se unen por una cintura de 4 mm de longitud, que en el caso del ASO puede tener un diámetro desde 4 hasta 40 mm; el disco del lado auricular izquierdo es mayor (14 mm más que la cintura) que el del lado derecho (10 mm mayor que la cintura). En los discos y la cintura se hallan unos parches de poliéster que provocan la coagulación y oclusión del defecto. El dispositivo se introduce cargado y atornillado al cable de transporte a través de una vaina de 6-12 Fr que se sitúa en la aurícula izquierda (AI) a través del defecto del SIA. Una gran ventaja es la posibilidad de recuperar y reposicionar el dispositivo tantas veces como sea preciso antes de su liberación definitiva.
Protocolo de cierre y seguimiento
Con anestesia local, se obtuvo acceso venoso femoral bilateral, izquierdo para EIC y derecho para avanzar una guía de 0,035" y 260 cm a través del defecto hasta la vena pulmonar superior izquierda, con ayuda, en caso necesario, de un catéter multiuso de 6 Fr. Tras examinar con EIC en al menos dos proyecciones ortogonales el defecto del SIA, se eligió un ASO de un tamaño 1-2 mm mayor que el máximo diámetro medido. En los FOP todos los dispositivos fueron de 25 mm (diámetro del disco auricular derecho). Tras colocar la vaina en el AI y retirar la guía, se avanzó el dispositivo elegido, desplegando el disco distal en la AI y el proximal en la AD con control de radioscopia y de EIC. Se confirmó la correcta posición de ambos discos con EIC y realizando la maniobra de Minnesota (empuje y tracción del dispositivo sin liberar hacia ambas aurículas)4 en proyección oblicua anterior izquierda 30° craneal 30°, y se liberó el dispositivo.
Todos los pacientes estaban en tratamiento con aspirina o clopidogrel y fueron anticoagulados con heparina sódica por vía intravenosa a 100 U/kg al iniciar el procedimiento. Se realizó profilaxis antibiótica con 1 g de cefazolina al finalizarlo. En ningún caso fue preciso recurrir al ETE para visualizar los defectos ni para decidir el tamaño del dispositivo, y por tanto ningún paciente precisó anestesia general o intubación orotraqueal. No se utilizó el balón de medición en ningún paciente para decidir el tamaño del dispositivo a implantar.
Se realizó un ecocardiograma transtorácico en las primeras 24 h para confirmar la correcta posición del dispositivo y la ausencia de potenciales complicaciones (trombos, derrame pericárdico). Todos los pacientes recibieron el alta hospitalaria sin complicaciones inmediatas, en tratamiento con 100 mg de aspirina o 75 mg de clopidogrel (si estaban en ritmo sinusal), ambos fármacos combinados en los pacientes con FOP, o aspirina más anticoagulación oral (si estaban en fibrilación auricular). No se detectaron complicaciones vasculares en los accesos femorales (todos venosos salvo en 5 pacientes, a los que también se realizó coronariografía diagnóstica por vía femoral durante el procedimiento por edad y/o factores de riesgo cardiovascular). A los 6 meses se realizó un nuevo ecocardiograma transtorácico, y una revisión clínica a los 6 y a los 12 meses, que se ha mantenido posteriormente de forma anual.
Análisis estadístico
Las variables cuantitativas se describen como la media ± desviación estándar, y como porcentajes en los casos apropiados.
RESULTADOS
Los datos basales y del procedimiento se resumen en la tabla 1. Se implantó el dispositivo con éxito y sin complicaciones inmediatas en 51 (98%) de los 52 pacientes. En un paciente no se logró el cierre de la CIA por no conseguir un correcto posicionamiento del dispositivo a pesar de realizar varios intentos con dos tamaños de ASO, y fue remitido a cirugía de forma electiva, que se realizó sin complicaciones. Dos pacientes tenían un septo cribiforme: uno con CIA grande y dos defectos muy próximos, que se cubrieron con un único ASO de 30 mm, y otro con FOP y aneurisma del SIA, que recibió dos dispositivos de FOP en dos procedimientos distintos.
En 7 pacientes con CIA, la presión sistólica pulmonar antes del cierre era ≥ 50 mmHg (50-88 mmHg). En estos casos se había documentado paso izquierda-derecha en el ETE y en algún caso, paso bidireccional con desaturación sistémica. Tras el implante del dispositivo no se produjo hipotensión sistémica ni otras complicaciones, y en algunos casos aumentó la saturación de forma inmediata.
En 4 casos el borde anterosuperior del SIA era mínimo (< 3 mm), pero se logró posicionar el dispositivo de forma estable con un cierto grado de apoyo retroaórtico, sin protruir o indentar la pared aórtica. En un caso el borde inferior estaba prácticamente ausente y el defecto era grande, pero se pudo implantar un dispositivo de 28 mm sin que el disco de la AI interfiriera con el movimiento de la valva anterior mitral. En estos casos se realizó ETE en el seguimiento a los 6 meses, para descartar algún mal posicionamiento o erosión aórtica.
El tiempo medio de seguimiento ha sido de 28 ± 9 (10-66) meses. No se registraron complicaciones vasculares significativas, derrame pericárdico, fenómenos embólicos sistémicos o embolización del dispositivo durante el seguimiento. En 3 pacientes se documentó fibrilación auricular paroxística sintomática en el primer mes tras el implante. En los 3 casos se inició anticoagulación oral profiláctica y se agregaron bloqueadores beta, sin que aparecieran recidivas. A los 3 meses se retiraron ambos tratamientos.
El ecocardiograma transtorácico a los 6 meses confirmó una correcta posición de los implantes y la ausencia de cortocircuito residual significativo con Doppler color en todos los pacientes. Se suspendió el tratamiento antiagregante en los pacientes con CIA sin otra indicación clínica para mantenerlo. En los pacientes con FOP se suspendió uno de los dos antiagregantes. El seguimiento clínico a los 12 meses se ha realizado sin incidencias.
DISCUSIÓN
La indicación de cierre de un defecto del SIA obligaba en el pasado a realizar una cirugía cardiaca abierta. A pesar del beneficio obtenido, la tasa de complicaciones importantes en adultos no es despreciable (9-13%)6,7,23,24. La evolución tecnológica de los dispositivos percutáneos, la experiencia de los cardiólogos intervencionistas dedicados a estas patologías y la innovación en las técnicas de imagen hacen del tratamiento percutáneo de estos defectos una técnica eficaz, segura y atractiva11,14-22.
Aunque el ETE define adecuadamente el SIA, su uso durante un procedimiento intervencionista en el laboratorio de hemodinámica implica la participación de otros profesionales (anestesista para la sedación o anestesia general del paciente, ecocardiografista para el manejo del ETE) y prolonga los tiempos de intervención11,17. En nuestra serie el uso de la EIC ha conseguido evitar la anestesia y la utilización del ETE en la sala de hemodinámica, sin disminuir por ello la eficacia y seguridad del procedimiento, con la consiguiente comodidad para los pacientes.
La definición de las estructuras intracardiacas que se obtiene con la EIC es óptima21, especialmente del SIA y las estructuras adyacentes (fig. 3). La facilidad de uso y, por supuesto, la fiable información obtenida durante el procedimiento han hecho ganar terreno a la EIC sobre el ETE. En su contra, lógicamente, está que los catéteres no son reutilizables, y ello conlleva un aumento del gasto. También su uso en pacientes pediátricos está limitado por el tamaño del propio catéter (9 Fr), aunque existen ya series en la literatura25 con catéteres similares de mayor tamaño (11 Fr) en pacientes de menos de 15 kg de peso y con media de edad de 3,1 años.
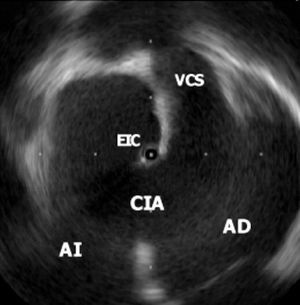
Fig. 3. El extremo del catéter de ecocardiografía intracardiaca (EIC) se encuentra en la aurícula izquierda (AI) a través de una gran comunicación interauricular (CIA) tipo ostium secundum. Se observa la entrada de la vena cava superior (VCS) en la aurícula derecha (AD).
Por otra parte, es bien conocida la discordancia en el tamaño de los defectos del SIA al utilizar tres referencias distintas: ETE, EIC y balón de medición (stretching balloon)11,15. El uso del balón, muy defendido por algunos grupos, produce una distensión del SIA hasta que se observa una cintura radiológica en el balón a nivel del defecto, que se mide posteriormente para cuantificar su diámetro máximo. Es frecuente observar que los rafes de las CIA son muy laxos, y esa sobredistensión puede magnificar el tamaño del defecto y llevar a elegir un dispositivo demasiado grande o generar complicaciones como arritmias o derrame pericárdico26,27.
En nuestra serie, las medidas obtenidas con el ETE muestran un menor diámetro del defecto que las del EIC. Varias razones pueden justificar estos hallazgos:
En algunas ocasiones el ETE puede no visualizar bien algunos bordes, como el inferior o el posterior, que sí son más fácilmente visibles con el EIC21,28.
La capacidad única del EIC de introducirse en el defecto y atravesarlo hacia la AI le permite examinar su geometría desde el interior y con más perspectivas. Es un hecho que las CIA no suelen ser absolutamente circulares y simétricas, y sus diámetros pueden variar significativamente según el plano de observación.
Las medidas del defecto con EIC en los dos planos habituales (longitudinal y transversal) y la verificación de los rafes a su alrededor aportan suficiente información fiable para elegir un dispositivo del tamaño adecuado, en general 1-2 mm mayor que el máximo defecto medido, con el fin de asegurar una correcta y sólida aposición sobre el SIA28.
Aunque actualmente se comercializan numerosos dispositivos para el cierre de defectos del SIA, con la familia Amplatzer se ha demostrado una versatilidad y una eficacia no igualadas por el resto. Su facilidad de implante, la capacidad de recuperación del dispositivo en caso de no posicionarse adecuadamente y la escasa tasa de complicaciones descritas lo convierten en el más sencillo y eficaz para el cardiólogo intervencionista28-31. En nuestra serie no se ha registrado ninguna complicación seria (embolización del dispositivo, erosión, embolias sistémicas), y sólo en 3 pacientes se documentó fibrilación auricular paroxística en las semanas posteriores, que se resolvió con tratamiento médico. Todos los pacientes fueron evaluados a los 6 meses con un ecocardiograma transtorácico, y en algunos casos seleccionados, con ETE (dispositivos muy grandes o localizaciones no centradas en el SIA). Aunque en las primeras horas tras el implante aún se documente paso de flujo (valorado por Doppler color) a través del dispositivo, el propio diseño del Amplatzer, que integra los parches de poliéster en su interior, produce en las siguientes semanas o meses la completa oclusión del defecto en la práctica totalidad de los casos31.
Limitaciones del estudio
El hecho de tratarse de un estudio de un único centro, de carácter retrospectivo, y el pequeño tamaño de la muestra son limitaciones de este trabajo.
CONCLUSIONES
En nuestra experiencia, la EIC proporciona excelente información anatómica del SIA y sus estructuras circundantes en pacientes con defectos septales. Su facilidad de uso y la comodidad añadida para el paciente, evitándole la sedación o la anestesia general con intubación orotraqueal, hacen de esta técnica una atractiva y segura alternativa al ETE durante el implante de dispositivos oclusores de defectos del SIA.
Full English text available from: www.revespcardiol.org
ABREVIATURAS
ASO: Amplatzer septal occluder.
CIA: comunicación interauricular.
EIC: ecocardiografía intracardiaca.
ETE: ecocardiografía transesofágica.
FOP: foramen oval permeable.
SIA: septo interauricular.
Véase editorial en págs. 451-3
Correspondencia: Dr. F. Hernández.
Unidad de Hemodinámica y Cardiología Intervencionista.
Hospital 12 de Octubre.
Avda. Córdoba s/n. 28041 Madrid. España.
Correo electrónico: fhernandezh@medynet.com
Recibido el 22 de marzo de 2007.
Aceptado para publicación el 4 de enero de 2008.